2.1 课时2 有机化学反应的主要类型2 课件(共19页) 2023-2024学年高二化学鲁科版(2019)选择性必修3
文档属性
| 名称 | 2.1 课时2 有机化学反应的主要类型2 课件(共19页) 2023-2024学年高二化学鲁科版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 35.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 00:00:00 | ||
图片预览





文档简介
(共19张PPT)
第1节 有机化学反应类型 课时2
1.根据有机化合物的结构转化特点认识消去反应;
2.从加(脱)氧、脱(加)氢的角度来认识氧化反应(还原反应);
3.能够判断给定化学方程式的反应类型,能够书写给定反应物和反应类型的有机化学反应的化学方程式。
乙烯的实验室制法
这个反应有何特点?
乙醇在浓硫酸的作用下,加热至170℃时生成乙烯。
CH3CH2OH CH2=CH2↑+H2O
浓硫酸
170℃
CH2—CH2 CH2=CH2↑+H2O
浓硫酸
170℃
OH
H
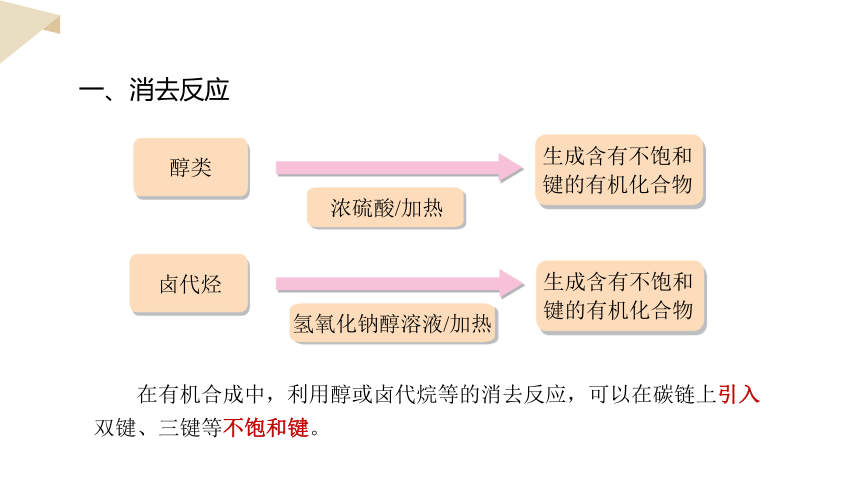
在一定条件下,有机化合物脱去小分子物质(如H2O、HBr等)生成分子中有不饱和键的有机化合物的反应——消去反应。
一、消去反应
醇类
浓硫酸/加热
生成含有不饱和键的有机化合物
卤代烃
氢氧化钠醇溶液/加热
生成含有不饱和键的有机化合物
在有机合成中,利用醇或卤代烷等的消去反应,可以在碳链上引入双键、三键等不饱和键。
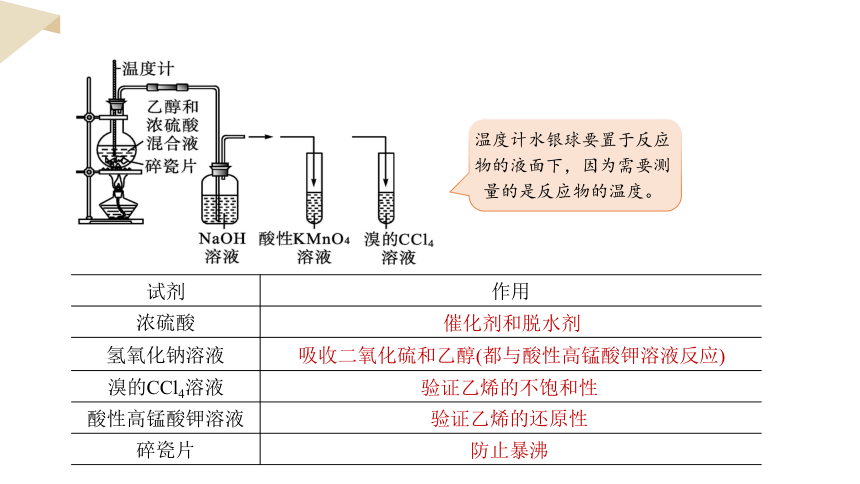
烧瓶中的液体逐渐变黑,酸性高锰酸钾溶液褪色;溴的四氯化碳溶液褪色。
【实验现象】
视频
(1)乙醇的消去反应
CH3CH2OH CH2=CH2↑+H2O
浓硫酸
170℃
注意:实验时,溶液要迅速升温至170℃,因为在140℃时乙醇将以另一种方式脱水,生成乙醚。
试剂 作用
浓硫酸
氢氧化钠溶液
溴的CCl4溶液
酸性高锰酸钾溶液
碎瓷片
催化剂和脱水剂
吸收二氧化硫和乙醇(都与酸性高锰酸钾溶液反应)
验证乙烯的不饱和性
验证乙烯的还原性
防止暴沸
温度计水银球要置于反应物的液面下,因为需要测量的是反应物的温度。
Ⅰ. 酒精与浓硫酸体积比为何要为1∶3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水乙醇,酒精与浓硫酸体积比以1∶3为宜。
Ⅱ.实验过程中观察到混合液变黑,为什么?
在加热的条件下,无水乙醇和浓硫酸除可生成乙烯外,浓硫酸能将无水乙醇脱水生成碳的单质等,碳的单质使烧瓶内的液体带上了黑色。
思考与交流
Ⅲ. 实验过程中闻到刺激性气味,可能发生了什么反应
因乙烯中混有SO2等气体能使酸性KMnO4溶液褪色影响乙烯的检验,故必须用NaOH溶液先将其除去。
Ⅳ. 为何要使用NaOH溶液除去杂质气体
C+2H2SO4(浓)===CO2↑+2SO2↑+2H2O
△
二、氧化反应、还原反应
氧化反应:
还原反应:
有机化合物分子中增加氧原子或减少氢原子的反应。
有机化合物分子中增加氢原子或减少氧原子的反应。
常见的氧化剂
氧气、酸性KMnO4溶液、臭氧、银氨溶液和新制氢氧化铜悬浊液等。
常见的还原剂
氢气、氢化铝锂(LiAlH4)和硼氢化钠(NaBH4)等。
醛
醇
羧酸
氧化
还原
氧化
还原
归纳
1.下列反应物到生成物,反应类型可能属于消去反应的是( )
A
【练一练】
一分为二,只下不上
脱去小分子,形成不饱和键
2.根据柠檬醛的结构简式如图,判断它不能发生( )
A.加成反应 B.氧化反应 C.还原反应 D.消去反应
D
CH3C=CHCH2CH2C=CH—C—H
CH3
CH3
O
3.下列反应属于消去反应的是( )
A.苯与浓硝酸、浓硫酸混合,温度保持在50~60℃
B.乙醇与浓硫酸共热,温度保持在170℃
C.乙醇与浓硫酸共热,温度保持在140℃
D.乙醇、乙酸和浓硫酸共热
B
4.如图是实验室制取乙烯的发生、净化和用排水法测量生成乙烯体积的实验装置图。图中A、B、C、D、E、F是玻璃导管接口。根据要求填写下列各小题空白:
(1)若所制气体按从左向右流向时,上述各仪器装置的正确连接顺序是
(填各装置的序号)。其中①与②装置相连时,玻璃导管连接方式(用装置中字母表示)应是 接 。
(2)若加热时间过长、温度过高,生成的乙烯中常混有SO2,为除去SO2,装置①中应盛的试剂是 。
③①②④
B
D
NaOH溶液(合理即可)
(3)装置③中碎瓷片的作用是 ,浓硫酸的作用是 ,此装置中发生的主要反应的化学方程式是 。
(4)实验开始时首先应检查装置的 ,实验结束时,应先拆去 与____处相连(用装置中字母表示)的玻璃导管,再熄灭③处的酒精灯。
催化剂、脱水剂
防止混合溶液在受热时暴沸
气密性
A
E
C2H5OH CH2=CH2↑+H2O
浓硫酸
170℃
消去反应
原理
现象
装置
大多数卤代烃或醇能发生消去反应
一分为二,只下不上
定义
实验:乙醇的消去反应
第1节 有机化学反应类型 课时2
1.根据有机化合物的结构转化特点认识消去反应;
2.从加(脱)氧、脱(加)氢的角度来认识氧化反应(还原反应);
3.能够判断给定化学方程式的反应类型,能够书写给定反应物和反应类型的有机化学反应的化学方程式。
乙烯的实验室制法
这个反应有何特点?
乙醇在浓硫酸的作用下,加热至170℃时生成乙烯。
CH3CH2OH CH2=CH2↑+H2O
浓硫酸
170℃
CH2—CH2 CH2=CH2↑+H2O
浓硫酸
170℃
OH
H
在一定条件下,有机化合物脱去小分子物质(如H2O、HBr等)生成分子中有不饱和键的有机化合物的反应——消去反应。
一、消去反应
醇类
浓硫酸/加热
生成含有不饱和键的有机化合物
卤代烃
氢氧化钠醇溶液/加热
生成含有不饱和键的有机化合物
在有机合成中,利用醇或卤代烷等的消去反应,可以在碳链上引入双键、三键等不饱和键。
烧瓶中的液体逐渐变黑,酸性高锰酸钾溶液褪色;溴的四氯化碳溶液褪色。
【实验现象】
视频
(1)乙醇的消去反应
CH3CH2OH CH2=CH2↑+H2O
浓硫酸
170℃
注意:实验时,溶液要迅速升温至170℃,因为在140℃时乙醇将以另一种方式脱水,生成乙醚。
试剂 作用
浓硫酸
氢氧化钠溶液
溴的CCl4溶液
酸性高锰酸钾溶液
碎瓷片
催化剂和脱水剂
吸收二氧化硫和乙醇(都与酸性高锰酸钾溶液反应)
验证乙烯的不饱和性
验证乙烯的还原性
防止暴沸
温度计水银球要置于反应物的液面下,因为需要测量的是反应物的温度。
Ⅰ. 酒精与浓硫酸体积比为何要为1∶3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水乙醇,酒精与浓硫酸体积比以1∶3为宜。
Ⅱ.实验过程中观察到混合液变黑,为什么?
在加热的条件下,无水乙醇和浓硫酸除可生成乙烯外,浓硫酸能将无水乙醇脱水生成碳的单质等,碳的单质使烧瓶内的液体带上了黑色。
思考与交流
Ⅲ. 实验过程中闻到刺激性气味,可能发生了什么反应
因乙烯中混有SO2等气体能使酸性KMnO4溶液褪色影响乙烯的检验,故必须用NaOH溶液先将其除去。
Ⅳ. 为何要使用NaOH溶液除去杂质气体
C+2H2SO4(浓)===CO2↑+2SO2↑+2H2O
△
二、氧化反应、还原反应
氧化反应:
还原反应:
有机化合物分子中增加氧原子或减少氢原子的反应。
有机化合物分子中增加氢原子或减少氧原子的反应。
常见的氧化剂
氧气、酸性KMnO4溶液、臭氧、银氨溶液和新制氢氧化铜悬浊液等。
常见的还原剂
氢气、氢化铝锂(LiAlH4)和硼氢化钠(NaBH4)等。
醛
醇
羧酸
氧化
还原
氧化
还原
归纳
1.下列反应物到生成物,反应类型可能属于消去反应的是( )
A
【练一练】
一分为二,只下不上
脱去小分子,形成不饱和键
2.根据柠檬醛的结构简式如图,判断它不能发生( )
A.加成反应 B.氧化反应 C.还原反应 D.消去反应
D
CH3C=CHCH2CH2C=CH—C—H
CH3
CH3
O
3.下列反应属于消去反应的是( )
A.苯与浓硝酸、浓硫酸混合,温度保持在50~60℃
B.乙醇与浓硫酸共热,温度保持在170℃
C.乙醇与浓硫酸共热,温度保持在140℃
D.乙醇、乙酸和浓硫酸共热
B
4.如图是实验室制取乙烯的发生、净化和用排水法测量生成乙烯体积的实验装置图。图中A、B、C、D、E、F是玻璃导管接口。根据要求填写下列各小题空白:
(1)若所制气体按从左向右流向时,上述各仪器装置的正确连接顺序是
(填各装置的序号)。其中①与②装置相连时,玻璃导管连接方式(用装置中字母表示)应是 接 。
(2)若加热时间过长、温度过高,生成的乙烯中常混有SO2,为除去SO2,装置①中应盛的试剂是 。
③①②④
B
D
NaOH溶液(合理即可)
(3)装置③中碎瓷片的作用是 ,浓硫酸的作用是 ,此装置中发生的主要反应的化学方程式是 。
(4)实验开始时首先应检查装置的 ,实验结束时,应先拆去 与____处相连(用装置中字母表示)的玻璃导管,再熄灭③处的酒精灯。
催化剂、脱水剂
防止混合溶液在受热时暴沸
气密性
A
E
C2H5OH CH2=CH2↑+H2O
浓硫酸
170℃
消去反应
原理
现象
装置
大多数卤代烃或醇能发生消去反应
一分为二,只下不上
定义
实验:乙醇的消去反应
