8.3 海水“制碱” 课件(共24张PPT内嵌视频) 2023-2024学年鲁教版化学九年级下册
文档属性
| 名称 | 8.3 海水“制碱” 课件(共24张PPT内嵌视频) 2023-2024学年鲁教版化学九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 16.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-19 21:43:51 | ||
图片预览







文档简介
(共24张PPT)
第三节 海水“制碱”
海水“晒盐”
工业盐
纯碱
思考:NaCl转化为Na2CO3,物质的元素组成发生了什么变化?需要哪些原料?
NaCl
Na2CO3
1.能概述氨碱法制纯碱的过程和化学反应原理
2.了解纯碱和小苏打在日常生活和工农业生产中的应用
3.能说出纯碱的主要物理性质和化学性质
4.能从微观角度解释复分解反应的实质
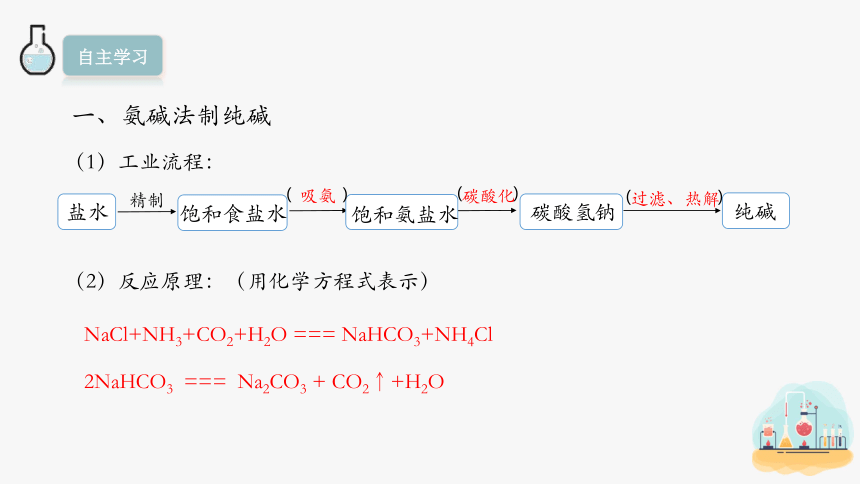
一、氨碱法制纯碱
(1)工业流程:
(2)反应原理:(用化学方程式表示)
盐水
精制
饱和食盐水
饱和氨盐水
碳酸氢钠
纯碱
NaCl+NH3+CO2+H2O === NaHCO3+NH4Cl
2NaHCO3 === Na2CO3 + CO2↑+H2O
碳酸化
过滤、热解
吸氨
( )
( )
( )
二、纯碱的性质
颜色: ;状态: ;溶解性: ;
1.物理性质
白色
粉末固体
易溶于水
①与指示剂的作用:能使酚酞试液变 ,说明其水溶液呈 。
②与酸的反应
与盐酸反应: ;
③与碱的反应
与氢氧化钡溶液反应: ;
④与盐的反应
与氯化钡溶液反应: 。
2.化学性质
红
碱性
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
Na2CO3+Ba(OH)2 = BaCO3↓+2NaOH
Na2CO3 + BaCl2 = BaCO3↓+2NaCl
探究一:氨碱法制纯碱
[情景展示]
海水中含有大量的氯化钠,从海水中得到的食盐不仅是必不可少的生活用品,更是重要的化工原料。纯碱或苏打(主要成分为碳酸钠)就是以食盐为原料,采用氨碱法制得的。
[思考交流]
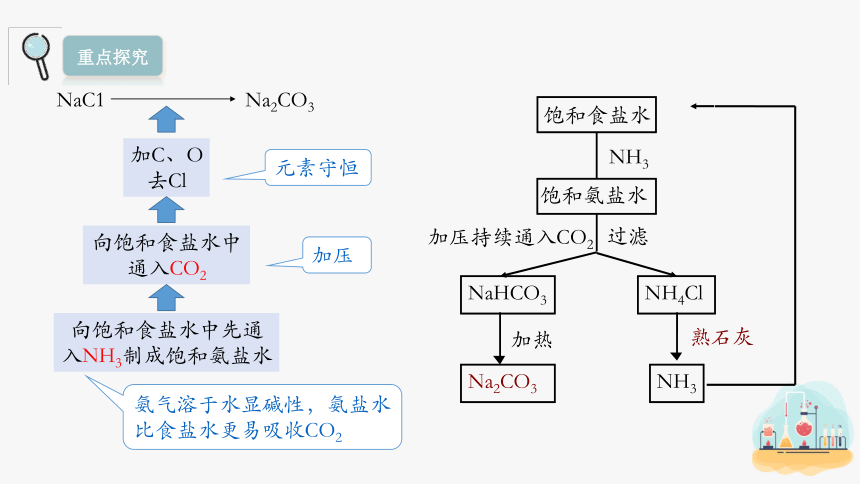
NaCl Na2CO3
C、O
1.从组成上看发生了什么变化?你认为还需要含什么元素的物质参加反应?
NaC1 Na2CO3
加C、O
去Cl
向饱和食盐水中通入CO2
向饱和食盐水中先通入NH3制成饱和氨盐水
元素守恒
加压
氨气溶于水显碱性,氨盐水比食盐水更易吸收CO2
NaHCO3
加热
NH4Cl
Na2CO3
NH3
熟石灰
饱和食盐水
NH3
饱和氨盐水
加压持续通入CO2
过滤
2.氨碱法制纯碱涉及的化学方程式?
2NaHCO3 === Na2CO3+CO2↑+H2O
△
NaCl+NH3+CO2+H2O === NaHCO3+NH4Cl
Ca(OH)2+ 2NH4Cl === CaCl2 +2NH3 ↑ +2H2O
[情景展示]
比较任一温度下,NaCl、NH4Cl、NaHCO3、NH4HCO3四种物质的溶解度大小?
NaCl、NH4Cl、NaHCO3、NH4HCO3在任一温度下,NaHCO3的溶解度最小。
1.请从酸碱反应的角度分析:在用氨碱法生产纯碱的过程中,为什么要先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳?
2.氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么?
氨气是一种极易溶于水的气体,其水溶液显碱性,更易吸收二氧化碳,且吸收的量也较食盐水多。
碳酸氢钠,因为在同样的条件下,碳酸氢钠的溶解度比氯化铵小,易结晶。
[思考交流]
探究二:碳酸钠和碳酸氢钠的性质
[活动]
阅读书本44-45,填写下表
碳酸钠 碳酸氢钠
化学式
常见物质的主要成分
颜色、状态
溶解性
水溶液酸碱性
热稳定性
用途
Na2CO3
NaHCO3
纯碱、苏打
小苏打、酸式碳酸钠
白色粉末
白色晶体
易溶
可溶
显碱性
显弱碱性
受热不易分解
受热易分解
石油精炼、洗涤剂、制造玻璃等
灭火器、制饮料、发酵粉、治疗胃酸
探究三:纯碱的性质
[实验]
1.纯碱与酸碱指示剂的作用
现象:碳酸钠溶于水形成无色溶液,滴加酚酞后,溶液由无色变为红色。
结论:碳酸钠易溶于水,溶液显碱性。
2.与酸反应
现象:试管中有气泡产生,产生的气体能使澄清和石灰水变浑浊。
结论:纯碱与盐酸反应生成二氧化碳。
化学方程式:
Na2CO3 +2HCl =2NaCl + CO2↑+ H2O
3.与氢氧化钙反应
现象:溶液中有白色沉淀生成。
结论:纯碱与氢氧化钙反应生成碳酸钙沉淀。
化学方程式:
Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH
4.与氯化钡反应
现象:溶液中有白色沉淀生成。
结论:纯碱与氯化钡反应生成碳酸钡沉淀。
化学方程式:
BaCl2+Na2CO3=BaCO3↓+ 2NaCl
1.上述实验反应的化学方程式如下,它们有什么共同点吗?
它们都是复分解反应,即由两种化合物互相交换成分,生成另外两种化合物的反应。
[思考交流]
2HCl + Na2CO3 === 2NaCl + H2O + CO2↑
Ca(OH)2 + Na2CO3 === CaCO3 ↓+ 2NaOH
Na2CO3 + BaCl2 === BaCO3↓+ 2NaCl
H2SO4 + Na2CO3 === Na2SO4 + H2O + CO2↑
它们有沉淀生成或者有气体生成或者有水生成
酸、碱、盐之间发生的复分解反
应,其实质是离子之间相互结合,生成难溶性的碱或盐、不稳定的酸(分解放出气体)或水。
2.根据复分解反应的实质,你能解决下列问题吗?
[思考交流]
下列离子能在同一溶液中大量共存并且形成无色溶液的是( )
A.Zn2+ 、Cu2+ 、Cl- 、SO42-
B.K+ 、Ba2+ 、NO3- 、Cl-
C.Mg2+、Cl-、Na+、OH-
D.K+、Na+、H+、OH-
B
(一)条件:如果一种阳离子和一种阴离子结合后可以生成水、气体或者沉淀,则两者不能共存。
(二)不能共存:
H+:OH-、CO32-、HCO3-等;
OH-:H+、NH4+、Fe3+、Cu2+、Fe2+、Mg2+、Al3+等;
CO32-:H+、Ba2+、Ca2+等;
SO42-:Ba2+等;
Cl-:Ag+等。
复分解反应的应用——离子共存
D
1.下列有关氨碱法与侯氏制碱法的说法错误的是( )
A. 这两种方法都利用了不同物质的溶解能力不同进行分离
B. 侯氏制碱法比氨碱法制碱的工艺更绿色环保
C. 所用盐水都是除去杂质后的精盐水
D. 其产品纯碱是一种用途广泛的碱
2. 鉴定某溶液中是否含有CO32-,应该选用的试剂是( )
A.稀盐酸和澄清石灰水 B.紫色石蕊试液
C.氢氧化钠溶液 D.酚酞试液
3.只用一种试剂就能把NaOH溶液、稀盐酸和澄清石灰水鉴别开来,这种试剂可以是下列物质中的( )
A.BaCl2溶液 B.石蕊试液 C.酚酞试液
D.Na2CO3溶液 E.pH试纸
A
D
4.有甲、乙两个相邻的工厂,排放的污水经过初步处理后只溶有:Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、OH-、NO3﹣中的各不相同的4种离子,若单独排放仍会造成环境污染,如按适当比例混合排放,则污染程度大大降低,现又测得甲厂污水pH>7,
试推断: (1)甲厂污水中含有的4种离子可能是 ;
(2)乙厂污水中含有的4种离子可能是 。
Na+、OH-、Cl-、SO42-
Ag+、Fe3+、Ba2+、NO3﹣
海水“制碱”
氨碱法制纯碱
纯碱的性质
流程
纯碱的用途
碳酸氢钠的性质和用途
碱性
与酸反应
与氢氧化钙反应
与氯化钡反应
复分解反应
第三节 海水“制碱”
海水“晒盐”
工业盐
纯碱
思考:NaCl转化为Na2CO3,物质的元素组成发生了什么变化?需要哪些原料?
NaCl
Na2CO3
1.能概述氨碱法制纯碱的过程和化学反应原理
2.了解纯碱和小苏打在日常生活和工农业生产中的应用
3.能说出纯碱的主要物理性质和化学性质
4.能从微观角度解释复分解反应的实质
一、氨碱法制纯碱
(1)工业流程:
(2)反应原理:(用化学方程式表示)
盐水
精制
饱和食盐水
饱和氨盐水
碳酸氢钠
纯碱
NaCl+NH3+CO2+H2O === NaHCO3+NH4Cl
2NaHCO3 === Na2CO3 + CO2↑+H2O
碳酸化
过滤、热解
吸氨
( )
( )
( )
二、纯碱的性质
颜色: ;状态: ;溶解性: ;
1.物理性质
白色
粉末固体
易溶于水
①与指示剂的作用:能使酚酞试液变 ,说明其水溶液呈 。
②与酸的反应
与盐酸反应: ;
③与碱的反应
与氢氧化钡溶液反应: ;
④与盐的反应
与氯化钡溶液反应: 。
2.化学性质
红
碱性
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
Na2CO3+Ba(OH)2 = BaCO3↓+2NaOH
Na2CO3 + BaCl2 = BaCO3↓+2NaCl
探究一:氨碱法制纯碱
[情景展示]
海水中含有大量的氯化钠,从海水中得到的食盐不仅是必不可少的生活用品,更是重要的化工原料。纯碱或苏打(主要成分为碳酸钠)就是以食盐为原料,采用氨碱法制得的。
[思考交流]
NaCl Na2CO3
C、O
1.从组成上看发生了什么变化?你认为还需要含什么元素的物质参加反应?
NaC1 Na2CO3
加C、O
去Cl
向饱和食盐水中通入CO2
向饱和食盐水中先通入NH3制成饱和氨盐水
元素守恒
加压
氨气溶于水显碱性,氨盐水比食盐水更易吸收CO2
NaHCO3
加热
NH4Cl
Na2CO3
NH3
熟石灰
饱和食盐水
NH3
饱和氨盐水
加压持续通入CO2
过滤
2.氨碱法制纯碱涉及的化学方程式?
2NaHCO3 === Na2CO3+CO2↑+H2O
△
NaCl+NH3+CO2+H2O === NaHCO3+NH4Cl
Ca(OH)2+ 2NH4Cl === CaCl2 +2NH3 ↑ +2H2O
[情景展示]
比较任一温度下,NaCl、NH4Cl、NaHCO3、NH4HCO3四种物质的溶解度大小?
NaCl、NH4Cl、NaHCO3、NH4HCO3在任一温度下,NaHCO3的溶解度最小。
1.请从酸碱反应的角度分析:在用氨碱法生产纯碱的过程中,为什么要先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳?
2.氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么?
氨气是一种极易溶于水的气体,其水溶液显碱性,更易吸收二氧化碳,且吸收的量也较食盐水多。
碳酸氢钠,因为在同样的条件下,碳酸氢钠的溶解度比氯化铵小,易结晶。
[思考交流]
探究二:碳酸钠和碳酸氢钠的性质
[活动]
阅读书本44-45,填写下表
碳酸钠 碳酸氢钠
化学式
常见物质的主要成分
颜色、状态
溶解性
水溶液酸碱性
热稳定性
用途
Na2CO3
NaHCO3
纯碱、苏打
小苏打、酸式碳酸钠
白色粉末
白色晶体
易溶
可溶
显碱性
显弱碱性
受热不易分解
受热易分解
石油精炼、洗涤剂、制造玻璃等
灭火器、制饮料、发酵粉、治疗胃酸
探究三:纯碱的性质
[实验]
1.纯碱与酸碱指示剂的作用
现象:碳酸钠溶于水形成无色溶液,滴加酚酞后,溶液由无色变为红色。
结论:碳酸钠易溶于水,溶液显碱性。
2.与酸反应
现象:试管中有气泡产生,产生的气体能使澄清和石灰水变浑浊。
结论:纯碱与盐酸反应生成二氧化碳。
化学方程式:
Na2CO3 +2HCl =2NaCl + CO2↑+ H2O
3.与氢氧化钙反应
现象:溶液中有白色沉淀生成。
结论:纯碱与氢氧化钙反应生成碳酸钙沉淀。
化学方程式:
Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH
4.与氯化钡反应
现象:溶液中有白色沉淀生成。
结论:纯碱与氯化钡反应生成碳酸钡沉淀。
化学方程式:
BaCl2+Na2CO3=BaCO3↓+ 2NaCl
1.上述实验反应的化学方程式如下,它们有什么共同点吗?
它们都是复分解反应,即由两种化合物互相交换成分,生成另外两种化合物的反应。
[思考交流]
2HCl + Na2CO3 === 2NaCl + H2O + CO2↑
Ca(OH)2 + Na2CO3 === CaCO3 ↓+ 2NaOH
Na2CO3 + BaCl2 === BaCO3↓+ 2NaCl
H2SO4 + Na2CO3 === Na2SO4 + H2O + CO2↑
它们有沉淀生成或者有气体生成或者有水生成
酸、碱、盐之间发生的复分解反
应,其实质是离子之间相互结合,生成难溶性的碱或盐、不稳定的酸(分解放出气体)或水。
2.根据复分解反应的实质,你能解决下列问题吗?
[思考交流]
下列离子能在同一溶液中大量共存并且形成无色溶液的是( )
A.Zn2+ 、Cu2+ 、Cl- 、SO42-
B.K+ 、Ba2+ 、NO3- 、Cl-
C.Mg2+、Cl-、Na+、OH-
D.K+、Na+、H+、OH-
B
(一)条件:如果一种阳离子和一种阴离子结合后可以生成水、气体或者沉淀,则两者不能共存。
(二)不能共存:
H+:OH-、CO32-、HCO3-等;
OH-:H+、NH4+、Fe3+、Cu2+、Fe2+、Mg2+、Al3+等;
CO32-:H+、Ba2+、Ca2+等;
SO42-:Ba2+等;
Cl-:Ag+等。
复分解反应的应用——离子共存
D
1.下列有关氨碱法与侯氏制碱法的说法错误的是( )
A. 这两种方法都利用了不同物质的溶解能力不同进行分离
B. 侯氏制碱法比氨碱法制碱的工艺更绿色环保
C. 所用盐水都是除去杂质后的精盐水
D. 其产品纯碱是一种用途广泛的碱
2. 鉴定某溶液中是否含有CO32-,应该选用的试剂是( )
A.稀盐酸和澄清石灰水 B.紫色石蕊试液
C.氢氧化钠溶液 D.酚酞试液
3.只用一种试剂就能把NaOH溶液、稀盐酸和澄清石灰水鉴别开来,这种试剂可以是下列物质中的( )
A.BaCl2溶液 B.石蕊试液 C.酚酞试液
D.Na2CO3溶液 E.pH试纸
A
D
4.有甲、乙两个相邻的工厂,排放的污水经过初步处理后只溶有:Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、OH-、NO3﹣中的各不相同的4种离子,若单独排放仍会造成环境污染,如按适当比例混合排放,则污染程度大大降低,现又测得甲厂污水pH>7,
试推断: (1)甲厂污水中含有的4种离子可能是 ;
(2)乙厂污水中含有的4种离子可能是 。
Na+、OH-、Cl-、SO42-
Ag+、Fe3+、Ba2+、NO3﹣
海水“制碱”
氨碱法制纯碱
纯碱的性质
流程
纯碱的用途
碳酸氢钠的性质和用途
碱性
与酸反应
与氢氧化钙反应
与氯化钡反应
复分解反应
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
