7.1 酸及其性质 课件(共27张PPT内嵌视频) 2023-2024学年鲁教版化学九年级下册
文档属性
| 名称 | 7.1 酸及其性质 课件(共27张PPT内嵌视频) 2023-2024学年鲁教版化学九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 54.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-19 22:07:47 | ||
图片预览








文档简介
(共27张PPT)
第一节 酸及其性质
2015年5月7日,104国道张夏镇凤凰庄路段硫酸罐车侧翻,18吨浓硫酸泄漏,消防部门不知情用水浇,排水沟升起几十米高白雾,浓硫酸泄漏区初定轻度污染。
“白雾”中的十几颗大树的树叶逐渐枯萎,说明硫酸有哪些性质?
1.能列举浓盐酸、浓硫酸的物理性质和用途;
2.能说出浓硫酸的特性和稀释方法;
3.能概括盐酸、稀硫酸的主要化学性质;
4.能从微观角度认识酸具有相似化学性质的原因;
5.能识别复分解反应。
一、常见的酸
浓盐酸是 液体, 气味, ,在空气中会形成____。
浓硫酸具有 和强烈的 ,在使用时应十分小心。
无色
有刺激性
易挥发
吸水性
腐蚀性
白雾
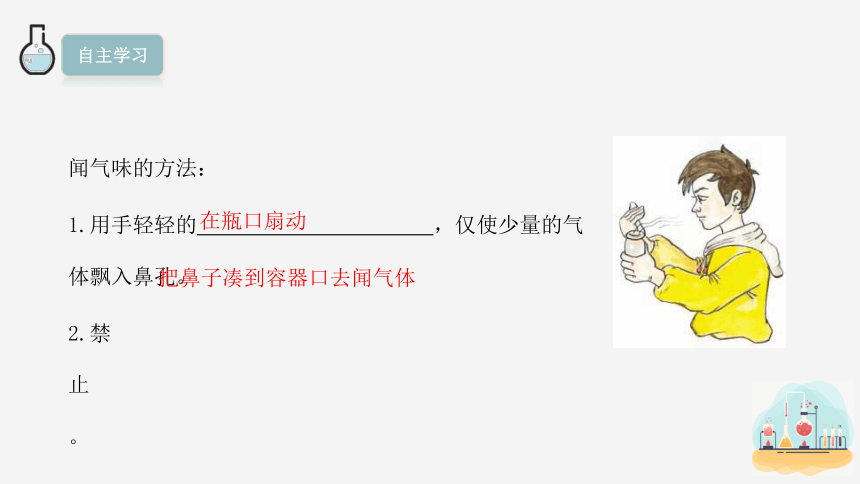
闻气味的方法:
1.用手轻轻的 ,仅使少量的气体飘入鼻孔。
2.禁止 。
在瓶口扇动
把鼻子凑到容器口去闻气体
二、酸的化学性质
1.使紫色石蕊试液变 ,使无色酚酞 。
2.酸+金属=== + (如:能与锌、铁、镁等反应)
①硫酸与镁条反应 。
②盐酸与铁钉反应 。
红
不变色
盐
氢气
Mg+H2SO4=MgSO4+H2↑
Fe+2HCl=FeCl2+H2↑
3.酸+金属氧化物=== + 。
4.与某些盐反应:酸+ === + 。
例:盐酸与硝酸银 。
盐
水
盐
新酸
新盐
HCl+AgNO3=AgCl↓+HNO3
由 阳离子和 阴离子构成的化合物,化学上把这类化合物称为盐。
金属
酸根
三、常见的酸的用途
1.工业上稀盐酸和稀硫酸都可以除 。
2.人体胃液中含有 ,帮助消化。
3.浓硫酸具有 性,在实验室中常用它做干燥剂。
铁锈
盐酸
吸水
用 途
浓硫酸 H2SO4 70%以上用于生产化肥,其余用于农药、炸药、医药、染料及冶金、石油化工、轻工、纺织等生产领域
浓盐酸 HCl 制药、作除锈剂等
浓硝酸 HNO3 生产化肥、炸药、染料、医药、橡胶、塑料及冶金、化
工等领域
探究一:浓硫酸与浓盐酸
[情景展示]
1.观察现象并填表
名称 颜色 状态 气味 密度 溶质质量分数 打开瓶塞后的现象 其他
浓盐酸
浓硫酸
无色
液态
刺激性气味
1.18mg/mL
36%-38%
瓶口出现白雾
挥发性
腐蚀性
无色
油状液体
无味
1.84mg/mL
95%-98%
无明显现象
腐蚀性吸水性
溶质的质量 溶剂的质量 溶液的质量 溶质的质量分数
浓盐酸
浓硫酸
减小
不变
减小
减小
不变
增大
增大
减小
浓盐酸、浓硫酸敞口放置后,相关量发生的变化及其原因。(不考虑水蒸发)
[思考交流]
[情景展示]
将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,用玻璃棒不断搅动,并用手接触烧杯外壁。
手的感觉
分析
发热或烫
浓硫酸溶于水放热
如何稀释浓硫酸
[思考交流]
1.将水注入到浓硫酸中会有什么后果?
水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅,这是非常危险的!
使浓硫酸溶于水放出的热量及时散失,防止液滴飞溅,灼伤皮肤。
2.你能解释玻璃棒不断搅拌的目的吗?
立即用大量水冲洗,再涂上3%-5%的碳酸氢钠溶液。
当稀硫酸沾到皮肤或衣服上,也必须及时处理,因为稀硫酸长期露置在空气中,随着水分的蒸发,将转变为浓硫酸,会对皮肤或衣服造成强烈的腐蚀。
3.如果不慎将浓硫酸沾到皮肤或衣服上,应如何处理
4.如果不慎将稀硫酸沾到皮肤或衣服上,有人认为不是浓硫酸,不需要进行处理,你觉得这种做法对吗?为什么?
探究二:酸的化学性质
【实验1】酸与指示剂的作用
【记录】
操作 分别取少量稀盐酸、稀硫酸,滴入石蕊试液 分别取少量稀盐酸、稀硫酸,滴入酚酞试液
现象
溶液变红
不变色
【结论】
酸可以使石蕊试液变红,使无色酚酞试液不变色。
【实验2】酸与金属反应
【记录】
【讨论】
操作 与稀盐酸反应 与稀硫酸反应
镁
锌
铁
Mg+2HCl=MgCl2 +H2↑
Zn+2HCl=ZnCl2 +H2↑
Fe+2HCl=FeCl2 +H2↑
Mg+H2SO4=MgSO4 +H2↑
Zn+H2SO4=ZnSO4 +H2↑
Fe+H2SO4=FeSO4 +H2↑
上面反应的生成物有什么共同之处?你能得出什么规律?
上述反应都会生成氢气,另一生成物是金属离子与酸根离子构成的化合物(盐)
酸 + 活泼金属 → 盐 + 氢气
【实验3】酸与金属氧化物反应
【记录】
【讨论】
上面反应的生成物有什么共同之处?你能得出什么规律?
上述反应都会生成水,另一生成物是金属离子与酸根离子构成的化合物(盐)
酸 + 金属氧化物 → 盐 + 水
现 象 化学方程式
铁锈+盐酸
铁锈+硫酸
铁锈消失,溶液变为黄色(Fe3+)
Fe2O3 + 6HCl = 2FeCl3+ 3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
【实验4】酸与盐反应
【记录】
【结论】
实验内容 现象 化学方程式
稀盐酸与硝酸银
稀盐酸与碳酸钠
稀硫酸与氯化钡
结论:酸 + 盐 → 新酸 + 新盐
AgNO3+HCl==AgCl↓+HNO3
有白色沉淀生成
有气体生成
Na2CO3+2HCl==2NaCl+H2O+CO2↑
H2SO4+BaCl2==BaSO4↓+2HCl
有白色沉淀生成
像这类由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
这些反应有什么共同之处?
[思考交流]
1.根据以上四个实验,你能总结出酸的通性吗?
1.能使紫色石蕊试液变红;
2.能与某些金属氧化物反应,生成盐和水;
3.能与某些金属反应,生成盐和氢气;
4.能与部分盐反应,生成新的盐和新的酸。
2.为什么硫酸、盐酸具有相似的化学性质呢?
那是因为硫酸、盐酸溶于水时,都解离出共同的阳离子——氢离子。正是由于氢离子的存在,导致它们具有相似的化学性质,称作酸的通性。
3.为什么在硫酸、盐酸与氯化钡的反应中,硫酸与盐酸又表现出不同的性质呢?
因为不同的酸溶于水时解离出的酸根阴离子不同,其性质也就存在差异。所以,硫酸能与氯化钡(BaCl2)反应生成白色沉淀(BaSO4),而盐酸不可以。
2.向某溶液中滴入无色酚酞溶液后不显色,向该溶液中滴入紫色石蕊溶液,则( )
A.一定显红色定 B.可能仍为紫色,也可能显示红色
C.可能仍为红色 D.一定显示蓝色
1.老师在滤纸上用紫色石蕊溶液画漫画,然后再喷洒某种液体X,滤纸上立即显示出红色图象,则X可能是( )
A.稀盐酸 B.蒸馏水 C.石灰水 D.食盐水
A
B
3.下列不能直接由金属与稀盐酸反应制得的是( )
A.氯化镁 B.氯化亚铁 C.氯化铁 D.氯化铝
C
4.将一枚生锈的铁钉(主要成份是Fe2O3)放入试管中,滴入足量稀盐酸,发现________消失,并产生_________,化学方程式表示可用_____________________________、_______________________。
铁锈
气泡
6HCl + Fe2O3=2FeCl3 +3H2O
2HCl + Fe=FeCl2+H2↑
常见的酸
酸的化学性质
盐酸
硫酸
与紫色石蕊试剂与无色酚酞试剂反应
与金属反应
与金属氧化物反应
与盐反应
复分解反应
第一节 酸及其性质
2015年5月7日,104国道张夏镇凤凰庄路段硫酸罐车侧翻,18吨浓硫酸泄漏,消防部门不知情用水浇,排水沟升起几十米高白雾,浓硫酸泄漏区初定轻度污染。
“白雾”中的十几颗大树的树叶逐渐枯萎,说明硫酸有哪些性质?
1.能列举浓盐酸、浓硫酸的物理性质和用途;
2.能说出浓硫酸的特性和稀释方法;
3.能概括盐酸、稀硫酸的主要化学性质;
4.能从微观角度认识酸具有相似化学性质的原因;
5.能识别复分解反应。
一、常见的酸
浓盐酸是 液体, 气味, ,在空气中会形成____。
浓硫酸具有 和强烈的 ,在使用时应十分小心。
无色
有刺激性
易挥发
吸水性
腐蚀性
白雾
闻气味的方法:
1.用手轻轻的 ,仅使少量的气体飘入鼻孔。
2.禁止 。
在瓶口扇动
把鼻子凑到容器口去闻气体
二、酸的化学性质
1.使紫色石蕊试液变 ,使无色酚酞 。
2.酸+金属=== + (如:能与锌、铁、镁等反应)
①硫酸与镁条反应 。
②盐酸与铁钉反应 。
红
不变色
盐
氢气
Mg+H2SO4=MgSO4+H2↑
Fe+2HCl=FeCl2+H2↑
3.酸+金属氧化物=== + 。
4.与某些盐反应:酸+ === + 。
例:盐酸与硝酸银 。
盐
水
盐
新酸
新盐
HCl+AgNO3=AgCl↓+HNO3
由 阳离子和 阴离子构成的化合物,化学上把这类化合物称为盐。
金属
酸根
三、常见的酸的用途
1.工业上稀盐酸和稀硫酸都可以除 。
2.人体胃液中含有 ,帮助消化。
3.浓硫酸具有 性,在实验室中常用它做干燥剂。
铁锈
盐酸
吸水
用 途
浓硫酸 H2SO4 70%以上用于生产化肥,其余用于农药、炸药、医药、染料及冶金、石油化工、轻工、纺织等生产领域
浓盐酸 HCl 制药、作除锈剂等
浓硝酸 HNO3 生产化肥、炸药、染料、医药、橡胶、塑料及冶金、化
工等领域
探究一:浓硫酸与浓盐酸
[情景展示]
1.观察现象并填表
名称 颜色 状态 气味 密度 溶质质量分数 打开瓶塞后的现象 其他
浓盐酸
浓硫酸
无色
液态
刺激性气味
1.18mg/mL
36%-38%
瓶口出现白雾
挥发性
腐蚀性
无色
油状液体
无味
1.84mg/mL
95%-98%
无明显现象
腐蚀性吸水性
溶质的质量 溶剂的质量 溶液的质量 溶质的质量分数
浓盐酸
浓硫酸
减小
不变
减小
减小
不变
增大
增大
减小
浓盐酸、浓硫酸敞口放置后,相关量发生的变化及其原因。(不考虑水蒸发)
[思考交流]
[情景展示]
将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,用玻璃棒不断搅动,并用手接触烧杯外壁。
手的感觉
分析
发热或烫
浓硫酸溶于水放热
如何稀释浓硫酸
[思考交流]
1.将水注入到浓硫酸中会有什么后果?
水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅,这是非常危险的!
使浓硫酸溶于水放出的热量及时散失,防止液滴飞溅,灼伤皮肤。
2.你能解释玻璃棒不断搅拌的目的吗?
立即用大量水冲洗,再涂上3%-5%的碳酸氢钠溶液。
当稀硫酸沾到皮肤或衣服上,也必须及时处理,因为稀硫酸长期露置在空气中,随着水分的蒸发,将转变为浓硫酸,会对皮肤或衣服造成强烈的腐蚀。
3.如果不慎将浓硫酸沾到皮肤或衣服上,应如何处理
4.如果不慎将稀硫酸沾到皮肤或衣服上,有人认为不是浓硫酸,不需要进行处理,你觉得这种做法对吗?为什么?
探究二:酸的化学性质
【实验1】酸与指示剂的作用
【记录】
操作 分别取少量稀盐酸、稀硫酸,滴入石蕊试液 分别取少量稀盐酸、稀硫酸,滴入酚酞试液
现象
溶液变红
不变色
【结论】
酸可以使石蕊试液变红,使无色酚酞试液不变色。
【实验2】酸与金属反应
【记录】
【讨论】
操作 与稀盐酸反应 与稀硫酸反应
镁
锌
铁
Mg+2HCl=MgCl2 +H2↑
Zn+2HCl=ZnCl2 +H2↑
Fe+2HCl=FeCl2 +H2↑
Mg+H2SO4=MgSO4 +H2↑
Zn+H2SO4=ZnSO4 +H2↑
Fe+H2SO4=FeSO4 +H2↑
上面反应的生成物有什么共同之处?你能得出什么规律?
上述反应都会生成氢气,另一生成物是金属离子与酸根离子构成的化合物(盐)
酸 + 活泼金属 → 盐 + 氢气
【实验3】酸与金属氧化物反应
【记录】
【讨论】
上面反应的生成物有什么共同之处?你能得出什么规律?
上述反应都会生成水,另一生成物是金属离子与酸根离子构成的化合物(盐)
酸 + 金属氧化物 → 盐 + 水
现 象 化学方程式
铁锈+盐酸
铁锈+硫酸
铁锈消失,溶液变为黄色(Fe3+)
Fe2O3 + 6HCl = 2FeCl3+ 3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
【实验4】酸与盐反应
【记录】
【结论】
实验内容 现象 化学方程式
稀盐酸与硝酸银
稀盐酸与碳酸钠
稀硫酸与氯化钡
结论:酸 + 盐 → 新酸 + 新盐
AgNO3+HCl==AgCl↓+HNO3
有白色沉淀生成
有气体生成
Na2CO3+2HCl==2NaCl+H2O+CO2↑
H2SO4+BaCl2==BaSO4↓+2HCl
有白色沉淀生成
像这类由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
这些反应有什么共同之处?
[思考交流]
1.根据以上四个实验,你能总结出酸的通性吗?
1.能使紫色石蕊试液变红;
2.能与某些金属氧化物反应,生成盐和水;
3.能与某些金属反应,生成盐和氢气;
4.能与部分盐反应,生成新的盐和新的酸。
2.为什么硫酸、盐酸具有相似的化学性质呢?
那是因为硫酸、盐酸溶于水时,都解离出共同的阳离子——氢离子。正是由于氢离子的存在,导致它们具有相似的化学性质,称作酸的通性。
3.为什么在硫酸、盐酸与氯化钡的反应中,硫酸与盐酸又表现出不同的性质呢?
因为不同的酸溶于水时解离出的酸根阴离子不同,其性质也就存在差异。所以,硫酸能与氯化钡(BaCl2)反应生成白色沉淀(BaSO4),而盐酸不可以。
2.向某溶液中滴入无色酚酞溶液后不显色,向该溶液中滴入紫色石蕊溶液,则( )
A.一定显红色定 B.可能仍为紫色,也可能显示红色
C.可能仍为红色 D.一定显示蓝色
1.老师在滤纸上用紫色石蕊溶液画漫画,然后再喷洒某种液体X,滤纸上立即显示出红色图象,则X可能是( )
A.稀盐酸 B.蒸馏水 C.石灰水 D.食盐水
A
B
3.下列不能直接由金属与稀盐酸反应制得的是( )
A.氯化镁 B.氯化亚铁 C.氯化铁 D.氯化铝
C
4.将一枚生锈的铁钉(主要成份是Fe2O3)放入试管中,滴入足量稀盐酸,发现________消失,并产生_________,化学方程式表示可用_____________________________、_______________________。
铁锈
气泡
6HCl + Fe2O3=2FeCl3 +3H2O
2HCl + Fe=FeCl2+H2↑
常见的酸
酸的化学性质
盐酸
硫酸
与紫色石蕊试剂与无色酚酞试剂反应
与金属反应
与金属氧化物反应
与盐反应
复分解反应
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
