1.2 化学能转化为电能——电池 课时训练(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.2 化学能转化为电能——电池 课时训练(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 357.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-19 19:26:58 | ||
图片预览




文档简介
1.2 化学能转化为电能——电池 课时训练
一、单选题
1.我国科学家发明一种新型电池,该电池以碳纳米管为正极、锌线为负极,放电时消耗二氧化碳,同时生成天然气.下列说法正确的是( )
A.碳纳米管参与电极反应 B.负极发生还原反应
C.阳离子由正极移向负极 D.正极产物为
2.如图是甲烷燃料电池的工作原理模拟示意图,下列说法不正确的是( )
A.电极B为正极
B.在电极A上发生氧化反应
C.电极A区发生反应:
D.当有通过外电路时,有通过阴离子交换膜
3.氢燃料电池汽车每投放100万辆,一年可减少二氧化碳排放5.1亿吨,这将极大助力碳中和目标实现。下列有关氢燃料电池说法错误的是( )
A.发展氢燃料电池汽车需要安全高效的储氢技术
B.理论上氢燃料电池汽车使用时不会产生污染物
C.氢燃料电池汽车直接将化学能转化为动能
D.氢燃料电池汽车运行不排放二氧化碳
4.一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为Cu+Br2=CuBr2。下列说法正确的是( )
A.铜为电池的正极
B.铂不断溶解
C.稀溴水为电解质溶液
D.电池工作时实现机械能向电能再向化学能转化
5.我们的生活与化学密切相关。下列叙述正确的是( )
A.氢燃料汽车是利用电解池的原理提供电能
B.石油分馏出来的各馏分仍是多种烃的混合物
C.苏打常用于治疗胃酸过多
D.“葱油粑粑”中的“油”属于酯类,是高分子
6.下列说法正确的是( )
A.构成原电池的两个电极必须是活泼性不同的两种金属
B.右图原电池中,电流由锌棒经外电路流向铜棒
C.通过构成原电池,能将反应的化学能全部转化为电能
D.银锌纽扣电池的放电反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应
7.化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是( )
A. Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 正极的电极反应式为Ag2O+2e +H2O 2Ag+2OH
C. 锌筒作负极,发生氧化反应,锌筒会变薄
D. 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
8.某种培根型碱性氢氧燃料电池示意图如所示,下列有关该电池的说法错误的是
A.电池放电时,向镍电极Ⅰ的方向迁移
B.正极电极反应为:
C.出口Ⅰ处有水生成
D.循环泵可使电解质溶液不断浓缩、循环
9.LiFePO4是锂离子电池一种电极材料,其结构稳定、资源丰富、安全性能好、无毒.该电极材料在充放电时的变化如图所示,下列有关说法正确的是( )
A.放电时该电极为负极
B.充电是Li+向阳极移动
C.充电时该电极发生氧化反应,反应式为LiFePO4﹣e﹣=FePO4+Li+
D.该电池可以用磷酸溶液作电解质
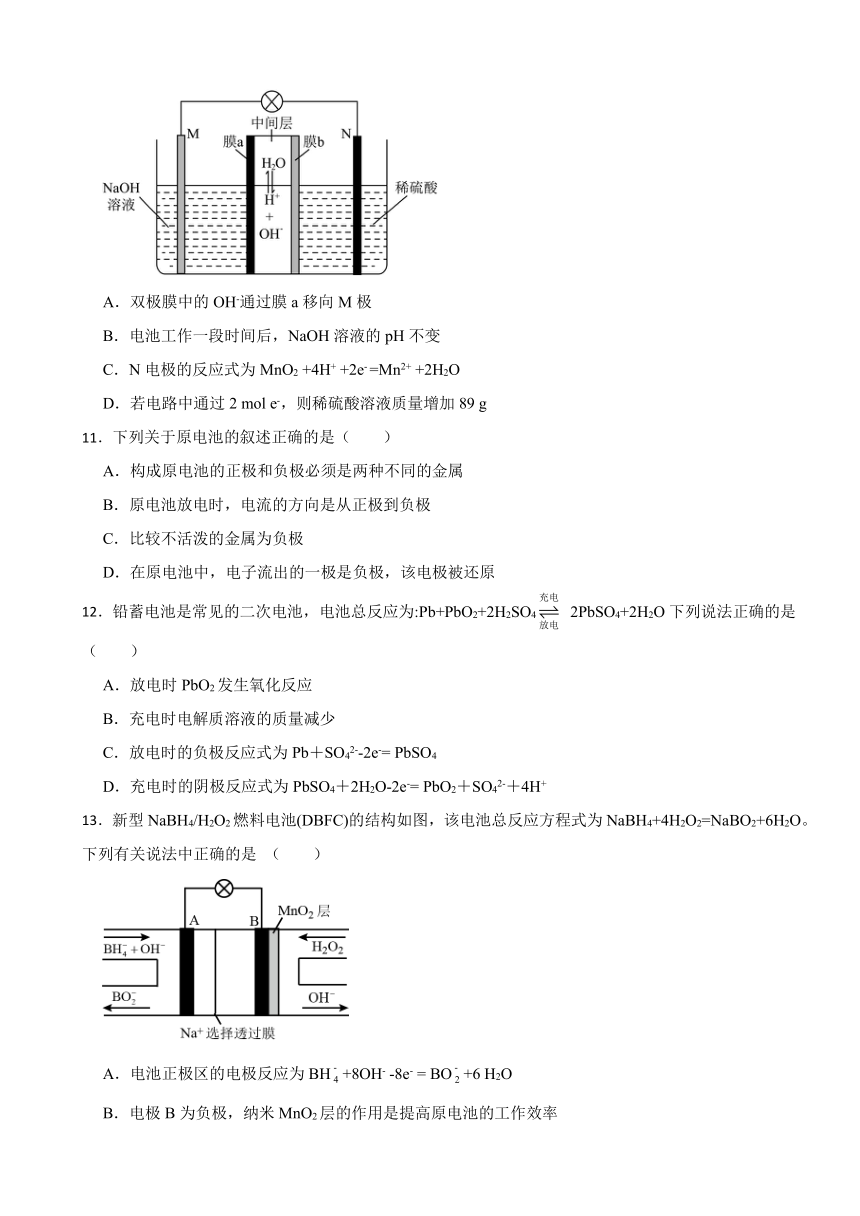
10.我国科研人员利用双极膜技术构造出一类具有高能量密度、优异的循环性能的新型水系电池,模拟装置如图所示。已知电极材料分别为Zn和MnO2,相应的产物为和Mn2+。下列说法错误的是
A.双极膜中的OH-通过膜a移向M极
B.电池工作一段时间后,NaOH溶液的pH不变
C.N电极的反应式为MnO2 +4H+ +2e- =Mn2+ +2H2O
D.若电路中通过2 mol e-,则稀硫酸溶液质量增加89 g
11.下列关于原电池的叙述正确的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池放电时,电流的方向是从正极到负极
C.比较不活泼的金属为负极
D.在原电池中,电子流出的一极是负极,该电极被还原
12.铅蓄电池是常见的二次电池,电池总反应为:Pb+PbO2+2H2SO4 2PbSO4+2H2O下列说法正确的是( )
A.放电时PbO2发生氧化反应
B.充电时电解质溶液的质量减少
C.放电时的负极反应式为Pb+SO42--2e-= PbSO4
D.充电时的阴极反应式为PbSO4+2H2O-2e-= PbO2+SO42-+4H+
13.新型NaBH4/H2O2燃料电池(DBFC)的结构如图,该电池总反应方程式为NaBH4+4H2O2=NaBO2+6H2O。下列有关说法中正确的是 ( )
A.电池正极区的电极反应为BH+8OH- -8e- = BO+6 H2O
B.电极B为负极,纳米MnO2层的作用是提高原电池的工作效率
C.燃料电池每消耗3 mol H2O2,理论上通过电路中的电子数为6NA
D.燃料电池在放电过程中,Na+从正极区向负极区迁移
14.如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
A.该装置将电能转变为化学能 B.电流从铜片经导线流向锌片
C.一段时间后,铜片质量减轻 D.锌片发生还原反应
15.如图所示,电流表A指针发生偏转,同时M极质量减少,N极有气泡冒出,B为电解质溶液。则M、N、B分别为( )
A.M是Cu,N是Zn,B是稀硫酸 B.M是Zn,N是Cu,B是CuCl2溶液
C.M是Fe,N是Al,B是NaOH溶液 D.M是Fe,N是Ag,B是稀硫酸
16.如图所示的原电池装置X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
A.电极X为正极,发生还原反应
B.移向Y电极
C.若分别用Zn和Fe做电极材料,则电极Y为Zn
D.电极Y上有氢气生成
17.某锂离子电池的工作原理如图所示(a极材料为金属锂和石墨的复合材料),其电池反应为Li+FePO4=LiFePO4。下列关于该电池的说法正确的是( )
A.a极为正极 B.b极发生氧化反应
C.Li+从a极室向b极室移动 D.可以用稀硫酸作电解质溶液
18.铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )
A.碱洗目的是除去铝材表面的自然氧化膜:2OH﹣+Al2O3═2AlO2﹣+H2O
B.碱洗时铝材表面会出现气泡:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
C.获得耐蚀铝材的电极反应为:4Al﹣12e﹣+3O2═2Al2O3
D.用稀氨水洗去耐蚀铝材表面的酸:NH3 H2O+H+═NH4++H2O
19.某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A.正极反应式为:O2+2H2O+4e﹣═4OH﹣
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2═2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
20.我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池,将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na
2Na2CO3+C,下列说法错误的是()
A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-=2CO32-+C
D.充电时,正极反应为:Na+ + e- =Na
答案解析部分
1.【答案】D
【解析】【解答】A、正极上是二氧化碳发生还原反应生成甲烷,碳纳米管不参与电极反应,故A错误;
B、负极发生氧化反应,故B错误;
C、原电池工作时,阳离子移向正极,故C错误;
D、由分析可知,正极上二氧化碳发生还原反应生成甲烷,故D正确;
故答案为:D。
【分析】该电池以碳纳米管为正极、锌线为负极,放电时消耗二氧化碳,同时生成天然气,则负极上锌发生氧化反应,正极上二氧化碳发生还原反应生成甲烷。
2.【答案】D
3.【答案】C
【解析】【解答】A. 氢气密度小、沸点低、难液化、难溶于水,发展氢燃料电池汽车需要安全高效的储氢技术,故A不符合题意;
B. 理论上氢燃料电池汽车使用时生成物为水,不会产生污染物,故B不符合题意;
C. 氢燃料电池汽车直接将化学能转化为电能再转化为动能等,故C符合题意;
D. 氢燃料电池汽车运行产物是水,不排放二氧化碳,故D不符合题意;
故答案为:C。
【分析】氢氧燃料电池是将化学能转化为电能的装置再将电能转化为动能,不是直接转化为动能,故其他选项均正确
4.【答案】C
【解析】【解答】A.根据电池反应 Cu+Br2=CuBr2 ,Cu失电子被氧化作负极,A错误;
B.根据电池反应 Cu+Br2=CuBr2 ,Cu失电子被氧化作负极,Pt为正极,Br2在Pt上得电子,Pt不反应,不会溶解,B错误;
C.Cu-Pt-溴水构成原电池,稀溴水为电解液,C正确;
D.原电池化学能变为电能,没有机械能变为电能,D错误;
故答案为:C
【分析】原电池工作原理
判断电极的方法:
(1)通过反应类型判断 ①失去电子的电极为负极,发生氧化反应; ②得到电子的电极为正极,发生还原反应。
(2)通过电子定向移动方向和电流方向判断 ①电子流出的电极为负极,电子经外电路流入正极; ②电流流出的电极为正极,电流经外电路流入负极。
(3)根据离子移动方向判断 阴离子向负极移动,阳离子向正极移动。 (4)根据电极现象判断 一般不断溶解、质量减轻的电极为负极;有固体析出、质量增加或不变或有气体产生的电极为正极。
5.【答案】B
【解析】【解答】A、氢燃料电池是利用氢气燃烧释放的能量转化为电能,属于原电池装置,A不符合题意。
B、石油分馏产物为多种烃的混合物,B符合题意。
C、苏打为Na2CO3,小苏打为NaHCO3,用于治疗胃酸过多的是小苏打,C不符合题意。
D、“葱油粑粑”中的“油”是油脂,属于酯类,但不是高分子,D不符合题意。
故答案为:B
【分析】A、燃料电池属于原电池。
B、石油的分馏产品为多种烃的混合物。
C、小苏打用于治疗胃酸过多。
D、“油”是油脂,不属于高分子。
6.【答案】D
【解析】【解答】解:A.构成原电池的两个电极不一定都是金属,可以是一极为较活泼金属,另一极为石墨棒,故A错误;
B.该原电池中,锌为负极,铜为正极,电流由铜棒经外电路流向锌棒,故B错误;
C.通过构成原电池,能将反应的化学能转化为电能,由于存在能量损失,则不可能将化学能全部转化为电能,故C错误;
D.由电池总反应可知该纽扣电池的反应中Zn为还原剂、Ag2O为氧化剂,故Zn为负极被氧化、Ag2O为正极被还原,发生还原反应,故D正确;
故选D.
【分析】A.两个电极中,可以一极为较活泼金属,另一极为石墨棒;
B.电流从原电池正极流向负极,锌为负极,铜为正极;
C.原电池是将化学能转化成电能的装置,但是能量的转化率不可能为100%;
D.根据化合价变化可知Ag元素化合价降低被还原,应为原电池的正极,在正极上发生还原反应.
7.【答案】A
【解析】【解答】A.Zn较Cu活泼,做负极,Zn失电子变Zn2+,电子经导线转移到铜电极,铜电极负电荷变多,吸引了溶液中的阳离子,因而Zn2+和H+迁移至铜电极,H+氧化性较强,得电子变H2,因而c(H+)减小,A项符合题意;
B. Ag2O作正极,得到来自Zn失去的电子,被还原成Ag,结合KOH作电解液,故电极反应式为Ag2O+2e +H2O 2Ag+2OH ,B项不符合题意;
C.Zn为较活泼电极,做负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,锌溶解,因而锌筒会变薄,C项不符合题意;
D.铅蓄电池总反应式为PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2O,可知放电一段时间后,H2SO4不断被消耗,因而电解质溶液的酸性减弱,导电能力下降,D项不符合题意。
故答案为:A。
【分析】A.根据原电池中离子移动是正移正,负移负,及电极反应进行判断。
8.【答案】A
【解析】【解答】A.原电池中,阳离子向正极移动,由分析可知镍电极Ⅱ为正极,则向镍电极Ⅱ的方向迁移,故A符合题意;
B.由分析可知,镍电极Ⅱ为正极,电极方程式为:,故B不符合题意;
C.镍电极Ⅰ为负极,电极方程式为:H2+2e-+2OH-=2H2O,出口Ⅰ处有水生成,故C不符合题意;
D.由图示可知,循环泵可使电解质溶液不断浓缩、循环,故D不符合题意;
故答案为:A。
【分析】氢氧燃料电池中,通入氢气的一极为负极,负极发生氧化反应,通入氧气的一极为正极,正极发生还原反应,原电池工作时,阳离子向正极移动。
9.【答案】C
【解析】【解答】A、放电时, LiFePO4得电子发生还原反应为正极,充电时发生氧化反应为阳极,故A不符合题意;
B、放电时,阳离子移向正极,充电时Li+向阴极移动,故B不符合题意;
C、放电时, LiFePO4得电子发生还原反应为正极,充电时发生氧化反应为阳极,电极反应式为: LiFePO4﹣e﹣=FePO4+Li+,所以C选项是符合题意的;
D、金属Li能够与硫酸反应,不可以用磷酸溶液作电解质,故D不符合题意;
故答案为:C。
【分析】根据放电时化合价变化判断原电池的电极,结合电解池原理和原电池原理进行解答即可。
10.【答案】B
【解析】【解答】A.由题给信息Zn生成Zn(OH),MnO2生成Mn2+可知,M极为Zn电极,N电极材料为MnO2,即M极为负极,N极为正极,OH-移向负极,A项不符合题意;
B.负极的电极反应式为Zn+4OH--2e-=Zn(OH),每转移2 mol e-,有2 molOH-移向NaOH溶液,而消耗4molOH-,NaOH溶液的pH变小,B项符合题意;
C.N电极材料为MnO2,MnO2在正极得到电子生成Mn2+,电极方程式为:MnO2 +4H+ +2e- =Mn2+ +2H2O,故C不符合题意;
D.若电路中通过2 mol e-,双极膜中有2 mol H+移向硫酸溶液,同时溶解1 mol MnO2,稀硫酸溶液质量增加2mol1g/mol+1mol87g/mol=89g,D项不符合题意;
故答案为:B。
【分析】根据题意,Zn发生氧化反应生成Zn(OH),Zn为负极,即M极为Zn,电极反应式为Zn+4OH--2e-=Zn(OH),N电极材料为MnO2,电极反应式为MnO2 +4H+ +2e- =Mn2+ +2H2O。
11.【答案】B
【解析】【解答】A. 构成原电池的正极和负极不一定必须是两种不同的金属,也可以是金属与能导电的非金属,A不符合题意;
B. 原电池放电时,电流的方向是从正极到负极,B符合题意;
C. 比较不活泼的金属为正极,C符合题意;
D. 在原电池中,电子流出的一极是负极,该电极被氧化,D不符合题意;
答案选B。
【分析】A.原电池的电极除活泼性不同的金属外,也可以是导电的非金属;
B.原电池的电流方向与电子流向相反;
C.原电池中相对活泼的金属做负极;
D.原电池中负极发生氧化反应。
12.【答案】C
【解析】【解答】A、放电时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,Pb元素的化合价由PbO2中的+4价降为+2价,PbO2发生得电子的还原反应,A不符合题意;
B、充电时反应为2PbSO4+2H2O=Pb+PbO2+2H2SO4,消耗2molH2O生成2molH2SO4,H2O的摩尔质量小于H2SO4的摩尔质量,电解质溶液的质量增加,B不符合题意;
C、放电时负极Pb失电子发生氧化反应,负极反应式为Pb+SO42--2e-=PbSO4,C符合题意;
D、充电时阴极发生得电子的还原反应,电极反应式为PbSO4+2e-=Pb+SO42-,D不符合题意;
故答案为:C
【分析】铅蓄电池放电过程,为原电池装置,其负极反应式为:Pb+SO42--2e-=PbSO4,正极反应式为:PbO2+4H++2e-+SO42-=PbSO4+2H2O;充电过程为电解池装置,其阳极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42-,其阴极反应式为:PbSO4+2e-=Pb+SO42-;据此结合选项进行分析。
13.【答案】C
【解析】【解答】A.根据分析,电极B为正极,正极区的电极反应为H2O2+2e-=2OH-,A项不符合题意;
B.根据分析,电极B为正极,B项不符合题意;
C.电池总反应方程式为NaBH4+4H2O2=NaBO2+6H2O,反应中H2O2中O元素的化合价由-1价降至-2价,每消耗3 mol H2O2,理论上通过电路中的电子物质的量为6mol,通过电路的电子数为6NA,C项符合题意;
D.燃料电池在放电过程中,阳离子Na+从负极区向正极区迁移,D项不符合题意;
故答案为:C。
【分析】A.电极A上发生氧化反应,作电池的负极;
B.电极B上H2O2发生还原反应,作正极;
C.;
D.原电池中阳离子移向正极。
14.【答案】B
【解析】【解答】解:Zn能够与稀硫酸反应,所以能构成原电池,化学能转化为电能,锌易失电子发生氧化反应而作负极,铜作正极,氢离子在Cu电极上得电子生成氢气,Cu质量不变,电流从正极Cu沿导线流向负极Zn,
故选B.
【分析】该装置能自发的进行氧化还原反应,所以能构成原电池,锌易失电子发生氧化反应而作负极,铜作正极,电子从负极沿导线流向正极,电流流向与此相反,据此分析解答.
15.【答案】D
【解析】【解答】A.由分析可知,M为负极N为正极,则M比N活泼,故A不选;
B.由A可知M比N活泼,M是Zn,N是Cu,但由于N极有气泡产生,则溶液应为酸,故B不选;
C.在NaOH强碱溶液中,Al电极发生氧化反应为负极,由题意N为正极,故C不选;
D.由题意有M是Fe,N是Ag,B是稀硫酸,银为正极,氢离子在此极得电子,生成氢气,有气泡冒出,
故答案为:D。
【分析】由题意可知,M极发生氧化反应为负极,N极为正极,结合原电池工作原理相关知识解此题。
16.【答案】D
【解析】【解答】A.X为负极,Y为正极,负极上发生失电子的氧化反应、正极上发生得电子的还原反应,A不符合题意;
B.原电池工作时X为负极,Y为正极,阴离子移向负极,即移向X电极,B不符合题意;
C.若分别用Zn和Fe做电极材料,活泼的金属Zn做负极,即电极X为Zn,C不符合题意;
D.原电池工作时X为负极,Y为正极,Y电极反应为2H++2e-=H2↑,D符合题意;
故答案为:D。
【分析】原电池的角度进行分析,活泼金属作为负极,负极质量减少,正极质量增加或者生产气体,电子由负极经过导线流向正极,电流由正极经过导线流向负极。
17.【答案】C
【解析】【解答】A. 依据电池反应为Li+FePO4=LiFePO4,Li元素化合价升高,发生氧化反应,故 a极为负极,A错误;
B.依据电池反应为Li+FePO4=LiFePO4,FePO4中Fe元素化合价降低,则b极为正极,得电子,发生还原反应,B错误;
C.原电池“同性相吸”,阳离子移向正极,阴离子移向负极;Li+透过隔膜,从a极室进入b极室,C正确;
D.Li是活泼金属,能与稀硫酸反应,故不能用稀硫酸作电解质溶液,D错误;
故选C。
【分析】A、B放电时,负极失电子,元素化合价升高,发生氧化反应;正极得电子,元素化合价降低,发生还原反应;
C.原电池“同性相吸”,阳离子移向正极,阴离子移向负极;
D.Li是活泼金属,能与稀硫酸反应。
18.【答案】C
【解析】【解答】解:A.氧化铝为两性氧化物,与强碱反应生成盐和水,反应的离子方程式:2OH﹣+Al2O3═2AlO2﹣+H2O,故A正确;
B.铝与强碱溶液反应生成偏铝酸盐和氢气,离子方程式:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,故B正确;
C.获得耐蚀铝材的电极反应为:2Al+3H2O﹣6e﹣=Al2O3+6H+,故C错误;
D.用稀氨水洗去耐蚀铝材表面的酸,离子方程式:NH3 H2O+H+═NH4++H2O,故D正确;
故选:C.
【分析】A.氧化铝为两性氧化物,与强碱反应生成盐和水;
B.铝与强碱溶液反应生成偏铝酸盐和氢气;
C.阳极铝失去电子生成氧化铝和氢离子;
D.一水合氨与酸反应生成铵盐和水.
19.【答案】D
【解析】【解答】解:A.正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e﹣=4OH﹣,故A正确;
B.负极上氢气和氢氧根离子反应生成水,正极上氧气得电子和水反应生成氢氧根离子,所以溶液中钾离子没有参与反应,根据原子守恒知,KOH的物质的量不变,故B正确;
C.负极电极反应式为H2﹣2e﹣+2OH﹣=2H2O,正极电极反应式为O2+2H2O+4e﹣=4OH﹣,反应的总方程式为2H2+O2=2H2O,故C正确;
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况),n(Cl2)=0.1mol,根据2Cl﹣﹣2e﹣=Cl2↑,转移电子0.2mol,故D错误;
故选D.
【分析】氢氧燃料碱性电池中,通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2﹣2e﹣+2OH﹣=2H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e﹣=4OH﹣,反应的总方程式为2H2+O2=2H2O,结合氧气和转移电子之间的关系式计算.
20.【答案】D
【解析】【解答】A.根据方程式3CO2+4Na 2Na2CO3+C可得出二氧化碳作氧化剂、金属钠作还原剂,金属钠作负极而镍电极做正极,电子从负极流向正极(外电路)、电解质溶液中阴离子从正极流向负极,A不符合题意
B.根据电池方程式3CO2+4Na 2Na2CO3+C可知,放电时吸收二氧化碳,则充电时释放二氧化碳,B不符合题意
C.放电时二氧化碳得到电子转化成碳酸根和碳,即3CO2+4e-=2CO32-+C,C不符合题意
D.充电时为电解池,与原电池规律相反,且与正极相连的为阳极、与负极相连的为阴极,阴极钠离子失电子转变成金属钠,故D项应阴极反应方程式,D符合题意
故答案为:D
【分析】该题重点考查原电池的组成、正负极的判断、电子和电荷的移动、原电池与电解池的区别与联系,本题考查到的知识点有①正负极判断:失电子为负极、得电子为正极;②负电荷的移动:外电路从负极到正极、电解质溶液中正极到负极;③正负极方程式的书写;④电解池与原电池规律相反,原电池负极失电子而电解池阳极失电子;
一、单选题
1.我国科学家发明一种新型电池,该电池以碳纳米管为正极、锌线为负极,放电时消耗二氧化碳,同时生成天然气.下列说法正确的是( )
A.碳纳米管参与电极反应 B.负极发生还原反应
C.阳离子由正极移向负极 D.正极产物为
2.如图是甲烷燃料电池的工作原理模拟示意图,下列说法不正确的是( )
A.电极B为正极
B.在电极A上发生氧化反应
C.电极A区发生反应:
D.当有通过外电路时,有通过阴离子交换膜
3.氢燃料电池汽车每投放100万辆,一年可减少二氧化碳排放5.1亿吨,这将极大助力碳中和目标实现。下列有关氢燃料电池说法错误的是( )
A.发展氢燃料电池汽车需要安全高效的储氢技术
B.理论上氢燃料电池汽车使用时不会产生污染物
C.氢燃料电池汽车直接将化学能转化为动能
D.氢燃料电池汽车运行不排放二氧化碳
4.一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为Cu+Br2=CuBr2。下列说法正确的是( )
A.铜为电池的正极
B.铂不断溶解
C.稀溴水为电解质溶液
D.电池工作时实现机械能向电能再向化学能转化
5.我们的生活与化学密切相关。下列叙述正确的是( )
A.氢燃料汽车是利用电解池的原理提供电能
B.石油分馏出来的各馏分仍是多种烃的混合物
C.苏打常用于治疗胃酸过多
D.“葱油粑粑”中的“油”属于酯类,是高分子
6.下列说法正确的是( )
A.构成原电池的两个电极必须是活泼性不同的两种金属
B.右图原电池中,电流由锌棒经外电路流向铜棒
C.通过构成原电池,能将反应的化学能全部转化为电能
D.银锌纽扣电池的放电反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应
7.化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是( )
A. Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 正极的电极反应式为Ag2O+2e +H2O 2Ag+2OH
C. 锌筒作负极,发生氧化反应,锌筒会变薄
D. 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
8.某种培根型碱性氢氧燃料电池示意图如所示,下列有关该电池的说法错误的是
A.电池放电时,向镍电极Ⅰ的方向迁移
B.正极电极反应为:
C.出口Ⅰ处有水生成
D.循环泵可使电解质溶液不断浓缩、循环
9.LiFePO4是锂离子电池一种电极材料,其结构稳定、资源丰富、安全性能好、无毒.该电极材料在充放电时的变化如图所示,下列有关说法正确的是( )
A.放电时该电极为负极
B.充电是Li+向阳极移动
C.充电时该电极发生氧化反应,反应式为LiFePO4﹣e﹣=FePO4+Li+
D.该电池可以用磷酸溶液作电解质
10.我国科研人员利用双极膜技术构造出一类具有高能量密度、优异的循环性能的新型水系电池,模拟装置如图所示。已知电极材料分别为Zn和MnO2,相应的产物为和Mn2+。下列说法错误的是
A.双极膜中的OH-通过膜a移向M极
B.电池工作一段时间后,NaOH溶液的pH不变
C.N电极的反应式为MnO2 +4H+ +2e- =Mn2+ +2H2O
D.若电路中通过2 mol e-,则稀硫酸溶液质量增加89 g
11.下列关于原电池的叙述正确的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池放电时,电流的方向是从正极到负极
C.比较不活泼的金属为负极
D.在原电池中,电子流出的一极是负极,该电极被还原
12.铅蓄电池是常见的二次电池,电池总反应为:Pb+PbO2+2H2SO4 2PbSO4+2H2O下列说法正确的是( )
A.放电时PbO2发生氧化反应
B.充电时电解质溶液的质量减少
C.放电时的负极反应式为Pb+SO42--2e-= PbSO4
D.充电时的阴极反应式为PbSO4+2H2O-2e-= PbO2+SO42-+4H+
13.新型NaBH4/H2O2燃料电池(DBFC)的结构如图,该电池总反应方程式为NaBH4+4H2O2=NaBO2+6H2O。下列有关说法中正确的是 ( )
A.电池正极区的电极反应为BH+8OH- -8e- = BO+6 H2O
B.电极B为负极,纳米MnO2层的作用是提高原电池的工作效率
C.燃料电池每消耗3 mol H2O2,理论上通过电路中的电子数为6NA
D.燃料电池在放电过程中,Na+从正极区向负极区迁移
14.如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
A.该装置将电能转变为化学能 B.电流从铜片经导线流向锌片
C.一段时间后,铜片质量减轻 D.锌片发生还原反应
15.如图所示,电流表A指针发生偏转,同时M极质量减少,N极有气泡冒出,B为电解质溶液。则M、N、B分别为( )
A.M是Cu,N是Zn,B是稀硫酸 B.M是Zn,N是Cu,B是CuCl2溶液
C.M是Fe,N是Al,B是NaOH溶液 D.M是Fe,N是Ag,B是稀硫酸
16.如图所示的原电池装置X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
A.电极X为正极,发生还原反应
B.移向Y电极
C.若分别用Zn和Fe做电极材料,则电极Y为Zn
D.电极Y上有氢气生成
17.某锂离子电池的工作原理如图所示(a极材料为金属锂和石墨的复合材料),其电池反应为Li+FePO4=LiFePO4。下列关于该电池的说法正确的是( )
A.a极为正极 B.b极发生氧化反应
C.Li+从a极室向b极室移动 D.可以用稀硫酸作电解质溶液
18.铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )
A.碱洗目的是除去铝材表面的自然氧化膜:2OH﹣+Al2O3═2AlO2﹣+H2O
B.碱洗时铝材表面会出现气泡:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
C.获得耐蚀铝材的电极反应为:4Al﹣12e﹣+3O2═2Al2O3
D.用稀氨水洗去耐蚀铝材表面的酸:NH3 H2O+H+═NH4++H2O
19.某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A.正极反应式为:O2+2H2O+4e﹣═4OH﹣
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2═2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
20.我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池,将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na
2Na2CO3+C,下列说法错误的是()
A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-=2CO32-+C
D.充电时,正极反应为:Na+ + e- =Na
答案解析部分
1.【答案】D
【解析】【解答】A、正极上是二氧化碳发生还原反应生成甲烷,碳纳米管不参与电极反应,故A错误;
B、负极发生氧化反应,故B错误;
C、原电池工作时,阳离子移向正极,故C错误;
D、由分析可知,正极上二氧化碳发生还原反应生成甲烷,故D正确;
故答案为:D。
【分析】该电池以碳纳米管为正极、锌线为负极,放电时消耗二氧化碳,同时生成天然气,则负极上锌发生氧化反应,正极上二氧化碳发生还原反应生成甲烷。
2.【答案】D
3.【答案】C
【解析】【解答】A. 氢气密度小、沸点低、难液化、难溶于水,发展氢燃料电池汽车需要安全高效的储氢技术,故A不符合题意;
B. 理论上氢燃料电池汽车使用时生成物为水,不会产生污染物,故B不符合题意;
C. 氢燃料电池汽车直接将化学能转化为电能再转化为动能等,故C符合题意;
D. 氢燃料电池汽车运行产物是水,不排放二氧化碳,故D不符合题意;
故答案为:C。
【分析】氢氧燃料电池是将化学能转化为电能的装置再将电能转化为动能,不是直接转化为动能,故其他选项均正确
4.【答案】C
【解析】【解答】A.根据电池反应 Cu+Br2=CuBr2 ,Cu失电子被氧化作负极,A错误;
B.根据电池反应 Cu+Br2=CuBr2 ,Cu失电子被氧化作负极,Pt为正极,Br2在Pt上得电子,Pt不反应,不会溶解,B错误;
C.Cu-Pt-溴水构成原电池,稀溴水为电解液,C正确;
D.原电池化学能变为电能,没有机械能变为电能,D错误;
故答案为:C
【分析】原电池工作原理
判断电极的方法:
(1)通过反应类型判断 ①失去电子的电极为负极,发生氧化反应; ②得到电子的电极为正极,发生还原反应。
(2)通过电子定向移动方向和电流方向判断 ①电子流出的电极为负极,电子经外电路流入正极; ②电流流出的电极为正极,电流经外电路流入负极。
(3)根据离子移动方向判断 阴离子向负极移动,阳离子向正极移动。 (4)根据电极现象判断 一般不断溶解、质量减轻的电极为负极;有固体析出、质量增加或不变或有气体产生的电极为正极。
5.【答案】B
【解析】【解答】A、氢燃料电池是利用氢气燃烧释放的能量转化为电能,属于原电池装置,A不符合题意。
B、石油分馏产物为多种烃的混合物,B符合题意。
C、苏打为Na2CO3,小苏打为NaHCO3,用于治疗胃酸过多的是小苏打,C不符合题意。
D、“葱油粑粑”中的“油”是油脂,属于酯类,但不是高分子,D不符合题意。
故答案为:B
【分析】A、燃料电池属于原电池。
B、石油的分馏产品为多种烃的混合物。
C、小苏打用于治疗胃酸过多。
D、“油”是油脂,不属于高分子。
6.【答案】D
【解析】【解答】解:A.构成原电池的两个电极不一定都是金属,可以是一极为较活泼金属,另一极为石墨棒,故A错误;
B.该原电池中,锌为负极,铜为正极,电流由铜棒经外电路流向锌棒,故B错误;
C.通过构成原电池,能将反应的化学能转化为电能,由于存在能量损失,则不可能将化学能全部转化为电能,故C错误;
D.由电池总反应可知该纽扣电池的反应中Zn为还原剂、Ag2O为氧化剂,故Zn为负极被氧化、Ag2O为正极被还原,发生还原反应,故D正确;
故选D.
【分析】A.两个电极中,可以一极为较活泼金属,另一极为石墨棒;
B.电流从原电池正极流向负极,锌为负极,铜为正极;
C.原电池是将化学能转化成电能的装置,但是能量的转化率不可能为100%;
D.根据化合价变化可知Ag元素化合价降低被还原,应为原电池的正极,在正极上发生还原反应.
7.【答案】A
【解析】【解答】A.Zn较Cu活泼,做负极,Zn失电子变Zn2+,电子经导线转移到铜电极,铜电极负电荷变多,吸引了溶液中的阳离子,因而Zn2+和H+迁移至铜电极,H+氧化性较强,得电子变H2,因而c(H+)减小,A项符合题意;
B. Ag2O作正极,得到来自Zn失去的电子,被还原成Ag,结合KOH作电解液,故电极反应式为Ag2O+2e +H2O 2Ag+2OH ,B项不符合题意;
C.Zn为较活泼电极,做负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,锌溶解,因而锌筒会变薄,C项不符合题意;
D.铅蓄电池总反应式为PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2O,可知放电一段时间后,H2SO4不断被消耗,因而电解质溶液的酸性减弱,导电能力下降,D项不符合题意。
故答案为:A。
【分析】A.根据原电池中离子移动是正移正,负移负,及电极反应进行判断。
8.【答案】A
【解析】【解答】A.原电池中,阳离子向正极移动,由分析可知镍电极Ⅱ为正极,则向镍电极Ⅱ的方向迁移,故A符合题意;
B.由分析可知,镍电极Ⅱ为正极,电极方程式为:,故B不符合题意;
C.镍电极Ⅰ为负极,电极方程式为:H2+2e-+2OH-=2H2O,出口Ⅰ处有水生成,故C不符合题意;
D.由图示可知,循环泵可使电解质溶液不断浓缩、循环,故D不符合题意;
故答案为:A。
【分析】氢氧燃料电池中,通入氢气的一极为负极,负极发生氧化反应,通入氧气的一极为正极,正极发生还原反应,原电池工作时,阳离子向正极移动。
9.【答案】C
【解析】【解答】A、放电时, LiFePO4得电子发生还原反应为正极,充电时发生氧化反应为阳极,故A不符合题意;
B、放电时,阳离子移向正极,充电时Li+向阴极移动,故B不符合题意;
C、放电时, LiFePO4得电子发生还原反应为正极,充电时发生氧化反应为阳极,电极反应式为: LiFePO4﹣e﹣=FePO4+Li+,所以C选项是符合题意的;
D、金属Li能够与硫酸反应,不可以用磷酸溶液作电解质,故D不符合题意;
故答案为:C。
【分析】根据放电时化合价变化判断原电池的电极,结合电解池原理和原电池原理进行解答即可。
10.【答案】B
【解析】【解答】A.由题给信息Zn生成Zn(OH),MnO2生成Mn2+可知,M极为Zn电极,N电极材料为MnO2,即M极为负极,N极为正极,OH-移向负极,A项不符合题意;
B.负极的电极反应式为Zn+4OH--2e-=Zn(OH),每转移2 mol e-,有2 molOH-移向NaOH溶液,而消耗4molOH-,NaOH溶液的pH变小,B项符合题意;
C.N电极材料为MnO2,MnO2在正极得到电子生成Mn2+,电极方程式为:MnO2 +4H+ +2e- =Mn2+ +2H2O,故C不符合题意;
D.若电路中通过2 mol e-,双极膜中有2 mol H+移向硫酸溶液,同时溶解1 mol MnO2,稀硫酸溶液质量增加2mol1g/mol+1mol87g/mol=89g,D项不符合题意;
故答案为:B。
【分析】根据题意,Zn发生氧化反应生成Zn(OH),Zn为负极,即M极为Zn,电极反应式为Zn+4OH--2e-=Zn(OH),N电极材料为MnO2,电极反应式为MnO2 +4H+ +2e- =Mn2+ +2H2O。
11.【答案】B
【解析】【解答】A. 构成原电池的正极和负极不一定必须是两种不同的金属,也可以是金属与能导电的非金属,A不符合题意;
B. 原电池放电时,电流的方向是从正极到负极,B符合题意;
C. 比较不活泼的金属为正极,C符合题意;
D. 在原电池中,电子流出的一极是负极,该电极被氧化,D不符合题意;
答案选B。
【分析】A.原电池的电极除活泼性不同的金属外,也可以是导电的非金属;
B.原电池的电流方向与电子流向相反;
C.原电池中相对活泼的金属做负极;
D.原电池中负极发生氧化反应。
12.【答案】C
【解析】【解答】A、放电时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,Pb元素的化合价由PbO2中的+4价降为+2价,PbO2发生得电子的还原反应,A不符合题意;
B、充电时反应为2PbSO4+2H2O=Pb+PbO2+2H2SO4,消耗2molH2O生成2molH2SO4,H2O的摩尔质量小于H2SO4的摩尔质量,电解质溶液的质量增加,B不符合题意;
C、放电时负极Pb失电子发生氧化反应,负极反应式为Pb+SO42--2e-=PbSO4,C符合题意;
D、充电时阴极发生得电子的还原反应,电极反应式为PbSO4+2e-=Pb+SO42-,D不符合题意;
故答案为:C
【分析】铅蓄电池放电过程,为原电池装置,其负极反应式为:Pb+SO42--2e-=PbSO4,正极反应式为:PbO2+4H++2e-+SO42-=PbSO4+2H2O;充电过程为电解池装置,其阳极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42-,其阴极反应式为:PbSO4+2e-=Pb+SO42-;据此结合选项进行分析。
13.【答案】C
【解析】【解答】A.根据分析,电极B为正极,正极区的电极反应为H2O2+2e-=2OH-,A项不符合题意;
B.根据分析,电极B为正极,B项不符合题意;
C.电池总反应方程式为NaBH4+4H2O2=NaBO2+6H2O,反应中H2O2中O元素的化合价由-1价降至-2价,每消耗3 mol H2O2,理论上通过电路中的电子物质的量为6mol,通过电路的电子数为6NA,C项符合题意;
D.燃料电池在放电过程中,阳离子Na+从负极区向正极区迁移,D项不符合题意;
故答案为:C。
【分析】A.电极A上发生氧化反应,作电池的负极;
B.电极B上H2O2发生还原反应,作正极;
C.;
D.原电池中阳离子移向正极。
14.【答案】B
【解析】【解答】解:Zn能够与稀硫酸反应,所以能构成原电池,化学能转化为电能,锌易失电子发生氧化反应而作负极,铜作正极,氢离子在Cu电极上得电子生成氢气,Cu质量不变,电流从正极Cu沿导线流向负极Zn,
故选B.
【分析】该装置能自发的进行氧化还原反应,所以能构成原电池,锌易失电子发生氧化反应而作负极,铜作正极,电子从负极沿导线流向正极,电流流向与此相反,据此分析解答.
15.【答案】D
【解析】【解答】A.由分析可知,M为负极N为正极,则M比N活泼,故A不选;
B.由A可知M比N活泼,M是Zn,N是Cu,但由于N极有气泡产生,则溶液应为酸,故B不选;
C.在NaOH强碱溶液中,Al电极发生氧化反应为负极,由题意N为正极,故C不选;
D.由题意有M是Fe,N是Ag,B是稀硫酸,银为正极,氢离子在此极得电子,生成氢气,有气泡冒出,
故答案为:D。
【分析】由题意可知,M极发生氧化反应为负极,N极为正极,结合原电池工作原理相关知识解此题。
16.【答案】D
【解析】【解答】A.X为负极,Y为正极,负极上发生失电子的氧化反应、正极上发生得电子的还原反应,A不符合题意;
B.原电池工作时X为负极,Y为正极,阴离子移向负极,即移向X电极,B不符合题意;
C.若分别用Zn和Fe做电极材料,活泼的金属Zn做负极,即电极X为Zn,C不符合题意;
D.原电池工作时X为负极,Y为正极,Y电极反应为2H++2e-=H2↑,D符合题意;
故答案为:D。
【分析】原电池的角度进行分析,活泼金属作为负极,负极质量减少,正极质量增加或者生产气体,电子由负极经过导线流向正极,电流由正极经过导线流向负极。
17.【答案】C
【解析】【解答】A. 依据电池反应为Li+FePO4=LiFePO4,Li元素化合价升高,发生氧化反应,故 a极为负极,A错误;
B.依据电池反应为Li+FePO4=LiFePO4,FePO4中Fe元素化合价降低,则b极为正极,得电子,发生还原反应,B错误;
C.原电池“同性相吸”,阳离子移向正极,阴离子移向负极;Li+透过隔膜,从a极室进入b极室,C正确;
D.Li是活泼金属,能与稀硫酸反应,故不能用稀硫酸作电解质溶液,D错误;
故选C。
【分析】A、B放电时,负极失电子,元素化合价升高,发生氧化反应;正极得电子,元素化合价降低,发生还原反应;
C.原电池“同性相吸”,阳离子移向正极,阴离子移向负极;
D.Li是活泼金属,能与稀硫酸反应。
18.【答案】C
【解析】【解答】解:A.氧化铝为两性氧化物,与强碱反应生成盐和水,反应的离子方程式:2OH﹣+Al2O3═2AlO2﹣+H2O,故A正确;
B.铝与强碱溶液反应生成偏铝酸盐和氢气,离子方程式:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,故B正确;
C.获得耐蚀铝材的电极反应为:2Al+3H2O﹣6e﹣=Al2O3+6H+,故C错误;
D.用稀氨水洗去耐蚀铝材表面的酸,离子方程式:NH3 H2O+H+═NH4++H2O,故D正确;
故选:C.
【分析】A.氧化铝为两性氧化物,与强碱反应生成盐和水;
B.铝与强碱溶液反应生成偏铝酸盐和氢气;
C.阳极铝失去电子生成氧化铝和氢离子;
D.一水合氨与酸反应生成铵盐和水.
19.【答案】D
【解析】【解答】解:A.正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e﹣=4OH﹣,故A正确;
B.负极上氢气和氢氧根离子反应生成水,正极上氧气得电子和水反应生成氢氧根离子,所以溶液中钾离子没有参与反应,根据原子守恒知,KOH的物质的量不变,故B正确;
C.负极电极反应式为H2﹣2e﹣+2OH﹣=2H2O,正极电极反应式为O2+2H2O+4e﹣=4OH﹣,反应的总方程式为2H2+O2=2H2O,故C正确;
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况),n(Cl2)=0.1mol,根据2Cl﹣﹣2e﹣=Cl2↑,转移电子0.2mol,故D错误;
故选D.
【分析】氢氧燃料碱性电池中,通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2﹣2e﹣+2OH﹣=2H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e﹣=4OH﹣,反应的总方程式为2H2+O2=2H2O,结合氧气和转移电子之间的关系式计算.
20.【答案】D
【解析】【解答】A.根据方程式3CO2+4Na 2Na2CO3+C可得出二氧化碳作氧化剂、金属钠作还原剂,金属钠作负极而镍电极做正极,电子从负极流向正极(外电路)、电解质溶液中阴离子从正极流向负极,A不符合题意
B.根据电池方程式3CO2+4Na 2Na2CO3+C可知,放电时吸收二氧化碳,则充电时释放二氧化碳,B不符合题意
C.放电时二氧化碳得到电子转化成碳酸根和碳,即3CO2+4e-=2CO32-+C,C不符合题意
D.充电时为电解池,与原电池规律相反,且与正极相连的为阳极、与负极相连的为阴极,阴极钠离子失电子转变成金属钠,故D项应阴极反应方程式,D符合题意
故答案为:D
【分析】该题重点考查原电池的组成、正负极的判断、电子和电荷的移动、原电池与电解池的区别与联系,本题考查到的知识点有①正负极判断:失电子为负极、得电子为正极;②负电荷的移动:外电路从负极到正极、电解质溶液中正极到负极;③正负极方程式的书写;④电解池与原电池规律相反,原电池负极失电子而电解池阳极失电子;
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
