第三章水溶液中的离子反应与平衡单元检测(含解析)2023--2024学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 第三章水溶液中的离子反应与平衡单元检测(含解析)2023--2024学年上学期高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 843.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-19 19:32:39 | ||
图片预览




文档简介
第三章水溶液中的离子反应与平衡 单元检测
一、单选题
1.某学习小组欲探究硫酸钙沉淀转化为碳酸钙沉淀的可能性,查得如下资料(25°C):
难溶电解质 CaSO4 CaCO3 MgCO3 Mg(OH)2
Ksp 9.1×10-6 2.8×10-9 6.8×10-6 1.8×10-11
实验步骤如下:
①向100mL0.1mol·L-1CaCl2溶液中加入100mL0.1mol·L-1Na2SO4溶液,充分混合反应。
②向上述体系中加入3gNa2CO3固体,充分搅拌、静置分层后弃去上层清液。
③再加入蒸馏水,充分搅拌、静置分层后再次弃去上层清液。
下列说法正确的是
A.难溶电解质的Ksp越小,其溶解度越小
B.上述实验证明CaSO4沉淀在一定条件下可转化为CaCO3沉淀
C.由于CaCO3的Ksp比CaSO4的小,故CaCO3沉淀不可能转化为CaSO4沉淀
D.实验步骤③的目的是洗去沉淀表面附着的离子,其后还应向沉淀中加入足量盐酸
2.25℃时,用调节二元弱酸溶液的,假设不同下均有。使用数字传感器测得溶液中含R微粒的物质的量浓度随的变化如图所示。下列分析不正确的是
A.25℃时,溶液的
B.溶液和溶液中:前者大于后者
C.的溶液中,
D.25℃时的,在足量的溶液中滴加少量溶液,发生反应:
3.已知:25℃时,,,下列说法正确的是
A.25℃时,饱和溶液与饱和溶液相比,前者的大于后者
B.25℃时,向的悬浊液中加入少量的固体,、都增大
C.25℃时,固体在0.1mol/L NaOH溶液中的比在等浓度氨水中的小
D.25℃时,向的悬浊液中加入浓NaF溶液,难以转化成
4.已知:Zn+2HNO3+NH4NO3=N2↑+Zn(NO3)2+3H2O。设NA为阿伏伽德罗常数的值,下列说法正确的是
A.标准状况下,2.24LH2O中含σ键数为0.2NA
B.0.1mol L-1HNO3溶液中离子总数大于0.2NA
C.若反应中消耗6.5gZn,则该反应转移的电子数为0.2NA
D.常温下,1LpH=5的NH4NO3溶液中含有的H+数目为10-5NA
5.甲酸是一种一元有机酸,下列性质中可以证明它是弱电解质的是
A.甲酸溶液的导电性比盐酸溶液的弱
B.甲酸可以与碳酸钠溶液反应
C.10 mL 1mol L 1的甲酸溶液恰好与10mL 1mol L 11NaOH溶液完全反应
D.0.1mol L 1甲酸溶液的pH约为3
6.化学学习中,使用“一定”来叙述要小心。下列叙述中,正确的是
A.溶液一定是无色透明的
B.燃烧一定要用火去点燃
C.物质的溶解度一定随温度的升高而增大
D.常温下pH大于7的溶液一定是碱性溶液
7.25 ℃时,某浓度的氯化铵溶液的pH = 4,下列叙述中正确的是
A.c(NH)+ c(H+)= c(Cl-)+ c(OH-)
B.NH4Cl溶液中滴加少量浓氢氧化钠溶液后c(NH)增大
C.溶液中由水电离出的 c(OH-)= 1×10 -10 mol·L-1
D.c(Cl-)> c(H+)> c(NH)> c(OH-)
8.10℃时加热NaHCO3溶液,测得溶液pH发生如下变化:
温度(℃) 10 20 30 加热煮沸后冷却到50℃
pH 8.3 8.4 8.5 8.8
下列判断正确的是A.50℃时,c(OH—)=1×10—5.2mol/L B.30℃时,c(Na+)=c(HCO3—) +2c(CO32—)
C.升高温度,c(Na+)/c(HCO3—)增大 D.将NaHCO3溶液蒸干,得到NaOH固体
9.下列实验过程中曲线变化正确的是( )
A.表示Na2CO3溶液中滴入稀盐酸
B.表示溴水中滴入Na2SO3溶液
C. 表示AgNO3溶液中滴入氨水
D. 表示一定条件下2SO2+O2 2SO3达平衡后,升高温度
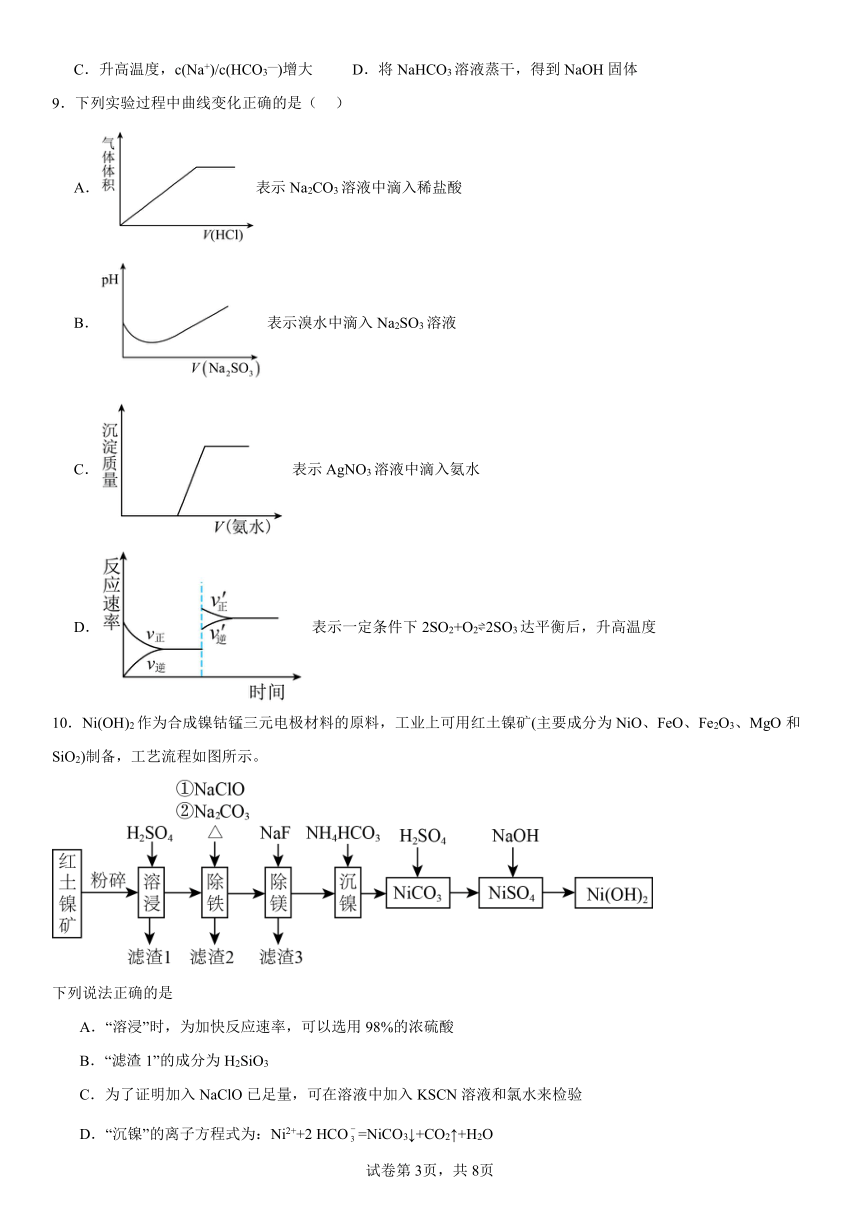
10.Ni(OH)2作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备,工艺流程如图所示。
下列说法正确的是
A.“溶浸”时,为加快反应速率,可以选用98%的浓硫酸
B.“滤渣1”的成分为H2SiO3
C.为了证明加入NaClO已足量,可在溶液中加入KSCN溶液和氯水来检验
D.“沉镍”的离子方程式为:Ni2++2 HCO=NiCO3↓+CO2↑+H2O
11.下列离子方程式书写正确的是
A.用FeS除去废水中的Hg2+:FeS+Hg2+=HgS+Fe2+
B.用醋酸溶液处理水垢中的氢氧化镁:Mg(OH)2+2H+=Mg2++2H2O
C.在Na2S溶液中滴加NaClO溶液:S2-+ClO-+2H+=S↓+Cl-+H2O
D.谷氨酸与足量氢氧化钠溶液反应:+OH-= +H2O
12.下列反应不属于水解反应或水解方程式不正确的是
①
②
③
④碳酸氢钠溶液:
⑤溶于中:
A.①②③④ B.①②③ C.②③ D.全部
13.关于pH都等于9的两种溶液:①NaOH溶液 ②CH3COONa溶液,下列说法正确的是
A.加水稀释相同倍数后溶液的pH:①=②
B.由水电离产生的OH-物质的量浓度:①>②
C.升高相同温度后,溶液pH:①=②
D.两种溶液中的Na+物质的量浓度:①<②
14.室温下,下列实验探究方案能达到探究目的的是
选项 探究方案 探究目的
A 将分别通入盛有品红溶液和溶液的试管中,观察两份溶液颜色变化 具有漂白性
B 用pH计测定浓度均为的溶液和溶液的pH 比较和的酸性强弱
C 向两支试管中各加入2mL的溶液,再同时各加入2mL和的稀硫酸,比较试管中出现浑浊现象的快慢 研究浓度对反应速率的影响
D 向25.00mL未知浓度的溶液中加入甲基橙指示剂,用标准溶液滴定,记录指示剂变色时消耗碱液的体积并计算 测定溶液的浓度
A.A B.B C.C D.D
二、填空题
15.请回答下列问题:
(1)pH=12相等体积相等的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m n (填“>”、“<”或“=”)。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ;在pH=3的CH3COOH溶液中,水电离出来的c(H+)= 。
(3)物质的量浓度相同的①NH4Cl,②CH3COONH4,③NH4HSO4,④NH3·H2O四种稀溶液中,NH4+浓度由大到小的顺序是(填序号) 。
(4)已知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液bL混和(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则出a∶b= 。
16.任何物质的水溶液都存在水的电离平衡,其电离方程式可表示为:。下表是不同温度下水的离子积数据:
温度(℃) 25
水的离子积常数 a
完成下列填空:
(1)25℃时,向100mL纯水中加入0.01mol的固体, (选填“促进”或“抑制”)了水的电离平衡,所得溶液呈 性(选填“酸”、“碱”或“中”),原因是(用离子反应方程式表示) 。
(2)若,则a (选填“”、“”或“=”),理由是 。
(3)℃时,测得纯水的,则 mol/L;该温度下某盐酸溶液的,该溶液的 mol/L。
(4)℃时,0.01mol/L的NaOH溶液的 。
17.现有下列五种溶液:盐酸、NH3·H2O、NH4HSO4、NaOH、CH3COOH。回答下列问题:
(1)将1LpH=2的HCl溶液分别与0.01mol·L-1的NH3· H2O溶液x L、0.01 mol·L-1的NaOH溶液yL充分反应至中性,x、y大小关系为:y x(填“>”“<”或“=”)。
(2)H+浓度相同的等体积的两份溶液:盐酸和CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是 (填写序号)。
①反应所需要的时间CH3COOH >HCl
②开始反应时的速率HCl>CH3COOH
③参加反应的锌粉物质的量HCl=CH3COOH
④反应过程的平均速率CH3COOH>HCl
⑤HCl溶液里有锌粉剩余
⑥CH3COOH溶液里有锌粉剩余
(3)将等体积、等物质的量浓度的NH3·H2O和NH4HSO4溶液混合后,升高温度(溶质不会分解)溶液pH随温度变化如图中的 曲线(填写序号)。
(4)室温下,向0.01mol·L-1NH4HSO4溶液中滴加0.01mol·L-1NaOH溶液至中性,得到的溶液中:c(Na+)+c(NH4+) 2c(SO42- )(填“>”“=”或“<”);用NH4HSO4与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7(填“>”“=”或“<”)
(5)25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将 (填“正向”“不”或“逆向”)移动。
18.与化学平衡类似,电离平衡的平衡常数叫作电离平衡常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 电离方程式 电离平衡常数
CH3COOH CH3COOHCH3COO-+H+ K=1.96×10-5
HClO HClOClO-+H+ K=3.0×10-8
H2CO3 H2CO3H++HCO HCO3-H++CO K1=4.4×10-7 K2=5.6×10-11
H3PO4 H3PO4H++H2PO H2POH++HPO HPOH++PO K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO、H3PO4、H2PO、HPO都看作是酸,则它们酸性最强的是 (填化学式,下同),最弱的是 。
(2)向NaClO溶液中通入少量的二氧化碳,发生反应的离子方程式为 。
(3)求出该温度下,0.10 mol·L-1的CH3COOH溶液中的c(H+)= mol·L-1
19.已知水在和时的电离平衡曲线如图所示。
(1)时水的电离平衡曲线应为 (填“A”或“B”)。时,将的溶液与的溶液混合,若所得混合溶液的,则溶液与溶液的体积比为 。
(2)时,若100体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是 。
(3)在曲线A所对应的温度下,的溶液和的某溶液中,若水的电离程度分别用、表示,则 (填“大于”“小于”“等于”“无法确定”)。
(4)时,某溶液中,取该溶液1mL加水稀释至10mL,则稀释后溶液中 。
(5)已知某温度下的电离常数。该温度下溶液中为 。
20.已知常温下:部分弱酸的电离平衡常数HCOOH Ka=1.77×10-4 ;HCN Ka=5.0×10-10 ; H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11 ;H2C2O4 Ka1=5.60×10-2,Ka2=5.42×10-5
(1)同浓度HCOONa、NaCN溶液中碱性最强是 ;
(2)体积相同、c(H+)相同的三种酸溶液a HCOOH;b HCN;c HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) 。
(3)NaHC2O4溶液呈 性(酸/碱);Na2C2O4溶液中物料守恒等式 ;
(4)常温下pH=3的H2C2O4溶液与pH=11的NaOH溶液等体积混合,所得溶液呈 性(酸/碱)
(5)等浓度、等体积的HCOOH与HCOONa溶液混合后pH<7,则溶液中离子浓度从大到小排序为 :
21.(1)如图1表示用相同浓度的NaOH溶液分别滴定浓度相同的3种一元酸,由图可确定酸性最强的是 (填“①”、“②“或“③”)。如图2表示用相同浓度的硝酸银标准溶液分别滴定浓度相同的含Cl-、Br-及I-的混合溶液,由图可确定首先沉淀的离子是 。
(2)25℃时,Ksp(AgCl)=1.8×10-10,若向1L 0.1 mol·L-1的NaCl溶液中加入1L 0.2mol·L-1的硝酸银溶液,充分反应后溶液中c(Cl-)= (不考虑混合后溶液体积的变化)。
22.五氧化二钒广泛用于冶金、化工等行业,主要用于冶炼钒铁、用作冶金添加剂,占五氧化二钒总消耗量的80%以上,其次是用作有机化工的催化剂。为了增加V2O5的利用率我们从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
25℃时取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:
pH 1.3 1.4 1.5 1.6 1.7 1.8 1.9 2.0
钒沉淀率/% 88.1 94.8 96.5 98.0 98.8 98.6 96.4 93.1
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则此时溶液中c(Fe2+)≤ 。已知:25℃时Ksp[Fe(OH)3]=2.6×10-39
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【解析】略
2.D
【分析】用调节二元弱酸溶液的,随pH升高,H2R的浓度降低、HR-的浓度先增大后降低、R2-的浓度升高,b表示H2R的物质的量浓度随的变化,a表示HR-的物质的量浓度随的变化,c表示R2-的物质的量浓度随的变化。根据a、c曲线的交点pH=4.2,25℃时,的;b、c曲线的交点,则, 。
【详解】A.由a、c曲线的交点可知,25℃时,的,故A正确;
B.的水解常数,的,H2R电离程度大于水解程度,所以溶液和溶液中,前者大于后者,故B正确;
C.因为,所以当溶液中时, ,根据电荷守恒,,所以,故C正确;
D.25℃时的,酸性:,在足量的溶液中滴加少量溶液生成次氯酸和Na2R,发生反应:,故D错误;
选D。
3.B
【详解】A. 25℃时,对于同类型的难溶电解质,越大,其饱和溶液中离子的浓度就越大,由于,则饱和溶液中大,A错误;
B. 25℃时,悬浊液中存在沉淀溶解平衡,向的悬浊液中加入少量的固体,结合溶液中的,使浓度减小,的沉淀溶解平衡向沉淀溶解的方向移动,溶液中增大,增大,B正确;
C. 只与温度有关,温度不变,则不变,C错误;
D. 25℃时,与接近,只要保证溶液中c2(F-)·c(Mg2+)>,就可以实现向的转化,D错误。答案选B。
4.D
【详解】A.标况下,H2O为非气体,无法计算H2O的物质的量,A项错误;
B.溶液中n=cV但V未知,无法计算,B项错误;
C.6.5gZn物质的量为,则Zn失去的电子为0.2NA,但在该反应中N的化合价也升高了所以该反应转移的电子数目大于0.2NA,C项错误;
D.pH=5的H+浓度为10-5mol/L,则n(H+)=cV=10-5mol,D项正确;
故选D。
5.D
【详解】A.应比较同浓度的甲酸溶液和盐酸溶液的导电性,若甲酸溶液的导电性比盐酸溶液导电性弱,才能证明它为弱电解质,故A不符合题意;
B.甲酸可以与碳酸钠溶液反应,只能证明甲酸酸性比碳酸强,故B不符合题意;
C.10 mL 1mol L 1的甲酸溶液恰好与10mL 1mol L 11NaOH溶液完全反应,只能证明它为一元酸,不能证明其为弱酸,故C不符合题意;
D.0.1mol L 1甲酸溶液的pH约为3,氢离子为1.0×10 3mol L 1,说明甲酸部分电离,能证明是弱电解质,故D符合题意。
故选D。
6.D
【详解】A. 有些金属的盐溶液不是无色的,如硫酸铜溶液是蓝色的,故A错误;
B. 燃点低的物质不需要点燃,在一定温度下可以自燃,如白磷可以自燃,故B错误;
C. 气体的溶解度或某些易溶物质的溶解度与温度成反比,熟石灰或气体的溶解度随温度的升高而减小,故C错误;
D. 常温下中性溶液的pH等于7,故pH大于7的溶液一定是碱性溶液,故D正确;
故选D。
7.A
【详解】A.根据电荷守恒可知c(NH)+ c(H+)= c(Cl-)+ c(OH-),A正确;
B.NH4Cl溶液中滴加少量浓氢氧化钠会发生反应,NH+OH-=NH3·H2O,会使c(NH)减小,B错误;
C.pH=4,H+浓度为1×10-4mol/L,且全部由水电离,水电离出的 c(OH-)= 1×10-4 mol/L,C错误;
D. NH4Cl溶液中NH水解,c(Cl- )>c(NH),水解显酸性,c(H+)>c(OH-),但NH水解程度不大,则c(Cl- )>c(NH)>c(H+)> c(OH- ),D错误;
故选A。
8.C
【详解】A. 50℃时,碳酸氢钠溶液的pH为8.8,说明溶液中氢离子浓度为10-8.8mol/L,但因为水的离子积常数不能确定,所以不能计算氢氧根离子浓度,故错误;
B.溶液中的物料守恒,c(Na+)=c(HCO3—) +c(CO32—) + c(H2CO3),溶液中碳酸氢根子水解生成碳酸,电离生成碳酸根离子,因为溶液显碱性,说明水解程度大于电离程度,即碳酸分子浓度大于碳酸根离子浓度,故c(Na+)=c(HCO3—) +2c(CO32—)错误;
C. 升高温度,碳酸氢根离子水解程度增大,碳酸氢根离子浓度减小,所以c(Na+)/c(HCO3—)增大,故正确;
D. 将NaHCO3溶液蒸干,碳酸氢钠受热分解生成碳酸钠和水和二氧化碳,不能得到NaOH固体,故错误。故选C。
【点睛】掌握常见的弱酸的酸式盐中的电离和水解程度的大小和影响因素。碳酸氢钠溶液中碳酸氢根离子的水解程度大于电离程度,溶液显碱性,亚硫酸氢钠溶液中亚硫酸氢根离子的电离程度大于水解程度,溶液显酸性,不管是电离还是水解,加热都会促进。
9.B
【详解】A、碳酸钠和少量的盐酸之间反应生成氯化钠和碳酸氢钠,开始不会产生气体,故A错误;
B、溴单质具有氧化性,溴水中滴入溶液,溴水中的溴单质能将亚硫酸钠氧化为硫酸钠,并且会生成强酸HBr,所以酸性增强;随着溶液的滴入,当氧化性的溴单质消耗掉,到最后相当于将之稀释,酸性减弱,pH增大,故B正确;
C、硝酸银中加入少量氨水,生成氢氧化银白色沉淀,继续滴加,沉淀消失,得到银氨溶液,故C错误;
D、是放热的,升高温度,化学反应速率加快,平衡逆向移动,即逆反应速率大于正反应速率,故D错误;
故选:B。
10.D
【分析】红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)粉碎后用硫酸浸取,Ni、Fe、Mg元素进入溶液,滤渣1为不溶于稀硫酸的SiO2;过滤后向滤液中加入次氯酸钠将Fe2+氧化成Fe3+,然后加入碳酸钠并加热除去铁元素,得到滤渣2;过滤后向滤液中加入NaF除去镁离子,得到滤渣3为MgF2;过滤后加入碳酸氢铵得到碳酸镍沉淀,将碳酸镍沉淀加稀硫酸溶解,再向溶液中加入NaOH得到Ni(OH)2,以此解答该题。
【详解】A.浓硫酸中水含量很少,硫酸电离出的氢离子较少,所以不宜选用98%的浓硫酸,A错误;
B.滤渣1主要为难溶于硫酸的SiO2,B错误;
C.NaClO的作用是将Fe2+氧化为Fe3+,所以检验NaClO是否足量,应检验溶液中是否还有Fe2+,所用试剂应为K3[Fe(CN)6],C错误;
D.沉镍时反应有Ni2+、NH4HCO3,产物有NiCO3说明不是双水解,而是Ni2+与HCO电离出的CO结合生成NiCO3沉淀,促进HCO的电离,同时产生大量的氢离子,而氢离子又和HCO反应生成二氧化碳和水,所以离子方程式为Ni2++2 HCO=NiCO3↓+CO2↑+H2O,D正确;
综上所述答案为D。
11.A
【详解】A.HgS的溶解度比FeS的溶解度小,所以可以用FeS除去废水中的Hg2+,故A正确;
B.醋酸是弱酸,在离子方程式里不能写成离子,故B错误;
C.Na2S溶液不是酸性的,所以在离子方程式里不能出现H+,正确的离子方程式为:S2-+ClO-+H2O=S↓+Cl-+2OH-,故C错误;
D.谷氨酸和足量的NaOH溶液反应,两个羧基都被中和成盐,正确的离子方程式为: +2OH-+2H2O,故D错误;
故选A。
12.D
【详解】①是HCl电离方程式,不属于水解反应;②水解方程式不正确,应为 ;③水解方程式不正确,应为 ;④是碳酸氢根离子的电离方程式,不属于水解反应;⑤水解方程式不正确,应为,全部符合题意。
13.D
【分析】NaOH为强碱,pH=9,则c(OH-)=10-5mol/L,c(NaOH)=10-5mol/L;CH3COONa为强碱弱酸盐,水解显碱性,则c(CH3COONa)>10-5mol/L。
【详解】分别加水稀释相同倍数时,促进CH3COONa水解,pH变化的小,所以醋酸钠的pH大于氢氧化钠的pH,故A错误;CH3COONa水解促进水电离,氢氧化钠抑制水电离,由水电离产生的OH-物质的量浓度:醋酸钠>氢氧化钠,故B错误;分别加热到相同温度时,NaOH溶液c(OH-)不变,加热促进CH3COONa水解,CH3COONa溶液中c(OH-)增大,升高相同温度,NaOH溶液的pH小于CH3COONa溶液,故C错误;两溶液因pH均为9,因此c( CH3COONa)大于c(NaOH),因此CH3COONa溶液中c(Na+)大于NaOH溶液中c(Na+),故D正确。
【点睛】本题考查盐类水解的应用,注意:酸、碱、能水解的盐对水的电离的影响是解答本题的关键,明确温度、稀释对水解的影响,题目难度中等。
14.C
【详解】A.通入品红溶液中,品红褪色,说明具有漂白性;通入溶液中,溶液褪色,说明具有还原性,故A错误;
B.对应的酸为,故不能通过比较溶液和溶液的pH比较和的酸性强弱,故B错误;
C.向两支试管中各加入2mL的溶液,再同时各加入2mL和的稀硫酸,通过观察两支试管变浑浊的快慢,来研究浓度对反应速率的影响,故C正确;
D.甲基橙的变色范围为pH=3.1~4.4,氢氧化钠与醋酸反应的产物为碱性,应用酚酞作指示剂,故D错误;
故选C。
15. ﹤ 10-3 mol/L 10-11 mol/L ③①②④ 9∶2
【详解】(1)NH3·H2O为弱电解质,存在电离平衡,NaOH为强电解质,完全电离;若氢氧根离子浓度均为0.1mol·L-1、等体积的NaOH和NH3·H2O分别加水稀释均为104倍,稀释后NH3·H2O溶液的pH>9,而NaOH溶液的pH=9,若要稀释后两种溶液的pH都变成9,NH3·H2O溶液要继续加水稀释直到pH=9,所以m<n;正确答案:﹤。
(2)CH3COONa溶液水解显碱性,促进水电离,,pH=11的CH3COONa溶液,c(H+)=10-11 mol/L, c(OH-)=10-3mol/L,溶液中水电离出来的c(OH-)=10-3mol/L;CH3COOH溶液电离显酸性,抑制水电离,pH=3的CH3COOH溶液中,c(H+)=10-3 mol/L,溶液中水电离出来的c(H+)= 10-11 mol/L;正确答案:10-3 mol/L; 10-11 mol/L。
(3)NH4HSO4溶液完全电离出NH4+、H+、SO42-,溶液中的H+抑制NH4+的水解,剩余的NH4+的量多;NH4Cl溶液发生少量水解,剩余的NH4+的量比NH4HSO4溶液中的少,CH3COONH4溶液中两种离子相互促进水解,剩余的NH4+的量比NH4Cl溶液中的少;NH3·H2O为弱电解质,发生微量电离,溶液中的NH4+的量最少;四种溶液中NH4+浓度由大到小的顺序是:③①②④;正确答案:③①②④。
(4)bL、pH=2的H2SO4溶液中n(H+)=b×10-2 mol,a L、pH=9的NaOH溶液中n(OH-)=10-3 ×a mol,根据题意可知,反应后溶液呈酸性:(b×10-2-10-3 ×a)/(a+b)=10-3,解之:a∶b=9∶2;正确答案:9∶2。
【点睛】酸、碱溶液抑制水电离,能够水解的盐溶液促进水电离。
16. 促进 酸 水的电离是吸热反应,升温,平衡正向移动,和都增大,,增大 10
【分析】(1)氯化铵水解显酸性;
(2)水的电离是吸热反应,升高温度促进水电离,导致水的离子积常数增大;
(3)在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同来计算回答;
(4)根据pH= -lgc(H+)来计算。
【详解】(1)25℃时,向100mL纯水中加入0.01mol的固体,促进水的电离,铵根离子水解显酸性,其水解方程式为:;
(2)水的电离为吸热反应,升高温度,平衡向着正反应方向移动,导致水的离子积常数增大,根据表格知,温度大小顺序是,25<t1<t2,则a>1×10 14;
(3)某温度下纯水中的c(H+)=2.4×10 7mol/L,则此时溶液中的c(OH )=2.4×10 7mol/L,该温度下水的离子积额Kw= c(H+)·c(OH )=2.4×10 7mol/L×2.4×10 7 mol/L=5.76×10 14;某盐酸溶液的,则氢离子浓度为10 2mol/L,因该溶液中c(OH )===5.76×10 12 mol L 1;
(4)0.01mol/L的氢氧化钠溶液氢氧根离子的浓度c(OH )=10 2mol/L,则c(H+)==10-10mol/L,pH= lgc(H+)= lg10 10=10。
【点睛】利用水的离子积进行水溶液中离子浓度的计算是重点也是难点。学生要合理利用公式,打破固定思维,不能误认为水的离子积常数是固定不变的,会随着温度的变化而变化。
17. < ③④⑤ ④ = > NH4++H2ONH3·H2O+H+ 逆向
【详解】(1)1LpH=2的HCl溶液与0.01mol·L-1的NaOH溶液1L充分反应恰好呈中性;一元强酸、一元弱碱溶液,等物质的量混合后恰好生成强酸弱碱盐,溶液呈酸性;若使1LpH=2的HCl溶液与0.01mol·L-1的NH3·H2O溶液充分反应至中性,则氨水的体积大于1L,所以y(2)根据以上分析,①反应开始后,醋酸不断电离,醋酸中氢离子浓度大于盐酸,氢离子浓度越大反应所需要的时间越短,所以CH3COOH<HCl,故①错误;②开始反应时溶液中氢离子浓度相等,所以反应时的速率相等:HCl=CH3COOH,故②错误;③因生成氢气量相等,所以参加反应的锌粉物质的量:HCl=CH3COOH,故③正确;④氢离子的浓度越大,反应过程的平均速率越快,由于反应反应过程中醋酸会继续电离出氢离子,所以醋酸中氢离子浓度大于盐酸,则反应速率CH3COOH>HCl,故④正确;盐酸的浓度小于CH3COOH的浓度,而体积相等,即醋酸的物质的量比盐酸的物质的量多,与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的量相同,锌与盐酸反应盐酸不足,锌与醋酸反应锌不足,故⑤正确、⑥错误。
(3)将等体积、等物质的量浓度的NH3·H2O和NH4HSO4溶液混合后,恰好生成(NH4)2SO4,溶液呈酸性,pH<7;升高温度促进铵根离子水解,溶液酸性增强,所以溶液pH随温度变化是图中的④曲线;
(4)根据电荷守恒,c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(OH-),溶液呈中性c(OH-)= c(H+),所以c(Na+)+c(NH4+)=2c(SO42-);NH4HSO4与氢氧化钡溶液1:1混合,溶液中SO42-恰好完全沉淀,反应离子方程式是NH4++H++SO42-+Ba2++2OH-BaSO4+H2O+NH3·H2O,由于生成NH3·H2O,所以溶液呈碱性,pH>7;
(5)NH4NO3是强酸弱碱盐,铵根离子水解,溶液呈酸性,水解离子方程式是NH4++H2ONH3·H2O+H+;氨水抑制水电离,所以滴加氨水的过程中水的电离平衡将逆向移动。
18. H3PO4 CO2+H2O+ClO-=HClO+ 1.4×10-3
【分析】(1)弱酸的电离平衡常数越大,其电离程度就越大,相应的酸的酸性就越强;弱酸的电离平衡常数越小,其电离程度就越小,相应的酸的酸性就越弱;
(2)碳酸的酸性比次氯酸强,应用强酸制弱酸书写反应方程式;
(3)根据该温度下酸溶液的电离平衡常数计算氢离子浓度。
【详解】(1)在同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数知,则它们酸性强弱顺序是:H3PO4>CH3COOH>H2CO3>>HClO>>,则酸性最强的是H3PO4,最弱的是;
(2)由于酸性:H2CO3>HClO>,则向NaClO溶液中通入少量的CO2,反应产生NaHCO3和HClO,该反应的离子方程式为:CO2+H2O+ClO-=HClO+;
(3)该温度下,0.10 mol/L的CH3COOH溶液中存在电离平衡,CH3COOH CH3COO-+H+,平衡常数K==1.76×10-5,c2(H+)=0.10×1.76×10-5 ,c(H+)≈1.4×10-3 mol/L。
【点睛】本题考查了弱电解质的平衡常数的应用。弱电解质电离平衡常数越大,物质电离程度越大,相同浓度时电离产生的离子浓度就越大。强酸可以与弱酸盐反应制取弱酸。
19.(1) A 10:1
(2)
(3)小于
(4)
(5)
【解析】(1)
水的电离是吸热过程,当温度升高时,促进水的电离,水的电离程度增大,水的离子积常数 增大,水中离子浓度都增大,由图可知曲线A的电离程度小于曲线B,所以25℃时水的电离平衡曲线应为A;25℃时纯水的pH=7,由于混合溶液的pH=7,说明酸、碱混合时溶液显示中性,水溶液中的的物质的量=碱溶液中离子的物质的量,pH=4的H2SO4溶液中=10-4mol/L,pH=9的NaOH溶液中 ,设H2SO4溶液的体积为x,NaOH溶液的体积为y,则有:,则。
(2)
95℃时,由图可知水的离子积常数,100L的pH=a的强酸溶液中,1L的 pH=b的强碱溶液 n(OH-) = 1L×10-(12-b)mol/L= 10b-12mol,混合后溶液呈中性,则,即:100×10-a = 10b-12,解得:a+b=14。
(3)
曲线对应的温度为25℃,此时水的离子积常数,由于HCl和BOH均会抑制水的电离,则在 pH=2的HCl溶液中,溶液中 C总(H+) = 1×10-2mol/L,则水电离出的 ,在pH=11的BOH溶液中,c总(H+) = 1×10-11mol/L,则由水电离出的c水(H+) = c总(H+)= 1×10-11mol/L>1×10-12mol/L,则a1(4)
25℃时,水的离子积常数,某Na2SO4溶液中,则溶液中Na+离子浓度 ,取该溶液1mL加水稀释至10mL,稀释10倍,则,但由于Na2SO4溶液是显中性的,,所以 。
(5)
已知该温度下的电离常数 ,溶液中存在 ,则,可知0.01mol/L溶液中。
20.(1)NaCN
(2)b>a>c
(3) 酸
(4)酸
(5)c(HCOO-)>c(Na+)>c(H+)>c(OH-)
【详解】(1)酸的电离常数越大,酸性越强,其对应的酸根离子水解程度越小,则相同浓度的钠盐溶液碱性越弱,电离平衡常数:HCOOH>HCN,水解程度HCOO-<CN-,则碱性HCOONa<NaCN;
(2)酸的电离常数越大,酸性越强,体积相同、c(H+)相同的三种酸溶液a HCOOH;b HCN;c HCl,三种溶液的浓度大小为:b>a>c,最终电离出n(H+)大小:b>a>c,则消耗NaOH的体积大小为:b>a>c;
(3),说明的电离程度大于其水解程度,NaHC2O4溶液呈酸性;Na2C2O4溶液中物料守恒为:;
(4)草酸为弱酸,pH=3的H2C2O4溶液浓度远大于10-3mol/L,pH=11的NaOH溶液浓度为10-3mol/L,等体积混合草酸过量,所得溶液呈酸性;
(5)等浓度等体积的HCOOH、HCOONa混合溶液的pH<7,溶液呈酸性,
c(H+)>c(OH-),说明HCOOH电离程度大于HCOO-的水解程度,Na+不水解,所以c(HCOO-)>c(Na+),但其电离和水解程度都较小,所以溶液中存在c(HCOO-)>c(Na+)>c(H+)>c(OH-);
21. ③ I- mol/L
【分析】(1)同浓度一元酸酸性越强,pH值越小;横坐标相同时,纵坐标数值越大,卤离子浓度越小,其溶度积常数越小,越先生成沉淀。
(2)硝酸银过量,先计算反应后溶液中银离子的浓度再根据Ksp计算氯离子浓度。
【详解】(1)根据图可知未加碱时相同浓度的三种一元酸pH值最小的是③,即酸性最强的是③;横坐标相同时,纵坐标数值越大,卤离子浓度越小,其溶度积常数越小,越先生成沉淀,根据图知,最先生成沉淀的是I-,
(2)硝酸银过量,混合后溶液中c(Ag+)=,c(Cl-)=mol/L。
【点睛】明确图2中纵横坐标含义及曲线变化趋势是解本题关键。
22. 1.7
【详解】从沉淀率和关系找出最佳沉淀率。若钒沉淀率为时,不产生沉淀,此时溶液,计算氢氧根离子浓度,结合溶度积常数计算溶液中铁离子的浓度。由表中数据可知,时钒的沉淀率最大为,故加入氨水调节溶液的最佳为1.7.若钒沉淀率为时不产生沉淀,此时溶液, ,,。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.某学习小组欲探究硫酸钙沉淀转化为碳酸钙沉淀的可能性,查得如下资料(25°C):
难溶电解质 CaSO4 CaCO3 MgCO3 Mg(OH)2
Ksp 9.1×10-6 2.8×10-9 6.8×10-6 1.8×10-11
实验步骤如下:
①向100mL0.1mol·L-1CaCl2溶液中加入100mL0.1mol·L-1Na2SO4溶液,充分混合反应。
②向上述体系中加入3gNa2CO3固体,充分搅拌、静置分层后弃去上层清液。
③再加入蒸馏水,充分搅拌、静置分层后再次弃去上层清液。
下列说法正确的是
A.难溶电解质的Ksp越小,其溶解度越小
B.上述实验证明CaSO4沉淀在一定条件下可转化为CaCO3沉淀
C.由于CaCO3的Ksp比CaSO4的小,故CaCO3沉淀不可能转化为CaSO4沉淀
D.实验步骤③的目的是洗去沉淀表面附着的离子,其后还应向沉淀中加入足量盐酸
2.25℃时,用调节二元弱酸溶液的,假设不同下均有。使用数字传感器测得溶液中含R微粒的物质的量浓度随的变化如图所示。下列分析不正确的是
A.25℃时,溶液的
B.溶液和溶液中:前者大于后者
C.的溶液中,
D.25℃时的,在足量的溶液中滴加少量溶液,发生反应:
3.已知:25℃时,,,下列说法正确的是
A.25℃时,饱和溶液与饱和溶液相比,前者的大于后者
B.25℃时,向的悬浊液中加入少量的固体,、都增大
C.25℃时,固体在0.1mol/L NaOH溶液中的比在等浓度氨水中的小
D.25℃时,向的悬浊液中加入浓NaF溶液,难以转化成
4.已知:Zn+2HNO3+NH4NO3=N2↑+Zn(NO3)2+3H2O。设NA为阿伏伽德罗常数的值,下列说法正确的是
A.标准状况下,2.24LH2O中含σ键数为0.2NA
B.0.1mol L-1HNO3溶液中离子总数大于0.2NA
C.若反应中消耗6.5gZn,则该反应转移的电子数为0.2NA
D.常温下,1LpH=5的NH4NO3溶液中含有的H+数目为10-5NA
5.甲酸是一种一元有机酸,下列性质中可以证明它是弱电解质的是
A.甲酸溶液的导电性比盐酸溶液的弱
B.甲酸可以与碳酸钠溶液反应
C.10 mL 1mol L 1的甲酸溶液恰好与10mL 1mol L 11NaOH溶液完全反应
D.0.1mol L 1甲酸溶液的pH约为3
6.化学学习中,使用“一定”来叙述要小心。下列叙述中,正确的是
A.溶液一定是无色透明的
B.燃烧一定要用火去点燃
C.物质的溶解度一定随温度的升高而增大
D.常温下pH大于7的溶液一定是碱性溶液
7.25 ℃时,某浓度的氯化铵溶液的pH = 4,下列叙述中正确的是
A.c(NH)+ c(H+)= c(Cl-)+ c(OH-)
B.NH4Cl溶液中滴加少量浓氢氧化钠溶液后c(NH)增大
C.溶液中由水电离出的 c(OH-)= 1×10 -10 mol·L-1
D.c(Cl-)> c(H+)> c(NH)> c(OH-)
8.10℃时加热NaHCO3溶液,测得溶液pH发生如下变化:
温度(℃) 10 20 30 加热煮沸后冷却到50℃
pH 8.3 8.4 8.5 8.8
下列判断正确的是A.50℃时,c(OH—)=1×10—5.2mol/L B.30℃时,c(Na+)=c(HCO3—) +2c(CO32—)
C.升高温度,c(Na+)/c(HCO3—)增大 D.将NaHCO3溶液蒸干,得到NaOH固体
9.下列实验过程中曲线变化正确的是( )
A.表示Na2CO3溶液中滴入稀盐酸
B.表示溴水中滴入Na2SO3溶液
C. 表示AgNO3溶液中滴入氨水
D. 表示一定条件下2SO2+O2 2SO3达平衡后,升高温度
10.Ni(OH)2作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备,工艺流程如图所示。
下列说法正确的是
A.“溶浸”时,为加快反应速率,可以选用98%的浓硫酸
B.“滤渣1”的成分为H2SiO3
C.为了证明加入NaClO已足量,可在溶液中加入KSCN溶液和氯水来检验
D.“沉镍”的离子方程式为:Ni2++2 HCO=NiCO3↓+CO2↑+H2O
11.下列离子方程式书写正确的是
A.用FeS除去废水中的Hg2+:FeS+Hg2+=HgS+Fe2+
B.用醋酸溶液处理水垢中的氢氧化镁:Mg(OH)2+2H+=Mg2++2H2O
C.在Na2S溶液中滴加NaClO溶液:S2-+ClO-+2H+=S↓+Cl-+H2O
D.谷氨酸与足量氢氧化钠溶液反应:+OH-= +H2O
12.下列反应不属于水解反应或水解方程式不正确的是
①
②
③
④碳酸氢钠溶液:
⑤溶于中:
A.①②③④ B.①②③ C.②③ D.全部
13.关于pH都等于9的两种溶液:①NaOH溶液 ②CH3COONa溶液,下列说法正确的是
A.加水稀释相同倍数后溶液的pH:①=②
B.由水电离产生的OH-物质的量浓度:①>②
C.升高相同温度后,溶液pH:①=②
D.两种溶液中的Na+物质的量浓度:①<②
14.室温下,下列实验探究方案能达到探究目的的是
选项 探究方案 探究目的
A 将分别通入盛有品红溶液和溶液的试管中,观察两份溶液颜色变化 具有漂白性
B 用pH计测定浓度均为的溶液和溶液的pH 比较和的酸性强弱
C 向两支试管中各加入2mL的溶液,再同时各加入2mL和的稀硫酸,比较试管中出现浑浊现象的快慢 研究浓度对反应速率的影响
D 向25.00mL未知浓度的溶液中加入甲基橙指示剂,用标准溶液滴定,记录指示剂变色时消耗碱液的体积并计算 测定溶液的浓度
A.A B.B C.C D.D
二、填空题
15.请回答下列问题:
(1)pH=12相等体积相等的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m n (填“>”、“<”或“=”)。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ;在pH=3的CH3COOH溶液中,水电离出来的c(H+)= 。
(3)物质的量浓度相同的①NH4Cl,②CH3COONH4,③NH4HSO4,④NH3·H2O四种稀溶液中,NH4+浓度由大到小的顺序是(填序号) 。
(4)已知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液bL混和(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则出a∶b= 。
16.任何物质的水溶液都存在水的电离平衡,其电离方程式可表示为:。下表是不同温度下水的离子积数据:
温度(℃) 25
水的离子积常数 a
完成下列填空:
(1)25℃时,向100mL纯水中加入0.01mol的固体, (选填“促进”或“抑制”)了水的电离平衡,所得溶液呈 性(选填“酸”、“碱”或“中”),原因是(用离子反应方程式表示) 。
(2)若,则a (选填“”、“”或“=”),理由是 。
(3)℃时,测得纯水的,则 mol/L;该温度下某盐酸溶液的,该溶液的 mol/L。
(4)℃时,0.01mol/L的NaOH溶液的 。
17.现有下列五种溶液:盐酸、NH3·H2O、NH4HSO4、NaOH、CH3COOH。回答下列问题:
(1)将1LpH=2的HCl溶液分别与0.01mol·L-1的NH3· H2O溶液x L、0.01 mol·L-1的NaOH溶液yL充分反应至中性,x、y大小关系为:y x(填“>”“<”或“=”)。
(2)H+浓度相同的等体积的两份溶液:盐酸和CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是 (填写序号)。
①反应所需要的时间CH3COOH >HCl
②开始反应时的速率HCl>CH3COOH
③参加反应的锌粉物质的量HCl=CH3COOH
④反应过程的平均速率CH3COOH>HCl
⑤HCl溶液里有锌粉剩余
⑥CH3COOH溶液里有锌粉剩余
(3)将等体积、等物质的量浓度的NH3·H2O和NH4HSO4溶液混合后,升高温度(溶质不会分解)溶液pH随温度变化如图中的 曲线(填写序号)。
(4)室温下,向0.01mol·L-1NH4HSO4溶液中滴加0.01mol·L-1NaOH溶液至中性,得到的溶液中:c(Na+)+c(NH4+) 2c(SO42- )(填“>”“=”或“<”);用NH4HSO4与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7(填“>”“=”或“<”)
(5)25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将 (填“正向”“不”或“逆向”)移动。
18.与化学平衡类似,电离平衡的平衡常数叫作电离平衡常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 电离方程式 电离平衡常数
CH3COOH CH3COOHCH3COO-+H+ K=1.96×10-5
HClO HClOClO-+H+ K=3.0×10-8
H2CO3 H2CO3H++HCO HCO3-H++CO K1=4.4×10-7 K2=5.6×10-11
H3PO4 H3PO4H++H2PO H2POH++HPO HPOH++PO K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO、H3PO4、H2PO、HPO都看作是酸,则它们酸性最强的是 (填化学式,下同),最弱的是 。
(2)向NaClO溶液中通入少量的二氧化碳,发生反应的离子方程式为 。
(3)求出该温度下,0.10 mol·L-1的CH3COOH溶液中的c(H+)= mol·L-1
19.已知水在和时的电离平衡曲线如图所示。
(1)时水的电离平衡曲线应为 (填“A”或“B”)。时,将的溶液与的溶液混合,若所得混合溶液的,则溶液与溶液的体积比为 。
(2)时,若100体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是 。
(3)在曲线A所对应的温度下,的溶液和的某溶液中,若水的电离程度分别用、表示,则 (填“大于”“小于”“等于”“无法确定”)。
(4)时,某溶液中,取该溶液1mL加水稀释至10mL,则稀释后溶液中 。
(5)已知某温度下的电离常数。该温度下溶液中为 。
20.已知常温下:部分弱酸的电离平衡常数HCOOH Ka=1.77×10-4 ;HCN Ka=5.0×10-10 ; H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11 ;H2C2O4 Ka1=5.60×10-2,Ka2=5.42×10-5
(1)同浓度HCOONa、NaCN溶液中碱性最强是 ;
(2)体积相同、c(H+)相同的三种酸溶液a HCOOH;b HCN;c HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) 。
(3)NaHC2O4溶液呈 性(酸/碱);Na2C2O4溶液中物料守恒等式 ;
(4)常温下pH=3的H2C2O4溶液与pH=11的NaOH溶液等体积混合,所得溶液呈 性(酸/碱)
(5)等浓度、等体积的HCOOH与HCOONa溶液混合后pH<7,则溶液中离子浓度从大到小排序为 :
21.(1)如图1表示用相同浓度的NaOH溶液分别滴定浓度相同的3种一元酸,由图可确定酸性最强的是 (填“①”、“②“或“③”)。如图2表示用相同浓度的硝酸银标准溶液分别滴定浓度相同的含Cl-、Br-及I-的混合溶液,由图可确定首先沉淀的离子是 。
(2)25℃时,Ksp(AgCl)=1.8×10-10,若向1L 0.1 mol·L-1的NaCl溶液中加入1L 0.2mol·L-1的硝酸银溶液,充分反应后溶液中c(Cl-)= (不考虑混合后溶液体积的变化)。
22.五氧化二钒广泛用于冶金、化工等行业,主要用于冶炼钒铁、用作冶金添加剂,占五氧化二钒总消耗量的80%以上,其次是用作有机化工的催化剂。为了增加V2O5的利用率我们从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
25℃时取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:
pH 1.3 1.4 1.5 1.6 1.7 1.8 1.9 2.0
钒沉淀率/% 88.1 94.8 96.5 98.0 98.8 98.6 96.4 93.1
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则此时溶液中c(Fe2+)≤ 。已知:25℃时Ksp[Fe(OH)3]=2.6×10-39
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【解析】略
2.D
【分析】用调节二元弱酸溶液的,随pH升高,H2R的浓度降低、HR-的浓度先增大后降低、R2-的浓度升高,b表示H2R的物质的量浓度随的变化,a表示HR-的物质的量浓度随的变化,c表示R2-的物质的量浓度随的变化。根据a、c曲线的交点pH=4.2,25℃时,的;b、c曲线的交点,则, 。
【详解】A.由a、c曲线的交点可知,25℃时,的,故A正确;
B.的水解常数,的,H2R电离程度大于水解程度,所以溶液和溶液中,前者大于后者,故B正确;
C.因为,所以当溶液中时, ,根据电荷守恒,,所以,故C正确;
D.25℃时的,酸性:,在足量的溶液中滴加少量溶液生成次氯酸和Na2R,发生反应:,故D错误;
选D。
3.B
【详解】A. 25℃时,对于同类型的难溶电解质,越大,其饱和溶液中离子的浓度就越大,由于,则饱和溶液中大,A错误;
B. 25℃时,悬浊液中存在沉淀溶解平衡,向的悬浊液中加入少量的固体,结合溶液中的,使浓度减小,的沉淀溶解平衡向沉淀溶解的方向移动,溶液中增大,增大,B正确;
C. 只与温度有关,温度不变,则不变,C错误;
D. 25℃时,与接近,只要保证溶液中c2(F-)·c(Mg2+)>,就可以实现向的转化,D错误。答案选B。
4.D
【详解】A.标况下,H2O为非气体,无法计算H2O的物质的量,A项错误;
B.溶液中n=cV但V未知,无法计算,B项错误;
C.6.5gZn物质的量为,则Zn失去的电子为0.2NA,但在该反应中N的化合价也升高了所以该反应转移的电子数目大于0.2NA,C项错误;
D.pH=5的H+浓度为10-5mol/L,则n(H+)=cV=10-5mol,D项正确;
故选D。
5.D
【详解】A.应比较同浓度的甲酸溶液和盐酸溶液的导电性,若甲酸溶液的导电性比盐酸溶液导电性弱,才能证明它为弱电解质,故A不符合题意;
B.甲酸可以与碳酸钠溶液反应,只能证明甲酸酸性比碳酸强,故B不符合题意;
C.10 mL 1mol L 1的甲酸溶液恰好与10mL 1mol L 11NaOH溶液完全反应,只能证明它为一元酸,不能证明其为弱酸,故C不符合题意;
D.0.1mol L 1甲酸溶液的pH约为3,氢离子为1.0×10 3mol L 1,说明甲酸部分电离,能证明是弱电解质,故D符合题意。
故选D。
6.D
【详解】A. 有些金属的盐溶液不是无色的,如硫酸铜溶液是蓝色的,故A错误;
B. 燃点低的物质不需要点燃,在一定温度下可以自燃,如白磷可以自燃,故B错误;
C. 气体的溶解度或某些易溶物质的溶解度与温度成反比,熟石灰或气体的溶解度随温度的升高而减小,故C错误;
D. 常温下中性溶液的pH等于7,故pH大于7的溶液一定是碱性溶液,故D正确;
故选D。
7.A
【详解】A.根据电荷守恒可知c(NH)+ c(H+)= c(Cl-)+ c(OH-),A正确;
B.NH4Cl溶液中滴加少量浓氢氧化钠会发生反应,NH+OH-=NH3·H2O,会使c(NH)减小,B错误;
C.pH=4,H+浓度为1×10-4mol/L,且全部由水电离,水电离出的 c(OH-)= 1×10-4 mol/L,C错误;
D. NH4Cl溶液中NH水解,c(Cl- )>c(NH),水解显酸性,c(H+)>c(OH-),但NH水解程度不大,则c(Cl- )>c(NH)>c(H+)> c(OH- ),D错误;
故选A。
8.C
【详解】A. 50℃时,碳酸氢钠溶液的pH为8.8,说明溶液中氢离子浓度为10-8.8mol/L,但因为水的离子积常数不能确定,所以不能计算氢氧根离子浓度,故错误;
B.溶液中的物料守恒,c(Na+)=c(HCO3—) +c(CO32—) + c(H2CO3),溶液中碳酸氢根子水解生成碳酸,电离生成碳酸根离子,因为溶液显碱性,说明水解程度大于电离程度,即碳酸分子浓度大于碳酸根离子浓度,故c(Na+)=c(HCO3—) +2c(CO32—)错误;
C. 升高温度,碳酸氢根离子水解程度增大,碳酸氢根离子浓度减小,所以c(Na+)/c(HCO3—)增大,故正确;
D. 将NaHCO3溶液蒸干,碳酸氢钠受热分解生成碳酸钠和水和二氧化碳,不能得到NaOH固体,故错误。故选C。
【点睛】掌握常见的弱酸的酸式盐中的电离和水解程度的大小和影响因素。碳酸氢钠溶液中碳酸氢根离子的水解程度大于电离程度,溶液显碱性,亚硫酸氢钠溶液中亚硫酸氢根离子的电离程度大于水解程度,溶液显酸性,不管是电离还是水解,加热都会促进。
9.B
【详解】A、碳酸钠和少量的盐酸之间反应生成氯化钠和碳酸氢钠,开始不会产生气体,故A错误;
B、溴单质具有氧化性,溴水中滴入溶液,溴水中的溴单质能将亚硫酸钠氧化为硫酸钠,并且会生成强酸HBr,所以酸性增强;随着溶液的滴入,当氧化性的溴单质消耗掉,到最后相当于将之稀释,酸性减弱,pH增大,故B正确;
C、硝酸银中加入少量氨水,生成氢氧化银白色沉淀,继续滴加,沉淀消失,得到银氨溶液,故C错误;
D、是放热的,升高温度,化学反应速率加快,平衡逆向移动,即逆反应速率大于正反应速率,故D错误;
故选:B。
10.D
【分析】红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)粉碎后用硫酸浸取,Ni、Fe、Mg元素进入溶液,滤渣1为不溶于稀硫酸的SiO2;过滤后向滤液中加入次氯酸钠将Fe2+氧化成Fe3+,然后加入碳酸钠并加热除去铁元素,得到滤渣2;过滤后向滤液中加入NaF除去镁离子,得到滤渣3为MgF2;过滤后加入碳酸氢铵得到碳酸镍沉淀,将碳酸镍沉淀加稀硫酸溶解,再向溶液中加入NaOH得到Ni(OH)2,以此解答该题。
【详解】A.浓硫酸中水含量很少,硫酸电离出的氢离子较少,所以不宜选用98%的浓硫酸,A错误;
B.滤渣1主要为难溶于硫酸的SiO2,B错误;
C.NaClO的作用是将Fe2+氧化为Fe3+,所以检验NaClO是否足量,应检验溶液中是否还有Fe2+,所用试剂应为K3[Fe(CN)6],C错误;
D.沉镍时反应有Ni2+、NH4HCO3,产物有NiCO3说明不是双水解,而是Ni2+与HCO电离出的CO结合生成NiCO3沉淀,促进HCO的电离,同时产生大量的氢离子,而氢离子又和HCO反应生成二氧化碳和水,所以离子方程式为Ni2++2 HCO=NiCO3↓+CO2↑+H2O,D正确;
综上所述答案为D。
11.A
【详解】A.HgS的溶解度比FeS的溶解度小,所以可以用FeS除去废水中的Hg2+,故A正确;
B.醋酸是弱酸,在离子方程式里不能写成离子,故B错误;
C.Na2S溶液不是酸性的,所以在离子方程式里不能出现H+,正确的离子方程式为:S2-+ClO-+H2O=S↓+Cl-+2OH-,故C错误;
D.谷氨酸和足量的NaOH溶液反应,两个羧基都被中和成盐,正确的离子方程式为: +2OH-+2H2O,故D错误;
故选A。
12.D
【详解】①是HCl电离方程式,不属于水解反应;②水解方程式不正确,应为 ;③水解方程式不正确,应为 ;④是碳酸氢根离子的电离方程式,不属于水解反应;⑤水解方程式不正确,应为,全部符合题意。
13.D
【分析】NaOH为强碱,pH=9,则c(OH-)=10-5mol/L,c(NaOH)=10-5mol/L;CH3COONa为强碱弱酸盐,水解显碱性,则c(CH3COONa)>10-5mol/L。
【详解】分别加水稀释相同倍数时,促进CH3COONa水解,pH变化的小,所以醋酸钠的pH大于氢氧化钠的pH,故A错误;CH3COONa水解促进水电离,氢氧化钠抑制水电离,由水电离产生的OH-物质的量浓度:醋酸钠>氢氧化钠,故B错误;分别加热到相同温度时,NaOH溶液c(OH-)不变,加热促进CH3COONa水解,CH3COONa溶液中c(OH-)增大,升高相同温度,NaOH溶液的pH小于CH3COONa溶液,故C错误;两溶液因pH均为9,因此c( CH3COONa)大于c(NaOH),因此CH3COONa溶液中c(Na+)大于NaOH溶液中c(Na+),故D正确。
【点睛】本题考查盐类水解的应用,注意:酸、碱、能水解的盐对水的电离的影响是解答本题的关键,明确温度、稀释对水解的影响,题目难度中等。
14.C
【详解】A.通入品红溶液中,品红褪色,说明具有漂白性;通入溶液中,溶液褪色,说明具有还原性,故A错误;
B.对应的酸为,故不能通过比较溶液和溶液的pH比较和的酸性强弱,故B错误;
C.向两支试管中各加入2mL的溶液,再同时各加入2mL和的稀硫酸,通过观察两支试管变浑浊的快慢,来研究浓度对反应速率的影响,故C正确;
D.甲基橙的变色范围为pH=3.1~4.4,氢氧化钠与醋酸反应的产物为碱性,应用酚酞作指示剂,故D错误;
故选C。
15. ﹤ 10-3 mol/L 10-11 mol/L ③①②④ 9∶2
【详解】(1)NH3·H2O为弱电解质,存在电离平衡,NaOH为强电解质,完全电离;若氢氧根离子浓度均为0.1mol·L-1、等体积的NaOH和NH3·H2O分别加水稀释均为104倍,稀释后NH3·H2O溶液的pH>9,而NaOH溶液的pH=9,若要稀释后两种溶液的pH都变成9,NH3·H2O溶液要继续加水稀释直到pH=9,所以m<n;正确答案:﹤。
(2)CH3COONa溶液水解显碱性,促进水电离,,pH=11的CH3COONa溶液,c(H+)=10-11 mol/L, c(OH-)=10-3mol/L,溶液中水电离出来的c(OH-)=10-3mol/L;CH3COOH溶液电离显酸性,抑制水电离,pH=3的CH3COOH溶液中,c(H+)=10-3 mol/L,溶液中水电离出来的c(H+)= 10-11 mol/L;正确答案:10-3 mol/L; 10-11 mol/L。
(3)NH4HSO4溶液完全电离出NH4+、H+、SO42-,溶液中的H+抑制NH4+的水解,剩余的NH4+的量多;NH4Cl溶液发生少量水解,剩余的NH4+的量比NH4HSO4溶液中的少,CH3COONH4溶液中两种离子相互促进水解,剩余的NH4+的量比NH4Cl溶液中的少;NH3·H2O为弱电解质,发生微量电离,溶液中的NH4+的量最少;四种溶液中NH4+浓度由大到小的顺序是:③①②④;正确答案:③①②④。
(4)bL、pH=2的H2SO4溶液中n(H+)=b×10-2 mol,a L、pH=9的NaOH溶液中n(OH-)=10-3 ×a mol,根据题意可知,反应后溶液呈酸性:(b×10-2-10-3 ×a)/(a+b)=10-3,解之:a∶b=9∶2;正确答案:9∶2。
【点睛】酸、碱溶液抑制水电离,能够水解的盐溶液促进水电离。
16. 促进 酸 水的电离是吸热反应,升温,平衡正向移动,和都增大,,增大 10
【分析】(1)氯化铵水解显酸性;
(2)水的电离是吸热反应,升高温度促进水电离,导致水的离子积常数增大;
(3)在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同来计算回答;
(4)根据pH= -lgc(H+)来计算。
【详解】(1)25℃时,向100mL纯水中加入0.01mol的固体,促进水的电离,铵根离子水解显酸性,其水解方程式为:;
(2)水的电离为吸热反应,升高温度,平衡向着正反应方向移动,导致水的离子积常数增大,根据表格知,温度大小顺序是,25<t1<t2,则a>1×10 14;
(3)某温度下纯水中的c(H+)=2.4×10 7mol/L,则此时溶液中的c(OH )=2.4×10 7mol/L,该温度下水的离子积额Kw= c(H+)·c(OH )=2.4×10 7mol/L×2.4×10 7 mol/L=5.76×10 14;某盐酸溶液的,则氢离子浓度为10 2mol/L,因该溶液中c(OH )===5.76×10 12 mol L 1;
(4)0.01mol/L的氢氧化钠溶液氢氧根离子的浓度c(OH )=10 2mol/L,则c(H+)==10-10mol/L,pH= lgc(H+)= lg10 10=10。
【点睛】利用水的离子积进行水溶液中离子浓度的计算是重点也是难点。学生要合理利用公式,打破固定思维,不能误认为水的离子积常数是固定不变的,会随着温度的变化而变化。
17. < ③④⑤ ④ = > NH4++H2ONH3·H2O+H+ 逆向
【详解】(1)1LpH=2的HCl溶液与0.01mol·L-1的NaOH溶液1L充分反应恰好呈中性;一元强酸、一元弱碱溶液,等物质的量混合后恰好生成强酸弱碱盐,溶液呈酸性;若使1LpH=2的HCl溶液与0.01mol·L-1的NH3·H2O溶液充分反应至中性,则氨水的体积大于1L,所以y
(3)将等体积、等物质的量浓度的NH3·H2O和NH4HSO4溶液混合后,恰好生成(NH4)2SO4,溶液呈酸性,pH<7;升高温度促进铵根离子水解,溶液酸性增强,所以溶液pH随温度变化是图中的④曲线;
(4)根据电荷守恒,c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(OH-),溶液呈中性c(OH-)= c(H+),所以c(Na+)+c(NH4+)=2c(SO42-);NH4HSO4与氢氧化钡溶液1:1混合,溶液中SO42-恰好完全沉淀,反应离子方程式是NH4++H++SO42-+Ba2++2OH-BaSO4+H2O+NH3·H2O,由于生成NH3·H2O,所以溶液呈碱性,pH>7;
(5)NH4NO3是强酸弱碱盐,铵根离子水解,溶液呈酸性,水解离子方程式是NH4++H2ONH3·H2O+H+;氨水抑制水电离,所以滴加氨水的过程中水的电离平衡将逆向移动。
18. H3PO4 CO2+H2O+ClO-=HClO+ 1.4×10-3
【分析】(1)弱酸的电离平衡常数越大,其电离程度就越大,相应的酸的酸性就越强;弱酸的电离平衡常数越小,其电离程度就越小,相应的酸的酸性就越弱;
(2)碳酸的酸性比次氯酸强,应用强酸制弱酸书写反应方程式;
(3)根据该温度下酸溶液的电离平衡常数计算氢离子浓度。
【详解】(1)在同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数知,则它们酸性强弱顺序是:H3PO4>CH3COOH>H2CO3>>HClO>>,则酸性最强的是H3PO4,最弱的是;
(2)由于酸性:H2CO3>HClO>,则向NaClO溶液中通入少量的CO2,反应产生NaHCO3和HClO,该反应的离子方程式为:CO2+H2O+ClO-=HClO+;
(3)该温度下,0.10 mol/L的CH3COOH溶液中存在电离平衡,CH3COOH CH3COO-+H+,平衡常数K==1.76×10-5,c2(H+)=0.10×1.76×10-5 ,c(H+)≈1.4×10-3 mol/L。
【点睛】本题考查了弱电解质的平衡常数的应用。弱电解质电离平衡常数越大,物质电离程度越大,相同浓度时电离产生的离子浓度就越大。强酸可以与弱酸盐反应制取弱酸。
19.(1) A 10:1
(2)
(3)小于
(4)
(5)
【解析】(1)
水的电离是吸热过程,当温度升高时,促进水的电离,水的电离程度增大,水的离子积常数 增大,水中离子浓度都增大,由图可知曲线A的电离程度小于曲线B,所以25℃时水的电离平衡曲线应为A;25℃时纯水的pH=7,由于混合溶液的pH=7,说明酸、碱混合时溶液显示中性,水溶液中的的物质的量=碱溶液中离子的物质的量,pH=4的H2SO4溶液中=10-4mol/L,pH=9的NaOH溶液中 ,设H2SO4溶液的体积为x,NaOH溶液的体积为y,则有:,则。
(2)
95℃时,由图可知水的离子积常数,100L的pH=a的强酸溶液中,1L的 pH=b的强碱溶液 n(OH-) = 1L×10-(12-b)mol/L= 10b-12mol,混合后溶液呈中性,则,即:100×10-a = 10b-12,解得:a+b=14。
(3)
曲线对应的温度为25℃,此时水的离子积常数,由于HCl和BOH均会抑制水的电离,则在 pH=2的HCl溶液中,溶液中 C总(H+) = 1×10-2mol/L,则水电离出的 ,在pH=11的BOH溶液中,c总(H+) = 1×10-11mol/L,则由水电离出的c水(H+) = c总(H+)= 1×10-11mol/L>1×10-12mol/L,则a1
25℃时,水的离子积常数,某Na2SO4溶液中,则溶液中Na+离子浓度 ,取该溶液1mL加水稀释至10mL,稀释10倍,则,但由于Na2SO4溶液是显中性的,,所以 。
(5)
已知该温度下的电离常数 ,溶液中存在 ,则,可知0.01mol/L溶液中。
20.(1)NaCN
(2)b>a>c
(3) 酸
(4)酸
(5)c(HCOO-)>c(Na+)>c(H+)>c(OH-)
【详解】(1)酸的电离常数越大,酸性越强,其对应的酸根离子水解程度越小,则相同浓度的钠盐溶液碱性越弱,电离平衡常数:HCOOH>HCN,水解程度HCOO-<CN-,则碱性HCOONa<NaCN;
(2)酸的电离常数越大,酸性越强,体积相同、c(H+)相同的三种酸溶液a HCOOH;b HCN;c HCl,三种溶液的浓度大小为:b>a>c,最终电离出n(H+)大小:b>a>c,则消耗NaOH的体积大小为:b>a>c;
(3),说明的电离程度大于其水解程度,NaHC2O4溶液呈酸性;Na2C2O4溶液中物料守恒为:;
(4)草酸为弱酸,pH=3的H2C2O4溶液浓度远大于10-3mol/L,pH=11的NaOH溶液浓度为10-3mol/L,等体积混合草酸过量,所得溶液呈酸性;
(5)等浓度等体积的HCOOH、HCOONa混合溶液的pH<7,溶液呈酸性,
c(H+)>c(OH-),说明HCOOH电离程度大于HCOO-的水解程度,Na+不水解,所以c(HCOO-)>c(Na+),但其电离和水解程度都较小,所以溶液中存在c(HCOO-)>c(Na+)>c(H+)>c(OH-);
21. ③ I- mol/L
【分析】(1)同浓度一元酸酸性越强,pH值越小;横坐标相同时,纵坐标数值越大,卤离子浓度越小,其溶度积常数越小,越先生成沉淀。
(2)硝酸银过量,先计算反应后溶液中银离子的浓度再根据Ksp计算氯离子浓度。
【详解】(1)根据图可知未加碱时相同浓度的三种一元酸pH值最小的是③,即酸性最强的是③;横坐标相同时,纵坐标数值越大,卤离子浓度越小,其溶度积常数越小,越先生成沉淀,根据图知,最先生成沉淀的是I-,
(2)硝酸银过量,混合后溶液中c(Ag+)=,c(Cl-)=mol/L。
【点睛】明确图2中纵横坐标含义及曲线变化趋势是解本题关键。
22. 1.7
【详解】从沉淀率和关系找出最佳沉淀率。若钒沉淀率为时,不产生沉淀,此时溶液,计算氢氧根离子浓度,结合溶度积常数计算溶液中铁离子的浓度。由表中数据可知,时钒的沉淀率最大为,故加入氨水调节溶液的最佳为1.7.若钒沉淀率为时不产生沉淀,此时溶液, ,,。
答案第1页,共2页
答案第1页,共2页
