第二章《化学反应的方向、限度与速率》(含解析)测试题2023-2024学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第二章《化学反应的方向、限度与速率》(含解析)测试题2023-2024学年上学期高二化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-20 00:00:00 | ||
图片预览



文档简介
第二章《化学反应的方向、限度与速率》测试题
一、单选题
1.在恒温恒容下,反应,达到平衡状态的标志是:
A.单位时间内生成2n molA,同时生成n mo1D
B.容器内压强不随时间而变化
C.单位时间内生成n molB,同时消耗1.5n molC
D.容器内混合气体密度不随时间而变化
2.工业上可用生产甲醇,反应为:。将和充入的密闭容器中,测得的物质的量随时间变化如图实线所示。图中虚线表示仅改变某一反应条件时,物质的量随时间的变化,下列说法正确的是( )
A.反应开始至a点时
B.若曲线Ⅰ对应的条件改变是升高温度,则该反应
C.曲线Ⅱ对应的条件改变是降低压强
D.保持温度不变,若将平衡后的容器体积缩小至,重新达平衡时则
3.下列实验方法或装置正确的是
A.用图1所示装置制取乙烯
B.用图2所示方法验证HCl气体易溶于水
C.用图3所示方法探究固体表面积对反应速率的影响
D.用图4所示方法检验溴乙烷与NaOH醇溶液共热产生乙烯
4.下列不能用勒夏特列原理解释的是
A.棕红色NO2加压后颜色先变深后变浅
B.Fe(SCN)3溶液中加入固体KSCN后颜色变深
C.氯水宜保存在低温、避光条件下
D.加催化剂,使氮气和氢气在一定条件下转化为氨气
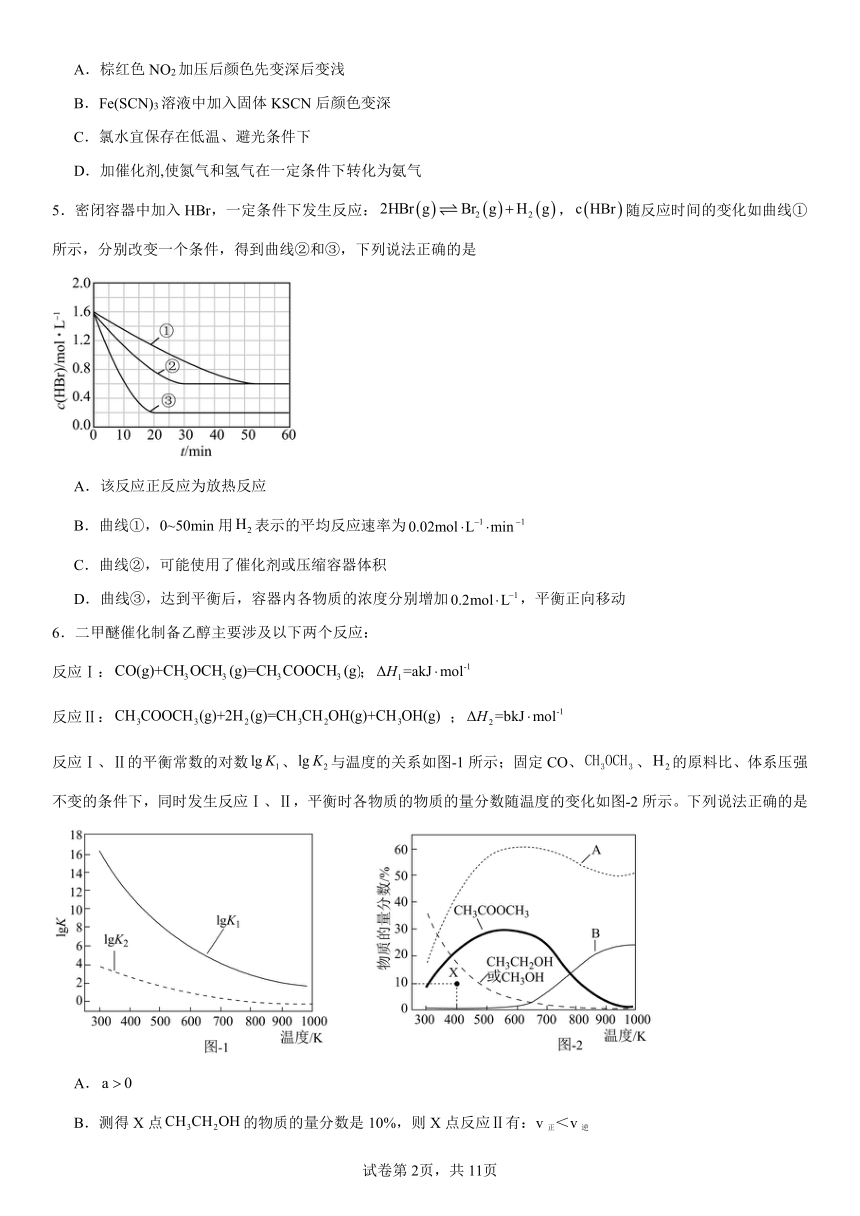
5.密闭容器中加入HBr,一定条件下发生反应:,随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②和③,下列说法正确的是
A.该反应正反应为放热反应
B.曲线①,0~50min用表示的平均反应速率为
C.曲线②,可能使用了催化剂或压缩容器体积
D.曲线③,达到平衡后,容器内各物质的浓度分别增加,平衡正向移动
6.二甲醚催化制备乙醇主要涉及以下两个反应:
反应Ⅰ:;
反应Ⅱ:;
反应Ⅰ、Ⅱ的平衡常数的对数、与温度的关系如图-1所示;固定CO、、的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图-2所示。下列说法正确的是
A.
B.测得X点的物质的量分数是10%,则X点反应Ⅱ有:v正<v逆
C.由的曲线知,600K后升高温度对反应Ⅰ的影响程度大于反应Ⅱ
D.曲线B表示的物质的量分数随温度的变化
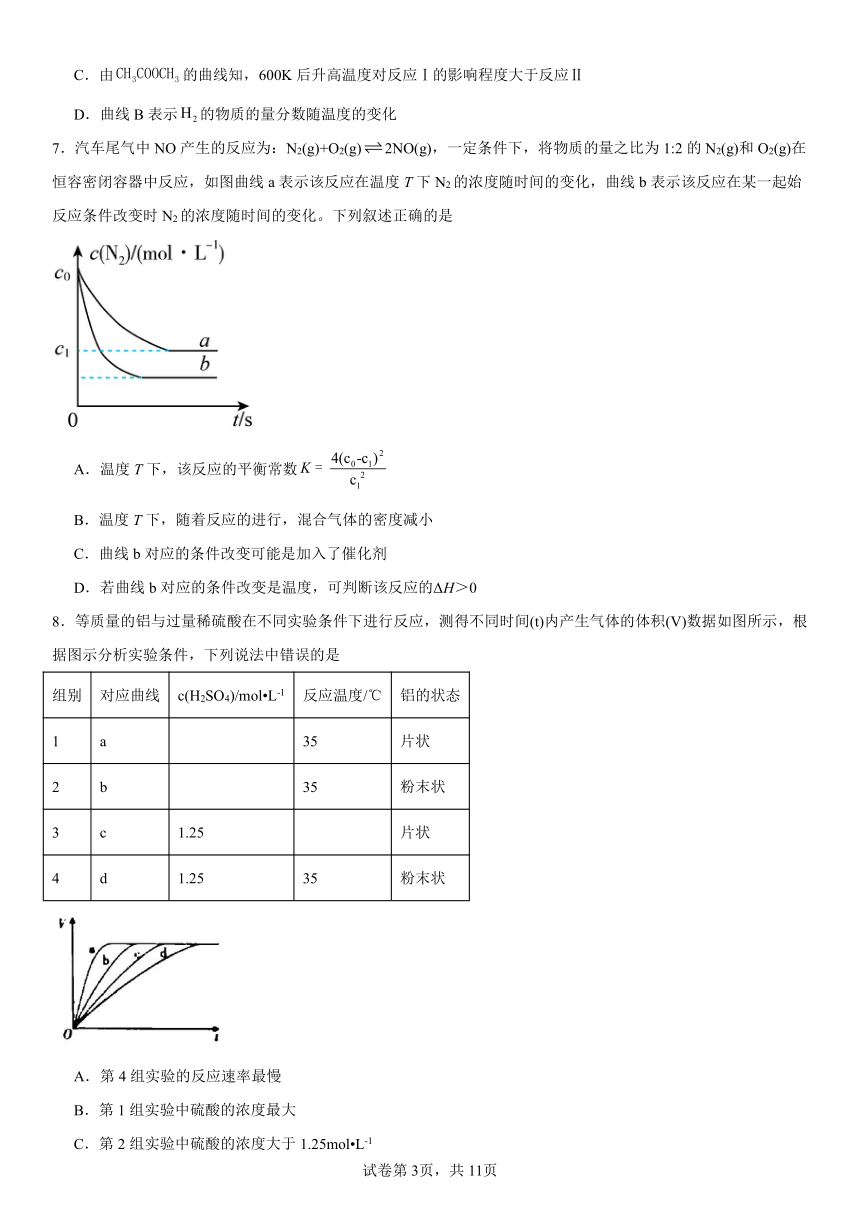
7.汽车尾气中NO产生的反应为:N2(g)+O2(g)2NO(g),一定条件下,将物质的量之比为1:2的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是
A.温度T下,该反应的平衡常数
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的ΔH>0
8.等质量的铝与过量稀硫酸在不同实验条件下进行反应,测得不同时间(t)内产生气体的体积(V)数据如图所示,根据图示分析实验条件,下列说法中错误的是
组别 对应曲线 c(H2SO4)/mol L-1 反应温度/℃ 铝的状态
1 a 35 片状
2 b 35 粉末状
3 c 1.25 片状
4 d 1.25 35 粉末状
A.第4组实验的反应速率最慢
B.第1组实验中硫酸的浓度最大
C.第2组实验中硫酸的浓度大于1.25mol L-1
D.第3组实验的反应温度低于35℃
9.臭氧层保护地球生物,免于紫外线伤害。科学家研究发现:反应有利于保护臭氧层,反应路径如图所示。(TS表示过渡态,IM表示中间物,表示氯自由基),下列说法错误的是
A.路径①的 B.的产率最高
C.路径④的逆反应的活化能最大 D.
10.《化学反应原理》模块从不同的视角对化学反应进行了探究、分析。以下观点中不正确的是
①放热反应在常温下均能自发进行;
②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应;
④加热时,放热反应的υ(正)会减小;
⑤化学平衡常数的表达式与化学反应方程式的书写无关。
A.①②④⑤ B.①④⑤ C.②③⑤ D.①②⑤
11.下列有关化学反应速率说法错误的是
A.对有气体参加的化学反应,扩大容器的体积使压强减小,化学反应速率减慢
B.向反应体系中加入反应物,化学反应速率会加快
C.降低温度,使反应物分子中活化分子百分数减小,化学反应速率减慢
D.一般情况下,加入适宜的催化剂,化学反应速率会加快
12.一定温度下,向a L密闭容器中加入2 mol NO2(g),发生如下反应:2NO2(g)2NO(g)+O2(g),此反应达到平衡状态的标志是
A.混合气体的密度不再变化
B.混合气体的颜色变浅
C.混合气体中NO2、NO、O2的物质的量之比为2∶2∶1
D.单位时间内生成2n mol NO同时生成2n mol NO2
13.定温时,在容积可变的密闭容器中,反应N2O4(g)2NO2(g)平衡体系中NO2的体积分数随压强的变化情况如图所示。下列说法正确的是
A.图中A、C两点的正反应速率关系为A>C
B.图中B点可能是向容器中再加入稀有气体后的状态
C.若D→C所需时间为x,E→A所需时间为y,则x<y
D.向定容容器中再加入NO2可实现图中点E→C的转变
二、填空题
14.十九大报告提出“要像对待生命一样对待生态环境”,对硫、氮等元素形成的有毒有害气体进行处理成为科学研究热点。请回答下列问题:
SO2主要来源于含硫燃料的燃烧,燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g) ΔH=-681.8 kJ/mol对煤进行脱硫处理以减少SO2的排放。T℃时,将煤燃烧产生的气体收集于一密闭容器中,发生上述反应,测得各物质的浓度与反应时间的关系如下:
时间(min) 浓度(mol L-1) 0 10 20 30 40 50
O2 1.00 0.79 0.60 0.60 0.64 0.64
CO2 0 0.42 0.80 0.80 0.88 0.88
用NH3催化还原NOx也可以消除氮氧化物的污染,其反应原理为:NO(g)+NO2(g)+2NH3(g) 2N2(g)+3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为,请计算此时的平衡常数Kp= (用只含P的代数式表示,且化至最简式。已知:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。某组分的平衡分压=P×该组分的物质的量分数)。
15.我国利用焦炉煤气制取甲醇及二甲醚技术已日臻成熟。回答下列问题:
(1)已知下列反应的热化学方程式:
①
②
③
则的 。
(2)二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
Ⅰ. ,;
Ⅱ. ,;
Ⅲ. ,。
①下列措施中,能提高平衡时产量的有 (填字母)。
A.使用过量的 B.升高温度 C.增大压强
②一定温度下,将和通入恒容密闭容器中,发生反应Ⅲ,后达到平衡状态,平衡后测得的体积分数为20%。则内 ,的转化率 , (用最简分数表示)。再往该平衡体系中充入和,则平衡向 (填“正向”“逆向”或“不”)移动,的转化率 (填“增大”“减小”或“不变”)。
16.按要求完成下列问题。
在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)2X(g)Y(g)+Z(s)
(乙)A(s)+2B(g)C(g)+D(g)
当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是 ;能表明(乙)达到化学平衡状态是 。
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
17.下列说法可以证明H2(g)+I2(g) 2HI(g)已达平衡状态的是 。
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H﹣H键断裂的同时有两个H﹣I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=v(HI)
E.温度和体积一定时,容器内压强不再变化
F.温度和体积一定时,混合气体密度不再变化
18.研究氮氧化物的反应机理对于消除环境污染有重要意义。NO在空气中的反应分两步完成,其反应历程如图所示:
(1)反应Ⅰ和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。
①决定反应速率的是 (填“反应Ⅰ”或“反应Ⅱ”)。
②升高反应体系温度,发现总反应速率反而变慢,其可能原因是 (反应未使用催化剂)。
(2)在恒压、NO和起始浓度一定的条件下,用活性炭对NO进行催化吸附,测得不同温度下NO转化为的转化率随温度的变化如图中实线所示。
①X点之前,升高温度NO转化率升高的原因可能是 (任写一种)。
②实现X点到Z点的方法有 (任写一种)。
③实现Z点到Y点的原因可能是 (任写一种)。
(3)存在如下平衡: ,在恒温、恒容条件下与的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:,,相应的速率与其分压关系如图所示。
①A点与的相对大小: (用“<”连接)。
②在D点情况下,继续通入一定量的气体,达到新平衡时,的转化率 (填“变大”“变小”或“不变”)。
③一定温度下, 、与平衡常数 (压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是= 。
19.Ⅰ.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1 L的恒温密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:,测得CO2和CH3OH的浓度随时间变化如图所示。
(1)能说明上述反应达到平衡状态的是 (填字母)。
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1 mol H2,同时生成1 mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
E.混合气体的密度不随时间的变化而变化
(2)平衡时CO2的转化率为 。
(3)平衡混合气体中CO2(g)和H2(g)的质量之比是 。
Ⅱ.(1)在恒温条件下将一定量X和Y的混合气体通入容积为2 L的密闭容器中,X和Y两物质的浓度随时间的变化情况如图所示。
①写出该反应的化学方程式(反应物或生成物用符号X、Y表示): 。
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(2)如图所示曲线是其他条件不变时,反应物的平衡转化率与温度的关系曲线。图中点1时刻,v正 v逆(填“大于”“小于”或“等于”,下同),点4时刻,v正 v逆,点3时刻,v正 v逆。
20.(1)K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
①写出有关的离子方程式 。
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol·L-1的NaOH溶液,试管中溶液呈 色。
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈 色。
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡 (填“向左移动”或“向右移动”),溶液颜色将 。
(2)现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①升高温度时,平衡向 反应方向移动,正反应为 (填“吸热”或“放热”)反应,平衡时B、C的浓度之比将 。(填“增大”“减小”或“不变”,下同)。
②减小压强时平衡向 反应方向移动, A的质量分数 ,且m+n p(填“>”或“<”)。
③若容积不变加入B,则B的转化率 ,A的转化率 。
④若加入催化剂,平衡时气体混合物的总物质的量 。
⑤恒温恒容时,通入氦气,A的质量分数 。
21.近几年全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)2CO2(g)+ N2(g) △H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中V(正)、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g) COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中在1L恒容容器内各物质的浓度随时间变化的曲线。回答下列问题:
①0—6 min内,反应的平均速率v(Cl2)= ;
②若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”);
③若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)= mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
④随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”);
⑤比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)________T(15) (填“<”、“>”或“=”)。
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。下图E,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g) + NO2(g) + 2NH3(g)2N2(g) + 3H2O(g)。
①该反应的△S 0,△H 0(填“>”、“=”或“<”)。
②以下说法正确的是 。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
③已知:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O;NO + NO2 + 2NaOH = 2NaNO2 + H2O标况下V升NO和NO2的混合气体通100mLNaOH溶液恰好完全反应,则NO和NO2的体积比是 ,NaOH的物质的量浓度为_______(用含V的数学表达式表示,反应后的溶液呈______性(填“酸”、“碱”或“中”)
22.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示。
(1)从反应开始到10 s,用Z表示的反应速率为 ;
(2)X的物质的量浓度减少了 ,该反应的化学方程式为 ;。
(3)10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示,则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度B.t1时刻,缩小了容器体积C.t1时刻,升高了体系温度D.t1时刻,使用了催化剂
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.单位时间内生成2n molA,同时生成n mo1D,说明正反应速率等于逆反应速率,反应达到平衡,故A正确;
B.该反应是气体体积不变的反应,反应过程中气体压强不变,当容器内压强不随时间而变化时,不能说明反应达到平衡状态,故B错误;
C.单位时间内生成n molB,同时消耗1.5n molC,不能说明正反应速率等于逆反应速率,不是反应达到平衡的标志,故C正确;
D.反应过程中气体总质量和总体积都不变,气体密度一直不变,当容器内混合气体密度不随时间而变化时,不能说明反应达到平衡状态,故D错误;
故选A。
2.D
【详解】A.反应开始至a点时,故A不选;
B.若曲线Ⅰ对应的条件改变是升高温度,氢气量增大,平衡逆向移动,即逆向是吸热反应,正反应为放热反应即反应,故B不选;
C.曲线Ⅱ达到平衡时比实线所需时间短,反应速率快,氢气量少,说明是正向移动,则对应的条件改变是加压,故C不选;
D.反应达到平衡时,则,则,生成的,保持温度不变,若将平衡后的容器体积缩小至,则,平衡正向移动,重新达平衡时,根据方程式关系用极限思维,全反应生成,最大浓度为,又由于是可逆反应,反应不完全,因此重新达到平衡,故选D。
答案选D。
3.B
【分析】
【详解】A.乙醇与浓硫酸的混合液迅速升温到170℃,才能制取乙烯,因此图1中的温度计水银球位置必须伸入液面下,不能与蒸馏烧瓶支管口相平,A错误;
B.挤压胶头滴管使其中水滴入平底烧瓶,如果气体易溶于水,瓶内气压迅速减小,外压大于内压,因此气球膨胀,如果气球不膨胀,则气体不溶于水或溶解度较小,B正确;
C.固体颗粒或表面积的大小、溶液的浓度都是影响铁与盐酸反应速率的变量,根据控制变量法原则可知,探究固体表面积对反应速率的影响时,酸溶液的浓度不能改变或必须相同,如果探究酸溶液的浓度对速率的影响,则固体反应物的表面积不能改变或必须相同,C错误;
D.溴乙烷与NaOH醇溶液共热时,逸出的气体中可能含有乙烯、乙醇等,乙烯、乙醇都能使酸性高锰酸钾溶液褪色,因此会干扰乙烯的检验,必须在检验之前通过洗气除杂装置,D错误;
答案选B。
4.D
【详解】A. 存在平衡2NO2 N2O4,加压条件下气体体积减小,混合气体颜色变深,但压强增大平衡正向移动,颜色变浅,能用勒夏特利原理解释;
B. 存在平衡Fe3++3SCN- Fe(SCN)3,加入固体KSCN,SCN-浓度增大,平衡正向移动,颜色加深,能用勒夏特利原理解释;
C.存在平衡Cl2+H2O- HCl+HClO,生成的次氯酸见光分解,促进平衡正向进行,故氯水宜保存在低温、避光条件下,能用勒夏特利原理解释;
D. 存在平衡N2+3H2 2NH3,催化剂能极大加快反应速率,不影响化学平衡移动,不能用勒夏特利原理解释;
本题选D。
【点睛】勒夏特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动;勒夏特列原理适用的对象是针对可逆反应过程中,平衡移动的规律,若条件改变,平衡不移动,不适用此规律,D选项就不适用此规律。
5.D
【分析】分别改变一个条件,得到曲线②、③,从曲线①得到曲线②,既加快速率平衡又不移动,只能使用催化剂,从曲线①得到曲线③,意味着反应速率加快但平衡右移了,则改变的另一个条件只能是升温。
【详解】A.由上述分析可知,升温平衡正向移动,则该反应为吸热反应,故A错误;
B.曲线①,0~ 50 min用HBr表示的平均反应速率为=0.02mol﹒L-1﹒min-1,根据化学反应速率之比等于化学计量数之比可知,用H2表示的平均反应速率为0.01 mol﹒L-1﹒min-1,故B错误;
C.曲线②,可能使用了催化剂,反应速率加快,平衡不移动,各物质浓度不变;如果缩小体积,气体浓度都增大了,而实际上HBr浓度减小了,与图像变化不符合,故C错误;
D.曲线③达到平衡时有:,得,往容器中加入浓度均为0.2 mol﹒L-1的三种物质,得,则Qc<K,平衡将向正反应方向移动,故D正确;
故答案选D。
6.C
【分析】图-1可知,升高温度,lgK1减小,则K1减小,说明温度升高平衡逆向移动,逆向是吸热反应;300~400K时,由图1知,此温度范围内反应Ⅰ较完全,温度升高,反应Ⅱ平衡左移,导致CH3CH2OH物质的量分数降低;600~700K时,CH3COOCH3物质的量分数随温度升高而降低,反应Ⅰ平衡左移超过反应Ⅱ平衡左移的幅度。A为H2,B为CO或CH3OH。
【详解】A. 结合图-1可知,升高温度,lgK1减小,则K1减小,说明温度升高平衡逆向移动,逆向是吸热反应,正向放热反应,所以a<0,故A错误;
B. 测得X点的物质的量分数是10%,要达到平衡,乙醇的物质的量分数要增大,平衡正向进行,则X点反应Ⅱ有:v正> v逆,故B错误;
C. 由图-1当温度相同时,K1大于K2,温度升高反应Ⅰ平衡逆向移动程度大,由图-2的曲线知,600K后升高温度反应Ⅰ平衡左移超过反应Ⅱ平衡左移的幅度,对反应Ⅰ的影响程度大于反应Ⅱ,故C正确;
D. 温度低时,反应Ⅰ较完全,反应反应Ⅱ进行得少,CO含量低,600K后,反应Ⅰ平衡左移超过反应Ⅱ平衡左移的幅度,CO含量增大,曲线B表示表示CO的物质的量分数随温度的变化,曲线A表示的物质的量分数随温度的变化,故D错误;
故选C。
7.D
【详解】A.温度T下,该反应的平衡常数 ,根据三段式,代入数据可得,A错误;
B.反应前后气体体积不变且质量守恒,所以混合气体的密度不变,B错误;
C.曲线b平衡已经发生移动,而催化剂只能改变反应的速率,不能改变反应的限度,C错误;
D.曲线b的反应速率比曲线a更快,若改变温度,曲线b温度更高,而N2浓度减小,说明平衡向正反应方向进行,可判断该反应的ΔH>0,D正确;
故本题答案为D。
8.D
【解析】温度越高、浓度越大、反应物接触面积越大,反应速率越快,反应速率越快,反应结束时间越短,根据图知,时间:a<b<c<d,则反应速率:a>b>c>d。
【详解】A.通过以上分析知,第4组反应速率最慢,故A正确;
B.第1组反应速率最快,且第1组金属为片状,则其浓度应该最大,故B正确;
C.第2组反应速率大于c、d而小于a,则第2组实验中硫酸的浓度大于1.25mol L-1,故C正确;
D.温度对反应速率影响大于浓度对反应速率影响,反应速率c>d,c中金属是片状、d中金属是粉末状,要使c中反应速率大于d,温度应该高于d,所以第3组实验的反应温度高于35℃,故D错误;
故选:D。
9.B
【详解】A.反应物的能量低于生成物,该反应为吸热反应ΔH>0,A项正确;
B.CH3Cl 的活化能较高,该反应速率较慢,其产率不是最高,B项错误;
C.①②③④路径的逆反应活化能分别为218.01-76.19=141.82、没有活化能、23.55-8.73=14.82、128.69-(-80.22)=208.91,总上看路径④逆反应的活化能最大,C项正确;
D.该反应的ΔH=E生成物-E反应物=76.19-40.47=35.72KJ/mol ,D项正确;
故选B。
10.A
【详解】①放热反应在常温下不一定能自发进行,比如碳在常温下不与氧气反应,故①错误;
②电解过程中,电能转化为化学能而“储存”起来,故②错误;
③原电池中负极失去电子,正极得到电子,因此原电池工作时所发生的反应一定有氧化还原反应,故③正确;
④加热时,放热反应的υ(正)会增大,υ(逆)会增大,故④错误;
⑤化学平衡常数的表达式与化学反应方程式的书写有关,方程式变为2倍,则平衡常数是原来的平方,故⑤错误;
因此①②④⑤错误,故A错误。
综上所述,答案为A。
11.B
【详解】A.对有气体参加的化学反应,扩大容器的体积使压强减小,气体的浓度减小,单位体积内活化分子数减少,单位时间内有效碰撞次数减少,化学反应速率减慢,A项正确;
B.若向反应体系中加入固体反应物,化学反应速率基本不变,B项错误;
C.降低温度,反应物分子中活化分子百分数减小,单位体积内活化分子数减少,单位时间内有效碰撞次数减少,化学反应速率减慢,C项正确;
D.一般情况下,加入适宜的催化剂,降低反应的活化能,使更多的反应物分子成为活化分子,单位体积内活化分子数增多,化学反应速率加快,D项正确;
答案选B。
12.D
【详解】A.混合气体的密度不变化,A错误;
B. NO2(g)有颜色,浓度变小,颜色变浅,且不再变化时达到平衡,B错误;
C.是一个特定情况,只有不再变化时才达到平衡,C错误;
D. 单位时间内生成2n mol NO同时生成2n mol NO2,说明正反应速率等于逆反应速率,此时能达到平衡,D正确;
故选D。
13.C
【详解】A.增大压强,反应速率增大,C点压强大于A点压强,所以AB.在容积可变的密闭容器中加入稀有气体后的状态相当于减压,平衡正向移动,平衡体系中NO2的体积分数应该增大,故B错误;
C.压强越大,反应速率越大,达到平衡状态时用的时间越少,应为x<y,故C正确;
D.向定容容器中再加入NO2平衡逆向移动,平衡体系中NO2的体积分数应该减小,图中点E→C NO2的体积分数没变,故D错误;
故答案为C
14.
【详解】对于反应NO(g)+NO2(g)+2NH3(g) 2N2(g)+3H2O(g),在一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,根据方程式可知:每反应产生2个N2,就会同时产生3个H2O(g),可由平衡产生n(N2)=2b mol,得到n(H2O)=3b mol,此时气体的总物质的量n(气)总=a mol+2a mol+2a mol+2b mol+3b mol=5(a+b) mol,由于N2(g)的体积分数为1/3,则,解得b=5a mol,故平衡时气体总物质的量为n(气)总=5(a+b) mol=5(a+5a)=30a mol,所以平衡时各种气体的体积分数为x(NO)=,x(NO2)=,x(NH3)=,x(N2)=,x(H2O)=,因此此时的平衡常数Kp=。
15.(1)
(2) AC 30% 正向 增大
【详解】(1)据盖斯定律③×2—①-②×2得:,故;
(2)①A.使用过量的H2,c(H2)增大,平衡向正反应方向移动,CH3OCH3产率增加,故A符合题意;
B.该反应为放热反应,升高温度,平衡向逆反应方向移动,CH3OCH3产率降低,故B不符合题意;
C.反应前的气体系数之和大于反应后气体系数,增大压强,平衡向正反应方向移动,CH3OCH3的产率增大,故C符合题意;
答案为AC;
②设达到平衡时CO转化的物质的量为xmol,可列出三段式: ,平衡时氢气的体积分数为20%,故:,解得x=0.06,故;CO的转化率为:;
平衡时各物质的量为:CO:0.14mol,H2O:0.04mol,CO2:0.06mol,H2:0.06mol,故平衡常数为: ;再往该平衡体系中充入0.1molCO和0.1moH2O(g),,平衡正向移动,但由于投料与最初的投料相比,相当于多投入了水蒸气的量,故一氧化碳的转化率增大;
16. ①②③④⑤⑥ ①②③⑤
【详解】①混合气体密度不变,甲反应是气体体积减小的反应,甲容器中气体体积不变,质量会变,密度也变,能判断达到平衡,由于乙反应的两边气体的体积相同,但气体的质量是变化的,所以密度始终不变可判断乙是否达到平衡状态;
②反应容器中生成物的百分含量不变是平衡标志;
③反应物的消耗速率与生成物的消耗速率之比等于系数之比,说明正逆反应速率相同,反应甲、乙达到平衡状态;
④恒温时,气体压强不再改变,乙反应的两边气体的体积相同且都是气体,压强始终不变,所以压强不变无法判断乙是否达到平衡状态,可以判断甲达到平衡状态;
⑤混合气体的平均相对分子质量不变,甲反应前后气体物质的量变化,质量变化,混合气体的平均相对分子质量不变,说明反应达到平衡状态,乙反应是反应前后气体物质的量不变,质量增大,当混合气体的平均相对分子质量不变,说明反应达到平衡状态;
⑥甲反应是气体体积减小的反应,乙是气体体积不变的反应,混合气体的总物质的量不变说明甲达到平衡状态,乙不能判断是否达到平衡状态;
能表明(甲)达到化学平衡状态是①②③④⑤⑥,能表明(乙)达到化学平衡状态是①②③⑤,故答案为:①②③④⑤⑥;①②③⑤。
17.BC
【详解】A.单位时间内生成n mol H2的同时,生成n mol HI,虽然反应进行的方向相反,但变化量之比不等于化学计量数之比,所以反应未达平衡;
B.一个H﹣H键断裂的同时有两个H﹣I键断裂,反应进行的方向相反,且变化量之比等于化学计量数之比,所以反应达平衡状态;
C.温度和体积一定时,混合气体颜色不再变化,则表明c(I2)不变,反应达平衡状态;
D.在反应体系中,始终存在反应速率v(H2)=v(I2)=v(HI),则反应不一定达平衡状态;
E.因为反应前后气体分子数相等,所以温度和体积一定时,容器内压强始终保持不变,反应不一定达平衡状态;
F.温度和体积一定时,混合气体的质量、体积始终不变,密度始终不变,反应不一定达平衡状态;
综合以上分析,BC符合题意,故选BC。
18.(1) 反应Ⅱ 温度升高后反应Ⅰ平衡逆向移动,导致浓度减小,温度升高对反应Ⅱ的影响弱于浓度减小对反应Ⅱ的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢
(2) 升高温度,反应速率加快或升高温度,催化剂活性增强 延长反应时间或增大压强 温度升高,平衡逆向移动
(3) 增大 2k2·
【详解】(1)①反应的活化能越大,反应速率越慢,化学反应速率由最慢的一步决定,所以决定反应速率的是反应Ⅱ,答案:反应Ⅱ;
②温度升高后反应Ⅰ平衡逆向移动,导致浓度减小,温度升高对反应Ⅱ的影响弱于浓度减小对反应Ⅱ的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢;
(2)①升高温度,反应速率加快或升高温度,催化剂活性增强;
②X点得转化率小于平衡转化率,可以延长反应时间或增大压强达到平衡转化率,答案:延长反应时间或增大压强;
③由图像可知该反应是放热反应,升高温度平衡逆向移动,答案:温度升高,平衡逆向移动;
(3)①A点表示两者的消耗速率相等,整体向左移动, ,答案:;
②在D点情况下,继续通入一定量的气体,相当于增大压强,达到新平衡时,的转化率增大,答案:增大;
③反应达到平衡时,,,所以 ==,所以k1=2k2·,答案:2k2·。
19. BD 75% 22:3 Y2X bd 小于 等于 大于
【详解】Ⅰ.(1)A.反应中CO2与CH3OH的物质的量浓度之比为1:1,为图象中曲线的交叉点,由于此时刻后CO2浓度进一步减小,CH3OH的浓度还在增大,说明反应正向进行,未达到平衡状态,A不符合题意;
B.该反应在恒容密闭容器中进行,气体的体积不变;该反应是反应前后气体物质的量改变的反应,若混合气体的压强不随时间的变化而变化,说明气体的物质的量不变,则反应已经达到平衡状态,B符合题意;
C.单位时间内生成1 mol CH3OH,就会反应消耗3 mol H2,且同时产生1 mol H2,则反应正向进行,未达到平衡状态,C不符合题意;
D.反应混合物都是气体,气体的质量不变;而该反应是气体物质的量改变的反应,若混合气体的平均相对分子质量不随时间的变化而变化,说明气体的物质的量不再改变,反应达到了平衡状态,D符合题意;
E.气体的质量和体积始终不变,则混合气体的密度一直不变,因此不能据此判断反应是否达到平衡状态,E不符合题意;
故合理选项是BD;
(2)根据图象可知:在反应开始时CO2的浓度是1.00 mol/L,反应达到平衡时CO2的浓度为0.25 mol/L,反应消耗CO2的浓度为(1.00-0.25)mol/L=0.75 mol/L,故CO2的平衡转化率为;
(3)反应开始时充入1 mol CO2和3 mol H2,二者反应的物质的量的比是1:3,故平衡时二者的物质的量的比仍然是1:3,由于容器的容积是1 L,故平衡时c(CO2)=0.25 mol/L,则n(CO2)=0.25 mol/L×1 L=0.25 mol,n(H2)=0.25 mol×3=0.75 mol,则平衡混合气体中CO2(g)和H2(g)的质量之比m(CO2):m(H2)=(0.25 mol×44 g/mol):(0.75 mol×2 g/mol)=22:3;
Ⅱ.(1)①由图可知:X的物质的量增加,Y的物质的量减少,则X为生成物,Y为反应物。由10 min达到平衡可知,△n(Y):△n(X)=(0.6-0.4) mol:(0.6-0.2) mol=1:2,物质的量变化量之比等于化学计量数之比,当反应在10 min后至25 min,两种物质都存在,且浓度不再发生改变,说明该反应是可逆反应,故反应方程式为:Y2X;
②由图可知:10~ 25 min及30 min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,其它时间段反应未处于平衡状态,即b、d处于化学平衡状态,故合理选项是bd;
(2)根据图示可知:1点反应物转化率大于平衡转化率,反应逆向进行,则v正小于v逆;
点4的反应物转化率等于物质的平衡转化率,说明该点处于平衡状态,因此v正= v逆;
点3时刻反应物转化率小于平衡转化率,说明反应正向进行,未达到平衡状态,因此反应速率v正大于v逆。
20. Cr2O72-+H2O2CrO42-+2H+ 黄 橙 向右移动 变浅或者变成无色 正 吸热 减小 逆 增大 > 减小 增大 不变 不变
【分析】(1)①K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,K2Cr2O7和K2CrO4之间形成平衡;
②加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动;
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,平衡向左移动,向生成K2Cr2O7的方向移动;
④溶液中加入Ba(NO3)2溶液,生成BaCrO4沉淀,CrO42-浓度降低,结合平衡移动原理解答;
(2)①升高温度时,B的转化率变大,则升高温度,平衡正向移动;
②当减小压强时,混合体系中C的质量分数减小,可知减小压强平衡逆向移动;
③容积不变加入B,平衡正向移动,但B的物质的量增加的多;
④催化剂对平衡移动无影响;
⑤恒温恒容时,通入氦气,平衡不移动,A的质量分数不变。
【详解】(1)①K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,K2Cr2O7和K2CrO4之间形成平衡,离子方程式为:Cr2O72-+H2O2CrO42-+2H+ ;
②加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,溶液变黄色;
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,平衡向左移动,向生成K2Cr2O7的方向移动,溶液变为橙色;
④向原溶液中逐滴加入Ba(NO3)2 溶液,生成BaCrO4为黄色沉淀,导致CrO42-减小,平衡正向移动,溶液的颜色变浅;
(2)①当升高温度时,B的转化率变大,说明温度升高平衡向正反应方向移动,则正反应吸热,B浓度减小,C浓度增大,平衡时B、C的浓度之比将减小;
②当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,A的质量分数增大,且m+n>p;
③若保持容器体积不变,加入B,平衡正向移动,A的转化率增大,B的转化率减小;
④若加入催化剂,平衡不移动,平衡时气体混合物的总物质的量不变;
⑤恒温恒容时,通入氦气,平衡不移动,A的质量分数不变。
21.(1)B D;
(2)①0.15 mol ·L-1·min -1 ;②向正反应方向;③ 0.5;④减小;⑤<;
(3)① >;<;②C;③ ≤1; mol/L;碱 。
【详解】试题分析:(1)A、t1时正反应速率仍然在变化,说明没有达到平衡状态,故A错误;B、t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,故B正确;C、t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,故C错误;D、t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,故D正确;故选BD;
(2)①由图可知,6min时Cl2的平衡浓度为0.3mol/L,浓度变化为1.2mol/L-0.3mol/L=0.9mol/L,则v(Cl2)=="0.15" mol L-1 min -1,故答案为0.15 mol L-1 min -1;
②8min时,平衡时c(Cl2)=0.3mol/L、c(CO)=0.1mol/L、c(COCl2)=0.9mol/L,则原平衡时n(Cl2):n(CO):n(COCl2)=3:1:9,现在第8 min 加入体系中的三种物质各1 mol,则反应物的浓度增大程度大些,平衡正向移动,故答案为向正反应方向;
③最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同,即与开始平衡为等效平衡,完全转化到左边满足Cl2浓度为1.2mol/L、CO浓度为1.0mol/L,则:0.7ol/L+c(COCl2)=1.2mol/L,c(CO)=0.5mol/L+c(COCl2)=1.0mol/L,故c(COCl2)=0.5mol/L,故答案为0.5;
④由图1可知,升温平衡向逆反应方向移动,正反应为放热反应,所以温度高,平衡常数减小,故答案为减小;
⑤根据图象,第8min反应处于平衡状态,在第10分钟时是改变温度使平衡向逆反应方向移动,由④升温平衡向逆反应方向移动,可知正反应为放热反应,升高温度平衡向逆反应方向移动,故T(8)<T(15),故答案为<;
(3)①反应前气体的化学计量数为4,反应后计量数之和为5,正反应是混乱度增加的反应,所以△S>0;根据①、②图象可知,达到平衡后升高温度后,氮氧化物的转化率减小,说明升高温度平衡向着逆向移动,正反应为放热反应,△H<0,故答案为>;<;
②A、催化剂不会影响转化率,只影响反应速率,所以第②种催化剂和第①种催化剂对转化率没有影响,故A错误;B、该反应为体积增大的反应,增大压强,平衡向着逆向移动,所以压强对脱氮率有影响,故B错误;C、由图象可知,催化剂①、②分别适合于250℃和450℃左右脱氮,其催化活性最好,故C正确;故选C;
③由NO2+NO+2NaOH═2NaNO2+H2O、2NO2+2NaOH═NaNO2+NaNO3+H2O可知,混合气体要能够完全与氢氧化钠反应,≤1;标准状况下VLNO2和NO的混合气体恰好与100mLNaOH溶液反应,则n(N)=n(NaOH)==mol,c(NaOH)==mol/L,反应生成的NaNO2属于强碱弱酸盐,水解显碱性,故答案为≤1; mol/L;碱 。
考点:考查了化学平衡状态的判断、化学平衡的影响因素等相关知识。
22. 0.079mol/(L·s) 0.395mol/L X(g)+Y(g) 2Z(g) BD
【详解】
(1)从反应开始到10s,Z的物质的量改变1.58mol,容器的体积为2L,则Z表示的反应速率为:=0.079mol/(L·s);
(2)根据图像可知,X的物质的量浓度减少了:=0.395mol/L;反应的物质的量之比等于化学计量数之比,则(1.2-0.41) mol:(1.00-0.21) mol:1.58mol=1:1:2,减少的为反应物,增大的为生成物,则方程式为X(g)+Y(g) 2Z(g);
(3) A.t1时刻,增大了X的浓度,X为反应物,则正反应速率增大,逆反应速率不变,A与图像不符;
B.反应为气体不变的反应,则t1时刻,缩小了容器体积,平衡不移动,正逆反应速率均增大,且增大的程度相同,B与图像符合;
C.t1时刻,升高了体系温度,正逆反应速率均增大,但增大的程度不同,C与图像不符;
D.t1时刻,使用了催化剂,正逆反应速率均增大,且增大的程度相同,D与图像符合;
答案为BD。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.在恒温恒容下,反应,达到平衡状态的标志是:
A.单位时间内生成2n molA,同时生成n mo1D
B.容器内压强不随时间而变化
C.单位时间内生成n molB,同时消耗1.5n molC
D.容器内混合气体密度不随时间而变化
2.工业上可用生产甲醇,反应为:。将和充入的密闭容器中,测得的物质的量随时间变化如图实线所示。图中虚线表示仅改变某一反应条件时,物质的量随时间的变化,下列说法正确的是( )
A.反应开始至a点时
B.若曲线Ⅰ对应的条件改变是升高温度,则该反应
C.曲线Ⅱ对应的条件改变是降低压强
D.保持温度不变,若将平衡后的容器体积缩小至,重新达平衡时则
3.下列实验方法或装置正确的是
A.用图1所示装置制取乙烯
B.用图2所示方法验证HCl气体易溶于水
C.用图3所示方法探究固体表面积对反应速率的影响
D.用图4所示方法检验溴乙烷与NaOH醇溶液共热产生乙烯
4.下列不能用勒夏特列原理解释的是
A.棕红色NO2加压后颜色先变深后变浅
B.Fe(SCN)3溶液中加入固体KSCN后颜色变深
C.氯水宜保存在低温、避光条件下
D.加催化剂,使氮气和氢气在一定条件下转化为氨气
5.密闭容器中加入HBr,一定条件下发生反应:,随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②和③,下列说法正确的是
A.该反应正反应为放热反应
B.曲线①,0~50min用表示的平均反应速率为
C.曲线②,可能使用了催化剂或压缩容器体积
D.曲线③,达到平衡后,容器内各物质的浓度分别增加,平衡正向移动
6.二甲醚催化制备乙醇主要涉及以下两个反应:
反应Ⅰ:;
反应Ⅱ:;
反应Ⅰ、Ⅱ的平衡常数的对数、与温度的关系如图-1所示;固定CO、、的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图-2所示。下列说法正确的是
A.
B.测得X点的物质的量分数是10%,则X点反应Ⅱ有:v正<v逆
C.由的曲线知,600K后升高温度对反应Ⅰ的影响程度大于反应Ⅱ
D.曲线B表示的物质的量分数随温度的变化
7.汽车尾气中NO产生的反应为:N2(g)+O2(g)2NO(g),一定条件下,将物质的量之比为1:2的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是
A.温度T下,该反应的平衡常数
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的ΔH>0
8.等质量的铝与过量稀硫酸在不同实验条件下进行反应,测得不同时间(t)内产生气体的体积(V)数据如图所示,根据图示分析实验条件,下列说法中错误的是
组别 对应曲线 c(H2SO4)/mol L-1 反应温度/℃ 铝的状态
1 a 35 片状
2 b 35 粉末状
3 c 1.25 片状
4 d 1.25 35 粉末状
A.第4组实验的反应速率最慢
B.第1组实验中硫酸的浓度最大
C.第2组实验中硫酸的浓度大于1.25mol L-1
D.第3组实验的反应温度低于35℃
9.臭氧层保护地球生物,免于紫外线伤害。科学家研究发现:反应有利于保护臭氧层,反应路径如图所示。(TS表示过渡态,IM表示中间物,表示氯自由基),下列说法错误的是
A.路径①的 B.的产率最高
C.路径④的逆反应的活化能最大 D.
10.《化学反应原理》模块从不同的视角对化学反应进行了探究、分析。以下观点中不正确的是
①放热反应在常温下均能自发进行;
②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应;
④加热时,放热反应的υ(正)会减小;
⑤化学平衡常数的表达式与化学反应方程式的书写无关。
A.①②④⑤ B.①④⑤ C.②③⑤ D.①②⑤
11.下列有关化学反应速率说法错误的是
A.对有气体参加的化学反应,扩大容器的体积使压强减小,化学反应速率减慢
B.向反应体系中加入反应物,化学反应速率会加快
C.降低温度,使反应物分子中活化分子百分数减小,化学反应速率减慢
D.一般情况下,加入适宜的催化剂,化学反应速率会加快
12.一定温度下,向a L密闭容器中加入2 mol NO2(g),发生如下反应:2NO2(g)2NO(g)+O2(g),此反应达到平衡状态的标志是
A.混合气体的密度不再变化
B.混合气体的颜色变浅
C.混合气体中NO2、NO、O2的物质的量之比为2∶2∶1
D.单位时间内生成2n mol NO同时生成2n mol NO2
13.定温时,在容积可变的密闭容器中,反应N2O4(g)2NO2(g)平衡体系中NO2的体积分数随压强的变化情况如图所示。下列说法正确的是
A.图中A、C两点的正反应速率关系为A>C
B.图中B点可能是向容器中再加入稀有气体后的状态
C.若D→C所需时间为x,E→A所需时间为y,则x<y
D.向定容容器中再加入NO2可实现图中点E→C的转变
二、填空题
14.十九大报告提出“要像对待生命一样对待生态环境”,对硫、氮等元素形成的有毒有害气体进行处理成为科学研究热点。请回答下列问题:
SO2主要来源于含硫燃料的燃烧,燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g) ΔH=-681.8 kJ/mol对煤进行脱硫处理以减少SO2的排放。T℃时,将煤燃烧产生的气体收集于一密闭容器中,发生上述反应,测得各物质的浓度与反应时间的关系如下:
时间(min) 浓度(mol L-1) 0 10 20 30 40 50
O2 1.00 0.79 0.60 0.60 0.64 0.64
CO2 0 0.42 0.80 0.80 0.88 0.88
用NH3催化还原NOx也可以消除氮氧化物的污染,其反应原理为:NO(g)+NO2(g)+2NH3(g) 2N2(g)+3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为,请计算此时的平衡常数Kp= (用只含P的代数式表示,且化至最简式。已知:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。某组分的平衡分压=P×该组分的物质的量分数)。
15.我国利用焦炉煤气制取甲醇及二甲醚技术已日臻成熟。回答下列问题:
(1)已知下列反应的热化学方程式:
①
②
③
则的 。
(2)二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
Ⅰ. ,;
Ⅱ. ,;
Ⅲ. ,。
①下列措施中,能提高平衡时产量的有 (填字母)。
A.使用过量的 B.升高温度 C.增大压强
②一定温度下,将和通入恒容密闭容器中,发生反应Ⅲ,后达到平衡状态,平衡后测得的体积分数为20%。则内 ,的转化率 , (用最简分数表示)。再往该平衡体系中充入和,则平衡向 (填“正向”“逆向”或“不”)移动,的转化率 (填“增大”“减小”或“不变”)。
16.按要求完成下列问题。
在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)2X(g)Y(g)+Z(s)
(乙)A(s)+2B(g)C(g)+D(g)
当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是 ;能表明(乙)达到化学平衡状态是 。
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
17.下列说法可以证明H2(g)+I2(g) 2HI(g)已达平衡状态的是 。
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H﹣H键断裂的同时有两个H﹣I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=v(HI)
E.温度和体积一定时,容器内压强不再变化
F.温度和体积一定时,混合气体密度不再变化
18.研究氮氧化物的反应机理对于消除环境污染有重要意义。NO在空气中的反应分两步完成,其反应历程如图所示:
(1)反应Ⅰ和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。
①决定反应速率的是 (填“反应Ⅰ”或“反应Ⅱ”)。
②升高反应体系温度,发现总反应速率反而变慢,其可能原因是 (反应未使用催化剂)。
(2)在恒压、NO和起始浓度一定的条件下,用活性炭对NO进行催化吸附,测得不同温度下NO转化为的转化率随温度的变化如图中实线所示。
①X点之前,升高温度NO转化率升高的原因可能是 (任写一种)。
②实现X点到Z点的方法有 (任写一种)。
③实现Z点到Y点的原因可能是 (任写一种)。
(3)存在如下平衡: ,在恒温、恒容条件下与的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:,,相应的速率与其分压关系如图所示。
①A点与的相对大小: (用“<”连接)。
②在D点情况下,继续通入一定量的气体,达到新平衡时,的转化率 (填“变大”“变小”或“不变”)。
③一定温度下, 、与平衡常数 (压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是= 。
19.Ⅰ.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1 L的恒温密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:,测得CO2和CH3OH的浓度随时间变化如图所示。
(1)能说明上述反应达到平衡状态的是 (填字母)。
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1 mol H2,同时生成1 mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
E.混合气体的密度不随时间的变化而变化
(2)平衡时CO2的转化率为 。
(3)平衡混合气体中CO2(g)和H2(g)的质量之比是 。
Ⅱ.(1)在恒温条件下将一定量X和Y的混合气体通入容积为2 L的密闭容器中,X和Y两物质的浓度随时间的变化情况如图所示。
①写出该反应的化学方程式(反应物或生成物用符号X、Y表示): 。
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(2)如图所示曲线是其他条件不变时,反应物的平衡转化率与温度的关系曲线。图中点1时刻,v正 v逆(填“大于”“小于”或“等于”,下同),点4时刻,v正 v逆,点3时刻,v正 v逆。
20.(1)K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
①写出有关的离子方程式 。
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol·L-1的NaOH溶液,试管中溶液呈 色。
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈 色。
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡 (填“向左移动”或“向右移动”),溶液颜色将 。
(2)现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①升高温度时,平衡向 反应方向移动,正反应为 (填“吸热”或“放热”)反应,平衡时B、C的浓度之比将 。(填“增大”“减小”或“不变”,下同)。
②减小压强时平衡向 反应方向移动, A的质量分数 ,且m+n p(填“>”或“<”)。
③若容积不变加入B,则B的转化率 ,A的转化率 。
④若加入催化剂,平衡时气体混合物的总物质的量 。
⑤恒温恒容时,通入氦气,A的质量分数 。
21.近几年全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)2CO2(g)+ N2(g) △H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中V(正)、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g) COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中在1L恒容容器内各物质的浓度随时间变化的曲线。回答下列问题:
①0—6 min内,反应的平均速率v(Cl2)= ;
②若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”);
③若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)= mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
④随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”);
⑤比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)________T(15) (填“<”、“>”或“=”)。
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。下图E,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g) + NO2(g) + 2NH3(g)2N2(g) + 3H2O(g)。
①该反应的△S 0,△H 0(填“>”、“=”或“<”)。
②以下说法正确的是 。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
③已知:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O;NO + NO2 + 2NaOH = 2NaNO2 + H2O标况下V升NO和NO2的混合气体通100mLNaOH溶液恰好完全反应,则NO和NO2的体积比是 ,NaOH的物质的量浓度为_______(用含V的数学表达式表示,反应后的溶液呈______性(填“酸”、“碱”或“中”)
22.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示。
(1)从反应开始到10 s,用Z表示的反应速率为 ;
(2)X的物质的量浓度减少了 ,该反应的化学方程式为 ;。
(3)10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示,则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度B.t1时刻,缩小了容器体积C.t1时刻,升高了体系温度D.t1时刻,使用了催化剂
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.单位时间内生成2n molA,同时生成n mo1D,说明正反应速率等于逆反应速率,反应达到平衡,故A正确;
B.该反应是气体体积不变的反应,反应过程中气体压强不变,当容器内压强不随时间而变化时,不能说明反应达到平衡状态,故B错误;
C.单位时间内生成n molB,同时消耗1.5n molC,不能说明正反应速率等于逆反应速率,不是反应达到平衡的标志,故C正确;
D.反应过程中气体总质量和总体积都不变,气体密度一直不变,当容器内混合气体密度不随时间而变化时,不能说明反应达到平衡状态,故D错误;
故选A。
2.D
【详解】A.反应开始至a点时,故A不选;
B.若曲线Ⅰ对应的条件改变是升高温度,氢气量增大,平衡逆向移动,即逆向是吸热反应,正反应为放热反应即反应,故B不选;
C.曲线Ⅱ达到平衡时比实线所需时间短,反应速率快,氢气量少,说明是正向移动,则对应的条件改变是加压,故C不选;
D.反应达到平衡时,则,则,生成的,保持温度不变,若将平衡后的容器体积缩小至,则,平衡正向移动,重新达平衡时,根据方程式关系用极限思维,全反应生成,最大浓度为,又由于是可逆反应,反应不完全,因此重新达到平衡,故选D。
答案选D。
3.B
【分析】
【详解】A.乙醇与浓硫酸的混合液迅速升温到170℃,才能制取乙烯,因此图1中的温度计水银球位置必须伸入液面下,不能与蒸馏烧瓶支管口相平,A错误;
B.挤压胶头滴管使其中水滴入平底烧瓶,如果气体易溶于水,瓶内气压迅速减小,外压大于内压,因此气球膨胀,如果气球不膨胀,则气体不溶于水或溶解度较小,B正确;
C.固体颗粒或表面积的大小、溶液的浓度都是影响铁与盐酸反应速率的变量,根据控制变量法原则可知,探究固体表面积对反应速率的影响时,酸溶液的浓度不能改变或必须相同,如果探究酸溶液的浓度对速率的影响,则固体反应物的表面积不能改变或必须相同,C错误;
D.溴乙烷与NaOH醇溶液共热时,逸出的气体中可能含有乙烯、乙醇等,乙烯、乙醇都能使酸性高锰酸钾溶液褪色,因此会干扰乙烯的检验,必须在检验之前通过洗气除杂装置,D错误;
答案选B。
4.D
【详解】A. 存在平衡2NO2 N2O4,加压条件下气体体积减小,混合气体颜色变深,但压强增大平衡正向移动,颜色变浅,能用勒夏特利原理解释;
B. 存在平衡Fe3++3SCN- Fe(SCN)3,加入固体KSCN,SCN-浓度增大,平衡正向移动,颜色加深,能用勒夏特利原理解释;
C.存在平衡Cl2+H2O- HCl+HClO,生成的次氯酸见光分解,促进平衡正向进行,故氯水宜保存在低温、避光条件下,能用勒夏特利原理解释;
D. 存在平衡N2+3H2 2NH3,催化剂能极大加快反应速率,不影响化学平衡移动,不能用勒夏特利原理解释;
本题选D。
【点睛】勒夏特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动;勒夏特列原理适用的对象是针对可逆反应过程中,平衡移动的规律,若条件改变,平衡不移动,不适用此规律,D选项就不适用此规律。
5.D
【分析】分别改变一个条件,得到曲线②、③,从曲线①得到曲线②,既加快速率平衡又不移动,只能使用催化剂,从曲线①得到曲线③,意味着反应速率加快但平衡右移了,则改变的另一个条件只能是升温。
【详解】A.由上述分析可知,升温平衡正向移动,则该反应为吸热反应,故A错误;
B.曲线①,0~ 50 min用HBr表示的平均反应速率为=0.02mol﹒L-1﹒min-1,根据化学反应速率之比等于化学计量数之比可知,用H2表示的平均反应速率为0.01 mol﹒L-1﹒min-1,故B错误;
C.曲线②,可能使用了催化剂,反应速率加快,平衡不移动,各物质浓度不变;如果缩小体积,气体浓度都增大了,而实际上HBr浓度减小了,与图像变化不符合,故C错误;
D.曲线③达到平衡时有:,得,往容器中加入浓度均为0.2 mol﹒L-1的三种物质,得,则Qc<K,平衡将向正反应方向移动,故D正确;
故答案选D。
6.C
【分析】图-1可知,升高温度,lgK1减小,则K1减小,说明温度升高平衡逆向移动,逆向是吸热反应;300~400K时,由图1知,此温度范围内反应Ⅰ较完全,温度升高,反应Ⅱ平衡左移,导致CH3CH2OH物质的量分数降低;600~700K时,CH3COOCH3物质的量分数随温度升高而降低,反应Ⅰ平衡左移超过反应Ⅱ平衡左移的幅度。A为H2,B为CO或CH3OH。
【详解】A. 结合图-1可知,升高温度,lgK1减小,则K1减小,说明温度升高平衡逆向移动,逆向是吸热反应,正向放热反应,所以a<0,故A错误;
B. 测得X点的物质的量分数是10%,要达到平衡,乙醇的物质的量分数要增大,平衡正向进行,则X点反应Ⅱ有:v正> v逆,故B错误;
C. 由图-1当温度相同时,K1大于K2,温度升高反应Ⅰ平衡逆向移动程度大,由图-2的曲线知,600K后升高温度反应Ⅰ平衡左移超过反应Ⅱ平衡左移的幅度,对反应Ⅰ的影响程度大于反应Ⅱ,故C正确;
D. 温度低时,反应Ⅰ较完全,反应反应Ⅱ进行得少,CO含量低,600K后,反应Ⅰ平衡左移超过反应Ⅱ平衡左移的幅度,CO含量增大,曲线B表示表示CO的物质的量分数随温度的变化,曲线A表示的物质的量分数随温度的变化,故D错误;
故选C。
7.D
【详解】A.温度T下,该反应的平衡常数 ,根据三段式,代入数据可得,A错误;
B.反应前后气体体积不变且质量守恒,所以混合气体的密度不变,B错误;
C.曲线b平衡已经发生移动,而催化剂只能改变反应的速率,不能改变反应的限度,C错误;
D.曲线b的反应速率比曲线a更快,若改变温度,曲线b温度更高,而N2浓度减小,说明平衡向正反应方向进行,可判断该反应的ΔH>0,D正确;
故本题答案为D。
8.D
【解析】温度越高、浓度越大、反应物接触面积越大,反应速率越快,反应速率越快,反应结束时间越短,根据图知,时间:a<b<c<d,则反应速率:a>b>c>d。
【详解】A.通过以上分析知,第4组反应速率最慢,故A正确;
B.第1组反应速率最快,且第1组金属为片状,则其浓度应该最大,故B正确;
C.第2组反应速率大于c、d而小于a,则第2组实验中硫酸的浓度大于1.25mol L-1,故C正确;
D.温度对反应速率影响大于浓度对反应速率影响,反应速率c>d,c中金属是片状、d中金属是粉末状,要使c中反应速率大于d,温度应该高于d,所以第3组实验的反应温度高于35℃,故D错误;
故选:D。
9.B
【详解】A.反应物的能量低于生成物,该反应为吸热反应ΔH>0,A项正确;
B.CH3Cl 的活化能较高,该反应速率较慢,其产率不是最高,B项错误;
C.①②③④路径的逆反应活化能分别为218.01-76.19=141.82、没有活化能、23.55-8.73=14.82、128.69-(-80.22)=208.91,总上看路径④逆反应的活化能最大,C项正确;
D.该反应的ΔH=E生成物-E反应物=76.19-40.47=35.72KJ/mol ,D项正确;
故选B。
10.A
【详解】①放热反应在常温下不一定能自发进行,比如碳在常温下不与氧气反应,故①错误;
②电解过程中,电能转化为化学能而“储存”起来,故②错误;
③原电池中负极失去电子,正极得到电子,因此原电池工作时所发生的反应一定有氧化还原反应,故③正确;
④加热时,放热反应的υ(正)会增大,υ(逆)会增大,故④错误;
⑤化学平衡常数的表达式与化学反应方程式的书写有关,方程式变为2倍,则平衡常数是原来的平方,故⑤错误;
因此①②④⑤错误,故A错误。
综上所述,答案为A。
11.B
【详解】A.对有气体参加的化学反应,扩大容器的体积使压强减小,气体的浓度减小,单位体积内活化分子数减少,单位时间内有效碰撞次数减少,化学反应速率减慢,A项正确;
B.若向反应体系中加入固体反应物,化学反应速率基本不变,B项错误;
C.降低温度,反应物分子中活化分子百分数减小,单位体积内活化分子数减少,单位时间内有效碰撞次数减少,化学反应速率减慢,C项正确;
D.一般情况下,加入适宜的催化剂,降低反应的活化能,使更多的反应物分子成为活化分子,单位体积内活化分子数增多,化学反应速率加快,D项正确;
答案选B。
12.D
【详解】A.混合气体的密度不变化,A错误;
B. NO2(g)有颜色,浓度变小,颜色变浅,且不再变化时达到平衡,B错误;
C.是一个特定情况,只有不再变化时才达到平衡,C错误;
D. 单位时间内生成2n mol NO同时生成2n mol NO2,说明正反应速率等于逆反应速率,此时能达到平衡,D正确;
故选D。
13.C
【详解】A.增大压强,反应速率增大,C点压强大于A点压强,所以A
C.压强越大,反应速率越大,达到平衡状态时用的时间越少,应为x<y,故C正确;
D.向定容容器中再加入NO2平衡逆向移动,平衡体系中NO2的体积分数应该减小,图中点E→C NO2的体积分数没变,故D错误;
故答案为C
14.
【详解】对于反应NO(g)+NO2(g)+2NH3(g) 2N2(g)+3H2O(g),在一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,根据方程式可知:每反应产生2个N2,就会同时产生3个H2O(g),可由平衡产生n(N2)=2b mol,得到n(H2O)=3b mol,此时气体的总物质的量n(气)总=a mol+2a mol+2a mol+2b mol+3b mol=5(a+b) mol,由于N2(g)的体积分数为1/3,则,解得b=5a mol,故平衡时气体总物质的量为n(气)总=5(a+b) mol=5(a+5a)=30a mol,所以平衡时各种气体的体积分数为x(NO)=,x(NO2)=,x(NH3)=,x(N2)=,x(H2O)=,因此此时的平衡常数Kp=。
15.(1)
(2) AC 30% 正向 增大
【详解】(1)据盖斯定律③×2—①-②×2得:,故;
(2)①A.使用过量的H2,c(H2)增大,平衡向正反应方向移动,CH3OCH3产率增加,故A符合题意;
B.该反应为放热反应,升高温度,平衡向逆反应方向移动,CH3OCH3产率降低,故B不符合题意;
C.反应前的气体系数之和大于反应后气体系数,增大压强,平衡向正反应方向移动,CH3OCH3的产率增大,故C符合题意;
答案为AC;
②设达到平衡时CO转化的物质的量为xmol,可列出三段式: ,平衡时氢气的体积分数为20%,故:,解得x=0.06,故;CO的转化率为:;
平衡时各物质的量为:CO:0.14mol,H2O:0.04mol,CO2:0.06mol,H2:0.06mol,故平衡常数为: ;再往该平衡体系中充入0.1molCO和0.1moH2O(g),,平衡正向移动,但由于投料与最初的投料相比,相当于多投入了水蒸气的量,故一氧化碳的转化率增大;
16. ①②③④⑤⑥ ①②③⑤
【详解】①混合气体密度不变,甲反应是气体体积减小的反应,甲容器中气体体积不变,质量会变,密度也变,能判断达到平衡,由于乙反应的两边气体的体积相同,但气体的质量是变化的,所以密度始终不变可判断乙是否达到平衡状态;
②反应容器中生成物的百分含量不变是平衡标志;
③反应物的消耗速率与生成物的消耗速率之比等于系数之比,说明正逆反应速率相同,反应甲、乙达到平衡状态;
④恒温时,气体压强不再改变,乙反应的两边气体的体积相同且都是气体,压强始终不变,所以压强不变无法判断乙是否达到平衡状态,可以判断甲达到平衡状态;
⑤混合气体的平均相对分子质量不变,甲反应前后气体物质的量变化,质量变化,混合气体的平均相对分子质量不变,说明反应达到平衡状态,乙反应是反应前后气体物质的量不变,质量增大,当混合气体的平均相对分子质量不变,说明反应达到平衡状态;
⑥甲反应是气体体积减小的反应,乙是气体体积不变的反应,混合气体的总物质的量不变说明甲达到平衡状态,乙不能判断是否达到平衡状态;
能表明(甲)达到化学平衡状态是①②③④⑤⑥,能表明(乙)达到化学平衡状态是①②③⑤,故答案为:①②③④⑤⑥;①②③⑤。
17.BC
【详解】A.单位时间内生成n mol H2的同时,生成n mol HI,虽然反应进行的方向相反,但变化量之比不等于化学计量数之比,所以反应未达平衡;
B.一个H﹣H键断裂的同时有两个H﹣I键断裂,反应进行的方向相反,且变化量之比等于化学计量数之比,所以反应达平衡状态;
C.温度和体积一定时,混合气体颜色不再变化,则表明c(I2)不变,反应达平衡状态;
D.在反应体系中,始终存在反应速率v(H2)=v(I2)=v(HI),则反应不一定达平衡状态;
E.因为反应前后气体分子数相等,所以温度和体积一定时,容器内压强始终保持不变,反应不一定达平衡状态;
F.温度和体积一定时,混合气体的质量、体积始终不变,密度始终不变,反应不一定达平衡状态;
综合以上分析,BC符合题意,故选BC。
18.(1) 反应Ⅱ 温度升高后反应Ⅰ平衡逆向移动,导致浓度减小,温度升高对反应Ⅱ的影响弱于浓度减小对反应Ⅱ的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢
(2) 升高温度,反应速率加快或升高温度,催化剂活性增强 延长反应时间或增大压强 温度升高,平衡逆向移动
(3) 增大 2k2·
【详解】(1)①反应的活化能越大,反应速率越慢,化学反应速率由最慢的一步决定,所以决定反应速率的是反应Ⅱ,答案:反应Ⅱ;
②温度升高后反应Ⅰ平衡逆向移动,导致浓度减小,温度升高对反应Ⅱ的影响弱于浓度减小对反应Ⅱ的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢;
(2)①升高温度,反应速率加快或升高温度,催化剂活性增强;
②X点得转化率小于平衡转化率,可以延长反应时间或增大压强达到平衡转化率,答案:延长反应时间或增大压强;
③由图像可知该反应是放热反应,升高温度平衡逆向移动,答案:温度升高,平衡逆向移动;
(3)①A点表示两者的消耗速率相等,整体向左移动, ,答案:;
②在D点情况下,继续通入一定量的气体,相当于增大压强,达到新平衡时,的转化率增大,答案:增大;
③反应达到平衡时,,,所以 ==,所以k1=2k2·,答案:2k2·。
19. BD 75% 22:3 Y2X bd 小于 等于 大于
【详解】Ⅰ.(1)A.反应中CO2与CH3OH的物质的量浓度之比为1:1,为图象中曲线的交叉点,由于此时刻后CO2浓度进一步减小,CH3OH的浓度还在增大,说明反应正向进行,未达到平衡状态,A不符合题意;
B.该反应在恒容密闭容器中进行,气体的体积不变;该反应是反应前后气体物质的量改变的反应,若混合气体的压强不随时间的变化而变化,说明气体的物质的量不变,则反应已经达到平衡状态,B符合题意;
C.单位时间内生成1 mol CH3OH,就会反应消耗3 mol H2,且同时产生1 mol H2,则反应正向进行,未达到平衡状态,C不符合题意;
D.反应混合物都是气体,气体的质量不变;而该反应是气体物质的量改变的反应,若混合气体的平均相对分子质量不随时间的变化而变化,说明气体的物质的量不再改变,反应达到了平衡状态,D符合题意;
E.气体的质量和体积始终不变,则混合气体的密度一直不变,因此不能据此判断反应是否达到平衡状态,E不符合题意;
故合理选项是BD;
(2)根据图象可知:在反应开始时CO2的浓度是1.00 mol/L,反应达到平衡时CO2的浓度为0.25 mol/L,反应消耗CO2的浓度为(1.00-0.25)mol/L=0.75 mol/L,故CO2的平衡转化率为;
(3)反应开始时充入1 mol CO2和3 mol H2,二者反应的物质的量的比是1:3,故平衡时二者的物质的量的比仍然是1:3,由于容器的容积是1 L,故平衡时c(CO2)=0.25 mol/L,则n(CO2)=0.25 mol/L×1 L=0.25 mol,n(H2)=0.25 mol×3=0.75 mol,则平衡混合气体中CO2(g)和H2(g)的质量之比m(CO2):m(H2)=(0.25 mol×44 g/mol):(0.75 mol×2 g/mol)=22:3;
Ⅱ.(1)①由图可知:X的物质的量增加,Y的物质的量减少,则X为生成物,Y为反应物。由10 min达到平衡可知,△n(Y):△n(X)=(0.6-0.4) mol:(0.6-0.2) mol=1:2,物质的量变化量之比等于化学计量数之比,当反应在10 min后至25 min,两种物质都存在,且浓度不再发生改变,说明该反应是可逆反应,故反应方程式为:Y2X;
②由图可知:10~ 25 min及30 min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,其它时间段反应未处于平衡状态,即b、d处于化学平衡状态,故合理选项是bd;
(2)根据图示可知:1点反应物转化率大于平衡转化率,反应逆向进行,则v正小于v逆;
点4的反应物转化率等于物质的平衡转化率,说明该点处于平衡状态,因此v正= v逆;
点3时刻反应物转化率小于平衡转化率,说明反应正向进行,未达到平衡状态,因此反应速率v正大于v逆。
20. Cr2O72-+H2O2CrO42-+2H+ 黄 橙 向右移动 变浅或者变成无色 正 吸热 减小 逆 增大 > 减小 增大 不变 不变
【分析】(1)①K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,K2Cr2O7和K2CrO4之间形成平衡;
②加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动;
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,平衡向左移动,向生成K2Cr2O7的方向移动;
④溶液中加入Ba(NO3)2溶液,生成BaCrO4沉淀,CrO42-浓度降低,结合平衡移动原理解答;
(2)①升高温度时,B的转化率变大,则升高温度,平衡正向移动;
②当减小压强时,混合体系中C的质量分数减小,可知减小压强平衡逆向移动;
③容积不变加入B,平衡正向移动,但B的物质的量增加的多;
④催化剂对平衡移动无影响;
⑤恒温恒容时,通入氦气,平衡不移动,A的质量分数不变。
【详解】(1)①K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,K2Cr2O7和K2CrO4之间形成平衡,离子方程式为:Cr2O72-+H2O2CrO42-+2H+ ;
②加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,溶液变黄色;
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,平衡向左移动,向生成K2Cr2O7的方向移动,溶液变为橙色;
④向原溶液中逐滴加入Ba(NO3)2 溶液,生成BaCrO4为黄色沉淀,导致CrO42-减小,平衡正向移动,溶液的颜色变浅;
(2)①当升高温度时,B的转化率变大,说明温度升高平衡向正反应方向移动,则正反应吸热,B浓度减小,C浓度增大,平衡时B、C的浓度之比将减小;
②当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,A的质量分数增大,且m+n>p;
③若保持容器体积不变,加入B,平衡正向移动,A的转化率增大,B的转化率减小;
④若加入催化剂,平衡不移动,平衡时气体混合物的总物质的量不变;
⑤恒温恒容时,通入氦气,平衡不移动,A的质量分数不变。
21.(1)B D;
(2)①0.15 mol ·L-1·min -1 ;②向正反应方向;③ 0.5;④减小;⑤<;
(3)① >;<;②C;③ ≤1; mol/L;碱 。
【详解】试题分析:(1)A、t1时正反应速率仍然在变化,说明没有达到平衡状态,故A错误;B、t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,故B正确;C、t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,故C错误;D、t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,故D正确;故选BD;
(2)①由图可知,6min时Cl2的平衡浓度为0.3mol/L,浓度变化为1.2mol/L-0.3mol/L=0.9mol/L,则v(Cl2)=="0.15" mol L-1 min -1,故答案为0.15 mol L-1 min -1;
②8min时,平衡时c(Cl2)=0.3mol/L、c(CO)=0.1mol/L、c(COCl2)=0.9mol/L,则原平衡时n(Cl2):n(CO):n(COCl2)=3:1:9,现在第8 min 加入体系中的三种物质各1 mol,则反应物的浓度增大程度大些,平衡正向移动,故答案为向正反应方向;
③最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同,即与开始平衡为等效平衡,完全转化到左边满足Cl2浓度为1.2mol/L、CO浓度为1.0mol/L,则:0.7ol/L+c(COCl2)=1.2mol/L,c(CO)=0.5mol/L+c(COCl2)=1.0mol/L,故c(COCl2)=0.5mol/L,故答案为0.5;
④由图1可知,升温平衡向逆反应方向移动,正反应为放热反应,所以温度高,平衡常数减小,故答案为减小;
⑤根据图象,第8min反应处于平衡状态,在第10分钟时是改变温度使平衡向逆反应方向移动,由④升温平衡向逆反应方向移动,可知正反应为放热反应,升高温度平衡向逆反应方向移动,故T(8)<T(15),故答案为<;
(3)①反应前气体的化学计量数为4,反应后计量数之和为5,正反应是混乱度增加的反应,所以△S>0;根据①、②图象可知,达到平衡后升高温度后,氮氧化物的转化率减小,说明升高温度平衡向着逆向移动,正反应为放热反应,△H<0,故答案为>;<;
②A、催化剂不会影响转化率,只影响反应速率,所以第②种催化剂和第①种催化剂对转化率没有影响,故A错误;B、该反应为体积增大的反应,增大压强,平衡向着逆向移动,所以压强对脱氮率有影响,故B错误;C、由图象可知,催化剂①、②分别适合于250℃和450℃左右脱氮,其催化活性最好,故C正确;故选C;
③由NO2+NO+2NaOH═2NaNO2+H2O、2NO2+2NaOH═NaNO2+NaNO3+H2O可知,混合气体要能够完全与氢氧化钠反应,≤1;标准状况下VLNO2和NO的混合气体恰好与100mLNaOH溶液反应,则n(N)=n(NaOH)==mol,c(NaOH)==mol/L,反应生成的NaNO2属于强碱弱酸盐,水解显碱性,故答案为≤1; mol/L;碱 。
考点:考查了化学平衡状态的判断、化学平衡的影响因素等相关知识。
22. 0.079mol/(L·s) 0.395mol/L X(g)+Y(g) 2Z(g) BD
【详解】
(1)从反应开始到10s,Z的物质的量改变1.58mol,容器的体积为2L,则Z表示的反应速率为:=0.079mol/(L·s);
(2)根据图像可知,X的物质的量浓度减少了:=0.395mol/L;反应的物质的量之比等于化学计量数之比,则(1.2-0.41) mol:(1.00-0.21) mol:1.58mol=1:1:2,减少的为反应物,增大的为生成物,则方程式为X(g)+Y(g) 2Z(g);
(3) A.t1时刻,增大了X的浓度,X为反应物,则正反应速率增大,逆反应速率不变,A与图像不符;
B.反应为气体不变的反应,则t1时刻,缩小了容器体积,平衡不移动,正逆反应速率均增大,且增大的程度相同,B与图像符合;
C.t1时刻,升高了体系温度,正逆反应速率均增大,但增大的程度不同,C与图像不符;
D.t1时刻,使用了催化剂,正逆反应速率均增大,且增大的程度相同,D与图像符合;
答案为BD。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
