专题3《水溶液中的离子反应》(含解析)单元检测题2023---2024学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题3《水溶液中的离子反应》(含解析)单元检测题2023---2024学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 902.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-20 12:42:51 | ||
图片预览




文档简介
专题3《水溶液中的离子反应》
一、单选题
1.NA为阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中lmolPCl3与足量Cl2反应生成PCl5,增加2NA个P-Cl键
B.将l mol Cl2通入足量水中,所得溶液中HClO、Cl-、ClO-三种微粒数目之和为2NA
C.足量锌粉与浓硫酸反应生成2.24L气体(标况下),转移电子数为0.2NA
D.含7.8 g Na2S的溶液中阴离子总数等于0.l NA
2.25℃时部分电解质的电离平衡常数数据如下。
HF HClO
下列说法正确的是
A.等物质的量浓度的三种溶液的pH大小关系:
B.的电离方程式为
C.向NaClO溶液中通入适量,漂白性增强的原因是
D.等浓度的NaF和混合溶液中存在
3.设为阿伏加德罗常数的值.下列说法正确的是
A.等质量的石墨与金刚石中键的数目之比为1∶1
B.标准状况下,2.24L中含有的氧原子的数目为0.2
C.常温下,1L的溶液中,发生电离的水分子数为
D.标准状况下1.12LCO中所含质子总数为1.4
4.草酸铵用于制安全炸药和供分析试剂等用,已知数据如表:
弱电解质 草酸(H2C2O4)
电离常数(25℃) K1=5.4×10-2,K2=5.4×10-5 K=1.8×10-5
关于常温下0.40mol·L-1的(NH4)2C2O4溶液,下列说法错误的是
A.由表中数据可判断该溶液呈酸性
B.
C.稀释溶液,减小
D.的水解平衡常数是Kh,Kh的数量级为10-5
5.用海水制盐工业中的母液来生产金属镁的一种工艺流程如下
下列说法错误的是
A.设计步骤①、②、③的主要目的是富集MgCl2
B.脱水时在HCl气氛中进行可防止MgCl2发生水解
C.步骤④电解熔融MgCl2时,阴极有金属Mg析出
D.电解得到的炽热镁粉可在氮气中冷却
6.溶液的酸碱性对人类生产、生活有十分重要的影响,酸碱性的变化规律是化学研究的重要组成部分。下列酸碱性及其变化的说法正确的是
A.氢离子浓度很小的溶液一定显酸性
B.25℃,pH=3的盐酸体积稀释到原来的10倍,所得溶液pH>4
C.硫酸溶液与等体积水混合后,所得溶液pH=1
D.25℃,pH=3的醋酸与pH=11的氢氧化钡溶液等体积混合后pH<7
7.常温下,向20.00mL0.1000mol·L-1的CH3COOH溶液中滴加0.1000mol·L-1的NaOH溶液,溶液中,lg随pH的变化关系如图所示(取lg5=0.7)。下列说法正确的是
A.常温下,CH3COOH的电离常数为10-4.76
B.当溶液的pH=7时,消耗NaOH溶液20.00mL
C.溶液中水的电离程度大小:a>b>c
D.c点溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
8.pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示。下列说法正确的是
A.A、B两酸溶液的物质的量浓度一定相等 B.a=5时,A是强酸,B是弱酸
C.稀释后,A酸溶液的酸性比B酸溶液强 D.若A、B都是弱酸,则a=5
9.化学与生产、生活密切相关,下列说法正确的是
A.漂白粉和明矾都常用于自来水的处理,二者的作用原理相同
B.采用催化转换技术不能提高汽车尾气中有害气体的平衡转化率
C.草木灰与混合施用可更好地为植物提供N、P、K三种元素
D.纯碱溶液加热后去污能力更强,是因为加热增大了纯碱的溶解度
10.常温下,将溶液与溶液混合,可制得,混合过程中有气体产生。已知:;;;下列说法不正确的是
A.向的氨水中通入少量,反应后溶液中存在:
B.溶液中:
C.生成的离子方程式为:
D.生成沉淀后的上层清液中:
11.2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是
A.醋酸钠是强电解质 B.醋酸钠溶液中
C.常温下,醋酸钠溶液的 D.结晶后,溶液中下降
12.对下列粒子组在溶液中能否大量共存的判断和分析正确的是
选项 粒子组 判断和分析
A NH、、、SO、 不能大量共存,只因为发生反应:
B 、、SO、 能大量共存,粒子间不反应
C 、、、MnO 不能大量共存,因为发生反应:
D 、、、SO、AlO 不能大量共存,因为发生反应:
A.A B.B C.C D.D
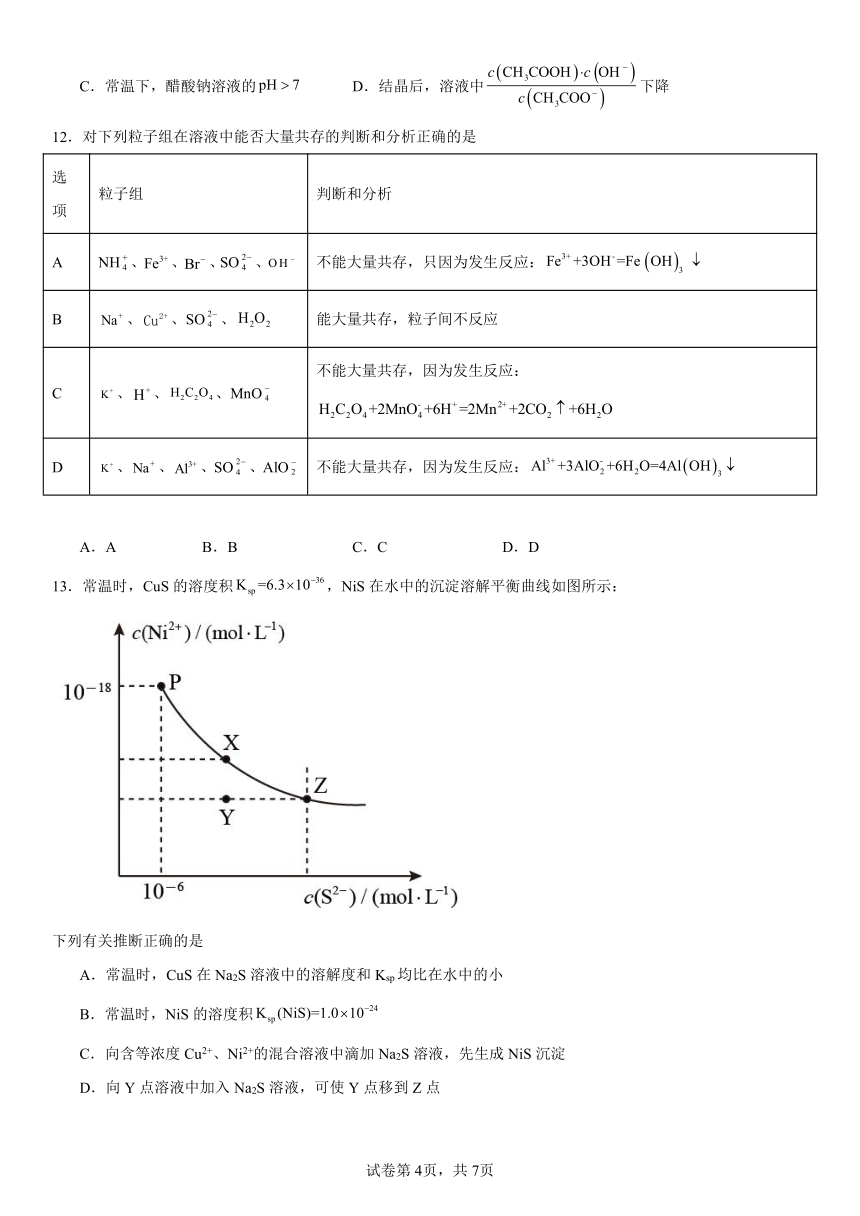
13.常温时,CuS的溶度积,NiS在水中的沉淀溶解平衡曲线如图所示:
下列有关推断正确的是
A.常温时,CuS在Na2S溶液中的溶解度和Ksp均比在水中的小
B.常温时,NiS的溶度积
C.向含等浓度Cu2+、Ni2+的混合溶液中滴加Na2S溶液,先生成NiS沉淀
D.向Y点溶液中加入Na2S溶液,可使Y点移到Z点
二、填空题
14.稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸(C11H23COOH)熔点为44℃;月桂酸和C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8,Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7g·L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于 mol·L-1(保留两位有效数字)。
15.T℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2C2O4、HC2O、C2O的物质的量分数(δ)与pH的关系如图所示:
回答下列问题:
(1)写出H2C2O4的电离方程式及电离平衡常数表达式
(2)根据A点,得Ka1=10-1.2,根据B点,得Ka2= 。
(3)在pH=2.7的溶液中,= 。
(4)0.1 mol·L-1的NaHC2O4溶液呈 性,其离子浓度从大到小的顺序为 。
16.小组同学对比和的性质,进行了如下实验。
(1)向相同体积、相同浓度的和溶液中分别滴加的盐酸,溶液pH变化如下。
①图 (填“甲”或“乙”)是的滴定曲线。
②A′-B′发生反应的离子方程式为 。
③下列说法正确的是 (填序号)。
a.和溶液中所含微粒种类相同
b.A、B、C均满足:
c.水的电离程度:
(2)向1mol的和溶液中分别滴加少量溶液,均产生白色沉淀,后者有气体产生。
资料:
i.1mol的溶液中,,
ii.25℃时,,
①补全与反应的离子方程式: 。
②通过计算说明与反应产生的沉淀为而不是 。
17.请回答下列问题:
Ⅰ.已知水的电离平衡曲线如图示,试回答下列问题:
(1)在100℃时,Kw表达式为 ,在此温度下,Kw为 。
(2)在室温下,将pH=12的Ba(OH)2溶液与pH=2的稀盐酸混合,欲使混合溶液pH=3,忽略两溶液混合时的体积变化,则Ba(OH)2与盐酸的体积比为 。
(3)室温时将pH为4的硫酸溶液稀释10000倍,稀释后溶液中,c(SO)和c(H+)之比约为 。
Ⅱ.今有①CH3COOH②HCl③H2SO4三种溶液,根据要求回答下列问题:
(4)写出①的电离方程式 。
(5)当它们pH相同时,其物质的量浓度由大到小的顺序为 (填序号)。
(6)当它们的物质的量浓度相同时,其溶液中水电离出的c(OH-)由大到小的顺序为 (填序号)。
(7)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为 (填序号)。
18.(1)25℃时,浓度为0.1 mol L-1的6种溶液①HCl ②CH3COOH ③Ba(OH)2④Na2CO3⑤KCl ⑥NH4Cl溶液pH由小到大的顺序为 (填写编号)。
(2)已知25℃时,CH3COOH电离常数Ka=1.7×10-5mol/L,则:
①该温度下CH3COONa的水解平衡常数Kh= mol L-1(保留到小数点后一位);
②将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3 H2O的电离常数Ka= ,混合后溶液中离子的浓度由大到小的顺序为 。
(3)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中
c(CH3COO-)+c(CH3COOH)= ;m与n的大小关系是m n(填“>”“=”或“<”)。
19.硫及其化合物在工业上有着广泛的应用。完成下列填空:
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下: Mn2++ S2O82﹣+ H2O→ MnO4﹣+ SO42﹣+ H+。配平该反应方程式,氧化产物是
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在 (填:“阳极”或“阴极”)反应生成S2O82﹣,另一极生成氢气,生成0.1mol的S2O82﹣同时可收集到 g氢气
(4)已知硫酸的第二级电离并不完全:HSO4﹣H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是 ,第4位的离子是 。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中 (填:“增大”、“减小”或“不变”)
(5)已知:HSO3﹣ H++SO32﹣K=1.02×10﹣7,NH4++H2O NH3 H2O+H+ K=5.65×10﹣10。往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是 (选填编号)
a.HSO3﹣+Ba2++OH﹣=BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣=2BaSO3↓+2H2O+NH3 H2O
c.NH4++HSO3﹣+Ba2++2OH﹣=BaSO3↓+H2O+NH3 H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣=3BaSO3↓+4H2O+2NH3 H2O+SO32﹣
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.PCl3与Cl2反应生成PCl5是可逆反应,即使Cl2足量,lmolPCl3也不可能完全转变为lmolPCl5,则增加的P-Cl键应小于2NA个,故A错误;
B.Cl2通入足量水中和水反应是可逆反应,反应后的容液中有含氯的微粒为Cl2、HClO、Cl-、ClO-四种微粒,则溶液中HClO、Cl-、ClO-三种微粒数目之和小于2NA,故B错误;
C.生成的气体应为SO2和H2的混合气体,其物质的量为0.1mol,无论生成的0.1mol气体是SO2还是H2还是它们的混合气体,根据硫元素和氢元素的化合价变化情况,转移的电子数都是0.2NA,故C正确;
D. Na2S的溶液中阴离子除了S2-外,还有水解生成的HS-和OH-,故阴离子总数大于0.l NA,故D错误;
本题答案C。
2.A
【详解】A.弱酸的电离平衡常数越大,其酸性越强,则酸性:HF>HClO>,根据‘越弱越水解’原理,弱酸的酸性越弱,其强碱弱酸盐的水解程度越大,则等物质的量浓度的三种溶液的pH大小关系:,A正确;
B.是二元弱酸,分两步电离,以第一电离为主,电离方程式为,B错误;
C.通过电离平衡常数Ka可知酸性:H2CO3>HClO>,则向NaClO溶液中通入少量CO2反应不能生成,离子方程式为ClO-+CO2+H2O=HClO+,C错误;
D.等浓度的NaF和混合溶液中c(Na+)最大,NaF的水解平衡常数为,的电离平衡常数,则电离出的c()大于c(F-),水解反应是微弱的,则存在,D错误;
故选:A。
3.C
【详解】A.等质量的石墨与金刚石中C-C键的数目之比为2:1.5=4:3,故A错误;
B.标况下二氧化氮不是气体,不能使用气体摩尔体积计算物质的量,故B错误;
C.1LpH=9的CH3COONa溶液中,发生电离的水分子数为mol/L×1L×NAmol-1=1×10-5NA,故C正确;
D.标准状况下1.12LCO物质的量,所含质子总数为:0.05mol×14×NAmol-1=0.7NA,故D错误;
故选:C。
4.D
【详解】A.在(NH4)2C2O4溶液中,水解使溶液呈酸性,其水解常数Kh= =5.6×10-10, 水解使溶液呈碱性,其水解常数 Kh==1.9×10-10,5.6×10-10>1.9×10-10,所以 的水解程度大于的水解程度,所以溶液呈酸性,故A正确;
B.在(NH4)2C2O4溶液中存在电荷守恒:c()+c(H+)= c()+c(OH-)+2 c(),故B正确;
C.稀释(NH4)2C2O4溶液,溶液的酸性减弱,c(H+)减小,则溶液中c(OH-)增大。, c(OH-)增大,则减小,故C正确;
D.由A分析可知,的水解平衡常数为1.9×10-10,数量级为10-10,故D错误;
故选D。
5.D
【分析】由题给流程可知,海水经蒸发得到粗盐和母液,向母液中加入碱溶液使溶液中的镁离子转化为氢氧化镁沉淀,过滤得到氢氧化镁;向氢氧化镁中加入盐酸反应、蒸发、过滤得到六水氯化镁,六水氯化镁在氯化氢气氛中加热脱水得到氯化镁,电解熔融的氯化镁在阴极得到金属镁。
【详解】A.由分析可知,设计步骤①、②、③的目的是富集氯化镁,将母液中低浓度的镁离子转化为氯化镁固体,故A正确;
B.氯化镁是强酸弱碱盐,在溶液中易发生水解,为防止氯化镁水解,六水氯化镁应在氯化氢气氛中加热脱水得到氯化镁,故B正确;
C.由分析可知,步骤④为电解熔融的氯化镁在阴极得到金属镁,故C正确;
D.镁在加热条件下能与氮气反应生成氮化镁,所以电解得到的炽热镁粉不能在氮气中冷却,故D错误;
故选D。
6.D
【详解】A.氢离子浓度越大pH值就越小,溶液酸性越强,故A错误;
B.25℃,pH=3的盐酸中氢离子浓度为,稀释到原来体积的10倍,氢离子浓度为,所得溶液pH=4,故B错误;
C.硫酸溶液中氢离子浓度为,与等体积水混合后,氢离子浓度为,溶液pH<1,故C错误;
D.25℃,pH=3的醋酸浓度大于与pH=11的氢氧化钡溶液中氢氧根离子浓度,混合溶液中醋酸电离程度大于醋酸根水解程度,溶于呈酸性,pH<7,故D正确;
故答案选D。
7.A
【详解】A.在常温下,b点pH=4.76时,lg=0,此时c(CH3COOH)=c(CH3COO-),醋酸的电离平衡常数Ka==c(H+)=10-4.76,故A正确;
B.醋酸是弱酸,当消耗NaOH溶液20.00mL时,恰好完全反应生成CH3COONa,此时溶液因CH3COO-的水解呈碱性,即溶液的pH>7,故B错误;
C.a点为CH3COOH溶液,抑制水的电离,水的电离最小,b点为CH3COOH和CH3COONa的混合溶液,且CH3COOH的电离大于CH3COO-的水解程度,水的电离受抑制,而c点为CH3COONa溶液,CH3COO-的水解促进水的电离,水的电离最大,即溶液中水的电离程度大小:a<b<c,故C错误;
D.c点为CH3COONa溶液,溶液中存在的电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),且此时溶液呈碱性,即c(H+)<c(OH-),且CH3COO-部分水解,则溶液中各离子浓度的大小关系是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D错误;
故选:A。
8.B
【详解】A.因A、B酸的强弱不同,对一元强酸来说c(酸)=c(H+),对于一元弱酸,c(酸)>c(H+),则A、B两种酸溶液的物质的量浓度不一定相等,故A错误;
B.由图可知,若a=5,A完全电离,则A是强酸,B的pH变化小,则B为弱酸,故B正确;
C.由图即可得到:当稀释后,A酸的pH明显大于B,则稀释后B的酸性强,故C错误;
D.若A、B都是弱酸,加水稀释促进弱酸的电离,溶液中2故选B。
9.B
【详解】A.漂白粉处理自来水是利用其强氧化性,明矾净水是利用其溶于水形成的胶体吸收自来水中的颗粒物,故A错误;
B.催化转换技术是将有害气体转化为无害气体的尾气处理技术,其中催化剂可以提高反应速率,但是不能使平衡移动,提高转化率,故B正确;
C.草木灰的主要成分为碳酸钾与混合使用发生双水解而降低肥效,故C错误;
D.纯碱加热后其水解程度增大,溶液中氢氧根离子浓度增大,故D错误;
故选B。
10.B
【详解】A.通入少量,,中碳酸根离子会发生水解:, ,相当,故反应后为氨水和碳酸铵的混合溶液,氢氧根浓度变化不大,,则,可知:,故A正确;
B.由电荷守恒: ①;
物料守恒: ②;
①-②得:③
在溶液中:的水解常数 Kh()=;
的水解常数,由于铵根离子水解程度大于碳酸氢根离子水解程度,故溶液呈碱性,结合①式可知:,故B错误;
C.由题意:电离出和,亚铁离子结合生成,并且结合生成二氧化碳和水,反应离子方程式为:,故C正确;
D.生成沉淀后的上层清液为碳酸亚铁的饱和溶液,溶液中,故D正确;
故选:B。
11.D
【详解】A.醋酸钠在水溶液中完全电离,产生醋酸根离子和钠离子,属于强电解质,A正确;
B.醋酸钠溶液中醋酸根离子会发生水解从而消耗少量的醋酸根离子,因此钠离子浓度大于醋酸根离子,B正确;
C.醋酸根离子水解生成醋酸和氢氧根离子,因此常温下,醋酸钠溶液的pH>7,C正确;
D.=,在温度不变的情况下,水的离子积常数KW和醋酸的电离常数K都不变,则不变,D错误;
故答案选D。
12.D
【详解】A.与也不能大量共存,故A错误;
B.能催化的分解,所以不能大量共存,故B错误;
C.离子方程式中氧原子反应前后不守恒,故C错误;
D.与发生双水解而不能大量共存,故D正确;
故选D。
13.B
【详解】A.Ksp是沉淀溶解平衡常数,只与温度有关,常温时,CuS在Na2S溶液中的Ksp和在水中的相同,由于同离子效应,CuS在Na2S溶液中的溶解度小于在水中的,A错误;
B.常温时,取图中P点对应离子浓度计算,NiS的溶度积,B正确;
C.根据B项计算和题给数据可知,CuS的溶度积小于NiS的溶度积,则向含等浓度Cu2+、Ni2+的混合溶液中滴加Na2S溶液,溶度积小的先沉淀,即先生成CuS沉淀,C错误;
D.向Y点溶液中加入Na2S溶液,溶液中S2-浓度增大,NiS在水中的沉淀溶解平衡朝产生沉淀方向移动,即Ni2+的物质的量浓度下降,而Y点与Z点的Ni2+的物质的量浓度相等,故不可能使Y点移到Z点,D错误;
故选B。
14.4.010-4
【分析】由流程可知,该类矿(含铁、铝等元素)加入酸化MgSO4溶液浸取,得到浸取液中含有、、、、、等离子,经氧化调pH使、形成沉淀,经过滤除去,滤液1中含有、、等离子,加入月桂酸钠,使形成沉淀,滤液2主要含有MgSO4溶液,可循环利用,滤饼加盐酸,经加热搅拌溶解后,再冷却结晶,析出月桂酸,再固液分离得到RECl3溶液。
【详解】滤液2中Mg2+浓度为2.7g·L-1,即0.1125mol/L,根据Ksp[(C11H23COO)2Mg]=1.8×10-8=c(Mg2+)×c2(C11H23COO-),若要加入月桂酸钠后只生成C11H23COO)3RE,而不产生(C11H23COO)2Mg,则c(C11H23COO-)<=410-4mol·L-1。
15. ①H2C2O4 H++HC2O,Ka1=;②HC2O H++C2O,Ka2= 10-4.2 1000 酸 c(Na+)>c(HC2O)>c(H+)>c(C2O)>c(OH-)
【详解】(1)H2C2O4是二元弱酸,分两步电离,电离方程式及电离平衡常数表达式为①H2C2O4 H++HC2O,Ka1=;②HC2O H++C2O,Ka2=;
(2)根据A点,c(H2C2O4)=c(HC2O),得Ka1=c(H+)=10-1.2,根据B点,c(HC2O)=c(C2O),得Ka2=c(H+)=10-4.2,
(3) ==1 000;
(4)HC2O+H2O H2C2O4+OH-,Kh===10-(14-1.2)Ka2,所以HC2O的电离大于其水解,则NaHC2O4溶液呈酸性,其离子浓度从大到小的顺序为:c(Na+)>c(HC2O)>c(H+)>c(C2O)>c(OH-)。
16.(1) 乙 H++= ac
(2) 2+Fe2+=FeCO3↓+CO2↑+H2O 1mol L 1 NaHCO3溶液中:生成FeCO3沉淀所需c1(Fe2+)===3.210-9mol L 1;生成Fe(OH)2沉淀所需c2(Fe2+)===1.2510-5mol L 1;c1(Fe2+)c2(Fe2+)。
【详解】(1)①H2CO3的电离平衡常数Ka1>Ka2,故相同浓度的Na2CO3和NaHCO3溶液,前者的pH更高,即图乙是Na2CO3的滴定曲线;
②HCl和Na2CO3的反应分为两步:HCl+Na2CO3=NaCl+NaHCO3,NaHCO3+HCl=NaCl+CO2↑+H2O,则A′-B′发生反应的离子方程式为H++=;
③a.Na2CO3和NaHCO3溶液中所含微粒均有Na+、H+、、、OH-、H2CO3和H2O,a正确;
b.图甲是NaHCO3的滴定曲线,B点表示NaHCO3和HCl恰好完全反应,此时溶液中已不含、、H2CO3,则仅A点满足c(Na+)+c(H+)=2c()+c()+c(OH-),b错误;
c.图甲中,A点的溶质是NaHCO3,的水解能促进水的电离;B点溶质是NaCl,对水的电离无影响;C点的溶质是NaCl和HCl,H+能抑制水的电离;故水的电离程度:A>B>C,c正确;
故选ac。
(2)①向NaHCO3溶液中滴加少量FeCl2溶液,产生白色FeCO3沉淀,还生成气体,该气体为CO2,该反应的离子方程式为2+Fe2+=FeCO3↓+CO2↑+H2O;
②1mol L 1 NaHCO3溶液中:生成FeCO3沉淀所需c1(Fe2+)===3.210-9mol L 1;生成Fe(OH)2沉淀所需c2(Fe2+)===1.2510-5mol L 1;c1(Fe2+)c2(Fe2+),故NaHCO3与FeCl2反应产生的沉淀为FeCO3而不是Fe(OH)2。
17.(1) Kw=c(H+) c(OH-) 1×10-12
(2)9:11
(3)1:20
(4)CH3COOHCH3COO-+H+
(5)①>②>③
(6)①>②>③
(7)①<②=③
【分析】(1)
根据水的离子积的定义可知,在100℃时,Kw表达式为Kw=c(H+) c(OH-),由图中数据可知,在此温度下,Kw=c(H+) c(OH-)=10-6×10-6=1×10-12,故答案为:Kw=c(H+) c(OH-);1×10-12;
(2)
在室温下,将pH=12的Ba(OH)2溶液与pH=2的稀盐酸混合,欲使混合溶液pH=3,忽略两溶液混合时的体积变化,设Ba(OH)2溶液与稀盐酸的体积分别为V1,V2,则有:,解得:V1:V2=9:11,Ba(OH)2与盐酸的体积比9:11,故答案为:9:11;
(3)
室温时将pH为4的硫酸溶液中c()=5×10-5mol/L,c(H+)=10-4mol/L,稀释10000倍后,c()=5×10-9mol/L,而H+无限稀释时溶液pH值接近7,故c(H+)=10-7mol/L,故稀释后溶液中,c(SO)和c(H+)之比约为5×10-9mol/L:10-7mol/L=1:20,故答案为:1:20;
(4)
由于CH3COOH是一元弱酸,故 CH3COOH的电离是一个可逆过程,故其电离方程式为:CH3COOHCH3COO-+H+,故答案为:CH3COOHCH3COO-+H+;
(5)
由于①CH3COOH是一元弱酸,②HCl是一元强酸,③H2SO4是二元强酸,故当它们pH相同时,其物质的量浓度由大到小的顺序为①>②>③,故答案为:①>②>③;
(6)
由于①CH3COOH是一元弱酸,②HCl是一元强酸,③H2SO4是二元强酸,当它们的物质的量浓度相同时,溶液中的c(H+)是①<②<③,而溶液中c(H+)c(OH-)的乘积是一个常数,其溶液中水电离出的c(OH-)由大到小的顺序为①>②>③,故答案为:①>②>③;
(7)
由于①CH3COOH是一元弱酸,②HCl是一元强酸,③H2SO4是二元强酸,CH3COOHCH3COO-+H+随着反应的进行平衡正向移动,故三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为①<②=③,故答案为:①<②=③。
18. ①②⑥⑤④③ 5.9×10-10 1.7×10-5mol/L 0.5mmol/L >
【详解】(1)盐酸和醋酸为酸,氢氧化钡为碱,碳酸钠、氯化钾和氯化铵为盐,碳酸钠为强碱弱酸盐,其溶液呈碱性,氯化钾为强酸强碱盐,为中性,氯化铵为强酸弱碱盐,其溶液为酸性,相同浓度的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,所以pH盐酸小于醋酸,则这几种溶液的pH由小到大的顺序是①②⑥⑤④③;
(2) CH3COONa的水解平衡常数=Kw/Ka=10-14/1.7×10-5=5.9×10-10;②25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相等,则醋酸和一水合氨电离程度相等,其电离平衡常数相等,即NH3 H2O的电离常数Ka=1.7×10-5mol/L,此时溶液显中性c(H+)=c(OH-),同时存在电荷守恒式 ,则c(NH4+)=c(CH3COO-)>c(H+)=c(OH-);
(3) 醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,所以m>n,二者混合时溶液体积增大一倍,溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=0.5mmol/L。
19. S+O2SO2 2 5 8 2 10 16 MnO4﹣ 阳极 0.2 HSO4﹣ SO42﹣ 减小 cd
【详解】(1)以硫磺为原料生产硫酸的过程为硫燃烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫和水反应生成硫酸,第一步反应的化学方程式为:S+O2SO2 ;
(2)反应中锰元素化合价+2价变化为+7价,电子转移5e-,S2O82-中硫元素化合价+7价变化为SO42-中硫元素化合价+6价,电子转移2e-,电子转移总数为10e-,Mn2+前系数,2,S2O82-前系数为5,结合原子守恒、电荷守恒配平书写离子方程式为:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+,反应中锰元素化合价+2价变化为+7价,做还原剂被氧化,生成氧化产物为MnO4-;
(3)用电解硫酸氢钾的方法制取过硫酸钾:阴离子在阳极失电子发生氧化反应,元素化合价分析可知硫元素化合价+6价变化为+7价,化合价升高失电子发生氧化反应生成S2O82-,HSO4-在阳极反应生成S2O82-,电极反应为:2HSO4--2e-═S2O82-+2H+,另一极生成氢气,电极反应为2H++2e-=H2↑,阳极电子守恒计算,生成0.1mol的S2O82-同时,电子转移0.2mol,S2O82-~H2↑~2e-,可收集到氢气物质的量0.1mol,质量=0.1mol×2g/mol=0.2g;
(4)已知硫酸的第二级电离并不完全,在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4-电离,溶液显酸性,则溶液中离子浓度大小为c(K+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-),则该溶液中离子浓度由大到小排列第2位的离子是HSO4-,第4位的离子是SO42-。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中c(HSO4-)、c(K+)浓度增大,但对于电离平衡,HSO4- H++SO42-,硫酸氢根离子只电离不水解,氢离子浓度增大平衡逆向进行,电离程度减小,c(HSO4-)增大的多,比值减小;
(5)已知:HSO3- H++SO32- K=1.02×10-7,NH4++H2O NH3 H2O+H+ K=5.65×10-10,亚硫酸氢根离子电离程度大于NH4+的水解程度,所以亚硫酸氢铵溶液中滴入氢氧化钡溶液,氢氧根离子先和亚硫酸氢根离子反应,后与铵根离子结合生成一水合氨,反应中氢氧化钡量不同产物不同,不足量的氢氧化钡反应时需要满足化学式的组成比,
a.从选项中的离子方程式分析,HSO3-+Ba2++OH-→BaSO3↓+H2O是氢氧化钡不足量时的反应,只和亚硫酸氢根离子反应,则氢氧化钡电离出的钡离子和氢氧根离子全部反应,需要符合化学式的组成比,正确的应为2HSO3-+Ba2++2OH-→BaSO3↓+2H2O+SO32-,故a错误;
b.选项中离子方程式分析,NH4++2HSO3-+2Ba2++3OH-→2BaSO3↓+2H2O+NH3 H2O,电离出2molBa2+,电离出的氢氧根离子为4mol,其中2molOH-和2mol亚硫酸氢根离子反应,2molOH-和2molNH4+离子反应,正确的反应离子方程式为:NH4++HSO3-+Ba2++2OH-→BaSO3↓+H2O+NH3 H2O,故B错误;
c.依据b分析可知,选项中离子方程式为氢氧化钡和亚硫酸氢铵1:1反应的离子方程式,NH4++HSO3-+Ba2++2OH-→BaSO3↓+H2O+NH3 H2O,故c正确;
d.2NH4++4HSO3-+3Ba2++6OH-→3BaSO3↓+4H2O+2NH3 H2O+SO32-,分析离子方程式,反应是4molNH4HSO3和3molBa(OH)2的反应,6molOH-离子先和4molHSO3-反应,剩余 2molOH-离子再和2molNH4+离子反应,剩余2molNH4+离子生成亚硫酸铵,反应的离子方程式正确,故d正确,
所以选cd。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.NA为阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中lmolPCl3与足量Cl2反应生成PCl5,增加2NA个P-Cl键
B.将l mol Cl2通入足量水中,所得溶液中HClO、Cl-、ClO-三种微粒数目之和为2NA
C.足量锌粉与浓硫酸反应生成2.24L气体(标况下),转移电子数为0.2NA
D.含7.8 g Na2S的溶液中阴离子总数等于0.l NA
2.25℃时部分电解质的电离平衡常数数据如下。
HF HClO
下列说法正确的是
A.等物质的量浓度的三种溶液的pH大小关系:
B.的电离方程式为
C.向NaClO溶液中通入适量,漂白性增强的原因是
D.等浓度的NaF和混合溶液中存在
3.设为阿伏加德罗常数的值.下列说法正确的是
A.等质量的石墨与金刚石中键的数目之比为1∶1
B.标准状况下,2.24L中含有的氧原子的数目为0.2
C.常温下,1L的溶液中,发生电离的水分子数为
D.标准状况下1.12LCO中所含质子总数为1.4
4.草酸铵用于制安全炸药和供分析试剂等用,已知数据如表:
弱电解质 草酸(H2C2O4)
电离常数(25℃) K1=5.4×10-2,K2=5.4×10-5 K=1.8×10-5
关于常温下0.40mol·L-1的(NH4)2C2O4溶液,下列说法错误的是
A.由表中数据可判断该溶液呈酸性
B.
C.稀释溶液,减小
D.的水解平衡常数是Kh,Kh的数量级为10-5
5.用海水制盐工业中的母液来生产金属镁的一种工艺流程如下
下列说法错误的是
A.设计步骤①、②、③的主要目的是富集MgCl2
B.脱水时在HCl气氛中进行可防止MgCl2发生水解
C.步骤④电解熔融MgCl2时,阴极有金属Mg析出
D.电解得到的炽热镁粉可在氮气中冷却
6.溶液的酸碱性对人类生产、生活有十分重要的影响,酸碱性的变化规律是化学研究的重要组成部分。下列酸碱性及其变化的说法正确的是
A.氢离子浓度很小的溶液一定显酸性
B.25℃,pH=3的盐酸体积稀释到原来的10倍,所得溶液pH>4
C.硫酸溶液与等体积水混合后,所得溶液pH=1
D.25℃,pH=3的醋酸与pH=11的氢氧化钡溶液等体积混合后pH<7
7.常温下,向20.00mL0.1000mol·L-1的CH3COOH溶液中滴加0.1000mol·L-1的NaOH溶液,溶液中,lg随pH的变化关系如图所示(取lg5=0.7)。下列说法正确的是
A.常温下,CH3COOH的电离常数为10-4.76
B.当溶液的pH=7时,消耗NaOH溶液20.00mL
C.溶液中水的电离程度大小:a>b>c
D.c点溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
8.pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示。下列说法正确的是
A.A、B两酸溶液的物质的量浓度一定相等 B.a=5时,A是强酸,B是弱酸
C.稀释后,A酸溶液的酸性比B酸溶液强 D.若A、B都是弱酸,则a=5
9.化学与生产、生活密切相关,下列说法正确的是
A.漂白粉和明矾都常用于自来水的处理,二者的作用原理相同
B.采用催化转换技术不能提高汽车尾气中有害气体的平衡转化率
C.草木灰与混合施用可更好地为植物提供N、P、K三种元素
D.纯碱溶液加热后去污能力更强,是因为加热增大了纯碱的溶解度
10.常温下,将溶液与溶液混合,可制得,混合过程中有气体产生。已知:;;;下列说法不正确的是
A.向的氨水中通入少量,反应后溶液中存在:
B.溶液中:
C.生成的离子方程式为:
D.生成沉淀后的上层清液中:
11.2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是
A.醋酸钠是强电解质 B.醋酸钠溶液中
C.常温下,醋酸钠溶液的 D.结晶后,溶液中下降
12.对下列粒子组在溶液中能否大量共存的判断和分析正确的是
选项 粒子组 判断和分析
A NH、、、SO、 不能大量共存,只因为发生反应:
B 、、SO、 能大量共存,粒子间不反应
C 、、、MnO 不能大量共存,因为发生反应:
D 、、、SO、AlO 不能大量共存,因为发生反应:
A.A B.B C.C D.D
13.常温时,CuS的溶度积,NiS在水中的沉淀溶解平衡曲线如图所示:
下列有关推断正确的是
A.常温时,CuS在Na2S溶液中的溶解度和Ksp均比在水中的小
B.常温时,NiS的溶度积
C.向含等浓度Cu2+、Ni2+的混合溶液中滴加Na2S溶液,先生成NiS沉淀
D.向Y点溶液中加入Na2S溶液,可使Y点移到Z点
二、填空题
14.稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸(C11H23COOH)熔点为44℃;月桂酸和C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8,Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7g·L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于 mol·L-1(保留两位有效数字)。
15.T℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2C2O4、HC2O、C2O的物质的量分数(δ)与pH的关系如图所示:
回答下列问题:
(1)写出H2C2O4的电离方程式及电离平衡常数表达式
(2)根据A点,得Ka1=10-1.2,根据B点,得Ka2= 。
(3)在pH=2.7的溶液中,= 。
(4)0.1 mol·L-1的NaHC2O4溶液呈 性,其离子浓度从大到小的顺序为 。
16.小组同学对比和的性质,进行了如下实验。
(1)向相同体积、相同浓度的和溶液中分别滴加的盐酸,溶液pH变化如下。
①图 (填“甲”或“乙”)是的滴定曲线。
②A′-B′发生反应的离子方程式为 。
③下列说法正确的是 (填序号)。
a.和溶液中所含微粒种类相同
b.A、B、C均满足:
c.水的电离程度:
(2)向1mol的和溶液中分别滴加少量溶液,均产生白色沉淀,后者有气体产生。
资料:
i.1mol的溶液中,,
ii.25℃时,,
①补全与反应的离子方程式: 。
②通过计算说明与反应产生的沉淀为而不是 。
17.请回答下列问题:
Ⅰ.已知水的电离平衡曲线如图示,试回答下列问题:
(1)在100℃时,Kw表达式为 ,在此温度下,Kw为 。
(2)在室温下,将pH=12的Ba(OH)2溶液与pH=2的稀盐酸混合,欲使混合溶液pH=3,忽略两溶液混合时的体积变化,则Ba(OH)2与盐酸的体积比为 。
(3)室温时将pH为4的硫酸溶液稀释10000倍,稀释后溶液中,c(SO)和c(H+)之比约为 。
Ⅱ.今有①CH3COOH②HCl③H2SO4三种溶液,根据要求回答下列问题:
(4)写出①的电离方程式 。
(5)当它们pH相同时,其物质的量浓度由大到小的顺序为 (填序号)。
(6)当它们的物质的量浓度相同时,其溶液中水电离出的c(OH-)由大到小的顺序为 (填序号)。
(7)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为 (填序号)。
18.(1)25℃时,浓度为0.1 mol L-1的6种溶液①HCl ②CH3COOH ③Ba(OH)2④Na2CO3⑤KCl ⑥NH4Cl溶液pH由小到大的顺序为 (填写编号)。
(2)已知25℃时,CH3COOH电离常数Ka=1.7×10-5mol/L,则:
①该温度下CH3COONa的水解平衡常数Kh= mol L-1(保留到小数点后一位);
②将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3 H2O的电离常数Ka= ,混合后溶液中离子的浓度由大到小的顺序为 。
(3)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中
c(CH3COO-)+c(CH3COOH)= ;m与n的大小关系是m n(填“>”“=”或“<”)。
19.硫及其化合物在工业上有着广泛的应用。完成下列填空:
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下: Mn2++ S2O82﹣+ H2O→ MnO4﹣+ SO42﹣+ H+。配平该反应方程式,氧化产物是
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在 (填:“阳极”或“阴极”)反应生成S2O82﹣,另一极生成氢气,生成0.1mol的S2O82﹣同时可收集到 g氢气
(4)已知硫酸的第二级电离并不完全:HSO4﹣H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是 ,第4位的离子是 。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中 (填:“增大”、“减小”或“不变”)
(5)已知:HSO3﹣ H++SO32﹣K=1.02×10﹣7,NH4++H2O NH3 H2O+H+ K=5.65×10﹣10。往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是 (选填编号)
a.HSO3﹣+Ba2++OH﹣=BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣=2BaSO3↓+2H2O+NH3 H2O
c.NH4++HSO3﹣+Ba2++2OH﹣=BaSO3↓+H2O+NH3 H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣=3BaSO3↓+4H2O+2NH3 H2O+SO32﹣
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.PCl3与Cl2反应生成PCl5是可逆反应,即使Cl2足量,lmolPCl3也不可能完全转变为lmolPCl5,则增加的P-Cl键应小于2NA个,故A错误;
B.Cl2通入足量水中和水反应是可逆反应,反应后的容液中有含氯的微粒为Cl2、HClO、Cl-、ClO-四种微粒,则溶液中HClO、Cl-、ClO-三种微粒数目之和小于2NA,故B错误;
C.生成的气体应为SO2和H2的混合气体,其物质的量为0.1mol,无论生成的0.1mol气体是SO2还是H2还是它们的混合气体,根据硫元素和氢元素的化合价变化情况,转移的电子数都是0.2NA,故C正确;
D. Na2S的溶液中阴离子除了S2-外,还有水解生成的HS-和OH-,故阴离子总数大于0.l NA,故D错误;
本题答案C。
2.A
【详解】A.弱酸的电离平衡常数越大,其酸性越强,则酸性:HF>HClO>,根据‘越弱越水解’原理,弱酸的酸性越弱,其强碱弱酸盐的水解程度越大,则等物质的量浓度的三种溶液的pH大小关系:,A正确;
B.是二元弱酸,分两步电离,以第一电离为主,电离方程式为,B错误;
C.通过电离平衡常数Ka可知酸性:H2CO3>HClO>,则向NaClO溶液中通入少量CO2反应不能生成,离子方程式为ClO-+CO2+H2O=HClO+,C错误;
D.等浓度的NaF和混合溶液中c(Na+)最大,NaF的水解平衡常数为,的电离平衡常数,则电离出的c()大于c(F-),水解反应是微弱的,则存在,D错误;
故选:A。
3.C
【详解】A.等质量的石墨与金刚石中C-C键的数目之比为2:1.5=4:3,故A错误;
B.标况下二氧化氮不是气体,不能使用气体摩尔体积计算物质的量,故B错误;
C.1LpH=9的CH3COONa溶液中,发生电离的水分子数为mol/L×1L×NAmol-1=1×10-5NA,故C正确;
D.标准状况下1.12LCO物质的量,所含质子总数为:0.05mol×14×NAmol-1=0.7NA,故D错误;
故选:C。
4.D
【详解】A.在(NH4)2C2O4溶液中,水解使溶液呈酸性,其水解常数Kh= =5.6×10-10, 水解使溶液呈碱性,其水解常数 Kh==1.9×10-10,5.6×10-10>1.9×10-10,所以 的水解程度大于的水解程度,所以溶液呈酸性,故A正确;
B.在(NH4)2C2O4溶液中存在电荷守恒:c()+c(H+)= c()+c(OH-)+2 c(),故B正确;
C.稀释(NH4)2C2O4溶液,溶液的酸性减弱,c(H+)减小,则溶液中c(OH-)增大。, c(OH-)增大,则减小,故C正确;
D.由A分析可知,的水解平衡常数为1.9×10-10,数量级为10-10,故D错误;
故选D。
5.D
【分析】由题给流程可知,海水经蒸发得到粗盐和母液,向母液中加入碱溶液使溶液中的镁离子转化为氢氧化镁沉淀,过滤得到氢氧化镁;向氢氧化镁中加入盐酸反应、蒸发、过滤得到六水氯化镁,六水氯化镁在氯化氢气氛中加热脱水得到氯化镁,电解熔融的氯化镁在阴极得到金属镁。
【详解】A.由分析可知,设计步骤①、②、③的目的是富集氯化镁,将母液中低浓度的镁离子转化为氯化镁固体,故A正确;
B.氯化镁是强酸弱碱盐,在溶液中易发生水解,为防止氯化镁水解,六水氯化镁应在氯化氢气氛中加热脱水得到氯化镁,故B正确;
C.由分析可知,步骤④为电解熔融的氯化镁在阴极得到金属镁,故C正确;
D.镁在加热条件下能与氮气反应生成氮化镁,所以电解得到的炽热镁粉不能在氮气中冷却,故D错误;
故选D。
6.D
【详解】A.氢离子浓度越大pH值就越小,溶液酸性越强,故A错误;
B.25℃,pH=3的盐酸中氢离子浓度为,稀释到原来体积的10倍,氢离子浓度为,所得溶液pH=4,故B错误;
C.硫酸溶液中氢离子浓度为,与等体积水混合后,氢离子浓度为,溶液pH<1,故C错误;
D.25℃,pH=3的醋酸浓度大于与pH=11的氢氧化钡溶液中氢氧根离子浓度,混合溶液中醋酸电离程度大于醋酸根水解程度,溶于呈酸性,pH<7,故D正确;
故答案选D。
7.A
【详解】A.在常温下,b点pH=4.76时,lg=0,此时c(CH3COOH)=c(CH3COO-),醋酸的电离平衡常数Ka==c(H+)=10-4.76,故A正确;
B.醋酸是弱酸,当消耗NaOH溶液20.00mL时,恰好完全反应生成CH3COONa,此时溶液因CH3COO-的水解呈碱性,即溶液的pH>7,故B错误;
C.a点为CH3COOH溶液,抑制水的电离,水的电离最小,b点为CH3COOH和CH3COONa的混合溶液,且CH3COOH的电离大于CH3COO-的水解程度,水的电离受抑制,而c点为CH3COONa溶液,CH3COO-的水解促进水的电离,水的电离最大,即溶液中水的电离程度大小:a<b<c,故C错误;
D.c点为CH3COONa溶液,溶液中存在的电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),且此时溶液呈碱性,即c(H+)<c(OH-),且CH3COO-部分水解,则溶液中各离子浓度的大小关系是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D错误;
故选:A。
8.B
【详解】A.因A、B酸的强弱不同,对一元强酸来说c(酸)=c(H+),对于一元弱酸,c(酸)>c(H+),则A、B两种酸溶液的物质的量浓度不一定相等,故A错误;
B.由图可知,若a=5,A完全电离,则A是强酸,B的pH变化小,则B为弱酸,故B正确;
C.由图即可得到:当稀释后,A酸的pH明显大于B,则稀释后B的酸性强,故C错误;
D.若A、B都是弱酸,加水稀释促进弱酸的电离,溶液中2
9.B
【详解】A.漂白粉处理自来水是利用其强氧化性,明矾净水是利用其溶于水形成的胶体吸收自来水中的颗粒物,故A错误;
B.催化转换技术是将有害气体转化为无害气体的尾气处理技术,其中催化剂可以提高反应速率,但是不能使平衡移动,提高转化率,故B正确;
C.草木灰的主要成分为碳酸钾与混合使用发生双水解而降低肥效,故C错误;
D.纯碱加热后其水解程度增大,溶液中氢氧根离子浓度增大,故D错误;
故选B。
10.B
【详解】A.通入少量,,中碳酸根离子会发生水解:, ,相当,故反应后为氨水和碳酸铵的混合溶液,氢氧根浓度变化不大,,则,可知:,故A正确;
B.由电荷守恒: ①;
物料守恒: ②;
①-②得:③
在溶液中:的水解常数 Kh()=;
的水解常数,由于铵根离子水解程度大于碳酸氢根离子水解程度,故溶液呈碱性,结合①式可知:,故B错误;
C.由题意:电离出和,亚铁离子结合生成,并且结合生成二氧化碳和水,反应离子方程式为:,故C正确;
D.生成沉淀后的上层清液为碳酸亚铁的饱和溶液,溶液中,故D正确;
故选:B。
11.D
【详解】A.醋酸钠在水溶液中完全电离,产生醋酸根离子和钠离子,属于强电解质,A正确;
B.醋酸钠溶液中醋酸根离子会发生水解从而消耗少量的醋酸根离子,因此钠离子浓度大于醋酸根离子,B正确;
C.醋酸根离子水解生成醋酸和氢氧根离子,因此常温下,醋酸钠溶液的pH>7,C正确;
D.=,在温度不变的情况下,水的离子积常数KW和醋酸的电离常数K都不变,则不变,D错误;
故答案选D。
12.D
【详解】A.与也不能大量共存,故A错误;
B.能催化的分解,所以不能大量共存,故B错误;
C.离子方程式中氧原子反应前后不守恒,故C错误;
D.与发生双水解而不能大量共存,故D正确;
故选D。
13.B
【详解】A.Ksp是沉淀溶解平衡常数,只与温度有关,常温时,CuS在Na2S溶液中的Ksp和在水中的相同,由于同离子效应,CuS在Na2S溶液中的溶解度小于在水中的,A错误;
B.常温时,取图中P点对应离子浓度计算,NiS的溶度积,B正确;
C.根据B项计算和题给数据可知,CuS的溶度积小于NiS的溶度积,则向含等浓度Cu2+、Ni2+的混合溶液中滴加Na2S溶液,溶度积小的先沉淀,即先生成CuS沉淀,C错误;
D.向Y点溶液中加入Na2S溶液,溶液中S2-浓度增大,NiS在水中的沉淀溶解平衡朝产生沉淀方向移动,即Ni2+的物质的量浓度下降,而Y点与Z点的Ni2+的物质的量浓度相等,故不可能使Y点移到Z点,D错误;
故选B。
14.4.010-4
【分析】由流程可知,该类矿(含铁、铝等元素)加入酸化MgSO4溶液浸取,得到浸取液中含有、、、、、等离子,经氧化调pH使、形成沉淀,经过滤除去,滤液1中含有、、等离子,加入月桂酸钠,使形成沉淀,滤液2主要含有MgSO4溶液,可循环利用,滤饼加盐酸,经加热搅拌溶解后,再冷却结晶,析出月桂酸,再固液分离得到RECl3溶液。
【详解】滤液2中Mg2+浓度为2.7g·L-1,即0.1125mol/L,根据Ksp[(C11H23COO)2Mg]=1.8×10-8=c(Mg2+)×c2(C11H23COO-),若要加入月桂酸钠后只生成C11H23COO)3RE,而不产生(C11H23COO)2Mg,则c(C11H23COO-)<=410-4mol·L-1。
15. ①H2C2O4 H++HC2O,Ka1=;②HC2O H++C2O,Ka2= 10-4.2 1000 酸 c(Na+)>c(HC2O)>c(H+)>c(C2O)>c(OH-)
【详解】(1)H2C2O4是二元弱酸,分两步电离,电离方程式及电离平衡常数表达式为①H2C2O4 H++HC2O,Ka1=;②HC2O H++C2O,Ka2=;
(2)根据A点,c(H2C2O4)=c(HC2O),得Ka1=c(H+)=10-1.2,根据B点,c(HC2O)=c(C2O),得Ka2=c(H+)=10-4.2,
(3) ==1 000;
(4)HC2O+H2O H2C2O4+OH-,Kh===10-(14-1.2)Ka2,所以HC2O的电离大于其水解,则NaHC2O4溶液呈酸性,其离子浓度从大到小的顺序为:c(Na+)>c(HC2O)>c(H+)>c(C2O)>c(OH-)。
16.(1) 乙 H++= ac
(2) 2+Fe2+=FeCO3↓+CO2↑+H2O 1mol L 1 NaHCO3溶液中:生成FeCO3沉淀所需c1(Fe2+)===3.210-9mol L 1;生成Fe(OH)2沉淀所需c2(Fe2+)===1.2510-5mol L 1;c1(Fe2+)c2(Fe2+)。
【详解】(1)①H2CO3的电离平衡常数Ka1>Ka2,故相同浓度的Na2CO3和NaHCO3溶液,前者的pH更高,即图乙是Na2CO3的滴定曲线;
②HCl和Na2CO3的反应分为两步:HCl+Na2CO3=NaCl+NaHCO3,NaHCO3+HCl=NaCl+CO2↑+H2O,则A′-B′发生反应的离子方程式为H++=;
③a.Na2CO3和NaHCO3溶液中所含微粒均有Na+、H+、、、OH-、H2CO3和H2O,a正确;
b.图甲是NaHCO3的滴定曲线,B点表示NaHCO3和HCl恰好完全反应,此时溶液中已不含、、H2CO3,则仅A点满足c(Na+)+c(H+)=2c()+c()+c(OH-),b错误;
c.图甲中,A点的溶质是NaHCO3,的水解能促进水的电离;B点溶质是NaCl,对水的电离无影响;C点的溶质是NaCl和HCl,H+能抑制水的电离;故水的电离程度:A>B>C,c正确;
故选ac。
(2)①向NaHCO3溶液中滴加少量FeCl2溶液,产生白色FeCO3沉淀,还生成气体,该气体为CO2,该反应的离子方程式为2+Fe2+=FeCO3↓+CO2↑+H2O;
②1mol L 1 NaHCO3溶液中:生成FeCO3沉淀所需c1(Fe2+)===3.210-9mol L 1;生成Fe(OH)2沉淀所需c2(Fe2+)===1.2510-5mol L 1;c1(Fe2+)c2(Fe2+),故NaHCO3与FeCl2反应产生的沉淀为FeCO3而不是Fe(OH)2。
17.(1) Kw=c(H+) c(OH-) 1×10-12
(2)9:11
(3)1:20
(4)CH3COOHCH3COO-+H+
(5)①>②>③
(6)①>②>③
(7)①<②=③
【分析】(1)
根据水的离子积的定义可知,在100℃时,Kw表达式为Kw=c(H+) c(OH-),由图中数据可知,在此温度下,Kw=c(H+) c(OH-)=10-6×10-6=1×10-12,故答案为:Kw=c(H+) c(OH-);1×10-12;
(2)
在室温下,将pH=12的Ba(OH)2溶液与pH=2的稀盐酸混合,欲使混合溶液pH=3,忽略两溶液混合时的体积变化,设Ba(OH)2溶液与稀盐酸的体积分别为V1,V2,则有:,解得:V1:V2=9:11,Ba(OH)2与盐酸的体积比9:11,故答案为:9:11;
(3)
室温时将pH为4的硫酸溶液中c()=5×10-5mol/L,c(H+)=10-4mol/L,稀释10000倍后,c()=5×10-9mol/L,而H+无限稀释时溶液pH值接近7,故c(H+)=10-7mol/L,故稀释后溶液中,c(SO)和c(H+)之比约为5×10-9mol/L:10-7mol/L=1:20,故答案为:1:20;
(4)
由于CH3COOH是一元弱酸,故 CH3COOH的电离是一个可逆过程,故其电离方程式为:CH3COOHCH3COO-+H+,故答案为:CH3COOHCH3COO-+H+;
(5)
由于①CH3COOH是一元弱酸,②HCl是一元强酸,③H2SO4是二元强酸,故当它们pH相同时,其物质的量浓度由大到小的顺序为①>②>③,故答案为:①>②>③;
(6)
由于①CH3COOH是一元弱酸,②HCl是一元强酸,③H2SO4是二元强酸,当它们的物质的量浓度相同时,溶液中的c(H+)是①<②<③,而溶液中c(H+)c(OH-)的乘积是一个常数,其溶液中水电离出的c(OH-)由大到小的顺序为①>②>③,故答案为:①>②>③;
(7)
由于①CH3COOH是一元弱酸,②HCl是一元强酸,③H2SO4是二元强酸,CH3COOHCH3COO-+H+随着反应的进行平衡正向移动,故三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为①<②=③,故答案为:①<②=③。
18. ①②⑥⑤④③ 5.9×10-10 1.7×10-5mol/L 0.5mmol/L >
【详解】(1)盐酸和醋酸为酸,氢氧化钡为碱,碳酸钠、氯化钾和氯化铵为盐,碳酸钠为强碱弱酸盐,其溶液呈碱性,氯化钾为强酸强碱盐,为中性,氯化铵为强酸弱碱盐,其溶液为酸性,相同浓度的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,所以pH盐酸小于醋酸,则这几种溶液的pH由小到大的顺序是①②⑥⑤④③;
(2) CH3COONa的水解平衡常数=Kw/Ka=10-14/1.7×10-5=5.9×10-10;②25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相等,则醋酸和一水合氨电离程度相等,其电离平衡常数相等,即NH3 H2O的电离常数Ka=1.7×10-5mol/L,此时溶液显中性c(H+)=c(OH-),同时存在电荷守恒式 ,则c(NH4+)=c(CH3COO-)>c(H+)=c(OH-);
(3) 醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,所以m>n,二者混合时溶液体积增大一倍,溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=0.5mmol/L。
19. S+O2SO2 2 5 8 2 10 16 MnO4﹣ 阳极 0.2 HSO4﹣ SO42﹣ 减小 cd
【详解】(1)以硫磺为原料生产硫酸的过程为硫燃烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫和水反应生成硫酸,第一步反应的化学方程式为:S+O2SO2 ;
(2)反应中锰元素化合价+2价变化为+7价,电子转移5e-,S2O82-中硫元素化合价+7价变化为SO42-中硫元素化合价+6价,电子转移2e-,电子转移总数为10e-,Mn2+前系数,2,S2O82-前系数为5,结合原子守恒、电荷守恒配平书写离子方程式为:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+,反应中锰元素化合价+2价变化为+7价,做还原剂被氧化,生成氧化产物为MnO4-;
(3)用电解硫酸氢钾的方法制取过硫酸钾:阴离子在阳极失电子发生氧化反应,元素化合价分析可知硫元素化合价+6价变化为+7价,化合价升高失电子发生氧化反应生成S2O82-,HSO4-在阳极反应生成S2O82-,电极反应为:2HSO4--2e-═S2O82-+2H+,另一极生成氢气,电极反应为2H++2e-=H2↑,阳极电子守恒计算,生成0.1mol的S2O82-同时,电子转移0.2mol,S2O82-~H2↑~2e-,可收集到氢气物质的量0.1mol,质量=0.1mol×2g/mol=0.2g;
(4)已知硫酸的第二级电离并不完全,在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4-电离,溶液显酸性,则溶液中离子浓度大小为c(K+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-),则该溶液中离子浓度由大到小排列第2位的离子是HSO4-,第4位的离子是SO42-。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中c(HSO4-)、c(K+)浓度增大,但对于电离平衡,HSO4- H++SO42-,硫酸氢根离子只电离不水解,氢离子浓度增大平衡逆向进行,电离程度减小,c(HSO4-)增大的多,比值减小;
(5)已知:HSO3- H++SO32- K=1.02×10-7,NH4++H2O NH3 H2O+H+ K=5.65×10-10,亚硫酸氢根离子电离程度大于NH4+的水解程度,所以亚硫酸氢铵溶液中滴入氢氧化钡溶液,氢氧根离子先和亚硫酸氢根离子反应,后与铵根离子结合生成一水合氨,反应中氢氧化钡量不同产物不同,不足量的氢氧化钡反应时需要满足化学式的组成比,
a.从选项中的离子方程式分析,HSO3-+Ba2++OH-→BaSO3↓+H2O是氢氧化钡不足量时的反应,只和亚硫酸氢根离子反应,则氢氧化钡电离出的钡离子和氢氧根离子全部反应,需要符合化学式的组成比,正确的应为2HSO3-+Ba2++2OH-→BaSO3↓+2H2O+SO32-,故a错误;
b.选项中离子方程式分析,NH4++2HSO3-+2Ba2++3OH-→2BaSO3↓+2H2O+NH3 H2O,电离出2molBa2+,电离出的氢氧根离子为4mol,其中2molOH-和2mol亚硫酸氢根离子反应,2molOH-和2molNH4+离子反应,正确的反应离子方程式为:NH4++HSO3-+Ba2++2OH-→BaSO3↓+H2O+NH3 H2O,故B错误;
c.依据b分析可知,选项中离子方程式为氢氧化钡和亚硫酸氢铵1:1反应的离子方程式,NH4++HSO3-+Ba2++2OH-→BaSO3↓+H2O+NH3 H2O,故c正确;
d.2NH4++4HSO3-+3Ba2++6OH-→3BaSO3↓+4H2O+2NH3 H2O+SO32-,分析离子方程式,反应是4molNH4HSO3和3molBa(OH)2的反应,6molOH-离子先和4molHSO3-反应,剩余 2molOH-离子再和2molNH4+离子反应,剩余2molNH4+离子生成亚硫酸铵,反应的离子方程式正确,故d正确,
所以选cd。
答案第1页,共2页
答案第1页,共2页
