3.4 物质组成的表示 第2课时 课件 (共21张PPT)2023-2024学年科粤版化学九年级上册
文档属性
| 名称 | 3.4 物质组成的表示 第2课时 课件 (共21张PPT)2023-2024学年科粤版化学九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 458.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-20 00:00:00 | ||
图片预览







文档简介
(共21张PPT)
3.4 物质组成的表示
第2课时
上节课我们学习了单质的化学式的书写原则,同学们还记得吗?请写出下列单质的化学式。
那化合物的化学式怎么书写呢?
要书写化合物的化学式,除了要知道化合物含有哪些元素成分外,还要知道元素的化合价。
汞
铜
氩气
Hg
Cu
Ar
学习目标
1.能规范标出某化合物中某元素的化合价。
2.能根据化合价书写化学式。
3.能根据化学式推导化合价。
学习目标
重点探究
任务一:什么是化学式
小组讨论,回答问题
[活动1]
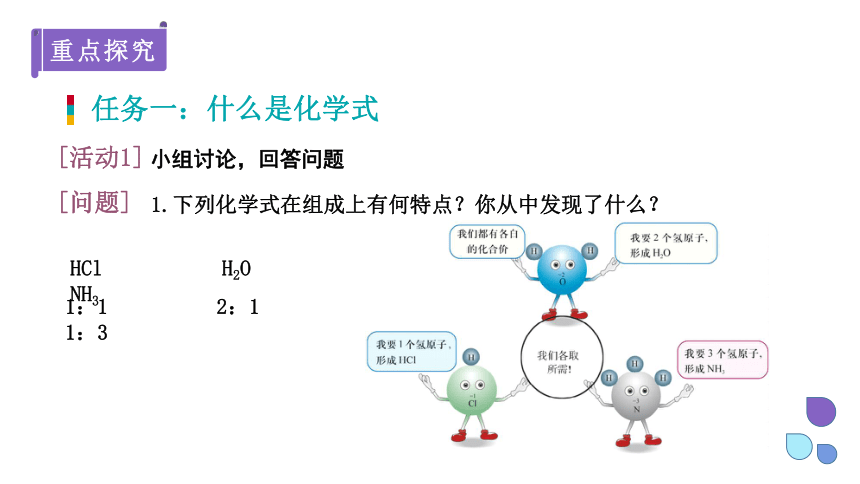
HCl H2O NH3
1:1 2:1 1:3
1.下列化学式在组成上有何特点?你从中发现了什么?
[问题]
重点探究
在不同元素间形成的化合物中,它们的原子个数比是不相同的,显示了这些元素某种特性,即元素的化合价。
化学上用化合价来确定化合物中原子或离子之间相互结合的数目。
化合价数越大的元素,提供原子或离子的个数越少;反之,化合价数越小的元素,提供原子或离子的个数越多。
重点探究
2.化合价如何表示?
例如: 表示-2价的氧元素。
R
+n
R
-n
O
元素的化合价标在元素符号的正上方,有正价和负价之分,用+n或-n表示,即:
-2
重点探究
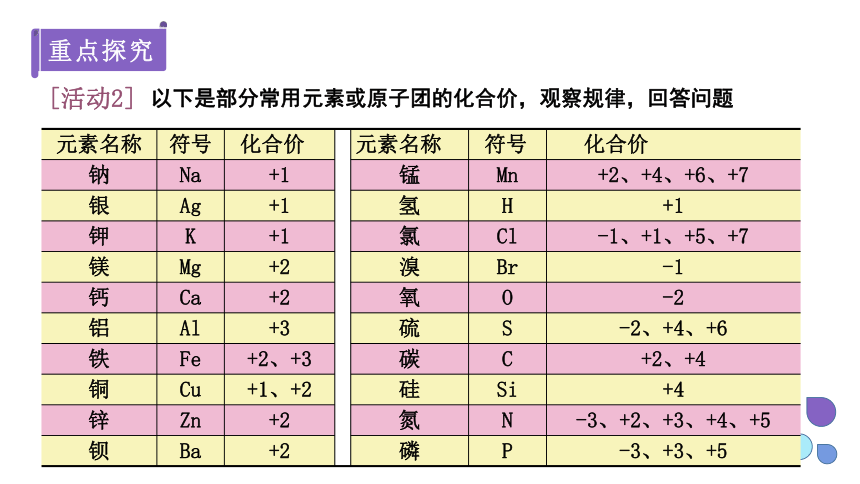
以下是部分常用元素或原子团的化合价,观察规律,回答问题
[活动2]
元素名称 符号 化合价 元素名称 符号 化合价
钠 Na +1 锰 Mn +2、+4、+6、+7
银 Ag +1 氢 H +1
钾 K +1 氯 Cl -1、+1、+5、+7
镁 Mg +2 溴 Br -1
钙 Ca +2 氧 O -2
铝 Al +3 硫 S -2、+4、+6
铁 Fe +2、+3 碳 C +2、+4
铜 Cu +1、+2 硅 Si +4
锌 Zn +2 氮 N -3、+2、+3、+4、+5
钡 Ba +2 磷 P -3、+3、+5
重点探究
重点探究
(1)化合价有正价和负价,金属与非金属形成化合物时,金属元素显正价,非金属元素显负价。
(2)氢元素通常显+1价,氧元素通常显-2价,许多非金属元素与氧元素形成化合物时,则显正价。
(3)部分元素可显不同的化合价。
(4)有一些化合物中,常常含有带电的原子团,叫做根,它们常作为一个整体参加反应,如氢氧化钠(NaOH)中的氢氧根(OH-)、硫酸(H2SO4)中的硫酸根(SO42-),它们既可分开计算每种元素的化合价,也可合并计算总的化合价。
[问题]
2.从上表中可以看出元素的化合价有什么特点?
重点探究
3.下列化合物中,正、负化合价的代数和有什么特点?
化合物里正负化合价代数和为0。
由于化合价是元素形成化合物时才表现出来的性质,因此,在单质中元素的化合价为0。
NaCl MgO N2 Al2O3 H2O SO2 MnO2
+1
-1
+2
-2
0
+3
-2
+1
-2
-2
+4
+4
-2
重点探究
一价氢氯钾钠银,二价氧钙钡镁锌;
三铝四硅五价磷,二三铁,二四碳;
二四六硫都齐全,铜汞二价最常见;
条件不同价不同,单质为零永不变。
一些常见元素化合价口诀
一些常见原子团的化合价
负一硝酸氢氧根,负二硫酸碳酸根;
负三记住磷酸根,正一价的是铵根。
标出下列物质中各元素的化合价。
MgO CaO H2 NaOH O2 AgCl
+2 -2
+2 -2
0
+1 -2 +1
0
+1 -1
[练一练]
重点探究
任务二:化合价和化学式
请根据化合价书写化学式
(1)写出组成化合物的元素,正价元素居左,负价元素居右
H O
(2)标出有关元素的化合价
H O
+1 -2
(3)根据化合物中各种元素化合价代数和等于零的原则,确定各有关原子的数目
∵2×(+1)+1×(-2)=0
∴2个氢原子,1个氧原子
(4)写出化学式
H2O
以“水”为例,请根据化合价书写化学式
[活动1]
[问题]
重点探究
请根据化学式求元素的化合价
[活动2]
解:根据化合物中正负化合价代数和为0的原则,设铁的化合价为x,
2×x+3×(-2)=0
故有
x= =+3
+6
2
1.已知氧化铁的化学式为Fe2O3,其中氧元素为-2价,求氧化铁中铁元素的化合价。
已知化学式,求其中某元素的化合价
[问题]
重点探究
2.请你求出五氧化二磷(P2O5)中磷元素的化合价: 。
还可以根据化合物中正负化合价代数和为0的原则,求出多于两种元素组成的化合物里某元素的化合价。
2×x+5×(-2)=0
故有
x= =+5
+10
2
+5
2×(+1)+x+4×(-2)=0
故有
x= (+8)+(-2)=+6
+6
3.请你再求出H2SO4中硫元素的化合价: 。
重点探究
任务三:怎样读化合物的化学式
[活动]
由两种元素组成的化合物,如NaCl、CO2 、P2O5 等,
分别读作:氯化钠、二氧化碳、五氧化二磷。
1.结合之前学习的单质的读法,说一说物质的化学式在读法上有什么规律?
根据以下示例,回答问题
[问题]
重点探究
①单质
氧化物一般要读出各种元素原子的个数。
O2:氧气,N2 :氮气
②化合物
读元素的名称。
Fe:铁,C :碳
若是气体在元素名称后加“ 气 ”。
由两种元素组成的化合物,一般从右往左读作某化某。
NaCl:氯化钠
CO:一氧化碳,
SO2:二氧化硫,
Fe3O4 :四氧化三铁
重点探究
补充:
①金属元素和原子团组成的物质,读为“某酸某”
如: Na2CO3 :碳酸钠 ZnSO4:硫酸锌 AgNO3:硝酸银
②氢原子和原子团组成的物质,读为“某酸”。
如:H2CO3 :碳酸 H2SO4:硫酸
③金属元素和氢氧根组成的物质,读为“氢氧化某”
如: KOH:氢氧化钾 Fe(OH) 3:氢氧化铁
当堂检测
⑤ CaCl2_________
⑥ KI____________
⑦N2__________
⑧ Na2S__________
氯化钙
碘化钾
氮气
硫化钠
①Fe3O4____________
②CO______________
③Al2O3___________
④CuO_____________
四氧化三铁
一氧化碳
三氧化二铝
氧化铜
1.读一读
当堂检测
2.某同学书写的试剂标签如图3-4-1所示,其中错误的是( )
B
[解析] 碳酸钠中,钠元素显+1价,碳酸根显-2价,则碳酸钠的化学式为Na2CO3。
当堂检测
3.写出下列物质的化学式,并标出各元素的化合价:
+2
-1
0
+1
-2
+1
+2-2
+1-2
+1-2
+2 -2+1
①氯化锌 ②金属锌 ③氢氧化钠 ④氧化镁 ⑤氧化钾 ⑥水 ⑦ 氢氧化钙
① ZnCl2
② Zn
③ Na O H
④ MgO
⑤ K2O
⑥ H2O
⑦ Ca(OH)2
课堂小结
化合价
用来表示元素在形成化合物时的原子个数比
①氧元素通常显-2价;氢元素通常显+1价
②金属和非金属化合时,金属元素显示正价、非金属元素显示负价
③化合物中正负化合价的代数和等于0;单质中元素的化合价为0
已知化学式求化合价
已知化合价书写化学式
概念
规律
应用
3.4 物质组成的表示
第2课时
上节课我们学习了单质的化学式的书写原则,同学们还记得吗?请写出下列单质的化学式。
那化合物的化学式怎么书写呢?
要书写化合物的化学式,除了要知道化合物含有哪些元素成分外,还要知道元素的化合价。
汞
铜
氩气
Hg
Cu
Ar
学习目标
1.能规范标出某化合物中某元素的化合价。
2.能根据化合价书写化学式。
3.能根据化学式推导化合价。
学习目标
重点探究
任务一:什么是化学式
小组讨论,回答问题
[活动1]
HCl H2O NH3
1:1 2:1 1:3
1.下列化学式在组成上有何特点?你从中发现了什么?
[问题]
重点探究
在不同元素间形成的化合物中,它们的原子个数比是不相同的,显示了这些元素某种特性,即元素的化合价。
化学上用化合价来确定化合物中原子或离子之间相互结合的数目。
化合价数越大的元素,提供原子或离子的个数越少;反之,化合价数越小的元素,提供原子或离子的个数越多。
重点探究
2.化合价如何表示?
例如: 表示-2价的氧元素。
R
+n
R
-n
O
元素的化合价标在元素符号的正上方,有正价和负价之分,用+n或-n表示,即:
-2
重点探究
以下是部分常用元素或原子团的化合价,观察规律,回答问题
[活动2]
元素名称 符号 化合价 元素名称 符号 化合价
钠 Na +1 锰 Mn +2、+4、+6、+7
银 Ag +1 氢 H +1
钾 K +1 氯 Cl -1、+1、+5、+7
镁 Mg +2 溴 Br -1
钙 Ca +2 氧 O -2
铝 Al +3 硫 S -2、+4、+6
铁 Fe +2、+3 碳 C +2、+4
铜 Cu +1、+2 硅 Si +4
锌 Zn +2 氮 N -3、+2、+3、+4、+5
钡 Ba +2 磷 P -3、+3、+5
重点探究
重点探究
(1)化合价有正价和负价,金属与非金属形成化合物时,金属元素显正价,非金属元素显负价。
(2)氢元素通常显+1价,氧元素通常显-2价,许多非金属元素与氧元素形成化合物时,则显正价。
(3)部分元素可显不同的化合价。
(4)有一些化合物中,常常含有带电的原子团,叫做根,它们常作为一个整体参加反应,如氢氧化钠(NaOH)中的氢氧根(OH-)、硫酸(H2SO4)中的硫酸根(SO42-),它们既可分开计算每种元素的化合价,也可合并计算总的化合价。
[问题]
2.从上表中可以看出元素的化合价有什么特点?
重点探究
3.下列化合物中,正、负化合价的代数和有什么特点?
化合物里正负化合价代数和为0。
由于化合价是元素形成化合物时才表现出来的性质,因此,在单质中元素的化合价为0。
NaCl MgO N2 Al2O3 H2O SO2 MnO2
+1
-1
+2
-2
0
+3
-2
+1
-2
-2
+4
+4
-2
重点探究
一价氢氯钾钠银,二价氧钙钡镁锌;
三铝四硅五价磷,二三铁,二四碳;
二四六硫都齐全,铜汞二价最常见;
条件不同价不同,单质为零永不变。
一些常见元素化合价口诀
一些常见原子团的化合价
负一硝酸氢氧根,负二硫酸碳酸根;
负三记住磷酸根,正一价的是铵根。
标出下列物质中各元素的化合价。
MgO CaO H2 NaOH O2 AgCl
+2 -2
+2 -2
0
+1 -2 +1
0
+1 -1
[练一练]
重点探究
任务二:化合价和化学式
请根据化合价书写化学式
(1)写出组成化合物的元素,正价元素居左,负价元素居右
H O
(2)标出有关元素的化合价
H O
+1 -2
(3)根据化合物中各种元素化合价代数和等于零的原则,确定各有关原子的数目
∵2×(+1)+1×(-2)=0
∴2个氢原子,1个氧原子
(4)写出化学式
H2O
以“水”为例,请根据化合价书写化学式
[活动1]
[问题]
重点探究
请根据化学式求元素的化合价
[活动2]
解:根据化合物中正负化合价代数和为0的原则,设铁的化合价为x,
2×x+3×(-2)=0
故有
x= =+3
+6
2
1.已知氧化铁的化学式为Fe2O3,其中氧元素为-2价,求氧化铁中铁元素的化合价。
已知化学式,求其中某元素的化合价
[问题]
重点探究
2.请你求出五氧化二磷(P2O5)中磷元素的化合价: 。
还可以根据化合物中正负化合价代数和为0的原则,求出多于两种元素组成的化合物里某元素的化合价。
2×x+5×(-2)=0
故有
x= =+5
+10
2
+5
2×(+1)+x+4×(-2)=0
故有
x= (+8)+(-2)=+6
+6
3.请你再求出H2SO4中硫元素的化合价: 。
重点探究
任务三:怎样读化合物的化学式
[活动]
由两种元素组成的化合物,如NaCl、CO2 、P2O5 等,
分别读作:氯化钠、二氧化碳、五氧化二磷。
1.结合之前学习的单质的读法,说一说物质的化学式在读法上有什么规律?
根据以下示例,回答问题
[问题]
重点探究
①单质
氧化物一般要读出各种元素原子的个数。
O2:氧气,N2 :氮气
②化合物
读元素的名称。
Fe:铁,C :碳
若是气体在元素名称后加“ 气 ”。
由两种元素组成的化合物,一般从右往左读作某化某。
NaCl:氯化钠
CO:一氧化碳,
SO2:二氧化硫,
Fe3O4 :四氧化三铁
重点探究
补充:
①金属元素和原子团组成的物质,读为“某酸某”
如: Na2CO3 :碳酸钠 ZnSO4:硫酸锌 AgNO3:硝酸银
②氢原子和原子团组成的物质,读为“某酸”。
如:H2CO3 :碳酸 H2SO4:硫酸
③金属元素和氢氧根组成的物质,读为“氢氧化某”
如: KOH:氢氧化钾 Fe(OH) 3:氢氧化铁
当堂检测
⑤ CaCl2_________
⑥ KI____________
⑦N2__________
⑧ Na2S__________
氯化钙
碘化钾
氮气
硫化钠
①Fe3O4____________
②CO______________
③Al2O3___________
④CuO_____________
四氧化三铁
一氧化碳
三氧化二铝
氧化铜
1.读一读
当堂检测
2.某同学书写的试剂标签如图3-4-1所示,其中错误的是( )
B
[解析] 碳酸钠中,钠元素显+1价,碳酸根显-2价,则碳酸钠的化学式为Na2CO3。
当堂检测
3.写出下列物质的化学式,并标出各元素的化合价:
+2
-1
0
+1
-2
+1
+2-2
+1-2
+1-2
+2 -2+1
①氯化锌 ②金属锌 ③氢氧化钠 ④氧化镁 ⑤氧化钾 ⑥水 ⑦ 氢氧化钙
① ZnCl2
② Zn
③ Na O H
④ MgO
⑤ K2O
⑥ H2O
⑦ Ca(OH)2
课堂小结
化合价
用来表示元素在形成化合物时的原子个数比
①氧元素通常显-2价;氢元素通常显+1价
②金属和非金属化合时,金属元素显示正价、非金属元素显示负价
③化合物中正负化合价的代数和等于0;单质中元素的化合价为0
已知化学式求化合价
已知化合价书写化学式
概念
规律
应用
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
