4.4 化学方程式 第1课时 课件(共17张PPT内嵌视频) 2023-2024学年科粤版化学九年级上册
文档属性
| 名称 | 4.4 化学方程式 第1课时 课件(共17张PPT内嵌视频) 2023-2024学年科粤版化学九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-20 00:00:00 | ||
图片预览





文档简介
(共17张PPT)
4.4 化学方程式
第1课时
学习目标
1.能举例说明化学方程式的意义 。
2.能从宏观和微观角度正确读出化学方程式。
3.能说出书写化学方程式的原则和步骤。
4.能运用最小公倍数法配平化学方程式。
5.能判断常见的化学方程式的正误。
学习目标
重点探究
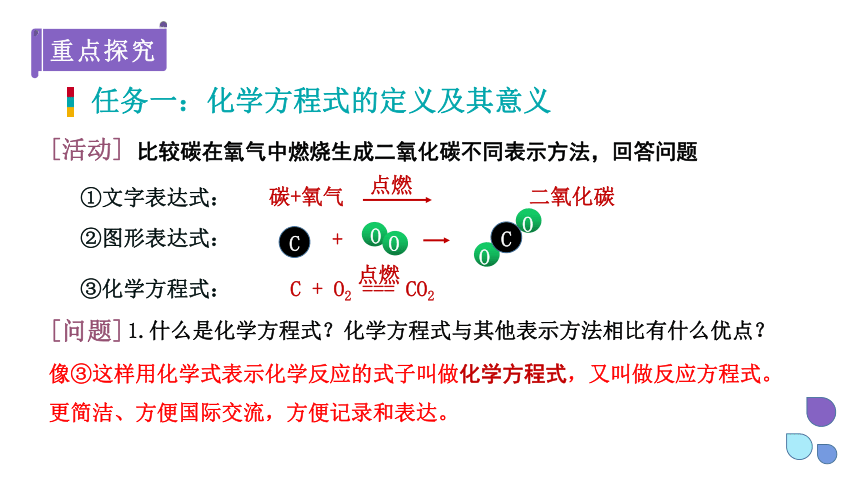
任务一:化学方程式的定义及其意义
①文字表达式:
点燃
碳+氧气 二氧化碳
[活动]
比较碳在氧气中燃烧生成二氧化碳不同表示方法,回答问题
②图形表达式:
+
C
O
O
O
O
C
C + O2 === CO2
点燃
③化学方程式:
[问题]
1.什么是化学方程式?化学方程式与其他表示方法相比有什么优点?
像③这样用化学式表示化学反应的式子叫做化学方程式,又叫做反应方程式。更简洁、方便国际交流,方便记录和表达。
重点探究
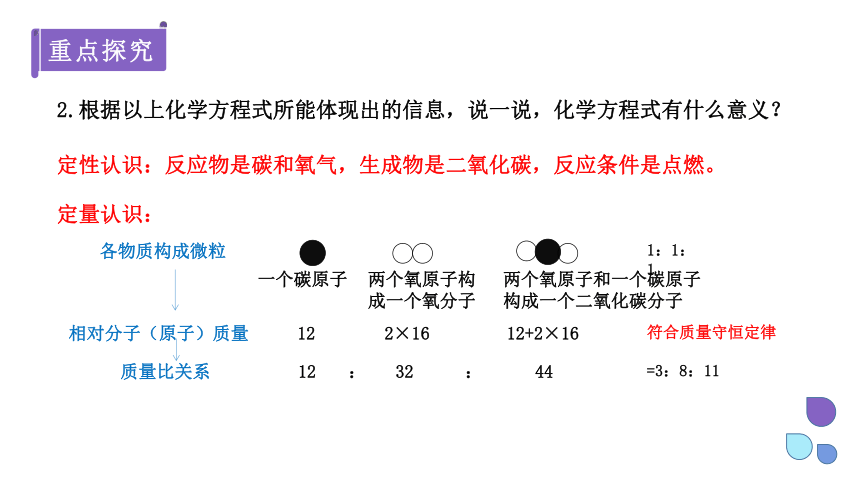
2.根据以上化学方程式所能体现出的信息,说一说,化学方程式有什么意义?
定性认识:反应物是碳和氧气,生成物是二氧化碳,反应条件是点燃。
各物质构成微粒
一个碳原子
两个氧原子构成一个氧分子
两个氧原子和一个碳原子构成一个二氧化碳分子
相对分子(原子)质量
12
2×16
12+2×16
质量比关系
12
32
44
:
:
=3:8:11
1:1:1
符合质量守恒定律
定量认识:
重点探究
①碳和氧气在点燃条件下反应生成二氧化碳。
②每12份质量的碳跟32份质量的氧气完全反应生成44份质量的二氧化碳。
③每一个碳原子和一个氧分子点燃生成一个二氧化碳分子。
微观
宏观
3.以碳在氧气中燃烧为例,说一说化学方程式应如何读?
重点探究
[总结]
定性方面:
定量方面:
化学方程式的意义:
①表示反应物、生成物和反应条件。
②表示反应物、生成物之间微粒个数比。
③表示反应物和生成物质量比。
重点探究
任务二:化学方程式的书写
[活动]
请你根据书写化学方程式的两个原则,回答问题
②遵循质量守恒定律(化学式两边的原子种类及数目必须相同)
①必须以科学实验的客观事实为根据(不能书写不存在的化学反应,也不能臆造不存在的物质)。
重点探究
1.判断下面的化学方程式是否符合书写原则,若不符合,请将其改正
[问题]
a.铁丝在氧气中燃烧:
b.过氧化氢制取氧气:
4Fe+3O2 ==== 2Fe2O3
点燃
H2O2 ==== H2↑+O2↑
MnO2
P + O2 ==== P2O5
点燃
Na+Cl2 ==== NaCl
点燃
c.磷在氧气中燃烧:
d.过氧化氢制取氧气:
3Fe+2O2 ====Fe3O4
点燃
2H2O2 ==== 2H2↑+O2↑
MnO2
4P + 5O2 ==== 2P2O5
点燃
2Na+Cl2 ==== 2NaCl
点燃
重点探究
步骤 实例
1.根据实验事实,在左、右两边分别写反应物和生成物的化学式
2.根据质量守恒定律,进行配平,即在有关化学式前配上适当的化学计量数,使反应前后各种元素的原子个数相等
3.标明反应条件和生成物状态
P + O2 —— P2O5
磷 + 氧气 五氧化二磷
点燃
P + O2 P2O5
4P + 5O2 2P2O5
点燃
4
5
2
2.从中挑选一例说一说你是怎么书写化学方程式的?
重点探究
最小公倍数法
P + O2 —— P2O5
5
2
10
2 ×2 =
4
点燃
两端各出现一次且原子数目较大的元素
方法
a.找元素
b.计算最小公倍数
3.你能说一说你是怎么配平化学方程式的吗?
重点探究
[练一练]
步骤 请练习
1.根据实验事实,在左、右两边分别写反应物和生成物的化学式
2.根据质量守恒定律,进行配平,即在有关化学式前配上适当的化学计量数,使反应前后各种元素的原子个数相等
3.标明反应条件和生成物状态
铝 +氧气 氧化铝
点燃
4Al + 3O2 2Al2O3
4Al + 3O2 2Al2O3
点燃
Al +O2 —— Al2O3
重点探究
化学方程式的书写步骤
[总结]
(1)写:根据实验事实,在左、右两边分别写出反应物和生成物的化学式,中间用“——”连接。
(2)配:配平化学方程式,即在化学式前面配上合适的系数,使反应前后各元素的原子个数相等,然后把“──”改成“====” 。
(3)标:标明反应条件和生成物的状态。
(4)查:检查化学方程式中的化学式是否正确、有没有配平、反应条件是否遗漏、有没有漏标“↑”或“↓”。
当堂检测
1.硫在氧气中燃烧的化学方程式是:S+O2 ==== SO2。这个式子不仅表明了反应物是________,生成物是_____,反应条件是_______,还表示了参与反应的各物质之间的质量关系,即在点燃条件下,每_____份质量的硫与_____份质量的氧气恰好完全反应生成____份质量的二氧化硫。
S与O2
SO2
点燃
点燃
32
32
64
2.下列关于化学方程式CH4+2O2 ==== CO2+2H2O的含义叙述错误的是( )
A.CH4和O2在点燃的条件下生成CO2和H2O B.甲烷具有可燃性
C.参加反应的CH4与O2的分子个数比为1:2 D.每消耗16g甲烷就会生成18g水
D
点燃
当堂检测
3.配平下列化学方程式
Al + O2 Al2O3
高温
CuO + C Cu + CO2
H2S + O2 S + H2O
点燃
4
3
2
2
2
2
2
2
当堂检测
①细铁丝燃烧
点燃
3Fe+2O2 ==== Fe3O4
②氢气燃烧
③实验室用过氧化氢制取氧气
2H2 + O2 ==== 2H2O
点燃
MnO2
2H2O2 ===== 2H2O+O2↑
④高锰酸钾受热分解
△
2KMnO4 === K2MnO4+MnO2+O2↑
4.正确书写下列反应的化学方程式:
课堂小结
用化学式来表示化学反应的式子
化学方程式
表明了反应物、生成物及反应条件
表明了反应物和生成物各物质的粒子个数之比
表明了反应物和生成物各物质的质量之比
意义
概念:
书写
写→配→标→等→查
原则
步骤
必须以客观事实为基础
遵守质量守恒定律
4.4 化学方程式
第1课时
学习目标
1.能举例说明化学方程式的意义 。
2.能从宏观和微观角度正确读出化学方程式。
3.能说出书写化学方程式的原则和步骤。
4.能运用最小公倍数法配平化学方程式。
5.能判断常见的化学方程式的正误。
学习目标
重点探究
任务一:化学方程式的定义及其意义
①文字表达式:
点燃
碳+氧气 二氧化碳
[活动]
比较碳在氧气中燃烧生成二氧化碳不同表示方法,回答问题
②图形表达式:
+
C
O
O
O
O
C
C + O2 === CO2
点燃
③化学方程式:
[问题]
1.什么是化学方程式?化学方程式与其他表示方法相比有什么优点?
像③这样用化学式表示化学反应的式子叫做化学方程式,又叫做反应方程式。更简洁、方便国际交流,方便记录和表达。
重点探究
2.根据以上化学方程式所能体现出的信息,说一说,化学方程式有什么意义?
定性认识:反应物是碳和氧气,生成物是二氧化碳,反应条件是点燃。
各物质构成微粒
一个碳原子
两个氧原子构成一个氧分子
两个氧原子和一个碳原子构成一个二氧化碳分子
相对分子(原子)质量
12
2×16
12+2×16
质量比关系
12
32
44
:
:
=3:8:11
1:1:1
符合质量守恒定律
定量认识:
重点探究
①碳和氧气在点燃条件下反应生成二氧化碳。
②每12份质量的碳跟32份质量的氧气完全反应生成44份质量的二氧化碳。
③每一个碳原子和一个氧分子点燃生成一个二氧化碳分子。
微观
宏观
3.以碳在氧气中燃烧为例,说一说化学方程式应如何读?
重点探究
[总结]
定性方面:
定量方面:
化学方程式的意义:
①表示反应物、生成物和反应条件。
②表示反应物、生成物之间微粒个数比。
③表示反应物和生成物质量比。
重点探究
任务二:化学方程式的书写
[活动]
请你根据书写化学方程式的两个原则,回答问题
②遵循质量守恒定律(化学式两边的原子种类及数目必须相同)
①必须以科学实验的客观事实为根据(不能书写不存在的化学反应,也不能臆造不存在的物质)。
重点探究
1.判断下面的化学方程式是否符合书写原则,若不符合,请将其改正
[问题]
a.铁丝在氧气中燃烧:
b.过氧化氢制取氧气:
4Fe+3O2 ==== 2Fe2O3
点燃
H2O2 ==== H2↑+O2↑
MnO2
P + O2 ==== P2O5
点燃
Na+Cl2 ==== NaCl
点燃
c.磷在氧气中燃烧:
d.过氧化氢制取氧气:
3Fe+2O2 ====Fe3O4
点燃
2H2O2 ==== 2H2↑+O2↑
MnO2
4P + 5O2 ==== 2P2O5
点燃
2Na+Cl2 ==== 2NaCl
点燃
重点探究
步骤 实例
1.根据实验事实,在左、右两边分别写反应物和生成物的化学式
2.根据质量守恒定律,进行配平,即在有关化学式前配上适当的化学计量数,使反应前后各种元素的原子个数相等
3.标明反应条件和生成物状态
P + O2 —— P2O5
磷 + 氧气 五氧化二磷
点燃
P + O2 P2O5
4P + 5O2 2P2O5
点燃
4
5
2
2.从中挑选一例说一说你是怎么书写化学方程式的?
重点探究
最小公倍数法
P + O2 —— P2O5
5
2
10
2 ×2 =
4
点燃
两端各出现一次且原子数目较大的元素
方法
a.找元素
b.计算最小公倍数
3.你能说一说你是怎么配平化学方程式的吗?
重点探究
[练一练]
步骤 请练习
1.根据实验事实,在左、右两边分别写反应物和生成物的化学式
2.根据质量守恒定律,进行配平,即在有关化学式前配上适当的化学计量数,使反应前后各种元素的原子个数相等
3.标明反应条件和生成物状态
铝 +氧气 氧化铝
点燃
4Al + 3O2 2Al2O3
4Al + 3O2 2Al2O3
点燃
Al +O2 —— Al2O3
重点探究
化学方程式的书写步骤
[总结]
(1)写:根据实验事实,在左、右两边分别写出反应物和生成物的化学式,中间用“——”连接。
(2)配:配平化学方程式,即在化学式前面配上合适的系数,使反应前后各元素的原子个数相等,然后把“──”改成“====” 。
(3)标:标明反应条件和生成物的状态。
(4)查:检查化学方程式中的化学式是否正确、有没有配平、反应条件是否遗漏、有没有漏标“↑”或“↓”。
当堂检测
1.硫在氧气中燃烧的化学方程式是:S+O2 ==== SO2。这个式子不仅表明了反应物是________,生成物是_____,反应条件是_______,还表示了参与反应的各物质之间的质量关系,即在点燃条件下,每_____份质量的硫与_____份质量的氧气恰好完全反应生成____份质量的二氧化硫。
S与O2
SO2
点燃
点燃
32
32
64
2.下列关于化学方程式CH4+2O2 ==== CO2+2H2O的含义叙述错误的是( )
A.CH4和O2在点燃的条件下生成CO2和H2O B.甲烷具有可燃性
C.参加反应的CH4与O2的分子个数比为1:2 D.每消耗16g甲烷就会生成18g水
D
点燃
当堂检测
3.配平下列化学方程式
Al + O2 Al2O3
高温
CuO + C Cu + CO2
H2S + O2 S + H2O
点燃
4
3
2
2
2
2
2
2
当堂检测
①细铁丝燃烧
点燃
3Fe+2O2 ==== Fe3O4
②氢气燃烧
③实验室用过氧化氢制取氧气
2H2 + O2 ==== 2H2O
点燃
MnO2
2H2O2 ===== 2H2O+O2↑
④高锰酸钾受热分解
△
2KMnO4 === K2MnO4+MnO2+O2↑
4.正确书写下列反应的化学方程式:
课堂小结
用化学式来表示化学反应的式子
化学方程式
表明了反应物、生成物及反应条件
表明了反应物和生成物各物质的粒子个数之比
表明了反应物和生成物各物质的质量之比
意义
概念:
书写
写→配→标→等→查
原则
步骤
必须以客观事实为基础
遵守质量守恒定律
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
