3.2 制取氧气 课件 (共28张PPT内嵌视频)2023-2024学年科粤版化学九年级上册
文档属性
| 名称 | 3.2 制取氧气 课件 (共28张PPT内嵌视频)2023-2024学年科粤版化学九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 93.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-20 18:09:38 | ||
图片预览








文档简介
(共28张PPT)
3.2 制取氧气
第1课时
潜水氧气瓶
液氧助燃剂
我们知道氧气有许多用途,那么我们如何制取氧气呢?
学习目标
1.了解实验室制氧气的方法,通过实验学会过氧化氢分解制氧气的方法,知道验证氧化生成的方法。
2.初步认识反应条件对反应速率的影响,通过实验探究认识催化剂和催化作用。
学习目标
重点探究
任务一:过氧化氢分解制取氧气
[活动1]
观察【实验3-4】,回答问题。
(1)
(2)
(3)
(4)
[问题]
1.你能描述出这个实验的现象吗?并做出推断。
重点探究
实验序号 观察到的现象 推断
(1)
(2)
(3)
(4)
木条不复燃
木条复燃
木条复燃
木条不复燃
常温下产生的氧气很少
二氧化锰不放出氧气
有氧气放出
又有氧气放出
2.这个实验的原理是,请你用文字表达式描述此反应。
过氧化氢 水 + 氧气
二氧化锰
H2O2 H2O + O2
在二氧化锰的催化作用下,过氧化氢迅速分解产生氧气和水。
重点探究
实验前用精密的天平称量二氧化锰的质量,实验后把二氧化锰洗净、干燥、再称量
4.请你设计实验探究二氧化锰在反应前后的质量的变化情况。
二氧化锰在反应前后质量没有发生变化
3.比较上述几步实验,说明过氧化氢在什么条件下分解放出氧气更容易?
二氧化锰存在条件下
重点探究
[归纳总结]
催化剂的性质
能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生。
重点探究
[在线测试]
①催化剂一定能加快其他物质的化学反应速率
②催化剂的物理性质可能改变
③过氧化氢分解的催化剂只有二氧化锰
④一种催化剂只能催化一种化学反应
⑤酶也是一种催化剂
⑥二氧化锰能加快过氧化氢的分解速率,也能 增大氧气的产量
正确
正确
错误
错误
错误
错误
( )
( )
( )
( )
( )
( )
当堂检测
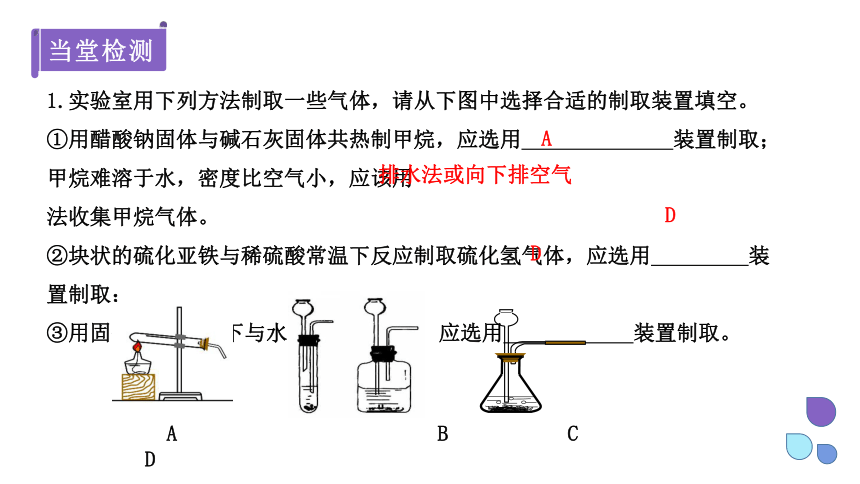
1.实验室用下列方法制取一些气体,请从下图中选择合适的制取装置填空。
①用醋酸钠固体与碱石灰固体共热制甲烷,应选用 装置制取;甲烷难溶于水,密度比空气小,应该用 法收集甲烷气体。
②块状的硫化亚铁与稀硫酸常温下反应制取硫化氢气体,应选用 装置制取;
③用固体Na2O2常温下与水反应制取氧气,应选用 装置制取。
A
A B C D
排水法或向下排空气
D
D
当堂检测
2.现有质量、浓度都相等的两份过氧化氢溶液,a中加入少量二氧化锰,b中不加二氧化锰,纵坐标表示产生氧气的质量,横坐标表示反应时间,其中正确的是( )
C
当堂检测
3.某同学用如图所示的装置和药品,制取并收集氧气。请回答下列问题:
(1)装置中标注仪器①的名称是 。
(2)装置中二氧化锰的作用 。
(3)图中发生反应的文字表达式为:
。
(4)连接好装置后,必须首先检查装置的 。收集氧气还可以采用
法。
分液漏斗
加快过氧化氢的反应速率
过氧化氢 → 水+氧气
二氧化锰
气密性
向上排空气
课堂小结
1.过氧化氢分解
过氧化氢 水+氧气
二氧化锰
能改变其他物质的化学反应速率,而本身的化学性质和质量在化学反应前后都没有发生变化的物质。
2.催化剂:
3.2 制取氧气
第2课时
上节课我们学习了过氧化氢制取氧气的方法,并接触了催化剂,大家还记得什么物质称之为催化剂吗?
能改变其他物质的化学反应速率而本身的质量和化学性质在反应前后都没有变化的物质叫做催化剂。
学习目标
1.初步学会仪器的连接,并能检查装置的气密性。
2.初步学会实验室高锰酸钾制取氧气的实验操作。
3.能概述分解反应的特征。
4.能概述工业制取氧气的原理
学习目标
重点探究
任务一:仪器的连接
观察仪器连接的相关操作,回答问题。
[活动]
玻璃管待插入的一端用水润湿,然后稍稍用力转动插入胶皮管。
手拿容器(切勿顶桌面),然后慢慢转动塞入。
在容器口塞橡皮塞时:
将玻璃管插入带孔橡皮塞:
将玻璃管插入带胶皮管:
玻璃管待插入的一端用水润湿,然后对准橡皮塞的孔稍用力插入。
填写仪器的连接操作:
[问题]
重点探究
任务二:实验室制取氧气的方法
观察【实验3-5】,回答问题
[活动1]
[问题]
1.请你简要说一说实验室用高锰酸钾制取氧气的步骤及原理。
①查:检查装置的气密性 ②装:将药品平铺在试管底部
③定:将试管固定在铁架台上 ④点:点燃酒精灯
⑤收:收集气体 ⑥离:将导管移出水面 ⑦熄:熄灭酒精灯
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
(KMnO4) (K2MnO4 )( MnO2)( O2)
重点探究
2.这是检查气密性的方法,它的根据是什么?
3.为什么要在试管口塞一团棉花?为什么试管口要略向下倾斜?
防止加热时高锰酸钾粉末进入导管
防止管口冷凝的水倒流使试管炸裂
空气的热胀冷缩
重点探究
4.为什么要用排水法收集氧气?
5.导气管为什么不直接插入集气瓶?
氧气不易溶于水,也不与水反应
导管口一开始有气泡冒出时是由于试管内空气随温度升高,受热膨胀,排出来的气体是空气,造成收集的氧气不纯净。
重点探究
6.为什么要先在试管下方来回移动酒精灯火焰,并用外焰加热?
7.为什么加热开始所产生的气泡不宜收集?
8.为什么要先将导气管从水槽移出再熄灭酒精灯?
先让试管预热,以防局部高温试管爆炸。
外焰加热因为外焰的温度高。
因为是实验装置内有残余的空气
如果先熄灭酒精灯,试管内气体减少,压强减小,水槽中的水就会被吸入热的试管内,使试管炸裂。
重点探究
验证氧气的化学性质
描述木炭在氧气中燃烧的现象:
。
反应文字表达式为:
。
燃烧很旺,发出白光
碳 + 氧气 二氧化碳
点燃
[活动2]
[问题]
1.木炭在氧气中燃烧有何现象?发生了什么反应?
重点探究
2.分析三个制取氧气的反应,它们有什么共同特征?与化合反应有什么不同?
过氧化氢 水 + 氧气
二氧化锰
氯酸钾 氯化钾 + 氧气
二氧化锰
加热
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
特点:“一变多”
分解反应:由一种反应物生成两种或两种以上其他物质的反应。
区别:化合反应的特点是“多变一”;分解反应的特点是“一变多”。
重点探究
任务三:工业制氧气
结合课本P78-79及相关资料,回答问题
[活动]
利用膜分离技术富集空气中的氧气,是近年来出现的新方法。在一定压力下,让空气通过具有富集功能的薄膜,反复进行多级分离,便可得到含氧气90%以上的富氧空气,它在医疗、化工、炼钢和发酵等方面都有广泛的应用。
重点探究
1.分离液态空气法:利用液态空气中各成份的沸点不同,由于液态氮的沸点比液态氧的沸点低,因此氮气首先从液态空气中蒸发出来,剩下的主要就是液态氧。
2.富氧膜分离技术:利用具有富集功能的薄膜,反复进行多级分离,得到富氧空气
工业上有哪些制取氧气的方法?原理是?
[问题]
当堂检测
1.在实验室里加热高锰酸钾制氧气并用排水法收集,下列操作先后顺序正确的是( )
A.固定装置时,先放酒精灯,后固定试管
B.先装入高锰酸钾,后检查装置的气密性
C.加热时,先对准药品集中加热,后移动酒精灯加热
D.实验结束时,先熄灭酒精灯火焰,后将导管移出水面
A
当堂检测
2.下列属于分解反应的是( )
A.蒸发食盐水得食盐
B.分离液态空气得氧气
C.过氧化氢分解制取氧气
D.蜡烛燃烧生成水和二氧化碳
C
当堂检测
3.如图所示是实验室用高锰酸钾制取氧气的实验装置。回答下列问题。
(1)指出仪器的名称:A. ,B. ,C. 。
(2)加热高锰酸钾制取氧气时,试管口要放棉花,是为了 。
(3)加热时试管口应略微向 (填“上”或“下”)倾斜,原因是 。
(4)观察到水槽中导管口气泡 时开始收集氧气,当集气瓶中的水被排出,瓶口有 冒出时,表明集气瓶内氧气已集满,在水下用玻璃片盖好集气瓶,取出,并 (填“倒”或“正”)放在桌面上。氧气能用排水法收集的原因是 。
(5)停止加热时要先把导管移出水面再熄灭酒精灯,
这是为了 。
酒精灯
水槽
试管
防止高锰酸钾粉末进入导管
下
可防止冷凝水倒流引起试管的炸裂
连续均匀冒出
大气泡向外
正
氧气不易溶于水
防止冷水倒吸、炸裂试管
课堂小结
2.分解反应:
一种物质反应生成两种或两种以上物质的反应
分解过氧化氢
加热高锰酸钾
加热氯酸钾
1.制取氧气的方法
实验室制取氧气
工业制取氧气
3.2 制取氧气
第1课时
潜水氧气瓶
液氧助燃剂
我们知道氧气有许多用途,那么我们如何制取氧气呢?
学习目标
1.了解实验室制氧气的方法,通过实验学会过氧化氢分解制氧气的方法,知道验证氧化生成的方法。
2.初步认识反应条件对反应速率的影响,通过实验探究认识催化剂和催化作用。
学习目标
重点探究
任务一:过氧化氢分解制取氧气
[活动1]
观察【实验3-4】,回答问题。
(1)
(2)
(3)
(4)
[问题]
1.你能描述出这个实验的现象吗?并做出推断。
重点探究
实验序号 观察到的现象 推断
(1)
(2)
(3)
(4)
木条不复燃
木条复燃
木条复燃
木条不复燃
常温下产生的氧气很少
二氧化锰不放出氧气
有氧气放出
又有氧气放出
2.这个实验的原理是,请你用文字表达式描述此反应。
过氧化氢 水 + 氧气
二氧化锰
H2O2 H2O + O2
在二氧化锰的催化作用下,过氧化氢迅速分解产生氧气和水。
重点探究
实验前用精密的天平称量二氧化锰的质量,实验后把二氧化锰洗净、干燥、再称量
4.请你设计实验探究二氧化锰在反应前后的质量的变化情况。
二氧化锰在反应前后质量没有发生变化
3.比较上述几步实验,说明过氧化氢在什么条件下分解放出氧气更容易?
二氧化锰存在条件下
重点探究
[归纳总结]
催化剂的性质
能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生。
重点探究
[在线测试]
①催化剂一定能加快其他物质的化学反应速率
②催化剂的物理性质可能改变
③过氧化氢分解的催化剂只有二氧化锰
④一种催化剂只能催化一种化学反应
⑤酶也是一种催化剂
⑥二氧化锰能加快过氧化氢的分解速率,也能 增大氧气的产量
正确
正确
错误
错误
错误
错误
( )
( )
( )
( )
( )
( )
当堂检测
1.实验室用下列方法制取一些气体,请从下图中选择合适的制取装置填空。
①用醋酸钠固体与碱石灰固体共热制甲烷,应选用 装置制取;甲烷难溶于水,密度比空气小,应该用 法收集甲烷气体。
②块状的硫化亚铁与稀硫酸常温下反应制取硫化氢气体,应选用 装置制取;
③用固体Na2O2常温下与水反应制取氧气,应选用 装置制取。
A
A B C D
排水法或向下排空气
D
D
当堂检测
2.现有质量、浓度都相等的两份过氧化氢溶液,a中加入少量二氧化锰,b中不加二氧化锰,纵坐标表示产生氧气的质量,横坐标表示反应时间,其中正确的是( )
C
当堂检测
3.某同学用如图所示的装置和药品,制取并收集氧气。请回答下列问题:
(1)装置中标注仪器①的名称是 。
(2)装置中二氧化锰的作用 。
(3)图中发生反应的文字表达式为:
。
(4)连接好装置后,必须首先检查装置的 。收集氧气还可以采用
法。
分液漏斗
加快过氧化氢的反应速率
过氧化氢 → 水+氧气
二氧化锰
气密性
向上排空气
课堂小结
1.过氧化氢分解
过氧化氢 水+氧气
二氧化锰
能改变其他物质的化学反应速率,而本身的化学性质和质量在化学反应前后都没有发生变化的物质。
2.催化剂:
3.2 制取氧气
第2课时
上节课我们学习了过氧化氢制取氧气的方法,并接触了催化剂,大家还记得什么物质称之为催化剂吗?
能改变其他物质的化学反应速率而本身的质量和化学性质在反应前后都没有变化的物质叫做催化剂。
学习目标
1.初步学会仪器的连接,并能检查装置的气密性。
2.初步学会实验室高锰酸钾制取氧气的实验操作。
3.能概述分解反应的特征。
4.能概述工业制取氧气的原理
学习目标
重点探究
任务一:仪器的连接
观察仪器连接的相关操作,回答问题。
[活动]
玻璃管待插入的一端用水润湿,然后稍稍用力转动插入胶皮管。
手拿容器(切勿顶桌面),然后慢慢转动塞入。
在容器口塞橡皮塞时:
将玻璃管插入带孔橡皮塞:
将玻璃管插入带胶皮管:
玻璃管待插入的一端用水润湿,然后对准橡皮塞的孔稍用力插入。
填写仪器的连接操作:
[问题]
重点探究
任务二:实验室制取氧气的方法
观察【实验3-5】,回答问题
[活动1]
[问题]
1.请你简要说一说实验室用高锰酸钾制取氧气的步骤及原理。
①查:检查装置的气密性 ②装:将药品平铺在试管底部
③定:将试管固定在铁架台上 ④点:点燃酒精灯
⑤收:收集气体 ⑥离:将导管移出水面 ⑦熄:熄灭酒精灯
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
(KMnO4) (K2MnO4 )( MnO2)( O2)
重点探究
2.这是检查气密性的方法,它的根据是什么?
3.为什么要在试管口塞一团棉花?为什么试管口要略向下倾斜?
防止加热时高锰酸钾粉末进入导管
防止管口冷凝的水倒流使试管炸裂
空气的热胀冷缩
重点探究
4.为什么要用排水法收集氧气?
5.导气管为什么不直接插入集气瓶?
氧气不易溶于水,也不与水反应
导管口一开始有气泡冒出时是由于试管内空气随温度升高,受热膨胀,排出来的气体是空气,造成收集的氧气不纯净。
重点探究
6.为什么要先在试管下方来回移动酒精灯火焰,并用外焰加热?
7.为什么加热开始所产生的气泡不宜收集?
8.为什么要先将导气管从水槽移出再熄灭酒精灯?
先让试管预热,以防局部高温试管爆炸。
外焰加热因为外焰的温度高。
因为是实验装置内有残余的空气
如果先熄灭酒精灯,试管内气体减少,压强减小,水槽中的水就会被吸入热的试管内,使试管炸裂。
重点探究
验证氧气的化学性质
描述木炭在氧气中燃烧的现象:
。
反应文字表达式为:
。
燃烧很旺,发出白光
碳 + 氧气 二氧化碳
点燃
[活动2]
[问题]
1.木炭在氧气中燃烧有何现象?发生了什么反应?
重点探究
2.分析三个制取氧气的反应,它们有什么共同特征?与化合反应有什么不同?
过氧化氢 水 + 氧气
二氧化锰
氯酸钾 氯化钾 + 氧气
二氧化锰
加热
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
特点:“一变多”
分解反应:由一种反应物生成两种或两种以上其他物质的反应。
区别:化合反应的特点是“多变一”;分解反应的特点是“一变多”。
重点探究
任务三:工业制氧气
结合课本P78-79及相关资料,回答问题
[活动]
利用膜分离技术富集空气中的氧气,是近年来出现的新方法。在一定压力下,让空气通过具有富集功能的薄膜,反复进行多级分离,便可得到含氧气90%以上的富氧空气,它在医疗、化工、炼钢和发酵等方面都有广泛的应用。
重点探究
1.分离液态空气法:利用液态空气中各成份的沸点不同,由于液态氮的沸点比液态氧的沸点低,因此氮气首先从液态空气中蒸发出来,剩下的主要就是液态氧。
2.富氧膜分离技术:利用具有富集功能的薄膜,反复进行多级分离,得到富氧空气
工业上有哪些制取氧气的方法?原理是?
[问题]
当堂检测
1.在实验室里加热高锰酸钾制氧气并用排水法收集,下列操作先后顺序正确的是( )
A.固定装置时,先放酒精灯,后固定试管
B.先装入高锰酸钾,后检查装置的气密性
C.加热时,先对准药品集中加热,后移动酒精灯加热
D.实验结束时,先熄灭酒精灯火焰,后将导管移出水面
A
当堂检测
2.下列属于分解反应的是( )
A.蒸发食盐水得食盐
B.分离液态空气得氧气
C.过氧化氢分解制取氧气
D.蜡烛燃烧生成水和二氧化碳
C
当堂检测
3.如图所示是实验室用高锰酸钾制取氧气的实验装置。回答下列问题。
(1)指出仪器的名称:A. ,B. ,C. 。
(2)加热高锰酸钾制取氧气时,试管口要放棉花,是为了 。
(3)加热时试管口应略微向 (填“上”或“下”)倾斜,原因是 。
(4)观察到水槽中导管口气泡 时开始收集氧气,当集气瓶中的水被排出,瓶口有 冒出时,表明集气瓶内氧气已集满,在水下用玻璃片盖好集气瓶,取出,并 (填“倒”或“正”)放在桌面上。氧气能用排水法收集的原因是 。
(5)停止加热时要先把导管移出水面再熄灭酒精灯,
这是为了 。
酒精灯
水槽
试管
防止高锰酸钾粉末进入导管
下
可防止冷凝水倒流引起试管的炸裂
连续均匀冒出
大气泡向外
正
氧气不易溶于水
防止冷水倒吸、炸裂试管
课堂小结
2.分解反应:
一种物质反应生成两种或两种以上物质的反应
分解过氧化氢
加热高锰酸钾
加热氯酸钾
1.制取氧气的方法
实验室制取氧气
工业制取氧气
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
