题型(二) 电化学(含答案)-2024年高考化学二轮复习
文档属性
| 名称 | 题型(二) 电化学(含答案)-2024年高考化学二轮复习 |  | |
| 格式 | DOCX | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-20 20:42:50 | ||
图片预览



文档简介
题型(二) 电化学
命题视角一 新型化学电源
1.图解化学电源工作原理
2.电极反应式的书写
(1)三步法(也适用于电解池)
步骤 示例 (Al|KOH溶液|Ag2O2)
①根据题中信息(如总反应方程式或原理图中元素化合价的升降等)判断还原剂和氧化产物、氧化剂和还原产物 强碱性溶液中:Al被氧化为AlO,Ag2O2被还原为Ag和OH-
②根据电池负极(或电解池阳极)为“还原剂-ne-―→氧化产物”、电池正极(或电解池阴极)为“氧化剂+ne-―→还原产物”初步写出电极反应式 负极:4Al-12e-―→4AlO; 正极:3Ag2O2+12e-―→6Ag+6OH-
③根据电荷守恒、原子守恒及电解质性质,在初步书写的电极反应式两侧补充介质,配平电极反应式。介质常为H2O、H+、OH-等 根据电荷守恒和反应环境呈强碱性进行补项。负极:在左边补充“4OH-”、右边补充“2H2O”,得4Al-12e-+16OH-===4AlO+8H2O。正极:在左边补充“2H2O”、右边补充“2OH-”,得3Ag2O2+12e-+6H2O===6Ag+12OH-
(2)加减法(一般适用于燃料电池或给出电池总反应的电池)
①根据题给信息,将已知的电池总反应写成“氧化剂+还原剂+介质1=还原产物+氧化产物+介质2”的形式,介质常为H2O、H+或OH-等。燃料电池电池总反应往往与燃料燃烧反应相同(注意介质)。
②燃料电池的正极反应式较简单,一般为O2得电子的还原反应,写出该电极反应式,并使反应式中O2的化学计量数与总反应式中O2的化学计量数相等。
③用电池总反应减去简单的电极反应式即得复杂的电极反应式。书写时要满足电荷守恒、质量守恒等。
[典例1] 科学家近年发明了一种新型Zn-CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是( )
A.放电时,负极反应为Zn-2e-+4OH-===[Zn(OH)4]2-
B.放电时,1 mol CO2转化为HCOOH,转移的电子为2 mol
C.充电时,电池总反应为2[Zn(OH)4]2-2Zn+O2↑+4OH-+2H2O
D.充电时,正极溶液中OH-浓度增大
答案 D
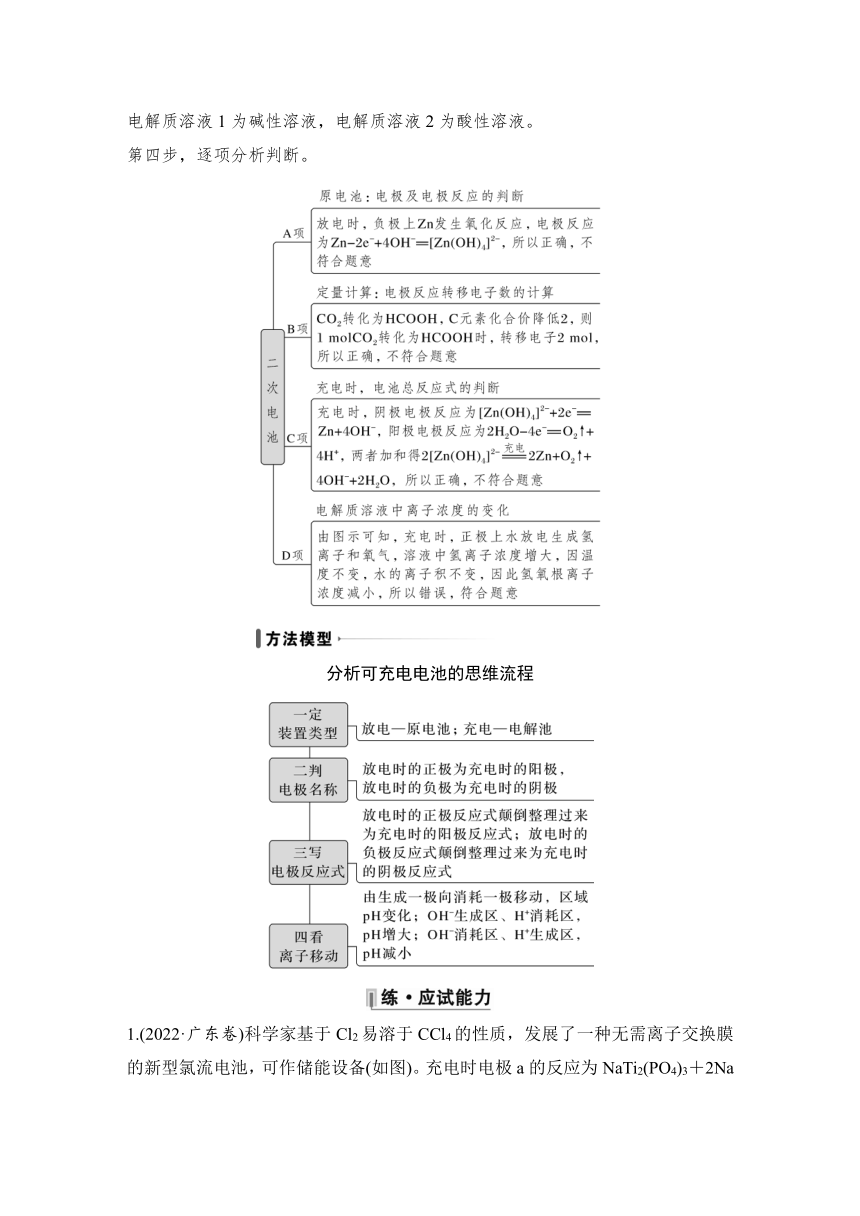
解析 第一步,根据图示判断电化学装置的类型,该装置为二次电池,既可充电又可放电。
第二步,根据粒子变化,判断正、负极和阴、阳极,放电时Zn失电子生成[Zn(OH)4]2-,Zn作负极。充电时在阳极上水失电子生成氧气,阴极上[Zn(OH)4]2-,得电子生成Zn。
第三步,根据电极反应原理确定各电极上发生的反应。负极电极反应为Zn-2e-+4OH-===[Zn(OH)4]2-,正极电极反应为CO2+2H++2e-===HCOOH,同时说明电解质溶液1为碱性溶液,电解质溶液2为酸性溶液。
第四步,逐项分析判断。
分析可充电电池的思维流程
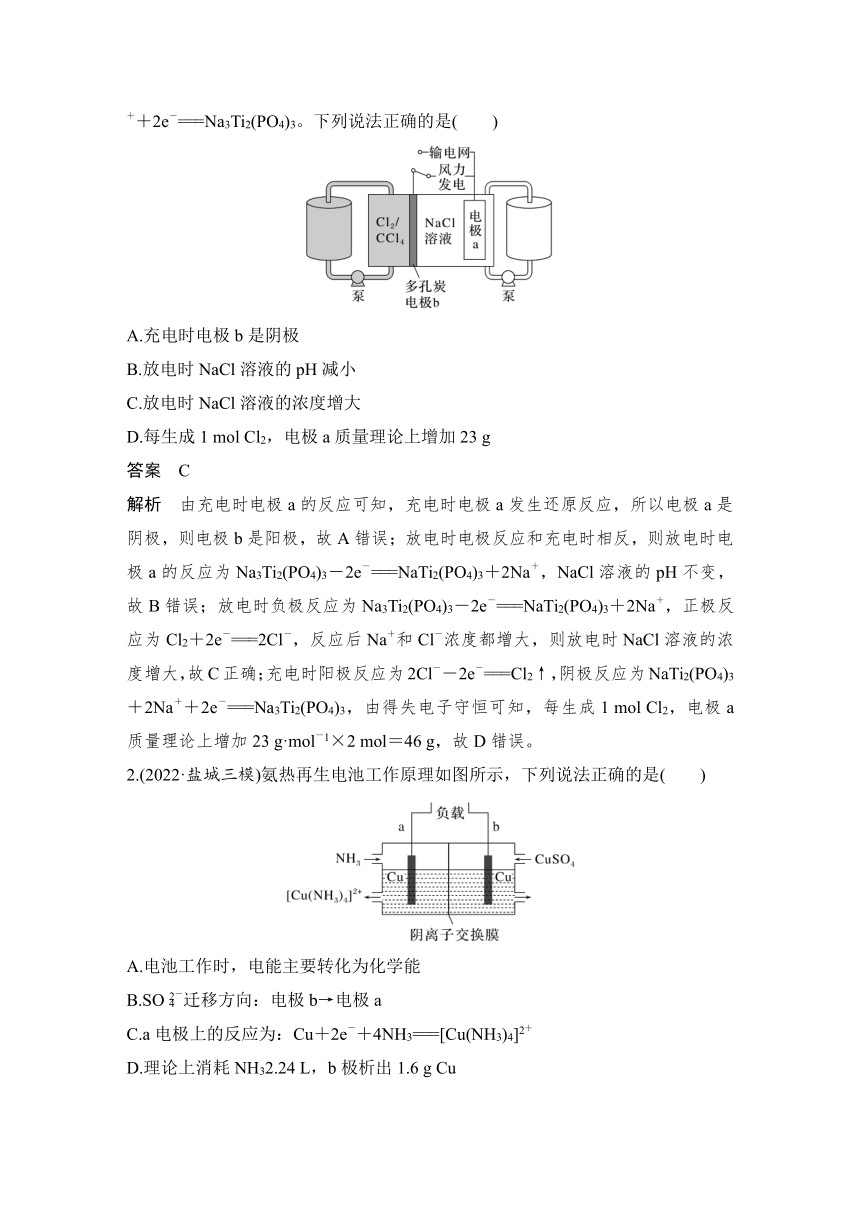
1.(2022·广东卷)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3。下列说法正确的是( )
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 mol Cl2,电极a质量理论上增加23 g
答案 C
解析 由充电时电极a的反应可知,充电时电极a发生还原反应,所以电极a是阴极,则电极b是阳极,故A错误;放电时电极反应和充电时相反,则放电时电极a的反应为Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+,NaCl溶液的pH不变,故B错误;放电时负极反应为Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+,正极反应为Cl2+2e-===2Cl-,反应后Na+和Cl-浓度都增大,则放电时NaCl溶液的浓度增大,故C正确;充电时阳极反应为2Cl--2e-===Cl2↑,阴极反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3,由得失电子守恒可知,每生成1 mol Cl2,电极a质量理论上增加23 g·mol-1×2 mol=46 g,故D错误。
2.(2022·盐城三模)氨热再生电池工作原理如图所示,下列说法正确的是( )
A.电池工作时,电能主要转化为化学能
B.SO迁移方向:电极b→电极a
C.a电极上的反应为:Cu+2e-+4NH3===[Cu(NH3)4]2+
D.理论上消耗NH32.24 L,b极析出1.6 g Cu
答案 B
解析 电极a上Cu失去电子结合NH3生成 [Cu(NH3)4]2+,则电极a为负极,电极b为正极。电池工作时将化学能转化为电能,A错误;原电池工作时,阴离子向负极移动,电极a为负极,电极b为正极,则SO迁移方向为电极b→电极a,B正确;a电极上Cu失去电子结合NH3生成[Cu(NH3)4]2+,电极反应式为Cu-2e-+4NH3===[Cu(NH3)4]2+,C错误;未指明气体处于标况下,D错误。
命题视角二 电解原理的应用
1.图解电解池工作原理
2.电解原理分析模型
以制备KIO3的电解装置为例
(1)提取信息
(2)分析流程
[典例2] (2022·江苏模拟)四甲基氢氧化铵[(CH3)4NOH]常用作光刻显影剂。以四甲基碳酸氢铵[(CH3)4NHCO3]水溶液为原料,电解制备(CH3)4NOH的装置如图所示。下列说法不正确的是( )
A.工作时原料室(CH3)4N+向Ⅱ室迁移
B.Ⅰ室可得到H2和CO2
C.当外电路中有1 mol电子通过时,理论上能生成1 mol (CH3)4NOH
D.电解总反应:4(CH3)4NHCO3+2H2O4(CH3)4NOH+2H2↑+O2↑+4CO2↑
答案 B
解析 电解池中阳离子向阴极运动,(CH3)4N+向Ⅱ室迁移,A正确;Ⅰ室为阳极室,水电离出的氢氧根离子放电发生氧化反应生成氧气,2H2O-4e-===4H++O2↑,HCO向Ⅰ室迁移与生成的氢离子生成水和二氧化碳气体,B错误;阴极室中水电离出的氢离子放电发生还原反应生成氢气,2H2O+2e-===2OH-+H2↑,溶液中氢氧根离子浓度变大,原料室中(CH3)4N+向Ⅱ室迁移生成(CH3)4NOH,(CH3)4N++OH-===(CH3)4NOH,当外电路中有1 mol电子通过时,理论上能生成1 mol (CH3)4NOH,C正确;由B、C分析可知,总反应为(CH3)4NHCO3和H2O反应生成氧气、二氧化碳、氢气、(CH3)4NOH,电解总反应:4(CH3)4NHCO3+2H2O4(CH3)4NOH+2H2↑+O2↑+4CO2↑,D正确。
3.(2022·济南检测)采用电渗析法可以从含NH4H2PO4和(NH4)2HPO4的废水中回收NH3·H2O和H3PO4,电解装置如图所示。下列说法正确的是( )
A.X电极应连电源的正极
B.M口处回收产生的浓氨水
C.隔膜ab为阳离子交换膜,隔膜cd为阴离子交换膜
D.电解一段时间后,产生的NH3·H2O和H3PO4的物质的量相等
答案 C
解析 由图示可知,左侧电极室通入稀氨水,说明左侧电极室的产品为NH3·H2O,则废水中的NH通过隔膜ab进入左侧电极室,发生反应NH+OH-===NH3·H2O,故隔膜ab为阳离子交换膜,X电极的电极反应式为2H2O+2e-===H2↑+2OH-,则X电极为阴极,与电源的负极相连,右侧电极室的产品为H3PO4,废水中的H2PO、HPO经过隔膜cd进入右侧电极室,与H+结合形成H3PO4,故隔膜cd为阴离子交换膜,Y电极为阳极,电极反应式为2H2O-4e-===O2↑+4H+。由以上分析可知,A错误,B错误,C正确;由于NH3·H2O和H3PO4均为弱电解质,产生的物质的量无法计算,D错误。
4.(2022·南京二模)电化学甘油氧化反应是一种具有前景的电化学反应,其反应原理如图所示。电解时,下列说法正确的是( )
A.化学能主要转化为电能
B.b电极附近溶液的pH减小
C.K+通过阳离子交换膜向阳极室移动
D.a电极上的电极反应式:C3H8O3-8e-+11OH-===3HCOO-+8H2O
答案 D
解析 该装置有外接电源,为电解池,是将电能转化为化学能,A错误;b为阴极,氢离子得电子生成氢气,电极反应式为2H++2e-===H2↑,消耗氢离子pH增大,B错误;电解池中阳离子移向阴极,则K+通过阳离子交换膜向阴极室移动,C错误;a电极甘油转化为HCOO-,C元素化合价升高,发生氧化反应,电极反应式为C3H8O3-8e-+11OH-===3HCOO-+8H2O,D正确。
1.科学家设想利用图示装置进行CO2的固定,同时产生电能。该装置工作时,生成的碳附着在电极上。下列说法错误的是( )
A.电极板(Li)作该电池的负极
B.若导线中流过4 mol e-,理论上负极区减少4 mol Li+
C.负极区不适合选用水溶液作电解质溶液
D.采用多孔催化剂电极有利于CO2扩散到电极表面
答案 B
解析 A.由图知,Li为负极,多孔催化剂电极为正极,故A正确;B.导线中流过4 mol e-,负极产生4 mol Li+,同时有4 mol Li+向正极区移动,所以理论上负极区Li+的物质的量不变,故B错误;C.Li能与水反应,负极区不适合选用水溶液作电解质溶液,故C正确;D.多孔结构有利于气体扩散,即有利于CO2扩散到电极表面,故D正确。
2.(2022·邯郸二模)《X—MOL》报道了一种两相无膜锌/吩噻嗪电池,其放电时的工作原理如图所示(PF在水系/非水系电解液界面上来回穿梭,维持电荷守恒)。
已知:CH2Cl2的密度为1.33 g·cm-3,难溶于水。下列说法错误的是( )
A.电池使用时不能倒置
B.充电时,石墨毡上的电极反应式为PTZ-e-===PTZ+
C.放电时,PF由CH2Cl2层移向水层
D.放电时,Zn板每减轻6.5 g,水层增重29 g
答案 D
解析 放电时,Zn失电子,发生氧化反应,故Zn作负极;石墨毡作正极。充电时,Zn电极发生得电子反应,作阴极;石墨毡作阳极。A.水和二氯甲烷的不互溶性和密度差能够将正极与负极分隔开,故不能倒置,故A正确;B.由分析可知,石墨毡作阳极,电极反应式为PTZ-e-===PTZ+,故B正确;C.放电时,阴离子移向负极,故移向水层,故C正确;D.放电时,Zn板每减轻6.5 g,同时水层增重6.5 g,转移电子的物质的量为0.2 mol,有0.2 mol PF移动到水层,故水层增重为0.2 mol×145 g/mol+6.5 g=35.5 g,故D错误。
3.(2022·日照联考)一种利用烃(CxHy)来消除氮氧化物污染的工作原理如图所示,装置中电极均为惰性电极,两侧电解质为同浓度的盐酸。下列说法错误的是( )
A.通入NO2的电极为正极,发生还原反应
B.若使用的烃为C2H6,该电极反应为:C2H6+4H2O-14e-===2CO2+14H+
C.装置中转移0.4 mol电子时,有0.4NA个H+通过质子交换膜
D.装置工作一段时间后,两侧电极室中溶液的pH不变
答案 D
解析 通入NO2的电极上NO2转化为N2,发生还原反应,该电极为正极,A项正确;若使用的烃为C2H6,C2H6转化为CO2,结合电解质溶液显酸性,知该电极反应为:C2H6+4H2O-14e-===2CO2+14H+,B项正确;为平衡电荷,装置中转移0.4 mol电子时,有0.4NA个H+通过质子交换膜,C项正确;结合B项中负极反应和正极反应:2NO2+8e-+8H+===N2+4H2O,知装置工作一段时间后,左室中溶液pH增大,右室中溶液pH减小,D项错误。
4.(2022·广东卷)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中( )
A.阴极发生的反应为Mg-2e-===Mg2+
B.阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
答案 C
解析 根据电解原理可知,电解池中阳极发生失电子的氧化反应,阴极发生得电子的还原反应,该题中以熔融盐为电解液,含Cu、Mg和Si等的铝合金废料为阳极进行电解,通过控制一定的条件,从而可使阳极区Mg和Al发生失电子的氧化反应,分别生成Mg2+和Al3+,Cu和Si不参与反应,阴极区Al3+得电子生成Al单质,从而实现Al的再生。阴极应该发生得电子的还原反应,实际上Mg在阳极失电子生成Mg2+,A错误;Al在阳极上被氧化生成Al3+,B错误;阳极材料中Cu和Si不参与氧化反应,在电解槽底部可形成阳极泥,C正确;因为阳极除了铝参与电子转移,镁也参与了电子转移,且还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,根据转移电子数守恒及元素守恒可知,阳极与阴极的质量变化不相等,D错误。
A卷
1.(2022·扬州一模)我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池,有望为火星探测提供一种潜在电化学能源系统。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na2Na2CO3+C。电池的工作原理如图所示,下列说法正确的是( )
A.放电时,ClO移向电源的正极
B.也可用NaClO4水溶液作为电解液
C.充电时,阳极的电极反应式2CO+C-4e-===3CO2↑
D.充电时,消耗1 mol Na2CO3转移1 mol电子
答案 C
解析 放电时,钠电极是原电池的负极,通入二氧化碳的镍电极是正极,阴离子高氯酸根离子移向负极,A错误;钠易与水反应,所以不能用高氯酸钠水溶液作为电解液,B错误;镍电极为阳极,碳在碳酸根离子作用下失去电子发生氧化反应生成二氧化碳,电极反应式为2CO+C-4e-===3CO2↑,C正确;由电池的总反应可知,充电时,消耗1 mol碳酸钠转移2 mol电子,D错误。
2.(2022·重庆抽测)我国科学家设计的一种甲酸(HCOOH)燃料电池如图所示(半透膜只允许K+、H+通过),下列说法错误的是( )
A.物质A可以是硫酸氢钾
B.左侧电极为电池负极,HCOO-发生氧化反应生成HCO
C.该燃料电池的总反应为2HCOOH+O2+2OH-===2HCO+2H2O
D.右侧每消耗11.2 L O2(标准状况),左侧有1 mol K+通过半透膜移向右侧
答案 D
解析 由图中物质转化知,右侧电解质储罐中发生反应4Fe2++O2+4H+===4Fe3++2H2O,结合电解质储罐中流出K2SO4,知物质A可为KHSO4,A项正确;左侧电极上HCOO-转化为HCO,碳元素由+2价升高为+4价,发生氧化反应,故左侧电极为电池负极,B项正确;根据图示知,该燃料电池总反应为HCOOH和O2在碱性条件下反应,生成KHCO3和H2O,C项正确;右侧每消耗11.2 L O2(标准状况),电路中通过的电子为×4=2 mol,则左侧有2 mol K+通过半透膜移向右侧,D项错误。
3.(2022·全国甲卷)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示[KOH溶液中,Zn2+以Zn(OH)存在]。电池放电时,下列叙述错误的是( )
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
B.Ⅰ区的SO通过隔膜向Ⅱ区迁移
C.MnO2电极反应:MnO2+2e-+4H+===Mn2++2H2O
D.电池总反应:Zn+4OH-+MnO2+4H+===Zn(OH)+Mn2++2H2O
答案 A
解析 根据图示的电池结构和题目所给信息可知,Ⅲ区Zn为电池的负极,电极反应为Zn-2e-+4OH-===Zn(OH),Ⅰ区MnO2为电池的正极,电极反应为MnO2+2e-+4H+===Mn2++2H2O,K+从Ⅲ区通过隔膜向Ⅱ区迁移,A错误;Ⅰ区的SO通过隔膜向Ⅱ区移动,B正确;MnO2电极的电极反应式为MnO2+2e-+4H+===Mn2++2H2O,C正确;电池的总反应为Zn+4OH-+MnO2+4H+===Zn(OH)+Mn2++2H2O,D正确。
4.科学家利用多晶铜高效催化电解CO2制乙烯,原理如图所示。已知:电解前后电解液浓度几乎不变。下列说法错误的是( )
A.铂电极产生的气体是O2和CO2
B.铜电极的电极反应式为2CO2+12HCO+12e-===C2H4+12CO+4H2O
C.通电过程中,溶液中HCO通过阴离子交换膜向左槽移动
D.当电路中通过0.6 mol电子时,理论上能产生标况下C2H4 1.12 L
答案 B
解析 CO2制乙烯,碳的化合价降低,得电子,故多晶铜电极作电解池的阴极;阴极生成的HCO,HCO经阴离子交换膜进入阳极区,因电解前后电解液浓度几乎不变,可判断HCO与水一起失去电子生成O2和CO2。A.据分析,铂电极产生的气体是O2和CO2,A正确;B.铜电极的电极反应式为14CO2+12e-+8H2O===C2H4+12HCO,B错误;C.通电过程中,溶液中HCO朝阳极移动,即通过阴离子交换膜向左槽移动,C正确;D.根据14CO2+12e-+8H2O===C2H4+12HCO,电路中通过0.6 mol电子时理论上能产生0.05 mol C2H4,即标况下1.12 L,D正确。
5.我国科学家最近发明了一种 Zn-PbO2电池,电解质为K2SO4、H2SO4和KOH,通过 a和 b两种离子交换膜将电解质溶液隔开,形成 M、R、N三个电解质溶液区域,结构示意图如下。下列说法正确的是( )
A.b为阳离子交换膜
B.R 区域的电解质为H2SO4
C.放电时,Zn 电极反应为:Zn-2e-+4OH-===Zn(OH)
D.消耗 6.5 g Zn,N 区域电解质溶液减少8.0 g
答案 C
解析 该电池为Zn-PbO2电池,从图中可知,Zn转化为Zn(OH),则M区为KOH,R区为K2SO4,N区为H2SO4。A.正极(b) PbO2+2e-+4H++SO===PbSO4+2H2O,负极(a) Zn-2e-+4OH-===Zn(OH),溶液维持电中性,则a为阳离子交换膜,A错误;B.根据分析,R区为K2SO4,B错误;C.根据分析,放电过程中,Zn 电极反应为:Zn-2e-+4OH-===Zn(OH),C正确;D.消耗6.5 g Zn,电子转移0.2 mol,N区消耗0.4 mol H+,0.1 mol SO,同时有0.1 mol SO移向R区,则相当于减少0.2 mol H2SO4,同时生成0.2 mol H2O,则R区实际减少质量为0.2 mol×98 g/mol-0.2 mol×18 g/mol=16 g,D错误。
6.硫酸工业尾气中的SO2可用Na2SO3溶液吸收,并通过电解方法实现吸收液的循环再生。如图所示,下列有关说法中正确的是( )
A.阳极发生的反应之一为SO+2OH--2e-===SO+2H2O
B.电解一段时间后,阴极室pH升高
C.电解一段时间后,b%D.电解一段时间后,两室生成的Na2SO3与H2SO4的物质的量相等
答案 B
解析 由装置图可知,阳离子移向阴极,Pt(Ⅰ)为阴极,阴离子移向阳极,Pt(Ⅱ)为阳极,电解池中,阳极发生氧化反应,化合价上升,失电子;阴极发生还原反应,化合价下降,得电子;阳极:SO+H2O-2e-===SO+2H+;HSO+H2O-2e-===SO+3H+,阴极:2H++2e-===H2↑;A.酸性介质中不存在氢氧根,A项错误;B.阴极氢离子放电,氢离子浓度减小,pH增大,B项正确;C.阳极可不断产生硫酸根离子和氢离子,b%>a%,C项错误;D.阳极产生1 mol硫酸转移2 mol电子,阴极消耗2 mol电子产生2 mol亚硫酸钠,两者物质的量不相等,D项错误。
7.(2022·南京师大附中模拟)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过电解法由氨气得到氢气,装置如图所示。下列说法不正确的是( )
A.该系统中只存在2种形式的能量转化
B.b为该装置的阴极
C.电解过程中OH-的移动方向为从右往左
D.a极的电极反应式为2NH3+6OH--6e-===N2+6H2O
答案 A
解析 该装置工作时,实现了光能转化为电能,电能转化为化学能,化学能转化为热能等,A错误;电解池中,左侧消耗NH3生成N2,发生氧化反应,a是阳极,b为该装置的阴极,故B正确;电解池中,左侧消耗NH3生成N2,发生氧化反应是阳极,消耗了OH-,右侧水中H+得电子生成H2,发生还原反应,是阴极,电极反应中生成OH-,故OH-从右向左移动,由b极区向a极区迁移,C正确;阳极是NH3失电子发生氧化反应生成N2,a极的电极反应式为2NH3+6OH--6e-===N2+6H2O,D正确。
8.工业上一种制备ClO2的装置如图所示。阴极生成的ClO2会进一步得电子产生瞬间中间体ClO,ClO随即与溶液中的ClO反应又生成ClO2,下列说法正确的是( )
A.a极的电极材料可以是Fe
B.电解一段时间后,阴极室的pH减小
C.阴极生成中间体ClO的过程可表示为ClO+2H++e-===ClO2↑+H2O、ClO2+e-===ClO
D.当电路中转移1 mol电子时,a极生成2.8 L(标准状况)气体X
答案 C
解析 由题干信息:阴极生成的ClO2会进一步得电子产生瞬间中间体ClO,ClO随即与溶液中的ClO反应又生成ClO2可知a极与电源正极相连,作阳极,电极反应为:2H2O-4e-===O2↑+4H+;b极与电源负极相连,作阴极,电极反应为:ClO+2H++e-===ClO2↑+H2O、ClO2+e-===ClO。A.由分析可知,a为阳极,若a极的电极材料为Fe,则电极反应为Fe-2e-===Fe2+,中间是质子交换膜,则电解池工作一段时间后,由于a极区无质子转移到b极区而无法工作,A错误;B.由分析可知,电解一段时间后,阴极室不断消耗H+,且有水生成,故溶液的pH增大,B错误;C.由分析可知,C正确;D.由分析可知,a极发生的电极反应为2H2O-4e-===O2↑+4H+,故当电路中转移1 mol电子时,生成气体X在标准状况下的体积为 mol×22.4 mol/L=5.6 L,D错误。
B卷
9.(2022·如皋中学三模)羟胺(NH2OH)常用于有机合成。一种电化学法制取盐酸羟胺(NH3OHCl)的装置原理如下图所示,已知铁可作NO反应的催化剂。下列说法正确的是( )
A.放电时Pt电极有Cl2生成
B.放电时的正极反应式为NO+3e-+4H+===NH3OH+
C.放电时,电路中每转移1 mol e-,负极区将增加1 mol H+
D.将质子交换膜改成阴离子交换膜,放电时的电极反应将发生变化
答案 B
解析 图示放电过程中,含铁电极表面NO得电子,发生还原反应生成NH3OH+,作正极,Pt电极表面H2失电子,发生氧化反应生成H+,作负极,H+通过质子交换膜从负极移向正极。根据分析,放电时Pt电极表面H2失电子,发生氧化反应生成H+,没有Cl2生成,A错误;放电时的正极上NO得电子,发生还原反应生成NH3OH+,电极反应式为NO+3e-+4H+===NH3OH+,B正确;原电池工作时,阳离子从负极移向正极,根据电荷守恒,电路中每转移1 mol e-,正极区将增加1 mol H+,C错误;原电池中阳离子向正极迁移,阴离子向负极迁移,所以若将质子交换膜改成阴离子交换膜,原来H+向含铁电极迁移,变成Cl-通过阴离子交换膜向Pt电极迁移,但放电时的电极反应不变,D错误。
10.Ca-LiFePO4可充电电池的工作原理示意图如图,其中锂离子交换膜只允许Li+通过,电池反应为:xCa+2Li1-xFePO4+2xLi+===xCa2++2LiFePO4。下列说法正确的是( )
A.LiPF6/LiAsF6电解质与Li2SO4溶液可互换
B.充电时,当转移0.1 mol电子时,左室中电解质的质量减轻1.3 g
C.充电时,阴极反应为:Li1-xFePO4+xLi++xe-===LiFePO4
D.放电时,Li1-xFePO4/LiFePO4电极发生Li+脱嵌,充电时发生Li+嵌入
答案 B
解析 A.Ca是活泼金属,易与水发生剧烈反应,所以LiPF6/LiAsF6为非水电解质,而Li2SO4溶液中有水,不可互换,A项错误;B.充电时每转移0.1 mol电子,左室中就有0.05 mol Ca2+转化为Ca,同时有0.1 mol Li+迁移到左室,所以左室中电解质的质量减轻0.05 mol×40 g/mol-0.1 mol×7 g/mol=1.3 g,B项正确;C.充电时,钙电极为阴极,电极反应为Ca2++2e-===Ca,C项错误;D.充电时为电解池,电解池中阳离子流向阴极,Li1-xFePO4/LiFePO4为阳极,所以Li1-xFePO4/LiFePO4电极发生Li+脱嵌然后流向阴极,放电时为原电池,原电池中阳离子流向正极,所以放电时发生Li+嵌入,D项错误。
11.(2022·南通模拟)锌电池具有成本低、安全性强、可循环使用等优点。一种新型锌电池的工作原理如图所示(凝胶中允许离子生成或迁移)。下列说法正确的是( )
A.充电过程中,a电极接外接电源的负极
B.充电过程中,b电极反应为:Zn2++2e-===Zn
C.放电过程中,H2SO4溶液中SO 向a电极迁移
D.放电过程中,转移 0.4 mol e-时,a电极消耗 0.8 mol H+
答案 D
解析 由图示可知,放电过程中b为负极,失去电子发生氧化反应;a为正极,得到电子发生还原反应;充电过程中 b为阴极,外接电源负极,a为阳极,外接电源正极,A错误;充电过程中b电极得到电子发生还原反应,由于在碱性环境中Zn以Zn(OH)形式存在,则充电过程中,b电极反应为:Zn(OH)+2e-===Zn+4OH-,B错误;放电过程中,a为正极,b极为负极,溶液中阳离子移向正极,阴离子移向负极,所以放电过程中,SO向b极迁移,C错误;放电过程中b电极为负极,其电极反应式为Zn+4OH--2e-===Zn(OH);a极为正极,则其电极反应式为MnO2+4H++2e-===Mn2++2H2O。所以放电过程中,转移0.4 mol e-时,a电极消耗0.8 mol H+,D正确。
12.(2022·江苏二模)H2S气体有高毒性和强腐蚀性,电化学法处理H2S的工作原理如图所示。下列说法正确的是( )
A.电极a连接电源负极,电解时H+由a极室移向b极室
B.反应池中发生反应的离子方程式:2VO+H2S+2H+===2VO2++S↓+2H2O
C.b极反应式:VO2++H2O+e-===VO+2H+
D.电解过程中每转移2 mol电子,理论上可生成22.4 L H2
答案 B
解析 电极a连接电源负极,电解时H+由阳极向阴极移动,故由b极室移向a极室,A错误;根据b极进入的和产生的物质,反应池中发生反应的离子方程式:2VO+H2S+2H+===2VO2++S↓+2H2O,B正确;b极为阳极,发生氧化反应,电极方程式:VO2++H2O-e-===VO+2H+,C错误;没有指明标准状况,氢气体积不可计算,D错误。
13.(2022·南通模拟)非水性嵌入铝电池是一种二次电池,该电池放电过程的示意图如图所示(R+表示某有机阳离子)。充电时阳极的电极反应为Cn+AlCl-e-===CnAlCl4。下列说法正确的是( )
A.放电时,电极a的电极反应为Al+AlCl-3e-+3Cl-===Al2Cl
B.放电时,电解质中AlCl的物质的量基本不变
C.充电时,电极b应与外接电源负极相连
D.充电时,电极a和电极b的质量均增加
答案 D
解析 放电时,电极a为Al,为负极,电极反应为Al+7AlCl-3e-===4Al2Cl,并且非水性体系中不存在氯离子,所以电极反应错误,A错误;放电时,负极反应为Al+7AlCl-3e-===4Al2Cl,正极反应为CnAlCl4+e-===Cn+AlCl,总反应为3CnAlCl4+Al+4AlCl===4Al2Cl+3Cn,电解质溶液中AlCl的物质的量减小,B错误;充电时,电极b为阳极,应与外接电源的正极相连,C错误;充电时,电极b为阳极,电极反应为Cn+AlCl-e-===CnAlCl4,a为阴极,电极反应为4Al2Cl+3e-===Al+7AlCl,电极a和电极b的质量均增加,D正确。
14.(2022·苏州模拟)锌元素对婴儿及青少年的智力和身体发育有重要的作用,被称为生命火花。利用电解NaBr溶液间接将葡萄糖[CH2OH(CHOH)4CHO]氧化为葡萄糖酸[CH2OH(CHOH)4COOH],进而制取葡萄糖酸锌,装置如图所示,下列说法不正确的是( )
A.石墨连接电源负极,发生还原反应
B.电解过程中每生成1 mol葡萄糖酸,理论上可生成标准状况下22.4 L H2
C.电解过程中硫酸钠溶液浓度保持不变
D.生成葡萄糖酸的反应式为:
CH2OH(CHOH)4CHO-2e-+H2O===CH2OH(CHOH)4COOH+2H+
答案 D
解析 由图可知,钛网为电解池的阳极,溴离子在阳极失去电子生成溴,电极反应式为2Br--2e-===Br2,溴将葡萄糖氧化为葡萄糖酸,反应的方程式为Br2+CH2OH(CHOH)4CHO+H2O===CH2OH(CHOH)4COOH+2HBr,石墨为阴极,水在阴极得到电子发生还原反应生成氢气,电极反应式为2H2O+2e-===H2↑+2OH-,氢离子通过质子交换膜由左侧移向右侧,与右侧生成的氢氧根离子反应生成水。由分析可知,石墨为阴极与直流电源负极相连,水在阴极得到电子发生还原反应生成氢气,A正确;由分析可得如下关系:CH2OH(CHOH)4COOH~H2,则电解过程中每生成1 mol葡萄糖酸,理论上可生成标准状况下22.4 L氢气,B正确;由分析可知,电解过程中,氢离子通过质子交换膜由左侧移向右侧,与右侧生成的氢氧根离子反应生成水,则右侧硫酸钠的物质的量、溶液的体积不变,硫酸钠溶液的浓度不变,C正确;由分析可知,溴将葡萄糖氧化为葡萄糖酸,反应方程式为Br2+CH2OH(CHOH)4CHO+H2O===CH2OH(CHOH)4COOH+2HBr,D错误。
15.(2022·唐山三模)2019年我国自主研发的首个31.25 kW铁-铬液流电池“容和一号”成功下线,该电堆是目前全球最大功率的铁-铬液流电池电堆。该电池总反应为:Fe3++Cr2+Fe2++Cr3+。某种K1、K2开关情况下,工作原理如图所示,其中a电极上涂有固体氢化铋(BiHx)。下列说法错误的是( )
A.电解质中除包含上述离子外,可选用盐酸环境
B.闭合K2时,与b电极连接的是电源的正极
C.放电时,负极反应式为BiHx-xe-===Bi+xH+
D.充电时,BiHx只起导电作用
答案 D
解析 由图可知,闭合K1时,该装置为原电池,电极a为负极,氢化铋在负极失去电子发生氧化反应生成铋和氢离子,铋和氢离子与溶液中的亚铬离子反应生成铬离子和氢化铋,电极b为正极,铁离子得到电子发生还原反应生成亚铁离子;闭合K2时,该装置为电解池,与直流电源负极相连的电极a为阴极,铋和氢离子在阴极得到电子发生还原反应生成氢化铋,氢化铋与溶液中的铬离子反应生成亚铬离子、铋和氢离子,与正极相连的电极b为阳极,亚铁离子失去电子发生氧化反应生成铁离子。A.由题意可知,铁-铬液流电池的电解质溶液可以为氯化铁、氯化亚铬和盐酸,其中盐酸起提供氢离子的作用,故A正确;B.由分析可知,闭合K2时,该装置为电解池,与正极相连的电极b为阳极,故B正确;C.由分析可知,放电时,电极a为负极,氢化铋在负极失去电子发生氧化反应生成铋和氢离子,电极反应式为BiHx-xe-===Bi+xH+,故C正确;D.由分析可知,充电时,电极a为阴极,铋和氢离子在阴极得到电子发生还原反应生成氢化铋,氢化铋与溶液中的铬离子反应生成亚铬离子、铋和氢离子,所以氢化铋起导电和还原剂的作用,故D错误。
16.(2022·溧阳二模)为适应可再生能源的波动性和间歇性,我国科学家设计了一种电化学装置,其原理如下图所示。当闭合K1和K3、打开K2时,装置处于蓄电状态;当打开K1和K3、闭合K2时,装置处于放电状态。放电状态时,双极膜中间层中的H2O解离为H+和OH-并分别向两侧迁移。下列有关该电化学装置工作时的说法不正确的是( )
A.蓄电时,碳锰电极为阳极
B.蓄电时,图中右侧电解池发生的总反应为2ZnO2Zn+O2↑
C.放电时,每消耗1 mol MnO2,理论上有2 mol H+由双极膜向碳锰电极迁移
D.理论上,该电化学装置运行过程中需要不断补充H2SO4和KOH溶液
答案 D
解析 当闭合K1和K3、打开K2时,装置处于蓄电状态,即为电解池,H+得电子生成H2,H元素化合价降低,则为阴极,Mn2+失电子生成MnO2,碳锰电极为阳极,ZnO得电子生成Zn,则锌电极为阴极,A正确;蓄电时,右侧电解池中ZnO得电子生成Zn,电极反应式为ZnO+2e-+H2O===Zn+2OH-,OH-失电子生成O2,电极反应式为4OH--4e-===O2↑+2H2O,发生的总反应为2ZnO2Zn+O2↑,B正确;放电时,碳锰电极为正极,电极反应式为MnO2+2e-+4H+===Mn2++2H2O,每消耗1 mol MnO2,需要消耗4 mol H+,但碳锰电极只生成2 mol正电荷,剩余正电荷需要从双极膜间解离出是氢离子转移至左侧,因此理论上有2 mol H+由双极膜向碳锰电极迁移,C正确;该电化学装置运行过程中H+得电子生成H2,但实际过程为消耗了溶剂水,氢离子浓度增大,OH-失电子生成O2,但实际也消耗了溶剂水,氢氧根离子浓度同样增大,则不需要不断补充H2SO4和KOH溶液,D错误。
命题视角一 新型化学电源
1.图解化学电源工作原理
2.电极反应式的书写
(1)三步法(也适用于电解池)
步骤 示例 (Al|KOH溶液|Ag2O2)
①根据题中信息(如总反应方程式或原理图中元素化合价的升降等)判断还原剂和氧化产物、氧化剂和还原产物 强碱性溶液中:Al被氧化为AlO,Ag2O2被还原为Ag和OH-
②根据电池负极(或电解池阳极)为“还原剂-ne-―→氧化产物”、电池正极(或电解池阴极)为“氧化剂+ne-―→还原产物”初步写出电极反应式 负极:4Al-12e-―→4AlO; 正极:3Ag2O2+12e-―→6Ag+6OH-
③根据电荷守恒、原子守恒及电解质性质,在初步书写的电极反应式两侧补充介质,配平电极反应式。介质常为H2O、H+、OH-等 根据电荷守恒和反应环境呈强碱性进行补项。负极:在左边补充“4OH-”、右边补充“2H2O”,得4Al-12e-+16OH-===4AlO+8H2O。正极:在左边补充“2H2O”、右边补充“2OH-”,得3Ag2O2+12e-+6H2O===6Ag+12OH-
(2)加减法(一般适用于燃料电池或给出电池总反应的电池)
①根据题给信息,将已知的电池总反应写成“氧化剂+还原剂+介质1=还原产物+氧化产物+介质2”的形式,介质常为H2O、H+或OH-等。燃料电池电池总反应往往与燃料燃烧反应相同(注意介质)。
②燃料电池的正极反应式较简单,一般为O2得电子的还原反应,写出该电极反应式,并使反应式中O2的化学计量数与总反应式中O2的化学计量数相等。
③用电池总反应减去简单的电极反应式即得复杂的电极反应式。书写时要满足电荷守恒、质量守恒等。
[典例1] 科学家近年发明了一种新型Zn-CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是( )
A.放电时,负极反应为Zn-2e-+4OH-===[Zn(OH)4]2-
B.放电时,1 mol CO2转化为HCOOH,转移的电子为2 mol
C.充电时,电池总反应为2[Zn(OH)4]2-2Zn+O2↑+4OH-+2H2O
D.充电时,正极溶液中OH-浓度增大
答案 D
解析 第一步,根据图示判断电化学装置的类型,该装置为二次电池,既可充电又可放电。
第二步,根据粒子变化,判断正、负极和阴、阳极,放电时Zn失电子生成[Zn(OH)4]2-,Zn作负极。充电时在阳极上水失电子生成氧气,阴极上[Zn(OH)4]2-,得电子生成Zn。
第三步,根据电极反应原理确定各电极上发生的反应。负极电极反应为Zn-2e-+4OH-===[Zn(OH)4]2-,正极电极反应为CO2+2H++2e-===HCOOH,同时说明电解质溶液1为碱性溶液,电解质溶液2为酸性溶液。
第四步,逐项分析判断。
分析可充电电池的思维流程
1.(2022·广东卷)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3。下列说法正确的是( )
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 mol Cl2,电极a质量理论上增加23 g
答案 C
解析 由充电时电极a的反应可知,充电时电极a发生还原反应,所以电极a是阴极,则电极b是阳极,故A错误;放电时电极反应和充电时相反,则放电时电极a的反应为Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+,NaCl溶液的pH不变,故B错误;放电时负极反应为Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+,正极反应为Cl2+2e-===2Cl-,反应后Na+和Cl-浓度都增大,则放电时NaCl溶液的浓度增大,故C正确;充电时阳极反应为2Cl--2e-===Cl2↑,阴极反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3,由得失电子守恒可知,每生成1 mol Cl2,电极a质量理论上增加23 g·mol-1×2 mol=46 g,故D错误。
2.(2022·盐城三模)氨热再生电池工作原理如图所示,下列说法正确的是( )
A.电池工作时,电能主要转化为化学能
B.SO迁移方向:电极b→电极a
C.a电极上的反应为:Cu+2e-+4NH3===[Cu(NH3)4]2+
D.理论上消耗NH32.24 L,b极析出1.6 g Cu
答案 B
解析 电极a上Cu失去电子结合NH3生成 [Cu(NH3)4]2+,则电极a为负极,电极b为正极。电池工作时将化学能转化为电能,A错误;原电池工作时,阴离子向负极移动,电极a为负极,电极b为正极,则SO迁移方向为电极b→电极a,B正确;a电极上Cu失去电子结合NH3生成[Cu(NH3)4]2+,电极反应式为Cu-2e-+4NH3===[Cu(NH3)4]2+,C错误;未指明气体处于标况下,D错误。
命题视角二 电解原理的应用
1.图解电解池工作原理
2.电解原理分析模型
以制备KIO3的电解装置为例
(1)提取信息
(2)分析流程
[典例2] (2022·江苏模拟)四甲基氢氧化铵[(CH3)4NOH]常用作光刻显影剂。以四甲基碳酸氢铵[(CH3)4NHCO3]水溶液为原料,电解制备(CH3)4NOH的装置如图所示。下列说法不正确的是( )
A.工作时原料室(CH3)4N+向Ⅱ室迁移
B.Ⅰ室可得到H2和CO2
C.当外电路中有1 mol电子通过时,理论上能生成1 mol (CH3)4NOH
D.电解总反应:4(CH3)4NHCO3+2H2O4(CH3)4NOH+2H2↑+O2↑+4CO2↑
答案 B
解析 电解池中阳离子向阴极运动,(CH3)4N+向Ⅱ室迁移,A正确;Ⅰ室为阳极室,水电离出的氢氧根离子放电发生氧化反应生成氧气,2H2O-4e-===4H++O2↑,HCO向Ⅰ室迁移与生成的氢离子生成水和二氧化碳气体,B错误;阴极室中水电离出的氢离子放电发生还原反应生成氢气,2H2O+2e-===2OH-+H2↑,溶液中氢氧根离子浓度变大,原料室中(CH3)4N+向Ⅱ室迁移生成(CH3)4NOH,(CH3)4N++OH-===(CH3)4NOH,当外电路中有1 mol电子通过时,理论上能生成1 mol (CH3)4NOH,C正确;由B、C分析可知,总反应为(CH3)4NHCO3和H2O反应生成氧气、二氧化碳、氢气、(CH3)4NOH,电解总反应:4(CH3)4NHCO3+2H2O4(CH3)4NOH+2H2↑+O2↑+4CO2↑,D正确。
3.(2022·济南检测)采用电渗析法可以从含NH4H2PO4和(NH4)2HPO4的废水中回收NH3·H2O和H3PO4,电解装置如图所示。下列说法正确的是( )
A.X电极应连电源的正极
B.M口处回收产生的浓氨水
C.隔膜ab为阳离子交换膜,隔膜cd为阴离子交换膜
D.电解一段时间后,产生的NH3·H2O和H3PO4的物质的量相等
答案 C
解析 由图示可知,左侧电极室通入稀氨水,说明左侧电极室的产品为NH3·H2O,则废水中的NH通过隔膜ab进入左侧电极室,发生反应NH+OH-===NH3·H2O,故隔膜ab为阳离子交换膜,X电极的电极反应式为2H2O+2e-===H2↑+2OH-,则X电极为阴极,与电源的负极相连,右侧电极室的产品为H3PO4,废水中的H2PO、HPO经过隔膜cd进入右侧电极室,与H+结合形成H3PO4,故隔膜cd为阴离子交换膜,Y电极为阳极,电极反应式为2H2O-4e-===O2↑+4H+。由以上分析可知,A错误,B错误,C正确;由于NH3·H2O和H3PO4均为弱电解质,产生的物质的量无法计算,D错误。
4.(2022·南京二模)电化学甘油氧化反应是一种具有前景的电化学反应,其反应原理如图所示。电解时,下列说法正确的是( )
A.化学能主要转化为电能
B.b电极附近溶液的pH减小
C.K+通过阳离子交换膜向阳极室移动
D.a电极上的电极反应式:C3H8O3-8e-+11OH-===3HCOO-+8H2O
答案 D
解析 该装置有外接电源,为电解池,是将电能转化为化学能,A错误;b为阴极,氢离子得电子生成氢气,电极反应式为2H++2e-===H2↑,消耗氢离子pH增大,B错误;电解池中阳离子移向阴极,则K+通过阳离子交换膜向阴极室移动,C错误;a电极甘油转化为HCOO-,C元素化合价升高,发生氧化反应,电极反应式为C3H8O3-8e-+11OH-===3HCOO-+8H2O,D正确。
1.科学家设想利用图示装置进行CO2的固定,同时产生电能。该装置工作时,生成的碳附着在电极上。下列说法错误的是( )
A.电极板(Li)作该电池的负极
B.若导线中流过4 mol e-,理论上负极区减少4 mol Li+
C.负极区不适合选用水溶液作电解质溶液
D.采用多孔催化剂电极有利于CO2扩散到电极表面
答案 B
解析 A.由图知,Li为负极,多孔催化剂电极为正极,故A正确;B.导线中流过4 mol e-,负极产生4 mol Li+,同时有4 mol Li+向正极区移动,所以理论上负极区Li+的物质的量不变,故B错误;C.Li能与水反应,负极区不适合选用水溶液作电解质溶液,故C正确;D.多孔结构有利于气体扩散,即有利于CO2扩散到电极表面,故D正确。
2.(2022·邯郸二模)《X—MOL》报道了一种两相无膜锌/吩噻嗪电池,其放电时的工作原理如图所示(PF在水系/非水系电解液界面上来回穿梭,维持电荷守恒)。
已知:CH2Cl2的密度为1.33 g·cm-3,难溶于水。下列说法错误的是( )
A.电池使用时不能倒置
B.充电时,石墨毡上的电极反应式为PTZ-e-===PTZ+
C.放电时,PF由CH2Cl2层移向水层
D.放电时,Zn板每减轻6.5 g,水层增重29 g
答案 D
解析 放电时,Zn失电子,发生氧化反应,故Zn作负极;石墨毡作正极。充电时,Zn电极发生得电子反应,作阴极;石墨毡作阳极。A.水和二氯甲烷的不互溶性和密度差能够将正极与负极分隔开,故不能倒置,故A正确;B.由分析可知,石墨毡作阳极,电极反应式为PTZ-e-===PTZ+,故B正确;C.放电时,阴离子移向负极,故移向水层,故C正确;D.放电时,Zn板每减轻6.5 g,同时水层增重6.5 g,转移电子的物质的量为0.2 mol,有0.2 mol PF移动到水层,故水层增重为0.2 mol×145 g/mol+6.5 g=35.5 g,故D错误。
3.(2022·日照联考)一种利用烃(CxHy)来消除氮氧化物污染的工作原理如图所示,装置中电极均为惰性电极,两侧电解质为同浓度的盐酸。下列说法错误的是( )
A.通入NO2的电极为正极,发生还原反应
B.若使用的烃为C2H6,该电极反应为:C2H6+4H2O-14e-===2CO2+14H+
C.装置中转移0.4 mol电子时,有0.4NA个H+通过质子交换膜
D.装置工作一段时间后,两侧电极室中溶液的pH不变
答案 D
解析 通入NO2的电极上NO2转化为N2,发生还原反应,该电极为正极,A项正确;若使用的烃为C2H6,C2H6转化为CO2,结合电解质溶液显酸性,知该电极反应为:C2H6+4H2O-14e-===2CO2+14H+,B项正确;为平衡电荷,装置中转移0.4 mol电子时,有0.4NA个H+通过质子交换膜,C项正确;结合B项中负极反应和正极反应:2NO2+8e-+8H+===N2+4H2O,知装置工作一段时间后,左室中溶液pH增大,右室中溶液pH减小,D项错误。
4.(2022·广东卷)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中( )
A.阴极发生的反应为Mg-2e-===Mg2+
B.阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
答案 C
解析 根据电解原理可知,电解池中阳极发生失电子的氧化反应,阴极发生得电子的还原反应,该题中以熔融盐为电解液,含Cu、Mg和Si等的铝合金废料为阳极进行电解,通过控制一定的条件,从而可使阳极区Mg和Al发生失电子的氧化反应,分别生成Mg2+和Al3+,Cu和Si不参与反应,阴极区Al3+得电子生成Al单质,从而实现Al的再生。阴极应该发生得电子的还原反应,实际上Mg在阳极失电子生成Mg2+,A错误;Al在阳极上被氧化生成Al3+,B错误;阳极材料中Cu和Si不参与氧化反应,在电解槽底部可形成阳极泥,C正确;因为阳极除了铝参与电子转移,镁也参与了电子转移,且还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,根据转移电子数守恒及元素守恒可知,阳极与阴极的质量变化不相等,D错误。
A卷
1.(2022·扬州一模)我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池,有望为火星探测提供一种潜在电化学能源系统。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na2Na2CO3+C。电池的工作原理如图所示,下列说法正确的是( )
A.放电时,ClO移向电源的正极
B.也可用NaClO4水溶液作为电解液
C.充电时,阳极的电极反应式2CO+C-4e-===3CO2↑
D.充电时,消耗1 mol Na2CO3转移1 mol电子
答案 C
解析 放电时,钠电极是原电池的负极,通入二氧化碳的镍电极是正极,阴离子高氯酸根离子移向负极,A错误;钠易与水反应,所以不能用高氯酸钠水溶液作为电解液,B错误;镍电极为阳极,碳在碳酸根离子作用下失去电子发生氧化反应生成二氧化碳,电极反应式为2CO+C-4e-===3CO2↑,C正确;由电池的总反应可知,充电时,消耗1 mol碳酸钠转移2 mol电子,D错误。
2.(2022·重庆抽测)我国科学家设计的一种甲酸(HCOOH)燃料电池如图所示(半透膜只允许K+、H+通过),下列说法错误的是( )
A.物质A可以是硫酸氢钾
B.左侧电极为电池负极,HCOO-发生氧化反应生成HCO
C.该燃料电池的总反应为2HCOOH+O2+2OH-===2HCO+2H2O
D.右侧每消耗11.2 L O2(标准状况),左侧有1 mol K+通过半透膜移向右侧
答案 D
解析 由图中物质转化知,右侧电解质储罐中发生反应4Fe2++O2+4H+===4Fe3++2H2O,结合电解质储罐中流出K2SO4,知物质A可为KHSO4,A项正确;左侧电极上HCOO-转化为HCO,碳元素由+2价升高为+4价,发生氧化反应,故左侧电极为电池负极,B项正确;根据图示知,该燃料电池总反应为HCOOH和O2在碱性条件下反应,生成KHCO3和H2O,C项正确;右侧每消耗11.2 L O2(标准状况),电路中通过的电子为×4=2 mol,则左侧有2 mol K+通过半透膜移向右侧,D项错误。
3.(2022·全国甲卷)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示[KOH溶液中,Zn2+以Zn(OH)存在]。电池放电时,下列叙述错误的是( )
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
B.Ⅰ区的SO通过隔膜向Ⅱ区迁移
C.MnO2电极反应:MnO2+2e-+4H+===Mn2++2H2O
D.电池总反应:Zn+4OH-+MnO2+4H+===Zn(OH)+Mn2++2H2O
答案 A
解析 根据图示的电池结构和题目所给信息可知,Ⅲ区Zn为电池的负极,电极反应为Zn-2e-+4OH-===Zn(OH),Ⅰ区MnO2为电池的正极,电极反应为MnO2+2e-+4H+===Mn2++2H2O,K+从Ⅲ区通过隔膜向Ⅱ区迁移,A错误;Ⅰ区的SO通过隔膜向Ⅱ区移动,B正确;MnO2电极的电极反应式为MnO2+2e-+4H+===Mn2++2H2O,C正确;电池的总反应为Zn+4OH-+MnO2+4H+===Zn(OH)+Mn2++2H2O,D正确。
4.科学家利用多晶铜高效催化电解CO2制乙烯,原理如图所示。已知:电解前后电解液浓度几乎不变。下列说法错误的是( )
A.铂电极产生的气体是O2和CO2
B.铜电极的电极反应式为2CO2+12HCO+12e-===C2H4+12CO+4H2O
C.通电过程中,溶液中HCO通过阴离子交换膜向左槽移动
D.当电路中通过0.6 mol电子时,理论上能产生标况下C2H4 1.12 L
答案 B
解析 CO2制乙烯,碳的化合价降低,得电子,故多晶铜电极作电解池的阴极;阴极生成的HCO,HCO经阴离子交换膜进入阳极区,因电解前后电解液浓度几乎不变,可判断HCO与水一起失去电子生成O2和CO2。A.据分析,铂电极产生的气体是O2和CO2,A正确;B.铜电极的电极反应式为14CO2+12e-+8H2O===C2H4+12HCO,B错误;C.通电过程中,溶液中HCO朝阳极移动,即通过阴离子交换膜向左槽移动,C正确;D.根据14CO2+12e-+8H2O===C2H4+12HCO,电路中通过0.6 mol电子时理论上能产生0.05 mol C2H4,即标况下1.12 L,D正确。
5.我国科学家最近发明了一种 Zn-PbO2电池,电解质为K2SO4、H2SO4和KOH,通过 a和 b两种离子交换膜将电解质溶液隔开,形成 M、R、N三个电解质溶液区域,结构示意图如下。下列说法正确的是( )
A.b为阳离子交换膜
B.R 区域的电解质为H2SO4
C.放电时,Zn 电极反应为:Zn-2e-+4OH-===Zn(OH)
D.消耗 6.5 g Zn,N 区域电解质溶液减少8.0 g
答案 C
解析 该电池为Zn-PbO2电池,从图中可知,Zn转化为Zn(OH),则M区为KOH,R区为K2SO4,N区为H2SO4。A.正极(b) PbO2+2e-+4H++SO===PbSO4+2H2O,负极(a) Zn-2e-+4OH-===Zn(OH),溶液维持电中性,则a为阳离子交换膜,A错误;B.根据分析,R区为K2SO4,B错误;C.根据分析,放电过程中,Zn 电极反应为:Zn-2e-+4OH-===Zn(OH),C正确;D.消耗6.5 g Zn,电子转移0.2 mol,N区消耗0.4 mol H+,0.1 mol SO,同时有0.1 mol SO移向R区,则相当于减少0.2 mol H2SO4,同时生成0.2 mol H2O,则R区实际减少质量为0.2 mol×98 g/mol-0.2 mol×18 g/mol=16 g,D错误。
6.硫酸工业尾气中的SO2可用Na2SO3溶液吸收,并通过电解方法实现吸收液的循环再生。如图所示,下列有关说法中正确的是( )
A.阳极发生的反应之一为SO+2OH--2e-===SO+2H2O
B.电解一段时间后,阴极室pH升高
C.电解一段时间后,b%
答案 B
解析 由装置图可知,阳离子移向阴极,Pt(Ⅰ)为阴极,阴离子移向阳极,Pt(Ⅱ)为阳极,电解池中,阳极发生氧化反应,化合价上升,失电子;阴极发生还原反应,化合价下降,得电子;阳极:SO+H2O-2e-===SO+2H+;HSO+H2O-2e-===SO+3H+,阴极:2H++2e-===H2↑;A.酸性介质中不存在氢氧根,A项错误;B.阴极氢离子放电,氢离子浓度减小,pH增大,B项正确;C.阳极可不断产生硫酸根离子和氢离子,b%>a%,C项错误;D.阳极产生1 mol硫酸转移2 mol电子,阴极消耗2 mol电子产生2 mol亚硫酸钠,两者物质的量不相等,D项错误。
7.(2022·南京师大附中模拟)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过电解法由氨气得到氢气,装置如图所示。下列说法不正确的是( )
A.该系统中只存在2种形式的能量转化
B.b为该装置的阴极
C.电解过程中OH-的移动方向为从右往左
D.a极的电极反应式为2NH3+6OH--6e-===N2+6H2O
答案 A
解析 该装置工作时,实现了光能转化为电能,电能转化为化学能,化学能转化为热能等,A错误;电解池中,左侧消耗NH3生成N2,发生氧化反应,a是阳极,b为该装置的阴极,故B正确;电解池中,左侧消耗NH3生成N2,发生氧化反应是阳极,消耗了OH-,右侧水中H+得电子生成H2,发生还原反应,是阴极,电极反应中生成OH-,故OH-从右向左移动,由b极区向a极区迁移,C正确;阳极是NH3失电子发生氧化反应生成N2,a极的电极反应式为2NH3+6OH--6e-===N2+6H2O,D正确。
8.工业上一种制备ClO2的装置如图所示。阴极生成的ClO2会进一步得电子产生瞬间中间体ClO,ClO随即与溶液中的ClO反应又生成ClO2,下列说法正确的是( )
A.a极的电极材料可以是Fe
B.电解一段时间后,阴极室的pH减小
C.阴极生成中间体ClO的过程可表示为ClO+2H++e-===ClO2↑+H2O、ClO2+e-===ClO
D.当电路中转移1 mol电子时,a极生成2.8 L(标准状况)气体X
答案 C
解析 由题干信息:阴极生成的ClO2会进一步得电子产生瞬间中间体ClO,ClO随即与溶液中的ClO反应又生成ClO2可知a极与电源正极相连,作阳极,电极反应为:2H2O-4e-===O2↑+4H+;b极与电源负极相连,作阴极,电极反应为:ClO+2H++e-===ClO2↑+H2O、ClO2+e-===ClO。A.由分析可知,a为阳极,若a极的电极材料为Fe,则电极反应为Fe-2e-===Fe2+,中间是质子交换膜,则电解池工作一段时间后,由于a极区无质子转移到b极区而无法工作,A错误;B.由分析可知,电解一段时间后,阴极室不断消耗H+,且有水生成,故溶液的pH增大,B错误;C.由分析可知,C正确;D.由分析可知,a极发生的电极反应为2H2O-4e-===O2↑+4H+,故当电路中转移1 mol电子时,生成气体X在标准状况下的体积为 mol×22.4 mol/L=5.6 L,D错误。
B卷
9.(2022·如皋中学三模)羟胺(NH2OH)常用于有机合成。一种电化学法制取盐酸羟胺(NH3OHCl)的装置原理如下图所示,已知铁可作NO反应的催化剂。下列说法正确的是( )
A.放电时Pt电极有Cl2生成
B.放电时的正极反应式为NO+3e-+4H+===NH3OH+
C.放电时,电路中每转移1 mol e-,负极区将增加1 mol H+
D.将质子交换膜改成阴离子交换膜,放电时的电极反应将发生变化
答案 B
解析 图示放电过程中,含铁电极表面NO得电子,发生还原反应生成NH3OH+,作正极,Pt电极表面H2失电子,发生氧化反应生成H+,作负极,H+通过质子交换膜从负极移向正极。根据分析,放电时Pt电极表面H2失电子,发生氧化反应生成H+,没有Cl2生成,A错误;放电时的正极上NO得电子,发生还原反应生成NH3OH+,电极反应式为NO+3e-+4H+===NH3OH+,B正确;原电池工作时,阳离子从负极移向正极,根据电荷守恒,电路中每转移1 mol e-,正极区将增加1 mol H+,C错误;原电池中阳离子向正极迁移,阴离子向负极迁移,所以若将质子交换膜改成阴离子交换膜,原来H+向含铁电极迁移,变成Cl-通过阴离子交换膜向Pt电极迁移,但放电时的电极反应不变,D错误。
10.Ca-LiFePO4可充电电池的工作原理示意图如图,其中锂离子交换膜只允许Li+通过,电池反应为:xCa+2Li1-xFePO4+2xLi+===xCa2++2LiFePO4。下列说法正确的是( )
A.LiPF6/LiAsF6电解质与Li2SO4溶液可互换
B.充电时,当转移0.1 mol电子时,左室中电解质的质量减轻1.3 g
C.充电时,阴极反应为:Li1-xFePO4+xLi++xe-===LiFePO4
D.放电时,Li1-xFePO4/LiFePO4电极发生Li+脱嵌,充电时发生Li+嵌入
答案 B
解析 A.Ca是活泼金属,易与水发生剧烈反应,所以LiPF6/LiAsF6为非水电解质,而Li2SO4溶液中有水,不可互换,A项错误;B.充电时每转移0.1 mol电子,左室中就有0.05 mol Ca2+转化为Ca,同时有0.1 mol Li+迁移到左室,所以左室中电解质的质量减轻0.05 mol×40 g/mol-0.1 mol×7 g/mol=1.3 g,B项正确;C.充电时,钙电极为阴极,电极反应为Ca2++2e-===Ca,C项错误;D.充电时为电解池,电解池中阳离子流向阴极,Li1-xFePO4/LiFePO4为阳极,所以Li1-xFePO4/LiFePO4电极发生Li+脱嵌然后流向阴极,放电时为原电池,原电池中阳离子流向正极,所以放电时发生Li+嵌入,D项错误。
11.(2022·南通模拟)锌电池具有成本低、安全性强、可循环使用等优点。一种新型锌电池的工作原理如图所示(凝胶中允许离子生成或迁移)。下列说法正确的是( )
A.充电过程中,a电极接外接电源的负极
B.充电过程中,b电极反应为:Zn2++2e-===Zn
C.放电过程中,H2SO4溶液中SO 向a电极迁移
D.放电过程中,转移 0.4 mol e-时,a电极消耗 0.8 mol H+
答案 D
解析 由图示可知,放电过程中b为负极,失去电子发生氧化反应;a为正极,得到电子发生还原反应;充电过程中 b为阴极,外接电源负极,a为阳极,外接电源正极,A错误;充电过程中b电极得到电子发生还原反应,由于在碱性环境中Zn以Zn(OH)形式存在,则充电过程中,b电极反应为:Zn(OH)+2e-===Zn+4OH-,B错误;放电过程中,a为正极,b极为负极,溶液中阳离子移向正极,阴离子移向负极,所以放电过程中,SO向b极迁移,C错误;放电过程中b电极为负极,其电极反应式为Zn+4OH--2e-===Zn(OH);a极为正极,则其电极反应式为MnO2+4H++2e-===Mn2++2H2O。所以放电过程中,转移0.4 mol e-时,a电极消耗0.8 mol H+,D正确。
12.(2022·江苏二模)H2S气体有高毒性和强腐蚀性,电化学法处理H2S的工作原理如图所示。下列说法正确的是( )
A.电极a连接电源负极,电解时H+由a极室移向b极室
B.反应池中发生反应的离子方程式:2VO+H2S+2H+===2VO2++S↓+2H2O
C.b极反应式:VO2++H2O+e-===VO+2H+
D.电解过程中每转移2 mol电子,理论上可生成22.4 L H2
答案 B
解析 电极a连接电源负极,电解时H+由阳极向阴极移动,故由b极室移向a极室,A错误;根据b极进入的和产生的物质,反应池中发生反应的离子方程式:2VO+H2S+2H+===2VO2++S↓+2H2O,B正确;b极为阳极,发生氧化反应,电极方程式:VO2++H2O-e-===VO+2H+,C错误;没有指明标准状况,氢气体积不可计算,D错误。
13.(2022·南通模拟)非水性嵌入铝电池是一种二次电池,该电池放电过程的示意图如图所示(R+表示某有机阳离子)。充电时阳极的电极反应为Cn+AlCl-e-===CnAlCl4。下列说法正确的是( )
A.放电时,电极a的电极反应为Al+AlCl-3e-+3Cl-===Al2Cl
B.放电时,电解质中AlCl的物质的量基本不变
C.充电时,电极b应与外接电源负极相连
D.充电时,电极a和电极b的质量均增加
答案 D
解析 放电时,电极a为Al,为负极,电极反应为Al+7AlCl-3e-===4Al2Cl,并且非水性体系中不存在氯离子,所以电极反应错误,A错误;放电时,负极反应为Al+7AlCl-3e-===4Al2Cl,正极反应为CnAlCl4+e-===Cn+AlCl,总反应为3CnAlCl4+Al+4AlCl===4Al2Cl+3Cn,电解质溶液中AlCl的物质的量减小,B错误;充电时,电极b为阳极,应与外接电源的正极相连,C错误;充电时,电极b为阳极,电极反应为Cn+AlCl-e-===CnAlCl4,a为阴极,电极反应为4Al2Cl+3e-===Al+7AlCl,电极a和电极b的质量均增加,D正确。
14.(2022·苏州模拟)锌元素对婴儿及青少年的智力和身体发育有重要的作用,被称为生命火花。利用电解NaBr溶液间接将葡萄糖[CH2OH(CHOH)4CHO]氧化为葡萄糖酸[CH2OH(CHOH)4COOH],进而制取葡萄糖酸锌,装置如图所示,下列说法不正确的是( )
A.石墨连接电源负极,发生还原反应
B.电解过程中每生成1 mol葡萄糖酸,理论上可生成标准状况下22.4 L H2
C.电解过程中硫酸钠溶液浓度保持不变
D.生成葡萄糖酸的反应式为:
CH2OH(CHOH)4CHO-2e-+H2O===CH2OH(CHOH)4COOH+2H+
答案 D
解析 由图可知,钛网为电解池的阳极,溴离子在阳极失去电子生成溴,电极反应式为2Br--2e-===Br2,溴将葡萄糖氧化为葡萄糖酸,反应的方程式为Br2+CH2OH(CHOH)4CHO+H2O===CH2OH(CHOH)4COOH+2HBr,石墨为阴极,水在阴极得到电子发生还原反应生成氢气,电极反应式为2H2O+2e-===H2↑+2OH-,氢离子通过质子交换膜由左侧移向右侧,与右侧生成的氢氧根离子反应生成水。由分析可知,石墨为阴极与直流电源负极相连,水在阴极得到电子发生还原反应生成氢气,A正确;由分析可得如下关系:CH2OH(CHOH)4COOH~H2,则电解过程中每生成1 mol葡萄糖酸,理论上可生成标准状况下22.4 L氢气,B正确;由分析可知,电解过程中,氢离子通过质子交换膜由左侧移向右侧,与右侧生成的氢氧根离子反应生成水,则右侧硫酸钠的物质的量、溶液的体积不变,硫酸钠溶液的浓度不变,C正确;由分析可知,溴将葡萄糖氧化为葡萄糖酸,反应方程式为Br2+CH2OH(CHOH)4CHO+H2O===CH2OH(CHOH)4COOH+2HBr,D错误。
15.(2022·唐山三模)2019年我国自主研发的首个31.25 kW铁-铬液流电池“容和一号”成功下线,该电堆是目前全球最大功率的铁-铬液流电池电堆。该电池总反应为:Fe3++Cr2+Fe2++Cr3+。某种K1、K2开关情况下,工作原理如图所示,其中a电极上涂有固体氢化铋(BiHx)。下列说法错误的是( )
A.电解质中除包含上述离子外,可选用盐酸环境
B.闭合K2时,与b电极连接的是电源的正极
C.放电时,负极反应式为BiHx-xe-===Bi+xH+
D.充电时,BiHx只起导电作用
答案 D
解析 由图可知,闭合K1时,该装置为原电池,电极a为负极,氢化铋在负极失去电子发生氧化反应生成铋和氢离子,铋和氢离子与溶液中的亚铬离子反应生成铬离子和氢化铋,电极b为正极,铁离子得到电子发生还原反应生成亚铁离子;闭合K2时,该装置为电解池,与直流电源负极相连的电极a为阴极,铋和氢离子在阴极得到电子发生还原反应生成氢化铋,氢化铋与溶液中的铬离子反应生成亚铬离子、铋和氢离子,与正极相连的电极b为阳极,亚铁离子失去电子发生氧化反应生成铁离子。A.由题意可知,铁-铬液流电池的电解质溶液可以为氯化铁、氯化亚铬和盐酸,其中盐酸起提供氢离子的作用,故A正确;B.由分析可知,闭合K2时,该装置为电解池,与正极相连的电极b为阳极,故B正确;C.由分析可知,放电时,电极a为负极,氢化铋在负极失去电子发生氧化反应生成铋和氢离子,电极反应式为BiHx-xe-===Bi+xH+,故C正确;D.由分析可知,充电时,电极a为阴极,铋和氢离子在阴极得到电子发生还原反应生成氢化铋,氢化铋与溶液中的铬离子反应生成亚铬离子、铋和氢离子,所以氢化铋起导电和还原剂的作用,故D错误。
16.(2022·溧阳二模)为适应可再生能源的波动性和间歇性,我国科学家设计了一种电化学装置,其原理如下图所示。当闭合K1和K3、打开K2时,装置处于蓄电状态;当打开K1和K3、闭合K2时,装置处于放电状态。放电状态时,双极膜中间层中的H2O解离为H+和OH-并分别向两侧迁移。下列有关该电化学装置工作时的说法不正确的是( )
A.蓄电时,碳锰电极为阳极
B.蓄电时,图中右侧电解池发生的总反应为2ZnO2Zn+O2↑
C.放电时,每消耗1 mol MnO2,理论上有2 mol H+由双极膜向碳锰电极迁移
D.理论上,该电化学装置运行过程中需要不断补充H2SO4和KOH溶液
答案 D
解析 当闭合K1和K3、打开K2时,装置处于蓄电状态,即为电解池,H+得电子生成H2,H元素化合价降低,则为阴极,Mn2+失电子生成MnO2,碳锰电极为阳极,ZnO得电子生成Zn,则锌电极为阴极,A正确;蓄电时,右侧电解池中ZnO得电子生成Zn,电极反应式为ZnO+2e-+H2O===Zn+2OH-,OH-失电子生成O2,电极反应式为4OH--4e-===O2↑+2H2O,发生的总反应为2ZnO2Zn+O2↑,B正确;放电时,碳锰电极为正极,电极反应式为MnO2+2e-+4H+===Mn2++2H2O,每消耗1 mol MnO2,需要消耗4 mol H+,但碳锰电极只生成2 mol正电荷,剩余正电荷需要从双极膜间解离出是氢离子转移至左侧,因此理论上有2 mol H+由双极膜向碳锰电极迁移,C正确;该电化学装置运行过程中H+得电子生成H2,但实际过程为消耗了溶剂水,氢离子浓度增大,OH-失电子生成O2,但实际也消耗了溶剂水,氢氧根离子浓度同样增大,则不需要不断补充H2SO4和KOH溶液,D错误。
同课章节目录
