专题2《化学反应速率与化学平衡》练习题(含解析)2023-2024学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题2《化学反应速率与化学平衡》练习题(含解析)2023-2024学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 624.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-21 21:28:21 | ||
图片预览



文档简介
专题2《化学反应速率与化学平衡》练习题
一、单选题
1.硫酸工业接触室发生如下反应: 。一定温度下,向甲、乙、丙三个容积相等的恒容密闭容器中投入和,下列说法正确的是。
容器 甲 乙 丙
起始物质的量 0.6 1.2 1.2
0.36 0.36 0.72
的平衡转化率 80%
A.甲容器中,平衡时反应放出的热量为59.1kJ
B.平衡时,的转化率:>80%
C.平衡时,丙中是甲中的2倍
D.三个容器中反应平衡常数不相等
2.一定量的铁片与足量稀硫酸反应制取氢气时,下列措施能使氢气生成速率增大且生成氢气总量不变的是
A.降低温度 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用等量的铁粉
3.一定温度下,将 1mol A(g)和 1mol B(g) 充入 2 L 密闭容器中发生反应:A(g) + B(g) xC(g) + D(s)<0,在 t1时达平衡。在 t2、t3时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。下列有关说法正确的是( )
A.t2时刻改变的条件是使用催化剂
B.t1~t2、t2~t3平衡常数均为 0.25
C.t3时刻改变的条件一定是增大反应物的浓度
D.t3时刻 v逆可能小于 t2时刻 v逆
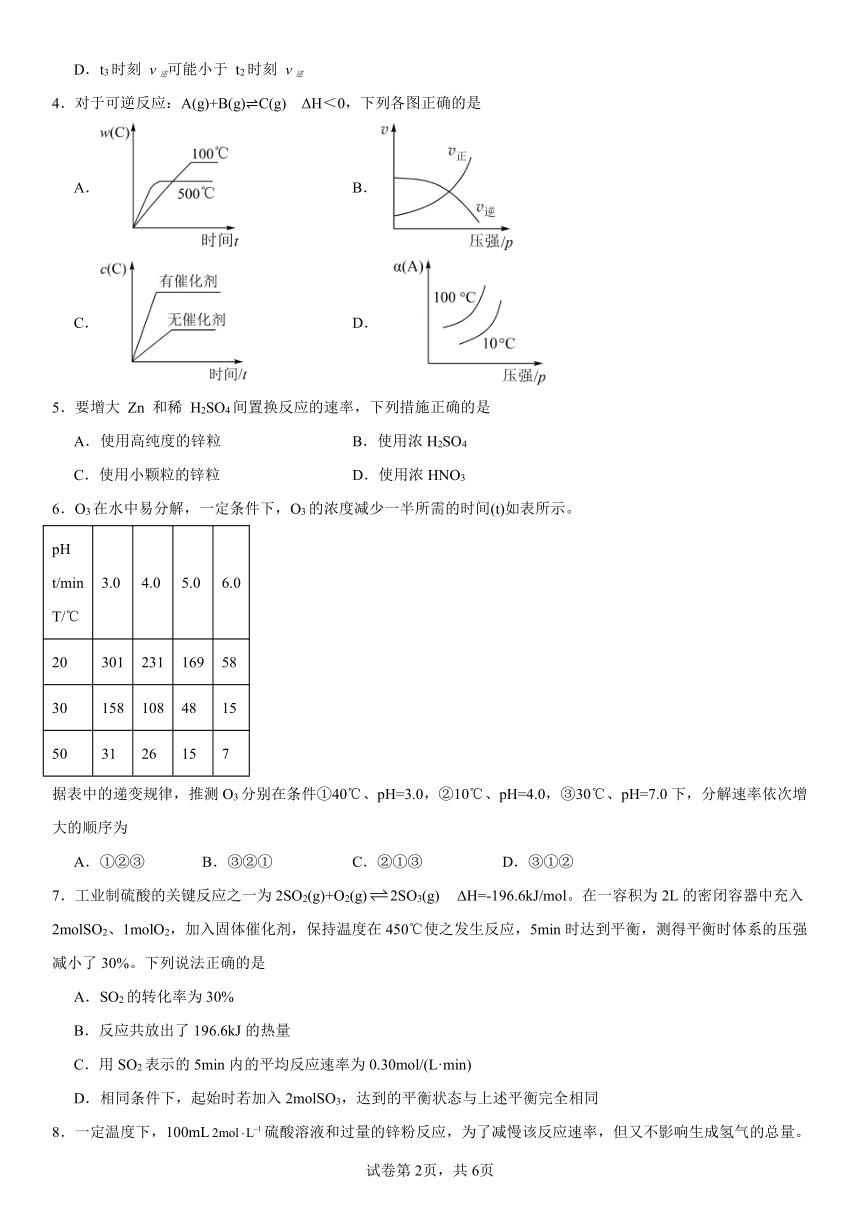
4.对于可逆反应:A(g)+B(g) C(g) ΔH<0,下列各图正确的是
A. B.
C. D.
5.要增大 Zn 和稀 H2SO4间置换反应的速率,下列措施正确的是
A.使用高纯度的锌粒 B.使用浓H2SO4
C.使用小颗粒的锌粒 D.使用浓HNO3
6.O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。
pH t/min T/℃ 3.0 4.0 5.0 6.0
20 301 231 169 58
30 158 108 48 15
50 31 26 15 7
据表中的递变规律,推测O3分别在条件①40℃、pH=3.0,②10℃、pH=4.0,③30℃、pH=7.0下,分解速率依次增大的顺序为
A.①②③ B.③②① C.②①③ D.③①②
7.工业制硫酸的关键反应之一为2SO2(g)+O2(g)2SO3(g) ΔH=-196.6kJ/mol。在一容积为2L的密闭容器中充入2molSO2、1molO2,加入固体催化剂,保持温度在450℃使之发生反应,5min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6kJ的热量
C.用SO2表示的5min内的平均反应速率为0.30mol/(L·min)
D.相同条件下,起始时若加入2molSO3,达到的平衡状态与上述平衡完全相同
8.一定温度下,100mL硫酸溶液和过量的锌粉反应,为了减慢该反应速率,但又不影响生成氢气的总量。可向反应体系中加入适量的
A.固体 B.固体 C.硫酸 D.NaOH溶液
9.对于化学反应,下列反应速率关系正确的是
A. B.
C. D.
10.反应A(s)+3B(g)=2C(g)+2D(g),以下速率的表示正确且反应速率最快的是
A.v(A)=2mol/ (L·s) B.v(B)=1.2mol/ (L·s)
C.v(C)=36mol/ (L·min) D.v(D)=1mol/ (L·s)
11.我国科学家制备的催化剂可用于人工固氮(),下列说法正确的是
A.该固氮反应中涉及的元素均位于短周期 B.工业上液氨常作制冷剂
C.该催化剂中易溶于水 D.催化剂能提高合成氨的转化率
12.H2NCOONH4是工业上由氨合成尿素的中间产物。在一定温度下、容积不变的密闭容器中发生反应H2NCOONH4(s) 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是
①每生成34gNH3的同时消耗44 gCO2
②混合气体的平均相对分子质量不变
③NH3的体积分数保持不变
④混合气体的密度保持不变
⑤c(NH3):c(CO2)=2:1
A.①③⑤ B.①④ C.①②④ D.①③④
13.反应,在不同情况下测得反应速率,反应最快的是
A. B.
C. D.
二、填空题
14.在537℃、1.01×105 Pa时,往容积可变的密闭容器中充入1 mol X和3 mol Y,此时容积为V L。保持恒温恒压,发生反应X(g)+3Y(g) 2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
(1)达到平衡时,X的转化率约为 。
(2)保持上述温度和压强恒定不变,若向容器中只充入4 mol Z,则反应达到平衡时,平衡气体中Y 的体积分数为 ,容器的容积为 L。
(3)若另选一容积固定不变的密闭容器,仍控制温度不变,使2 mol X和6 mol Y反应,达到平衡时平衡气体中Z的体积分数仍为0.5,则该密闭容器的容积为 。
(4)若温度仍为537℃,容器体积保持VL不变(恒容),往其中充入a mol X的b mol Y,使反应达到平衡,这时平衡气体中Z的体积分数仍为0.5,体系压强为1.01×105 Pa,若a:b =1:3,则a = 。
15.消除尾气中的NO是环境科学研究的热点课题。
I.NO氧化机理
已知:2NO(g)+O2(g) 2NO2(g)△H=-110kJ·mol-1
25℃时,将NO和O2按物质的量之比为2:1充入恒容反应容器中,用测压法研究其反应的进行情况。体系的总压强p随时间t的变化如下表所示(忽略NO2与N2O4的转化)
t/min 0 80 160
p/kPa 75.0 63.0 55.0 55.0
(1)0~80min,v(O2)= kPa/min;随着反应进行,反应速率逐渐减小的原因是 。
用平衡分压代替平衡浓度所得到的平衡常数用K(p)表示,25℃时,K(p)的值为 (保留3位有效数字)。
(2)查阅资料,对于总反应2NOg)+O2(g) 2NO2(g)有如下两步历程
第一步2NO(g) N2O2(g) 快速反应
第二步N2O2(g)+O2(g) 2NO2(g) 慢反应
总反应速率主要由第 步决定;若利用分子捕获器适当减少反应容器中的N2O2,总反应的平衡常数K(p)将 (填“增大”、“减小”或“不变”);若提高反应温度至35℃,则体系压强P(35℃) P(25℃)(填“大于”、“等于”或“小于”)。
II. 某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。
(1)反应体系达平衡后压强为P1,若升高温度,再次达平衡后,混合气体的平均相对分子质量 填“增大”、“减小”或“不变”;
(2)若在恒温恒容条件下,向平衡体系中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol/L,则P2:P1=
(3)该温度下反应2NO(g)+O2(g) 2NO2(g)的化学平衡常数K为 。
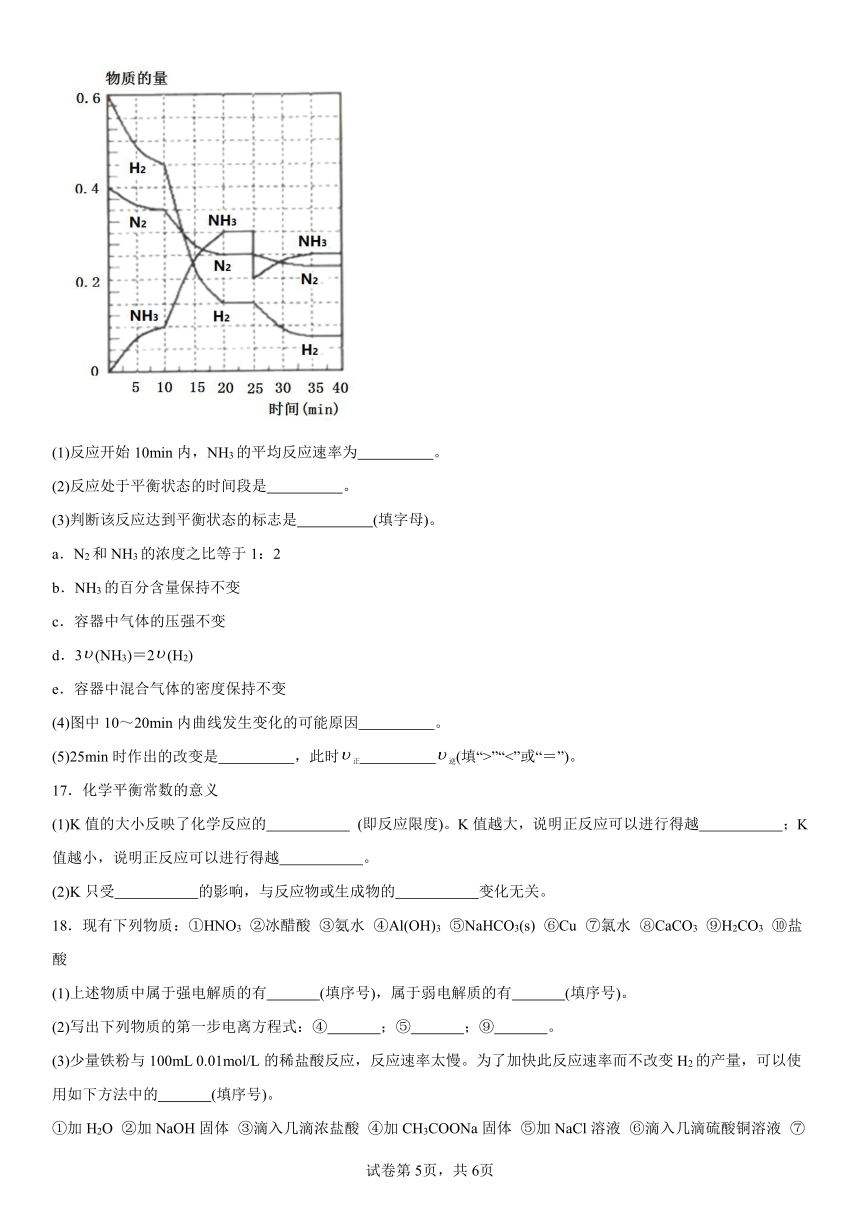
16.在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应,反应过程中H2、N2和NH3的物质的量变化如图所示。
(1)反应开始10min内,NH3的平均反应速率为 。
(2)反应处于平衡状态的时间段是 。
(3)判断该反应达到平衡状态的标志是 (填字母)。
a.N2和NH3的浓度之比等于1:2
b.NH3的百分含量保持不变
c.容器中气体的压强不变
d.3(NH3)=2(H2)
e.容器中混合气体的密度保持不变
(4)图中10~20min内曲线发生变化的可能原因 。
(5)25min时作出的改变是 ,此时正 逆(填“>”“<”或“=”)。
17.化学平衡常数的意义
(1)K值的大小反映了化学反应的 (即反应限度)。K值越大,说明正反应可以进行得越 ;K值越小,说明正反应可以进行得越 。
(2)K只受 的影响,与反应物或生成物的 变化无关。
18.现有下列物质:①HNO3 ②冰醋酸 ③氨水 ④Al(OH)3 ⑤NaHCO3(s) ⑥Cu ⑦氯水 ⑧CaCO3 ⑨H2CO3 ⑩盐酸
(1)上述物质中属于强电解质的有 (填序号),属于弱电解质的有 (填序号)。
(2)写出下列物质的第一步电离方程式:④ ;⑤ ;⑨ 。
(3)少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的 (填序号)。
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 0.1mol/L盐酸。
19.现将0.4molA气体和0.2molB气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图:
(1)0至t1时间内C物质的平均反应速率为 ;该反应在t2时刻达到平衡,则其化学反应方程式为 。
(2)据图中曲线变化情况分析,t1时刻改变的反应条件可能是 。
A.加入了催化剂 B.降低了反应温度 C.向容器中充入了气体C D.缩小了容器体积
(3)该条件下反应在t2平衡时的平衡常数为 。
20.一定温度下,向容积为2L的恒容密闭容器中加入等物质的量的H2和I2,发生反应H2(g)+I2(g) 2HI(g) ΔH<0。测得不同反应时间容器内H2的物质的量如表;
时间/min 0 10 20 30 40
n(H2)/mol 1 0.75 0.65 0.6 0.6
回答下列问题:
(1)0~20min内HI的平均反应速率为 。
(2)反应达到化学平衡状态时,I2的转化率为 ,HI的产率为 ,容器内H2的体积分数为 。
(3)该条件下,能说明上述反应达到化学平衡状态的是 (填标号)。
A.混合气体颜色不再改变
B.容器内压强不再改变
C.H2、I2、HI三种气体体积分数不再改变
D.混合气体密度不再改变
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】由题中条件可知甲、乙、丙三者不是等效平衡,乙相当于在甲条件的基础上增加了SO2的浓度,平衡正向移动,O2的转化率增大,SO2的转化率减小;丙相当于在甲的条件上加压一倍,平衡正向移动,O2和SO2的转化率均增大。
【详解】A.由该反应热效应和甲条件下的平衡转化率可得反应放出的热量为,A错误;
B.根据题目条件可得乙中SO2的转化率低于甲中SO2转化率,而丙中SO2转化率高于甲中SO2转化率,B正确;
C.丙中SO2的转化率大于甲的,则丙中SO2的浓度小于甲中的2倍,C错误;
D.化学平衡常数的大小与温度有关,与反应物浓度、压强等无关,甲、乙、丙均在恒温恒容的条件下反应,化学平衡常数相等,D错误;
故选B。
2.D
【详解】A.因降温时反应体系的温度降低,则化学反应速率减慢,A错误;
B.铁与浓硫酸发生钝化阻碍反应进行,减少氢气生成量,B错误;
C.滴加少量CuSO4溶液,铁置换出Cu,构成 Fe、Cu原电池,从而加快了生成氢气的反应速率,但是氢气总质量减少,C错误;
D.改用铁粉,增大了铁与硫酸反应的接触面积,则反应速率加快,D正确;
答案选D。
3.D
【详解】A.t2时刻瞬间C的浓度增大,t2 t3阶段C的浓度不变,说明平衡不移动,应是增大压强造成的,压强不影响该平衡,所以有x=1+1=2,加入催化剂不改变化学平衡,C的浓度不发生变化,故A错误;
B.t1 t3间温度相同,平衡常数相同,可计算t1 t2平衡常数K,
t1 t2平衡常数K===4,故B错误;
C.反应正向放热,降低温度或增加了A(或B)的物质的量,平衡均正向移动,C的浓度随时间而增大,由图象可知,C的反应速率降低了,所以t3时刻改变的一个条件可能是降低温度,故C错误;
D.反应正向放热,降低温度平衡正向移动,C的浓度增大,由图象可知C的反应速率降低,所以t3时刻改变的一个条件可能是降低温度,即t3时刻v逆小于t2时刻v逆,故D正确;
综上所述,说法正确的是D项,故答案为D。
4.A
【详解】A.为C的质量分数-时间-温度曲线,根据A(g)+B(g) (g) ΔH<0可知,升高温度化学反应速率加快,先达到化学平衡,C的质量分数减小,与图象相符,故A正确;
B.为速率-压强曲线,根据A(g)+B(g) (g) ΔH<0可知,增大压强,平衡向正反应方向移动,正逆反应速率均增大,交叉点后,正反应速率大于逆反应速率,与图象不相符,故B错误;
C.由为C的浓度-时间-催化剂曲线,根据A(g)+B(g) (g) ΔH<0可知,催化剂能加快反应速率,但不改变化学平衡,有无催化剂,C的浓度都不变化,与图象不相符,故C错误;
D.为转化率-压强-温度恒温条件下,增大压强,平衡正向移动,A的转化率增大,但恒压条件下,反应放热,升高温度,平衡向逆反应方向移动,A的转化率减小,与图象不相符,故D错误;
故答案:A。
5.C
【分析】增大压强、升高温度、提高浓度以及使用催化剂等可增大反应速率,根据外界条件对化学反应速率的影响分析。
【详解】A.使用高纯度的锌粒,不会改变反应速率,故A错误;
B.锌和浓硫酸之间发生反应,不生成氢气,不是置换反应,故B错误;
C.增大固体的表面积可以加快化学反应速率,故C正确;
D.锌和浓硝酸之间发生反应,不生成氢气,不是置换反应,故D错误。
故选C。
6.C
【详解】由表中数据可知,温度越高反应速率越快,pH越大反应速率越快,所以40℃、pH=3.0时,所需时间在31~158min之间;10℃、pH=4.0时,所需时间>231min;30℃、pH=7.0时,所需时间<15min,则分解速率依次增大的顺序为②、①、③,故选C。
7.D
【分析】由题意可知该反应的三段式如下:
由于平衡时压强减少30%,则(2-2x)+(1-x)+2x=3×70%
X=0.9mol,所以SO2的转化率为90%,反应放热为196.6×90%=176.94kJ,
【详解】A.由分析可知SO2的转化率为90%,A错误;
B.由分析可知反应放出了176.94kJ的热量,B错误;
C.用SO2表示的5min内的平均反应速率为,C错误;
D.该反应在恒温恒容条件下进行,起始时向容器中充入2molSO3达到的平衡和充入2molSO2,以及1molO2建立的平衡是等效的,而且是量相等的等效平衡,故达到的平衡状态与上述平衡完全相同,D正确;
故选D。
8.A
【分析】一定温度下,100mL2mol·L-1硫酸溶液和过量的锌粉反应,反应的离子方程式为Zn+2H+=Zn2++H2↑;为了减慢该反应速率,但又不影响生成氢气的总量,则需保证n(H+)不变,但c(H+)应减小。
【详解】A.加入CH3COONa溶液,CH3COO-能与H+反应生成CH3COOH,但CH3COOH还能与Zn反应,所以不影响最终参加反应的n(H+),生成n(H2)不变;由于溶液体积增大,c(H+)减小,所以反应速率减慢,A符合题意;
B.加入硫酸铜溶液,锌单质将铜离子转化为铜单质,形成铜锌硫酸原电池加速反应,B不符合题意;
C.加入0.1mol·L-1的硫酸溶液,n(H+)增大,生成氢气的总量增多,C不符合题意;
D.加入NaOH溶液,n(H+)减少,生成氢气的总量减小,D不符合题意;
故选A。
9.B
【分析】根据反应速率之比等于化学计量数之比;
【详解】A.由化学反应可知,SiO2是固体浓度是一个固定值,无法单位时间用浓度改变来表示反应速率,A错误;
B.由化学计量数可知,v(HF):v(SiF4) =4:1,v(HF)= 4v(SiF4),B正确;
C.由化学计量数可知,v(HF):v(H2O)=4:2=2:1,即v(HF)=2v(H2O),C错误;
D.由化学计量数可知,v(SiF4):v(H2O)=1:2,2v(SiF4)=v(H2O),D错误;
故选B。
10.D
【详解】同一反应中不同物质的反应速率之比等于计量数之比,都转化为用同一单位,以B物质表示的反应速率,然后进行比较;
A.A为固体,不能用来表示反应速率;
B.v(B)=1.2mol/(L·s);
C.v(C)=36mol/(L·min),则v(B)=v(C)=54mol/(L·min)=0.9 mol/(L·s);
D.v(D)=1mol/(L·s),则v(B)=v(D)=1.5mol/(L·s);
综上所述表示正确且反应速率最大的为D,故选D。
11.B
【详解】A.该固氮反应中涉及的元素不均位于短周期,催化剂中元素就不都位于短周期,A项错误;
B.工业上液氨常作制冷剂,B项正确;
C.该催化剂中不溶于水,C项错误;
D.催化剂不能提高合成氨的平衡转化率,D项错误;
答案选B。
12.B
【分析】可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变。
【详解】①每生成34g NH3的同时消耗44 gCO2,说明正逆反应速率相等,反应达到平衡状态,故①符合题意;
②该反应混合气体的平均相对分子质量始终不变,因此当混合气体的平均相对分子质量不变,不能判断反应是否达到平衡状态,故②不符合题意;
③容器中只有NH3和CO2为气体,且二者体积之比始终为2:1,则NH3的体积分数始终不变,所以NH3的体积分数保持不变,不能说明反应达到平衡状态,故③不符合题意;
④由于反应物H2NCOONH4是固体,没有达到平衡状态前,气体质量会变化,容器体积不变,则混合气体的密度会发生变化,因此混合气体的密度保持不变,说明反应达到了平衡状态,故④符合题意;
⑤任何时刻均存在c(NH3):c(CO2)=2:1,因此当c(NH3):c(CO2)=2:1时,不能说明反应达到平衡状态,故⑤不符合题意;
故答案选B。
13.C
【详解】根据化学反应过程中,各物质的反应速率之比=物质对应计量数之比可将速率转化为NH3的反应速率,然后进行比较。
A.即为=×=0.16;
B.即为=×=0.16;
C.;
D.即为==0.1;
综上所述,反应最快的是,故答案为C。
14. 66.7% 1.5mol
【详解】(1) 根据题目条件列出“三段式”为:
所以根据题意可知=0.5,解得n= ,所以转化率是×100%=66.7%,故答案为:66.7%;
(2)4molZ相当于是2molX和6molY,由于是恒温恒压,所以平衡是等效的,因此Y的体积分数不变,是0.5×=;由物质的量与体积成正比可以知道,设平衡的体积为x,则,计算得出x=,故答案为:;;
(3)容积固定不变的密闭容器,仍控制温度不变,使2molX 和6mol Y反应,达到平衡时平衡气体中Z的体积分数仍为0.5,与加入4molZ建立的平衡等效,体积为L,故答案为:;
(4)容器体积保持VL不变(恒容),往其中充入a mol X的b mol Y,使反应达到平衡,这时平衡气体中Z的体积分数仍为0.5,体系压强为1.01105Pa,若a:b=1:3,则有
到平衡时,平衡混合气体中Z的体积分数为0.5,=0.5,4a-2x=4mol,计算得出a=1.5mol,故答案为:1.5mol。
15. 0.15 反应物浓度减小,反应速率降低 3.2 二 不变 大于 减小 13:5 100L/mol
【详解】I. 2NO(g)+O2(g) 2NO2(g)
初始:2n n
反应:2x x 2x
80min:2n-2x n-x 2x
160min:2n-2x n-x 2x
80min:3n=75.0,2n-2x+n-x+2x=63.0,则x=12.0kPa;
160min:3n=75.0,2n-2x+n-x+2x=55.0,则x=20.0kPa;
(1)0~80min,O2减少的分压为12.0kPa,v(O2)=12.0kPa/80min=0.15 kPa/min;随反应的进行,反应物的浓度逐渐减小,则反应速率减慢;K(p)=(55.0×)2/[55.0××(55.0×)2]=3.20;
(2)反应速率慢的步骤决定总反应速率的快慢;平衡常数K(p)与温度有关,降低容器中的N2O2,温度未变,则K(p)不变;若提高反应温度至35℃,正反应为放热反应,则平衡逆向移动,则体系的压强增大,K(p)增大,则p(35℃)大于p(25℃);
II.(1)2NO2(g) 2NO(g)+O2(g) △H=+110kJ/mol,升高温度平衡向吸热的方向移动,则气体的总物质的量增大,气体总质量不变,则摩尔质量减小,相对分子质量减小;
(2)2NO2(g) 2NO(g)+O2(g)
初始:0.040
反应:0.020 0.020 0.010
平衡:0.02 0.020 0.010
反应:2x 2x x
平衡:0.02+2x 0.020-2x 0.09
P2:P1=(0.040+0.09):0.050=13:5;
(2)温度未变,则化学平衡常数未变,K==100。
16. 0.005mol/(L·min) 20~25min,35~40min b、c 升高温度或使用了催化剂 分离出0.1molNH3 >
【分析】根据来计算反应速率;达到平衡状态时,物质的量不变,以此判断达到平衡的时间段;当反应达到化学平衡状态时,正逆反应速率相等,各物质的浓度不再改变;由图象可知10~20min时各组分物质的量变化加快,且10min时都是逐渐变化的,反应速率增大,且N2、H2物质的量减小,NH3的物质的量增多,故说明为使用催化剂或者升高温度;第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,且此后N2、H2物质的量减小,NH3的物质的量增多,故平衡正向移动。
【详解】(1)从图中可知,NH3从0变为0.1mol,故故答案为:0.005mol L-1 min-1;
(2)由图象可以看出,当反应进行到时20-25min,35-40min,各物质的物质的量保持不变,说明此时反应达到平衡状态,故答案为:20-25min,35-40min;
(3)a.N2和NH3浓度是否相等取决于反应的起始量和转化的程度,不能判断是否达到平衡,故a错误;
b.NH3百分含量保持不变,说明反应达到平衡状态,故b正确;
c.反应前后气体的物质的量不等,容器中气体的压强不变,说明达到平衡状态,故c正确;
d.3(NH3)=2(H2),并未指明正反应还是逆反应的速率,故无法判断正逆反应速率是否相等,故无法判断是否达到平衡状态,故d错误;
e.由于气体的质量和容器的体积不变,则无论是否达到平衡状态,容器中混合气体的密度都保持不变,故e错误;
故答案为:bc;
(4)由图可知,0-10分钟内n(N2)=0.025mol×2=0.05mol;10-20分钟内n′(N2)=0.025mol×4=0.1mol,所以0-10分钟与10到20分钟两个时间段中,N2的反应速率之比为0.05mol:0.1mol=1:2;由图象可知其他各组分物质的量变化加快,且10min时变化时各物质是连续变化的,20min达平衡时,说明10min可能改变的条件是升高温度或使用催化剂,故答案为:升高温度或使用了催化剂;
(5)从图中可知:第25分钟,NH3的物质的量突然减少了0.1mol,而H2、N2的物质的量不变,说明应是分离出NH3,生成物的浓度减小,平衡向正反应方向进行,正反应速率大于逆反应速率,故答案为:分离出0.1molNH3;>。
17.(1) 进行程度 完全 不完全
(2) 温度 浓度
【详解】(1)化学平衡常数的大小反映了化学反应的进行程度(即反应限度)。K值越大,说明正反应可以进行得越完全;K值越小,说明正反应可以进行得越不完全;
(2)化学平衡常数K只受温度的影响,与反应物或生成物的浓度变化无关。
18.(1) ①⑤⑧ ②④⑨
(2) H2O+AlO+H+Al(OH)3Al3++3OH- NaHCO3=Na++HCO H2CO3H++HCO
(3)③⑦⑧
【详解】(1)①是强酸,溶于水,在水中全部电离,是强电解质;②冰醋酸是弱酸,溶于水,在水中部分电离,冰醋酸是弱电解质;③氨水是混合物,既不是电解质也不是非电解质;④溶于水的部分,在水溶液中部分电离,是弱电解质;⑤溶于水,在水中全部电离,是强电解质;⑥Cu是单质,既不是电解质也不是非电解质;⑦氯水是混合物,既不是电解质也不是非电解质;⑧ 溶于水的部分,在水中全部电离,是强电解质;⑨是弱酸,在水溶液中部分电离,是弱电解质;⑩盐酸是混合物,既不是电解质也不是非电解质;故上述物质属于强电解质的有①⑤⑧;上述物质属于弱电解质的有②④⑨;
(2)④是两性物质并且属于弱电解质,在水溶液中既存在酸式电离,又存在碱式电离,其电离方程式为;⑤是强电解质,其电离方程式为;⑨是二元弱酸,是弱电解质,分步电离,第一步电离为主,其电离方程式为;
(3)①加,溶液中氢离子的物质的量浓度减小,反应速率减慢,①不符合题意;②加NaOH固体后,,溶液中氢离子的浓度减小,反应速率减慢,②不符合题意;③滴入几滴浓盐酸,氢离子浓度增大,反应速率加快,③符合题意;④加醋酸钠固体生成醋酸,醋酸是弱电解质,溶液中的氢离子的浓度减小,反应速率减慢,④不符合题意;⑤加NaCl溶液,溶液中的氢离子的浓度减小,反应速率减慢,⑤不符合题意;⑥滴入几滴硫酸铜溶液,金属铁把溶液中的铜离子置换出来,少量的铜覆盖在铁表面,在稀盐酸中形成原电池,反应速率加快,与盐酸反应的铁的物质的量减少,导致生成氢气的物质的量减少,⑥不符合题意;⑦升高温度(不考虑盐酸挥发),反应速率加快,⑦符合题意;⑧改用盐酸,氢离子的浓度增大,反应速率加快,⑧符合题意;故③⑦⑧符合题意。
19. mol·L-1·min-1 3A(g)+B(g) 2C(g) AD 4×104
【详解】(1)根据,0至t1时间内C物质的平均反应速率为 mol·L-1·min-1;0至t2时间内A、B、C物质的量的变化分别是0.3mol、0.1mol、0.2mol,根据化学计量数比等于物质的量变化之比,反应的方程式是3A(g)+B(g) 2C(g);
(2)A.根据图象,t1~t2速率加快;加入了催化剂可加快反应速率,故A可能;
B.降低了反应温度,反应速率减慢,故B不可能;
C.向容器中充入了C,C的物质的量应该突变,而图象中C的物质的量是渐变,故C不可能;
D.缩小了容器体积,浓度增大,化学反应速率加快,故D可能;
故答案选AD;
(3)化学平衡常数;
【点睛】可逆化学反应达到平衡状态时生成物与反应物的浓度(方程式化学计量数幂次方)乘积比是化学平衡常数。
20. 0.0175mol L-1 min-1 40% 40% 30% AC
【详解】(1)0~20min内HI的平均反应速率。
(2) 反应达到化学平衡状态时, ,则I2的转化率为 ,HI的理论产量为2mol,HI的产率为,容器内H2的体积分数为 。
(3) A.混合气体颜色不再改变 ,即碘蒸气浓度不再改变,则说明已经平衡,A正确;
B.氢气和碘蒸气生成碘化氢气体的反应中气体分子总数不变、体积容器内压强始终不变,则压强不变不能说明已平衡,B错误;
C.H2、I2、HI三种气体体积分数不再改变,符合平衡特征,说明已平衡,C正确;
D.密闭容器中,气体总质量、容积体积始终不变,故气体密度也始终不变、则混合气体密度不变不能说明已平衡,选项D错误;
该条件下,能说明上述反应达到化学平衡状态的是AC。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.硫酸工业接触室发生如下反应: 。一定温度下,向甲、乙、丙三个容积相等的恒容密闭容器中投入和,下列说法正确的是。
容器 甲 乙 丙
起始物质的量 0.6 1.2 1.2
0.36 0.36 0.72
的平衡转化率 80%
A.甲容器中,平衡时反应放出的热量为59.1kJ
B.平衡时,的转化率:>80%
C.平衡时,丙中是甲中的2倍
D.三个容器中反应平衡常数不相等
2.一定量的铁片与足量稀硫酸反应制取氢气时,下列措施能使氢气生成速率增大且生成氢气总量不变的是
A.降低温度 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用等量的铁粉
3.一定温度下,将 1mol A(g)和 1mol B(g) 充入 2 L 密闭容器中发生反应:A(g) + B(g) xC(g) + D(s)<0,在 t1时达平衡。在 t2、t3时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。下列有关说法正确的是( )
A.t2时刻改变的条件是使用催化剂
B.t1~t2、t2~t3平衡常数均为 0.25
C.t3时刻改变的条件一定是增大反应物的浓度
D.t3时刻 v逆可能小于 t2时刻 v逆
4.对于可逆反应:A(g)+B(g) C(g) ΔH<0,下列各图正确的是
A. B.
C. D.
5.要增大 Zn 和稀 H2SO4间置换反应的速率,下列措施正确的是
A.使用高纯度的锌粒 B.使用浓H2SO4
C.使用小颗粒的锌粒 D.使用浓HNO3
6.O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。
pH t/min T/℃ 3.0 4.0 5.0 6.0
20 301 231 169 58
30 158 108 48 15
50 31 26 15 7
据表中的递变规律,推测O3分别在条件①40℃、pH=3.0,②10℃、pH=4.0,③30℃、pH=7.0下,分解速率依次增大的顺序为
A.①②③ B.③②① C.②①③ D.③①②
7.工业制硫酸的关键反应之一为2SO2(g)+O2(g)2SO3(g) ΔH=-196.6kJ/mol。在一容积为2L的密闭容器中充入2molSO2、1molO2,加入固体催化剂,保持温度在450℃使之发生反应,5min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6kJ的热量
C.用SO2表示的5min内的平均反应速率为0.30mol/(L·min)
D.相同条件下,起始时若加入2molSO3,达到的平衡状态与上述平衡完全相同
8.一定温度下,100mL硫酸溶液和过量的锌粉反应,为了减慢该反应速率,但又不影响生成氢气的总量。可向反应体系中加入适量的
A.固体 B.固体 C.硫酸 D.NaOH溶液
9.对于化学反应,下列反应速率关系正确的是
A. B.
C. D.
10.反应A(s)+3B(g)=2C(g)+2D(g),以下速率的表示正确且反应速率最快的是
A.v(A)=2mol/ (L·s) B.v(B)=1.2mol/ (L·s)
C.v(C)=36mol/ (L·min) D.v(D)=1mol/ (L·s)
11.我国科学家制备的催化剂可用于人工固氮(),下列说法正确的是
A.该固氮反应中涉及的元素均位于短周期 B.工业上液氨常作制冷剂
C.该催化剂中易溶于水 D.催化剂能提高合成氨的转化率
12.H2NCOONH4是工业上由氨合成尿素的中间产物。在一定温度下、容积不变的密闭容器中发生反应H2NCOONH4(s) 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是
①每生成34gNH3的同时消耗44 gCO2
②混合气体的平均相对分子质量不变
③NH3的体积分数保持不变
④混合气体的密度保持不变
⑤c(NH3):c(CO2)=2:1
A.①③⑤ B.①④ C.①②④ D.①③④
13.反应,在不同情况下测得反应速率,反应最快的是
A. B.
C. D.
二、填空题
14.在537℃、1.01×105 Pa时,往容积可变的密闭容器中充入1 mol X和3 mol Y,此时容积为V L。保持恒温恒压,发生反应X(g)+3Y(g) 2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
(1)达到平衡时,X的转化率约为 。
(2)保持上述温度和压强恒定不变,若向容器中只充入4 mol Z,则反应达到平衡时,平衡气体中Y 的体积分数为 ,容器的容积为 L。
(3)若另选一容积固定不变的密闭容器,仍控制温度不变,使2 mol X和6 mol Y反应,达到平衡时平衡气体中Z的体积分数仍为0.5,则该密闭容器的容积为 。
(4)若温度仍为537℃,容器体积保持VL不变(恒容),往其中充入a mol X的b mol Y,使反应达到平衡,这时平衡气体中Z的体积分数仍为0.5,体系压强为1.01×105 Pa,若a:b =1:3,则a = 。
15.消除尾气中的NO是环境科学研究的热点课题。
I.NO氧化机理
已知:2NO(g)+O2(g) 2NO2(g)△H=-110kJ·mol-1
25℃时,将NO和O2按物质的量之比为2:1充入恒容反应容器中,用测压法研究其反应的进行情况。体系的总压强p随时间t的变化如下表所示(忽略NO2与N2O4的转化)
t/min 0 80 160
p/kPa 75.0 63.0 55.0 55.0
(1)0~80min,v(O2)= kPa/min;随着反应进行,反应速率逐渐减小的原因是 。
用平衡分压代替平衡浓度所得到的平衡常数用K(p)表示,25℃时,K(p)的值为 (保留3位有效数字)。
(2)查阅资料,对于总反应2NOg)+O2(g) 2NO2(g)有如下两步历程
第一步2NO(g) N2O2(g) 快速反应
第二步N2O2(g)+O2(g) 2NO2(g) 慢反应
总反应速率主要由第 步决定;若利用分子捕获器适当减少反应容器中的N2O2,总反应的平衡常数K(p)将 (填“增大”、“减小”或“不变”);若提高反应温度至35℃,则体系压强P(35℃) P(25℃)(填“大于”、“等于”或“小于”)。
II. 某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。
(1)反应体系达平衡后压强为P1,若升高温度,再次达平衡后,混合气体的平均相对分子质量 填“增大”、“减小”或“不变”;
(2)若在恒温恒容条件下,向平衡体系中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol/L,则P2:P1=
(3)该温度下反应2NO(g)+O2(g) 2NO2(g)的化学平衡常数K为 。
16.在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应,反应过程中H2、N2和NH3的物质的量变化如图所示。
(1)反应开始10min内,NH3的平均反应速率为 。
(2)反应处于平衡状态的时间段是 。
(3)判断该反应达到平衡状态的标志是 (填字母)。
a.N2和NH3的浓度之比等于1:2
b.NH3的百分含量保持不变
c.容器中气体的压强不变
d.3(NH3)=2(H2)
e.容器中混合气体的密度保持不变
(4)图中10~20min内曲线发生变化的可能原因 。
(5)25min时作出的改变是 ,此时正 逆(填“>”“<”或“=”)。
17.化学平衡常数的意义
(1)K值的大小反映了化学反应的 (即反应限度)。K值越大,说明正反应可以进行得越 ;K值越小,说明正反应可以进行得越 。
(2)K只受 的影响,与反应物或生成物的 变化无关。
18.现有下列物质:①HNO3 ②冰醋酸 ③氨水 ④Al(OH)3 ⑤NaHCO3(s) ⑥Cu ⑦氯水 ⑧CaCO3 ⑨H2CO3 ⑩盐酸
(1)上述物质中属于强电解质的有 (填序号),属于弱电解质的有 (填序号)。
(2)写出下列物质的第一步电离方程式:④ ;⑤ ;⑨ 。
(3)少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的 (填序号)。
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 0.1mol/L盐酸。
19.现将0.4molA气体和0.2molB气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图:
(1)0至t1时间内C物质的平均反应速率为 ;该反应在t2时刻达到平衡,则其化学反应方程式为 。
(2)据图中曲线变化情况分析,t1时刻改变的反应条件可能是 。
A.加入了催化剂 B.降低了反应温度 C.向容器中充入了气体C D.缩小了容器体积
(3)该条件下反应在t2平衡时的平衡常数为 。
20.一定温度下,向容积为2L的恒容密闭容器中加入等物质的量的H2和I2,发生反应H2(g)+I2(g) 2HI(g) ΔH<0。测得不同反应时间容器内H2的物质的量如表;
时间/min 0 10 20 30 40
n(H2)/mol 1 0.75 0.65 0.6 0.6
回答下列问题:
(1)0~20min内HI的平均反应速率为 。
(2)反应达到化学平衡状态时,I2的转化率为 ,HI的产率为 ,容器内H2的体积分数为 。
(3)该条件下,能说明上述反应达到化学平衡状态的是 (填标号)。
A.混合气体颜色不再改变
B.容器内压强不再改变
C.H2、I2、HI三种气体体积分数不再改变
D.混合气体密度不再改变
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】由题中条件可知甲、乙、丙三者不是等效平衡,乙相当于在甲条件的基础上增加了SO2的浓度,平衡正向移动,O2的转化率增大,SO2的转化率减小;丙相当于在甲的条件上加压一倍,平衡正向移动,O2和SO2的转化率均增大。
【详解】A.由该反应热效应和甲条件下的平衡转化率可得反应放出的热量为,A错误;
B.根据题目条件可得乙中SO2的转化率低于甲中SO2转化率,而丙中SO2转化率高于甲中SO2转化率,B正确;
C.丙中SO2的转化率大于甲的,则丙中SO2的浓度小于甲中的2倍,C错误;
D.化学平衡常数的大小与温度有关,与反应物浓度、压强等无关,甲、乙、丙均在恒温恒容的条件下反应,化学平衡常数相等,D错误;
故选B。
2.D
【详解】A.因降温时反应体系的温度降低,则化学反应速率减慢,A错误;
B.铁与浓硫酸发生钝化阻碍反应进行,减少氢气生成量,B错误;
C.滴加少量CuSO4溶液,铁置换出Cu,构成 Fe、Cu原电池,从而加快了生成氢气的反应速率,但是氢气总质量减少,C错误;
D.改用铁粉,增大了铁与硫酸反应的接触面积,则反应速率加快,D正确;
答案选D。
3.D
【详解】A.t2时刻瞬间C的浓度增大,t2 t3阶段C的浓度不变,说明平衡不移动,应是增大压强造成的,压强不影响该平衡,所以有x=1+1=2,加入催化剂不改变化学平衡,C的浓度不发生变化,故A错误;
B.t1 t3间温度相同,平衡常数相同,可计算t1 t2平衡常数K,
t1 t2平衡常数K===4,故B错误;
C.反应正向放热,降低温度或增加了A(或B)的物质的量,平衡均正向移动,C的浓度随时间而增大,由图象可知,C的反应速率降低了,所以t3时刻改变的一个条件可能是降低温度,故C错误;
D.反应正向放热,降低温度平衡正向移动,C的浓度增大,由图象可知C的反应速率降低,所以t3时刻改变的一个条件可能是降低温度,即t3时刻v逆小于t2时刻v逆,故D正确;
综上所述,说法正确的是D项,故答案为D。
4.A
【详解】A.为C的质量分数-时间-温度曲线,根据A(g)+B(g) (g) ΔH<0可知,升高温度化学反应速率加快,先达到化学平衡,C的质量分数减小,与图象相符,故A正确;
B.为速率-压强曲线,根据A(g)+B(g) (g) ΔH<0可知,增大压强,平衡向正反应方向移动,正逆反应速率均增大,交叉点后,正反应速率大于逆反应速率,与图象不相符,故B错误;
C.由为C的浓度-时间-催化剂曲线,根据A(g)+B(g) (g) ΔH<0可知,催化剂能加快反应速率,但不改变化学平衡,有无催化剂,C的浓度都不变化,与图象不相符,故C错误;
D.为转化率-压强-温度恒温条件下,增大压强,平衡正向移动,A的转化率增大,但恒压条件下,反应放热,升高温度,平衡向逆反应方向移动,A的转化率减小,与图象不相符,故D错误;
故答案:A。
5.C
【分析】增大压强、升高温度、提高浓度以及使用催化剂等可增大反应速率,根据外界条件对化学反应速率的影响分析。
【详解】A.使用高纯度的锌粒,不会改变反应速率,故A错误;
B.锌和浓硫酸之间发生反应,不生成氢气,不是置换反应,故B错误;
C.增大固体的表面积可以加快化学反应速率,故C正确;
D.锌和浓硝酸之间发生反应,不生成氢气,不是置换反应,故D错误。
故选C。
6.C
【详解】由表中数据可知,温度越高反应速率越快,pH越大反应速率越快,所以40℃、pH=3.0时,所需时间在31~158min之间;10℃、pH=4.0时,所需时间>231min;30℃、pH=7.0时,所需时间<15min,则分解速率依次增大的顺序为②、①、③,故选C。
7.D
【分析】由题意可知该反应的三段式如下:
由于平衡时压强减少30%,则(2-2x)+(1-x)+2x=3×70%
X=0.9mol,所以SO2的转化率为90%,反应放热为196.6×90%=176.94kJ,
【详解】A.由分析可知SO2的转化率为90%,A错误;
B.由分析可知反应放出了176.94kJ的热量,B错误;
C.用SO2表示的5min内的平均反应速率为,C错误;
D.该反应在恒温恒容条件下进行,起始时向容器中充入2molSO3达到的平衡和充入2molSO2,以及1molO2建立的平衡是等效的,而且是量相等的等效平衡,故达到的平衡状态与上述平衡完全相同,D正确;
故选D。
8.A
【分析】一定温度下,100mL2mol·L-1硫酸溶液和过量的锌粉反应,反应的离子方程式为Zn+2H+=Zn2++H2↑;为了减慢该反应速率,但又不影响生成氢气的总量,则需保证n(H+)不变,但c(H+)应减小。
【详解】A.加入CH3COONa溶液,CH3COO-能与H+反应生成CH3COOH,但CH3COOH还能与Zn反应,所以不影响最终参加反应的n(H+),生成n(H2)不变;由于溶液体积增大,c(H+)减小,所以反应速率减慢,A符合题意;
B.加入硫酸铜溶液,锌单质将铜离子转化为铜单质,形成铜锌硫酸原电池加速反应,B不符合题意;
C.加入0.1mol·L-1的硫酸溶液,n(H+)增大,生成氢气的总量增多,C不符合题意;
D.加入NaOH溶液,n(H+)减少,生成氢气的总量减小,D不符合题意;
故选A。
9.B
【分析】根据反应速率之比等于化学计量数之比;
【详解】A.由化学反应可知,SiO2是固体浓度是一个固定值,无法单位时间用浓度改变来表示反应速率,A错误;
B.由化学计量数可知,v(HF):v(SiF4) =4:1,v(HF)= 4v(SiF4),B正确;
C.由化学计量数可知,v(HF):v(H2O)=4:2=2:1,即v(HF)=2v(H2O),C错误;
D.由化学计量数可知,v(SiF4):v(H2O)=1:2,2v(SiF4)=v(H2O),D错误;
故选B。
10.D
【详解】同一反应中不同物质的反应速率之比等于计量数之比,都转化为用同一单位,以B物质表示的反应速率,然后进行比较;
A.A为固体,不能用来表示反应速率;
B.v(B)=1.2mol/(L·s);
C.v(C)=36mol/(L·min),则v(B)=v(C)=54mol/(L·min)=0.9 mol/(L·s);
D.v(D)=1mol/(L·s),则v(B)=v(D)=1.5mol/(L·s);
综上所述表示正确且反应速率最大的为D,故选D。
11.B
【详解】A.该固氮反应中涉及的元素不均位于短周期,催化剂中元素就不都位于短周期,A项错误;
B.工业上液氨常作制冷剂,B项正确;
C.该催化剂中不溶于水,C项错误;
D.催化剂不能提高合成氨的平衡转化率,D项错误;
答案选B。
12.B
【分析】可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变。
【详解】①每生成34g NH3的同时消耗44 gCO2,说明正逆反应速率相等,反应达到平衡状态,故①符合题意;
②该反应混合气体的平均相对分子质量始终不变,因此当混合气体的平均相对分子质量不变,不能判断反应是否达到平衡状态,故②不符合题意;
③容器中只有NH3和CO2为气体,且二者体积之比始终为2:1,则NH3的体积分数始终不变,所以NH3的体积分数保持不变,不能说明反应达到平衡状态,故③不符合题意;
④由于反应物H2NCOONH4是固体,没有达到平衡状态前,气体质量会变化,容器体积不变,则混合气体的密度会发生变化,因此混合气体的密度保持不变,说明反应达到了平衡状态,故④符合题意;
⑤任何时刻均存在c(NH3):c(CO2)=2:1,因此当c(NH3):c(CO2)=2:1时,不能说明反应达到平衡状态,故⑤不符合题意;
故答案选B。
13.C
【详解】根据化学反应过程中,各物质的反应速率之比=物质对应计量数之比可将速率转化为NH3的反应速率,然后进行比较。
A.即为=×=0.16;
B.即为=×=0.16;
C.;
D.即为==0.1;
综上所述,反应最快的是,故答案为C。
14. 66.7% 1.5mol
【详解】(1) 根据题目条件列出“三段式”为:
所以根据题意可知=0.5,解得n= ,所以转化率是×100%=66.7%,故答案为:66.7%;
(2)4molZ相当于是2molX和6molY,由于是恒温恒压,所以平衡是等效的,因此Y的体积分数不变,是0.5×=;由物质的量与体积成正比可以知道,设平衡的体积为x,则,计算得出x=,故答案为:;;
(3)容积固定不变的密闭容器,仍控制温度不变,使2molX 和6mol Y反应,达到平衡时平衡气体中Z的体积分数仍为0.5,与加入4molZ建立的平衡等效,体积为L,故答案为:;
(4)容器体积保持VL不变(恒容),往其中充入a mol X的b mol Y,使反应达到平衡,这时平衡气体中Z的体积分数仍为0.5,体系压强为1.01105Pa,若a:b=1:3,则有
到平衡时,平衡混合气体中Z的体积分数为0.5,=0.5,4a-2x=4mol,计算得出a=1.5mol,故答案为:1.5mol。
15. 0.15 反应物浓度减小,反应速率降低 3.2 二 不变 大于 减小 13:5 100L/mol
【详解】I. 2NO(g)+O2(g) 2NO2(g)
初始:2n n
反应:2x x 2x
80min:2n-2x n-x 2x
160min:2n-2x n-x 2x
80min:3n=75.0,2n-2x+n-x+2x=63.0,则x=12.0kPa;
160min:3n=75.0,2n-2x+n-x+2x=55.0,则x=20.0kPa;
(1)0~80min,O2减少的分压为12.0kPa,v(O2)=12.0kPa/80min=0.15 kPa/min;随反应的进行,反应物的浓度逐渐减小,则反应速率减慢;K(p)=(55.0×)2/[55.0××(55.0×)2]=3.20;
(2)反应速率慢的步骤决定总反应速率的快慢;平衡常数K(p)与温度有关,降低容器中的N2O2,温度未变,则K(p)不变;若提高反应温度至35℃,正反应为放热反应,则平衡逆向移动,则体系的压强增大,K(p)增大,则p(35℃)大于p(25℃);
II.(1)2NO2(g) 2NO(g)+O2(g) △H=+110kJ/mol,升高温度平衡向吸热的方向移动,则气体的总物质的量增大,气体总质量不变,则摩尔质量减小,相对分子质量减小;
(2)2NO2(g) 2NO(g)+O2(g)
初始:0.040
反应:0.020 0.020 0.010
平衡:0.02 0.020 0.010
反应:2x 2x x
平衡:0.02+2x 0.020-2x 0.09
P2:P1=(0.040+0.09):0.050=13:5;
(2)温度未变,则化学平衡常数未变,K==100。
16. 0.005mol/(L·min) 20~25min,35~40min b、c 升高温度或使用了催化剂 分离出0.1molNH3 >
【分析】根据来计算反应速率;达到平衡状态时,物质的量不变,以此判断达到平衡的时间段;当反应达到化学平衡状态时,正逆反应速率相等,各物质的浓度不再改变;由图象可知10~20min时各组分物质的量变化加快,且10min时都是逐渐变化的,反应速率增大,且N2、H2物质的量减小,NH3的物质的量增多,故说明为使用催化剂或者升高温度;第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,且此后N2、H2物质的量减小,NH3的物质的量增多,故平衡正向移动。
【详解】(1)从图中可知,NH3从0变为0.1mol,故故答案为:0.005mol L-1 min-1;
(2)由图象可以看出,当反应进行到时20-25min,35-40min,各物质的物质的量保持不变,说明此时反应达到平衡状态,故答案为:20-25min,35-40min;
(3)a.N2和NH3浓度是否相等取决于反应的起始量和转化的程度,不能判断是否达到平衡,故a错误;
b.NH3百分含量保持不变,说明反应达到平衡状态,故b正确;
c.反应前后气体的物质的量不等,容器中气体的压强不变,说明达到平衡状态,故c正确;
d.3(NH3)=2(H2),并未指明正反应还是逆反应的速率,故无法判断正逆反应速率是否相等,故无法判断是否达到平衡状态,故d错误;
e.由于气体的质量和容器的体积不变,则无论是否达到平衡状态,容器中混合气体的密度都保持不变,故e错误;
故答案为:bc;
(4)由图可知,0-10分钟内n(N2)=0.025mol×2=0.05mol;10-20分钟内n′(N2)=0.025mol×4=0.1mol,所以0-10分钟与10到20分钟两个时间段中,N2的反应速率之比为0.05mol:0.1mol=1:2;由图象可知其他各组分物质的量变化加快,且10min时变化时各物质是连续变化的,20min达平衡时,说明10min可能改变的条件是升高温度或使用催化剂,故答案为:升高温度或使用了催化剂;
(5)从图中可知:第25分钟,NH3的物质的量突然减少了0.1mol,而H2、N2的物质的量不变,说明应是分离出NH3,生成物的浓度减小,平衡向正反应方向进行,正反应速率大于逆反应速率,故答案为:分离出0.1molNH3;>。
17.(1) 进行程度 完全 不完全
(2) 温度 浓度
【详解】(1)化学平衡常数的大小反映了化学反应的进行程度(即反应限度)。K值越大,说明正反应可以进行得越完全;K值越小,说明正反应可以进行得越不完全;
(2)化学平衡常数K只受温度的影响,与反应物或生成物的浓度变化无关。
18.(1) ①⑤⑧ ②④⑨
(2) H2O+AlO+H+Al(OH)3Al3++3OH- NaHCO3=Na++HCO H2CO3H++HCO
(3)③⑦⑧
【详解】(1)①是强酸,溶于水,在水中全部电离,是强电解质;②冰醋酸是弱酸,溶于水,在水中部分电离,冰醋酸是弱电解质;③氨水是混合物,既不是电解质也不是非电解质;④溶于水的部分,在水溶液中部分电离,是弱电解质;⑤溶于水,在水中全部电离,是强电解质;⑥Cu是单质,既不是电解质也不是非电解质;⑦氯水是混合物,既不是电解质也不是非电解质;⑧ 溶于水的部分,在水中全部电离,是强电解质;⑨是弱酸,在水溶液中部分电离,是弱电解质;⑩盐酸是混合物,既不是电解质也不是非电解质;故上述物质属于强电解质的有①⑤⑧;上述物质属于弱电解质的有②④⑨;
(2)④是两性物质并且属于弱电解质,在水溶液中既存在酸式电离,又存在碱式电离,其电离方程式为;⑤是强电解质,其电离方程式为;⑨是二元弱酸,是弱电解质,分步电离,第一步电离为主,其电离方程式为;
(3)①加,溶液中氢离子的物质的量浓度减小,反应速率减慢,①不符合题意;②加NaOH固体后,,溶液中氢离子的浓度减小,反应速率减慢,②不符合题意;③滴入几滴浓盐酸,氢离子浓度增大,反应速率加快,③符合题意;④加醋酸钠固体生成醋酸,醋酸是弱电解质,溶液中的氢离子的浓度减小,反应速率减慢,④不符合题意;⑤加NaCl溶液,溶液中的氢离子的浓度减小,反应速率减慢,⑤不符合题意;⑥滴入几滴硫酸铜溶液,金属铁把溶液中的铜离子置换出来,少量的铜覆盖在铁表面,在稀盐酸中形成原电池,反应速率加快,与盐酸反应的铁的物质的量减少,导致生成氢气的物质的量减少,⑥不符合题意;⑦升高温度(不考虑盐酸挥发),反应速率加快,⑦符合题意;⑧改用盐酸,氢离子的浓度增大,反应速率加快,⑧符合题意;故③⑦⑧符合题意。
19. mol·L-1·min-1 3A(g)+B(g) 2C(g) AD 4×104
【详解】(1)根据,0至t1时间内C物质的平均反应速率为 mol·L-1·min-1;0至t2时间内A、B、C物质的量的变化分别是0.3mol、0.1mol、0.2mol,根据化学计量数比等于物质的量变化之比,反应的方程式是3A(g)+B(g) 2C(g);
(2)A.根据图象,t1~t2速率加快;加入了催化剂可加快反应速率,故A可能;
B.降低了反应温度,反应速率减慢,故B不可能;
C.向容器中充入了C,C的物质的量应该突变,而图象中C的物质的量是渐变,故C不可能;
D.缩小了容器体积,浓度增大,化学反应速率加快,故D可能;
故答案选AD;
(3)化学平衡常数;
【点睛】可逆化学反应达到平衡状态时生成物与反应物的浓度(方程式化学计量数幂次方)乘积比是化学平衡常数。
20. 0.0175mol L-1 min-1 40% 40% 30% AC
【详解】(1)0~20min内HI的平均反应速率。
(2) 反应达到化学平衡状态时, ,则I2的转化率为 ,HI的理论产量为2mol,HI的产率为,容器内H2的体积分数为 。
(3) A.混合气体颜色不再改变 ,即碘蒸气浓度不再改变,则说明已经平衡,A正确;
B.氢气和碘蒸气生成碘化氢气体的反应中气体分子总数不变、体积容器内压强始终不变,则压强不变不能说明已平衡,B错误;
C.H2、I2、HI三种气体体积分数不再改变,符合平衡特征,说明已平衡,C正确;
D.密闭容器中,气体总质量、容积体积始终不变,故气体密度也始终不变、则混合气体密度不变不能说明已平衡,选项D错误;
该条件下,能说明上述反应达到化学平衡状态的是AC。
答案第1页,共2页
答案第1页,共2页
