8.2.3常见的碱课件(共29张PPT内嵌视频)2023-2024学年度科粤版化学九年级下册
文档属性
| 名称 | 8.2.3常见的碱课件(共29张PPT内嵌视频)2023-2024学年度科粤版化学九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 44.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-21 00:00:00 | ||
图片预览








文档简介
(共29张PPT)
课时3 常见的碱
九下 化学
科粤版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
教学环节
1.认识两种常见碱的组成、主要性质和用途。
2.认识碱的化学性质,知道碱能使指示剂变色、能够与非金属氧化物反应。
重难点
重点
情境导入
人类社会除了需要酸,同样也离不开碱,它们在生产生活中有哪些应用?
炉具清洁剂和肥皂中含有碱
使用石灰浆保护树木,防止冻伤,并防止害虫生卵。
实验室中常用的碱有哪些?它们都有哪些基本的性质?
氢氧化钠NaOH
俗称烧碱、火碱或苛性钠
氢氧化钾(KOH)
常见的碱
氢氧化钙Ca(OH)2
俗称熟石灰、消石灰
氢氧化钙是白色粉末状固体,微溶于水,俗称熟石灰其水溶液俗称石灰水。实验室常用石灰水检验CO2,当石灰水中存在较多未溶解的熟石灰时,就称为石灰乳或石灰浆。
氢氧化钙对皮肤、衣服等有腐蚀作用,使用时要注意安全。
Ca(OH)2微溶于水,结合以前所学知识,你能设计实验证明水中已溶有 Ca(OH)2吗?
粉刷墙壁作建筑材料
改良酸性土壤
配制农药波尔多液
涂刷树木防虫防病
氢氧化钙在生产中有着广泛的用途
工业上是如何制得 Ca(OH)2的呢?
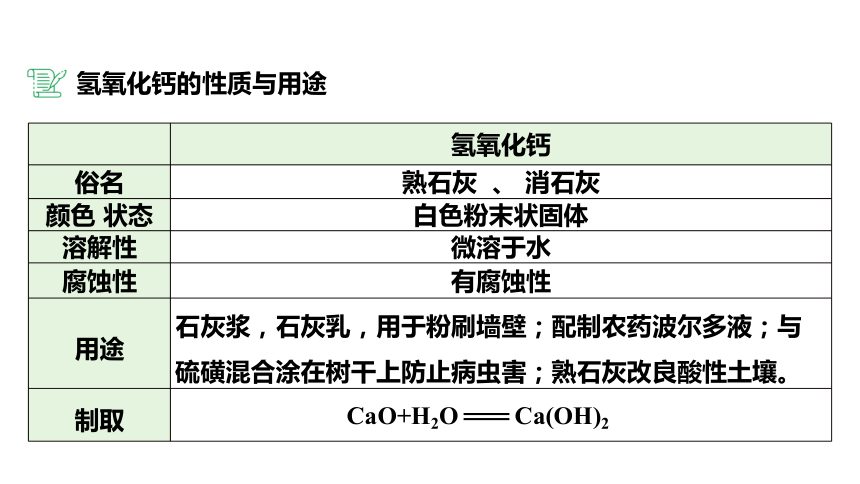
氢氧化钙
俗名 熟石灰 、 消石灰
颜色 状态 白色粉末状固体
溶解性 微溶于水
腐蚀性 有腐蚀性
用途 石灰浆,石灰乳,用于粉刷墙壁;配制农药波尔多液;与硫磺混合涂在树干上防止病虫害;熟石灰改良酸性土壤。
制取
CaO+H2O Ca(OH)2
氢氧化钙的性质与用途
CaCO3 Ca(OH)2+H2O
2.生石灰与水反应变成熟石灰:
CaO+H2O Ca(OH)2
生石灰:俗称氧化钙;具有强烈的吸水性,极易与水发生反应——常作为食品干燥剂;生石灰与水反应生成熟石灰的过程会放出大量的热。
生石灰可干燥某些碱性(NH3)或者中性气体(H2、O2);不能干燥CO2、SO2、HCl等气体。
1.高温煅烧石灰石(主要成分CaCO3 )得到生石灰
高温
熟石灰的制取
民族英雄林则徐曾在虎门用生石灰销毁鸦片,销毁鸦片为何不用火烧,是销烟而不是烧烟?
历史知识
氢氧化钠有强烈的腐蚀性,所以又叫做苛性钠、火碱或烧碱。
实验操作 实验现象 说明氢氧化钠何性质
(1)取少量固体氢氧化钠放在表面皿上 , 暴露在空气中一段时间
【实验8-10】知道氢氧化钠的潮解性 、水溶性和腐蚀性
表面潮湿并逐渐溶解
能吸收水分,潮解
吸收空气中的水分,表面潮湿并逐渐溶解,这种现象叫做潮解,属于物理变化。
O2
(含有H2O)
O2
氢氧化钠易吸水潮解(性质)
干燥剂(用途)
氢氧化钠作干燥剂用来干燥碱性(NH3)或者中性气体(H2、O2)(注意:不能干燥CO2、SO2、HCl等气体)。
氢氧化钠
实验操作 实验现象 说明氢氧化钠何性质
(2)取少量固体氢氧化钠放在试管中 , 加 水振荡 , 观察它的水溶性 , 并用手触摸试管 壁 , 感觉温度变化情况
试管外壁温度较高
溶解时放热
你还记得氢氧化钠固体溶于水的现象吗?
实验操作 实验现象 说明氢氧化钠何性质
(3) 取一块鸡腿肉 , 放进烧杯中 , 加入20% 的氢氧化钠溶液 , 浸泡数小时后 , 观察变化
腐烂
有强烈的腐蚀性
在工业上,氢氧化钠是一种重要的化工原料,广泛应用于制取肥皂,以及石油、造纸、纺织和印染等工业。
肥皂
造纸
纺织
印染
石油
氢氧化钠还能与油脂反应,在生活中可以用来去除油污,这就是炉具清洁剂中含有氢氧化钠的原因。
氢氧化钠
俗名 火碱 、 烧碱 、苛性钠 、
颜色 状态 白色固体
溶解性 易溶于水
潮解性 吸水性,可作某些气体的干燥剂
腐蚀性 有腐蚀性(称量时不能直接放在托盘中,要放在玻璃器皿中)
用途 化工原料,制肥皂,造纸,纺织,印染,去油污(炉具清洁剂)
氢氧化钠的性质与用途
下列各组物质的名称或俗称和化学式表示的是同一种物质的是( )
A.熟石灰、消石灰、CaO
B.铁锈、氢氧化铁、Fe(OH)3
C.生石灰、消石灰、Ca(OH)2
D.烧碱、火碱、NaOH
D
针对训练
×
Ca(OH)2
Fe2O3
CaO
紫色石蕊溶液 无色酚酞溶液
氢氧化钠溶液
氢氧化钙溶液
碱溶液(可溶性碱)能使无色酚酞溶液变红,使紫色石蕊溶液变蓝。
变红
变红
变蓝
变蓝
与酸碱指示剂作用
碱溶液的化学性质
碱与非金属氧化物反应
【实验8-11】两支充满二氧化碳的试管,一支倒插入水中,一支倒插入氢氧化钠溶液中,摆动试管。
现象:
两试管中的液面均上升,倒插在氢氧化钠溶液中的试管中的液面上升更高
化学方程式:
CO2 + 2NaOH ===Na2CO3 + H2O
碱 + 非金属氧化物 盐+水
是否所有的非金属氧化物都能与碱发生反应呢?观察一下反应你有什么发现?
Ca(OH)2 + CO2 === CaCO3↓ + H2O
2NaOH + CO2 === Na2CO3 + H2O
2NaOH + SO3 === Na2SO4 + H2O
这类反应中,反应前后每一种元素的化合价都没有变化
这类非金属氧化物恰好有“对应价态的酸根离子”
-2
-2
-2
+4
+2
+4
+4
+6
+6
+4
-2
-2
-2
+1
+1
+1
+1
+1
+2
+1
+1
+1
+1
+1
碱与盐反应
【实验 8 -12】用澄清石灰水分别与硫酸铜溶液和氯化铁溶液反应。
现象 化学方程式
石灰水+ CuSO4溶液
石灰水+ FeCl3溶液
CuSO4 + Ca(OH)2 === Cu(OH)2↓+CaSO4
产生蓝色沉淀
产生红褐色沉淀
碱+盐 新碱+新盐
2FeCl3+ 3Ca(OH)2 === 2Fe(OH)3↓+3CaCl2
氢氧化钠、氢氧化钙等碱在水溶液中都能产生氢氧根离子,所以碱溶液具有许多共同的化学性质
与酸碱指示剂作用
生成盐和水
与非金属氧化物
反应
与盐反应
碱的通性
新碱和新盐
石蕊溶液遇碱变蓝色
酚酞溶液遇碱变红色
碱的化学性质
碱溶液中都含有OH-,因此不同碱会表现出一些共同性质,下列有关氢氧化钙的描述中不能体现碱的共同性质的是( )
A. 能使无色酚酞试液变为红色
B. 能与碳酸钠反应生成碳酸钙沉淀
C. 能与氯化铜溶液反应生成氢氧化铜沉淀
D. 能与酸反应生成水
B
针对训练
碱溶液的组成
(都含有OH—)
1.与指示剂作用
化学性质
(碱性)
2.碱+非金属氧化物→盐+水
3.碱+盐→新盐+新盐
常见的碱
氢氧化钠、氢氧化钙等的性质与用途
组成
性质
决定
1. 下列物质中,不用密封保存的是( )
A.浓硫酸 B.氯化钠固体 C.浓盐酸 D.烧碱固体
2.盛放在敞口瓶内的下列物质长期暴露在空气中,瓶内物质的质量会减少的是( )
A.盐酸 B. 生石灰
C.浓硫酸 D.烧碱固体
B
A
3.下列气体中,既能用固体NaOH干燥又能用浓H2SO4干燥的是( )
A. CO2 B. HCl C. SO2 D. O2
D
4.如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压胶头滴管,使液体Y滴入锥形瓶中,充分振荡,观察到小气球膨胀起来。则气体X和液体Y不可能是( )
A.HCl、水
B.SO2、NaOH溶液
C.CO、稀硫酸
D.CO2、KOH溶液
C
5. 同学们为验证氢氧化钙的化学性质,做了以下实验(试管中均盛有氢氧化钙溶液)。
(1)将酚酞试液滴入氢氧化钙溶液中,溶液由无色变成红色,原因是其在水溶液中能解离出________(填离子符号)。
(2)B试管中发生反应的化学方程式为_______________________________。
OH-
Ca(OH) 2+CO2===CaCO3↓+ H2O
(3)C试管中可观察到的现象是______________。
(4)将B、C试管中反应后的物质过滤,将滤液倒入同一个大烧杯中,观察到有沉淀产生,由此可得出C试管反应后溶液中的溶质为___________
(填化学式)。
产生蓝色沉淀
CuCl2、CaCl2
1.选择外形完整、大小合适、具有网状叶脉的树叶。
2.用水将树叶刷洗干净,放在约10%的氢氧化钠溶液中煮沸。当叶肉呈现黄色后取出树叶,用水将树叶上的碱液洗净。
(使用氢氧化钠时要注意安全!)
3.将叶子平铺在瓷砖或玻璃板上,用试管刷或软牙刷
轻轻刷去叶肉。将剩下的叶脉放在水中轻轻清洗,
稍稍晾干后,夹在书中压平。
实践与拓展
自制“叶脉书签”
课时3 常见的碱
九下 化学
科粤版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
教学环节
1.认识两种常见碱的组成、主要性质和用途。
2.认识碱的化学性质,知道碱能使指示剂变色、能够与非金属氧化物反应。
重难点
重点
情境导入
人类社会除了需要酸,同样也离不开碱,它们在生产生活中有哪些应用?
炉具清洁剂和肥皂中含有碱
使用石灰浆保护树木,防止冻伤,并防止害虫生卵。
实验室中常用的碱有哪些?它们都有哪些基本的性质?
氢氧化钠NaOH
俗称烧碱、火碱或苛性钠
氢氧化钾(KOH)
常见的碱
氢氧化钙Ca(OH)2
俗称熟石灰、消石灰
氢氧化钙是白色粉末状固体,微溶于水,俗称熟石灰其水溶液俗称石灰水。实验室常用石灰水检验CO2,当石灰水中存在较多未溶解的熟石灰时,就称为石灰乳或石灰浆。
氢氧化钙对皮肤、衣服等有腐蚀作用,使用时要注意安全。
Ca(OH)2微溶于水,结合以前所学知识,你能设计实验证明水中已溶有 Ca(OH)2吗?
粉刷墙壁作建筑材料
改良酸性土壤
配制农药波尔多液
涂刷树木防虫防病
氢氧化钙在生产中有着广泛的用途
工业上是如何制得 Ca(OH)2的呢?
氢氧化钙
俗名 熟石灰 、 消石灰
颜色 状态 白色粉末状固体
溶解性 微溶于水
腐蚀性 有腐蚀性
用途 石灰浆,石灰乳,用于粉刷墙壁;配制农药波尔多液;与硫磺混合涂在树干上防止病虫害;熟石灰改良酸性土壤。
制取
CaO+H2O Ca(OH)2
氢氧化钙的性质与用途
CaCO3 Ca(OH)2+H2O
2.生石灰与水反应变成熟石灰:
CaO+H2O Ca(OH)2
生石灰:俗称氧化钙;具有强烈的吸水性,极易与水发生反应——常作为食品干燥剂;生石灰与水反应生成熟石灰的过程会放出大量的热。
生石灰可干燥某些碱性(NH3)或者中性气体(H2、O2);不能干燥CO2、SO2、HCl等气体。
1.高温煅烧石灰石(主要成分CaCO3 )得到生石灰
高温
熟石灰的制取
民族英雄林则徐曾在虎门用生石灰销毁鸦片,销毁鸦片为何不用火烧,是销烟而不是烧烟?
历史知识
氢氧化钠有强烈的腐蚀性,所以又叫做苛性钠、火碱或烧碱。
实验操作 实验现象 说明氢氧化钠何性质
(1)取少量固体氢氧化钠放在表面皿上 , 暴露在空气中一段时间
【实验8-10】知道氢氧化钠的潮解性 、水溶性和腐蚀性
表面潮湿并逐渐溶解
能吸收水分,潮解
吸收空气中的水分,表面潮湿并逐渐溶解,这种现象叫做潮解,属于物理变化。
O2
(含有H2O)
O2
氢氧化钠易吸水潮解(性质)
干燥剂(用途)
氢氧化钠作干燥剂用来干燥碱性(NH3)或者中性气体(H2、O2)(注意:不能干燥CO2、SO2、HCl等气体)。
氢氧化钠
实验操作 实验现象 说明氢氧化钠何性质
(2)取少量固体氢氧化钠放在试管中 , 加 水振荡 , 观察它的水溶性 , 并用手触摸试管 壁 , 感觉温度变化情况
试管外壁温度较高
溶解时放热
你还记得氢氧化钠固体溶于水的现象吗?
实验操作 实验现象 说明氢氧化钠何性质
(3) 取一块鸡腿肉 , 放进烧杯中 , 加入20% 的氢氧化钠溶液 , 浸泡数小时后 , 观察变化
腐烂
有强烈的腐蚀性
在工业上,氢氧化钠是一种重要的化工原料,广泛应用于制取肥皂,以及石油、造纸、纺织和印染等工业。
肥皂
造纸
纺织
印染
石油
氢氧化钠还能与油脂反应,在生活中可以用来去除油污,这就是炉具清洁剂中含有氢氧化钠的原因。
氢氧化钠
俗名 火碱 、 烧碱 、苛性钠 、
颜色 状态 白色固体
溶解性 易溶于水
潮解性 吸水性,可作某些气体的干燥剂
腐蚀性 有腐蚀性(称量时不能直接放在托盘中,要放在玻璃器皿中)
用途 化工原料,制肥皂,造纸,纺织,印染,去油污(炉具清洁剂)
氢氧化钠的性质与用途
下列各组物质的名称或俗称和化学式表示的是同一种物质的是( )
A.熟石灰、消石灰、CaO
B.铁锈、氢氧化铁、Fe(OH)3
C.生石灰、消石灰、Ca(OH)2
D.烧碱、火碱、NaOH
D
针对训练
×
Ca(OH)2
Fe2O3
CaO
紫色石蕊溶液 无色酚酞溶液
氢氧化钠溶液
氢氧化钙溶液
碱溶液(可溶性碱)能使无色酚酞溶液变红,使紫色石蕊溶液变蓝。
变红
变红
变蓝
变蓝
与酸碱指示剂作用
碱溶液的化学性质
碱与非金属氧化物反应
【实验8-11】两支充满二氧化碳的试管,一支倒插入水中,一支倒插入氢氧化钠溶液中,摆动试管。
现象:
两试管中的液面均上升,倒插在氢氧化钠溶液中的试管中的液面上升更高
化学方程式:
CO2 + 2NaOH ===Na2CO3 + H2O
碱 + 非金属氧化物 盐+水
是否所有的非金属氧化物都能与碱发生反应呢?观察一下反应你有什么发现?
Ca(OH)2 + CO2 === CaCO3↓ + H2O
2NaOH + CO2 === Na2CO3 + H2O
2NaOH + SO3 === Na2SO4 + H2O
这类反应中,反应前后每一种元素的化合价都没有变化
这类非金属氧化物恰好有“对应价态的酸根离子”
-2
-2
-2
+4
+2
+4
+4
+6
+6
+4
-2
-2
-2
+1
+1
+1
+1
+1
+2
+1
+1
+1
+1
+1
碱与盐反应
【实验 8 -12】用澄清石灰水分别与硫酸铜溶液和氯化铁溶液反应。
现象 化学方程式
石灰水+ CuSO4溶液
石灰水+ FeCl3溶液
CuSO4 + Ca(OH)2 === Cu(OH)2↓+CaSO4
产生蓝色沉淀
产生红褐色沉淀
碱+盐 新碱+新盐
2FeCl3+ 3Ca(OH)2 === 2Fe(OH)3↓+3CaCl2
氢氧化钠、氢氧化钙等碱在水溶液中都能产生氢氧根离子,所以碱溶液具有许多共同的化学性质
与酸碱指示剂作用
生成盐和水
与非金属氧化物
反应
与盐反应
碱的通性
新碱和新盐
石蕊溶液遇碱变蓝色
酚酞溶液遇碱变红色
碱的化学性质
碱溶液中都含有OH-,因此不同碱会表现出一些共同性质,下列有关氢氧化钙的描述中不能体现碱的共同性质的是( )
A. 能使无色酚酞试液变为红色
B. 能与碳酸钠反应生成碳酸钙沉淀
C. 能与氯化铜溶液反应生成氢氧化铜沉淀
D. 能与酸反应生成水
B
针对训练
碱溶液的组成
(都含有OH—)
1.与指示剂作用
化学性质
(碱性)
2.碱+非金属氧化物→盐+水
3.碱+盐→新盐+新盐
常见的碱
氢氧化钠、氢氧化钙等的性质与用途
组成
性质
决定
1. 下列物质中,不用密封保存的是( )
A.浓硫酸 B.氯化钠固体 C.浓盐酸 D.烧碱固体
2.盛放在敞口瓶内的下列物质长期暴露在空气中,瓶内物质的质量会减少的是( )
A.盐酸 B. 生石灰
C.浓硫酸 D.烧碱固体
B
A
3.下列气体中,既能用固体NaOH干燥又能用浓H2SO4干燥的是( )
A. CO2 B. HCl C. SO2 D. O2
D
4.如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压胶头滴管,使液体Y滴入锥形瓶中,充分振荡,观察到小气球膨胀起来。则气体X和液体Y不可能是( )
A.HCl、水
B.SO2、NaOH溶液
C.CO、稀硫酸
D.CO2、KOH溶液
C
5. 同学们为验证氢氧化钙的化学性质,做了以下实验(试管中均盛有氢氧化钙溶液)。
(1)将酚酞试液滴入氢氧化钙溶液中,溶液由无色变成红色,原因是其在水溶液中能解离出________(填离子符号)。
(2)B试管中发生反应的化学方程式为_______________________________。
OH-
Ca(OH) 2+CO2===CaCO3↓+ H2O
(3)C试管中可观察到的现象是______________。
(4)将B、C试管中反应后的物质过滤,将滤液倒入同一个大烧杯中,观察到有沉淀产生,由此可得出C试管反应后溶液中的溶质为___________
(填化学式)。
产生蓝色沉淀
CuCl2、CaCl2
1.选择外形完整、大小合适、具有网状叶脉的树叶。
2.用水将树叶刷洗干净,放在约10%的氢氧化钠溶液中煮沸。当叶肉呈现黄色后取出树叶,用水将树叶上的碱液洗净。
(使用氢氧化钠时要注意安全!)
3.将叶子平铺在瓷砖或玻璃板上,用试管刷或软牙刷
轻轻刷去叶肉。将剩下的叶脉放在水中轻轻清洗,
稍稍晾干后,夹在书中压平。
实践与拓展
自制“叶脉书签”
