8.4.1几种常见盐的用途课件(共26张PPT)2023-2024学年度科粤版化学九年级下册
文档属性
| 名称 | 8.4.1几种常见盐的用途课件(共26张PPT)2023-2024学年度科粤版化学九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 15.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-22 00:00:00 | ||
图片预览








文档简介
(共26张PPT)
课时1 几种常见盐的
用途
九下 化学
科粤版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
教学环节
1. 了解氯化钠、碳酸钠、碳酸氢钠、碳酸钙这几种盐的性状和用途;
2. 知道氯化钠、碳酸钠、碳酸氢钠、碳酸钙等物质在生产、生活中的重要性。
重点
学习目标
氯化钠
NaCl
碳酸钠
Na2CO3
碳酸钙
CaCO3
碳酸氢钠
NaHCO3
以上生活中常见的盐,你了解它们的组成和性质及用途吗?
(1)性状
①白色晶体,易溶于水,有咸味,
②溶液呈中性,溶解度受外界温度变化影响不大
氯化钠(NaCl)食盐的主要成分
“食盐是盐,盐就是食盐”这句话对吗?
几种常见盐的用途
(2)用途
医疗:配制生理盐水
农业:选种
工业:化工原料
交通:融雪剂
生活:作调味品、腌渍食品
(3)分布
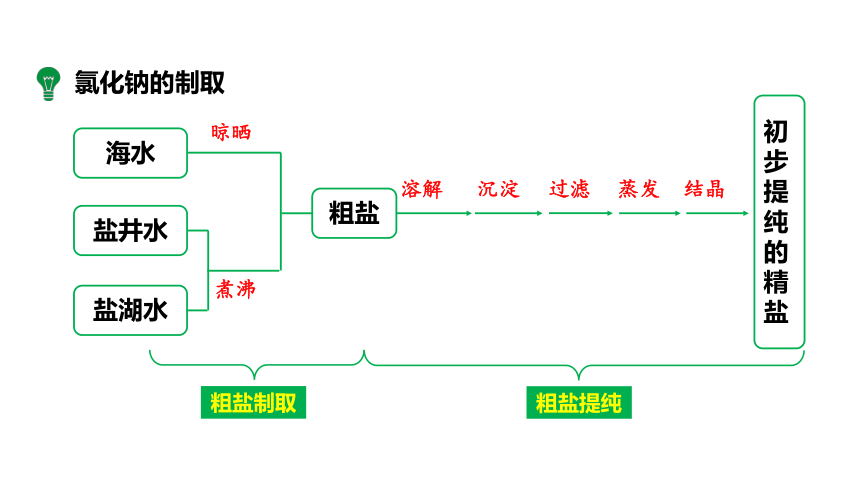
氯化钠在自然界中分布很广,除海水里含有大量氯化钠外,盐湖、盐井和盐矿也是氯化钠的来源。
海洋
盐湖
盐井
盐矿
粗盐制取
海水
盐井水
盐湖水
粗盐
初步提纯的精盐
溶解
沉淀
过滤
蒸发
结晶
煮沸
粗盐提纯
氯化钠的制取
晾晒
碳酸钙(CaCO3)石灰石、大理石的主要成分
(1)性状
①白色固体(纯净物为白色粉末)
②不溶于水,能溶于酸
CaCO3可用作建筑材料、补钙剂、炼铁炼钢的原料
(2)用途
(3)自然界中碳酸钙的存在
大理石
石灰石
珍珠
蛋壳
贝壳
水垢
圆明园号称万园之园,是我国劳动人民用血汗修建的皇家园林,收藏了许多精美的珍宝、图书和艺术杰作,动用了大量的汉白玉石料(主要成分是CaCO3)。1860年,英法联军攻入北京在圆内大肆抢夺、破坏,到处放火,熊火烧毁了亭台楼阁,
一些用汉白玉修建的宏伟建筑经大火
焚烧,酥裂开来,成了碎片。你能说
出导致大理石酥裂的原因吗?
碳酸钙高温分解:CaCO3 CaO + CO2↑
石灰石、生石灰、熟石灰在一定条件下可以相互转化,你能写出反应的化学方程式吗?
石灰石(碳酸钙)
生石灰
熟石灰
高温
水
CO2
CaCO3 CaO + CO2↑
CaO + H2O===Ca(OH)2
CO2 + Ca(OH)2=== CaCO3↓ + H2O
碳酸钠(Na2CO3)俗名纯碱、苏打
(1)性状
白色晶体,易溶于水,水溶液显碱性
虽然碳酸钠的水溶液呈碱性,但它可不是碱哦!纯碱不是碱!
碳酸钠广泛用于玻璃、纺织、造纸和洗涤剂的生产等。
(2)用途
碳酸氢钠(NaHCO3)俗名小苏打
(1)物理性质
①白色粉末,能溶于水
②水溶液有弱碱性,较易分解
(2)用途
碳酸氢钠科做治疗胃酸的胃药、做面点发酵剂、含做灭火剂的原料等
我国制碱专家侯德榜
纯碱用途广泛。在过去 ,其生产技术长期把持在西方发达国家手中。生于福建农民家庭的侯德榜(1890— 1974)1921年从美国获博士学位后回国创业。1926 年他主持生产出高纯度的“红三角牌”
纯碱,获当年美国费城万国博览会金奖,为中国民
族化工赢得了声誉,结束了列强垄断纯碱生产的局
面。抗日战争时期,在艰苦条件下,侯德榜成功摸
索和改进西方制碱方法,发明将制碱与制氨结合起
来的联合制碱法。此法提高了原料利用率,降低了
成本 ,被世界上公认,称之为“侯氏联合制碱法”。
拓展视野
1. 将氯化钠溶于水制成饱和氯化钠溶液。
2. 先通入NH3达饱和。
3. 再通入CO2至饱和。
4. 过滤,得到碳酸氢钠固体。
5. 加热固体,得纯碱。
6. 滤液,主要是氯化铵。
NH3+CO2+H2O === NH4HCO3
NaCl+NH4HCO3 ===NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+H2O+CO2↑
NaCl+H2O + NH3+CO2═══NaHCO3↓+NH4Cl
侯德榜制碱法工艺流程
△
物质 氯化钠 碳酸钠 碳酸氢钠 碳酸钙
俗称或主要成分 食盐 的主要成分 纯碱、苏打 小苏打 大理石、石灰石的主要成分
化学式 NaCl Na2CO3 NaHCO3 CaCO3
颜色、状态 白色晶体 白色粉末状固体 白色晶体 白色固体
氯化钠、碳酸钠、碳酸氢钠、碳酸钙的比较
物质 氯化钠 碳酸钠 碳酸氢钠 碳酸钙
水溶性 易溶于水 易溶于水 能溶于水 不溶于水
水溶性的酸碱性 中性 碱性 碱性
主要 用途 作调味品,配制生理盐水,生产氯气、烧碱等 用于玻璃、造纸、纺织和日用化学工业等 治疗胃酸过多,焙制糕点等 补钙剂,石灰石作建筑材料、实验室制CO2等
1. 氯化钠是日常生活中最常见的一种盐,下列有关氯化钠的描述正确的是( )
A. 氯化钠是重要的调味品,可以腌渍蔬菜、鱼、肉等
B. 氯化钠是人体正常生理活动所必需的,所以摄入量越多越好
C. 氯化钠可以用来配制农药波尔多液
D. 通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到纯净的氯化钠
A
2. 下列有关碳酸钠的说法正确的是( )
A. 碳酸钠的俗称是烧碱
B. 碳酸钠是发酵粉的主要成分之一
C. 碳酸钠的相对分子质量为106
D. 实验室常用碳酸钠与稀盐酸反应制取二氧化碳
C
3. 下列不能用于鉴别碳酸钙和氯化钙固体的方法是( )
A. 加入蒸馏水 B. 加入稀硫酸
C. 观察颜色 D. 加入稀盐酸
C
4. 现有下列物质:纯碱、小苏打、苛性钠、氯化钠,请选择合适物质的化学式填空。
(1)可用于制肥皂的是________。
(2)可用于治疗胃酸过多的是__________。
(3)可用来消除公路上积雪的是________。
(4)可用于玻璃、造纸、纺织和洗涤剂的生产的是________。
NaOH
NaHCO3
NaCl
Na2CO3
4. (2022巴中)我国著名的化工专家侯德榜,为纯碱和氮肥工业的发展作出了杰出贡献。侯氏制碱法的原理为:
NaCl+NH3+CO2+H2O ===== NH4Cl+NaHCO3↓、
2NaHCO3 Na2CO3+CO2↑+H2O。
(1)Na2CO3属于_____(选填“酸”“碱”或“盐”),溶于水形成的溶液显_____性, 其用途_____________________________(任写一条)。
(2)NH3中氮元素的化合价是____价。
革命文化
盐
碱
可用作洗涤剂的生产(合理即可)
-3
(3)写出碳酸钠溶液与澄清石灰水反应的化学方程式_______________________________________。
(4)NaHCO3是发酵粉的主要成分,它与厨房中食醋的主要成分反应如下:NaHCO3+CH3COOH ===== CH3COONa+X+CO2↑,则X为______(填化学式)。
H2O
Na2CO3 + 2HCl 2NaCl + CO2 ↑ + H2O
课时1 几种常见盐的
用途
九下 化学
科粤版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
教学环节
1. 了解氯化钠、碳酸钠、碳酸氢钠、碳酸钙这几种盐的性状和用途;
2. 知道氯化钠、碳酸钠、碳酸氢钠、碳酸钙等物质在生产、生活中的重要性。
重点
学习目标
氯化钠
NaCl
碳酸钠
Na2CO3
碳酸钙
CaCO3
碳酸氢钠
NaHCO3
以上生活中常见的盐,你了解它们的组成和性质及用途吗?
(1)性状
①白色晶体,易溶于水,有咸味,
②溶液呈中性,溶解度受外界温度变化影响不大
氯化钠(NaCl)食盐的主要成分
“食盐是盐,盐就是食盐”这句话对吗?
几种常见盐的用途
(2)用途
医疗:配制生理盐水
农业:选种
工业:化工原料
交通:融雪剂
生活:作调味品、腌渍食品
(3)分布
氯化钠在自然界中分布很广,除海水里含有大量氯化钠外,盐湖、盐井和盐矿也是氯化钠的来源。
海洋
盐湖
盐井
盐矿
粗盐制取
海水
盐井水
盐湖水
粗盐
初步提纯的精盐
溶解
沉淀
过滤
蒸发
结晶
煮沸
粗盐提纯
氯化钠的制取
晾晒
碳酸钙(CaCO3)石灰石、大理石的主要成分
(1)性状
①白色固体(纯净物为白色粉末)
②不溶于水,能溶于酸
CaCO3可用作建筑材料、补钙剂、炼铁炼钢的原料
(2)用途
(3)自然界中碳酸钙的存在
大理石
石灰石
珍珠
蛋壳
贝壳
水垢
圆明园号称万园之园,是我国劳动人民用血汗修建的皇家园林,收藏了许多精美的珍宝、图书和艺术杰作,动用了大量的汉白玉石料(主要成分是CaCO3)。1860年,英法联军攻入北京在圆内大肆抢夺、破坏,到处放火,熊火烧毁了亭台楼阁,
一些用汉白玉修建的宏伟建筑经大火
焚烧,酥裂开来,成了碎片。你能说
出导致大理石酥裂的原因吗?
碳酸钙高温分解:CaCO3 CaO + CO2↑
石灰石、生石灰、熟石灰在一定条件下可以相互转化,你能写出反应的化学方程式吗?
石灰石(碳酸钙)
生石灰
熟石灰
高温
水
CO2
CaCO3 CaO + CO2↑
CaO + H2O===Ca(OH)2
CO2 + Ca(OH)2=== CaCO3↓ + H2O
碳酸钠(Na2CO3)俗名纯碱、苏打
(1)性状
白色晶体,易溶于水,水溶液显碱性
虽然碳酸钠的水溶液呈碱性,但它可不是碱哦!纯碱不是碱!
碳酸钠广泛用于玻璃、纺织、造纸和洗涤剂的生产等。
(2)用途
碳酸氢钠(NaHCO3)俗名小苏打
(1)物理性质
①白色粉末,能溶于水
②水溶液有弱碱性,较易分解
(2)用途
碳酸氢钠科做治疗胃酸的胃药、做面点发酵剂、含做灭火剂的原料等
我国制碱专家侯德榜
纯碱用途广泛。在过去 ,其生产技术长期把持在西方发达国家手中。生于福建农民家庭的侯德榜(1890— 1974)1921年从美国获博士学位后回国创业。1926 年他主持生产出高纯度的“红三角牌”
纯碱,获当年美国费城万国博览会金奖,为中国民
族化工赢得了声誉,结束了列强垄断纯碱生产的局
面。抗日战争时期,在艰苦条件下,侯德榜成功摸
索和改进西方制碱方法,发明将制碱与制氨结合起
来的联合制碱法。此法提高了原料利用率,降低了
成本 ,被世界上公认,称之为“侯氏联合制碱法”。
拓展视野
1. 将氯化钠溶于水制成饱和氯化钠溶液。
2. 先通入NH3达饱和。
3. 再通入CO2至饱和。
4. 过滤,得到碳酸氢钠固体。
5. 加热固体,得纯碱。
6. 滤液,主要是氯化铵。
NH3+CO2+H2O === NH4HCO3
NaCl+NH4HCO3 ===NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+H2O+CO2↑
NaCl+H2O + NH3+CO2═══NaHCO3↓+NH4Cl
侯德榜制碱法工艺流程
△
物质 氯化钠 碳酸钠 碳酸氢钠 碳酸钙
俗称或主要成分 食盐 的主要成分 纯碱、苏打 小苏打 大理石、石灰石的主要成分
化学式 NaCl Na2CO3 NaHCO3 CaCO3
颜色、状态 白色晶体 白色粉末状固体 白色晶体 白色固体
氯化钠、碳酸钠、碳酸氢钠、碳酸钙的比较
物质 氯化钠 碳酸钠 碳酸氢钠 碳酸钙
水溶性 易溶于水 易溶于水 能溶于水 不溶于水
水溶性的酸碱性 中性 碱性 碱性
主要 用途 作调味品,配制生理盐水,生产氯气、烧碱等 用于玻璃、造纸、纺织和日用化学工业等 治疗胃酸过多,焙制糕点等 补钙剂,石灰石作建筑材料、实验室制CO2等
1. 氯化钠是日常生活中最常见的一种盐,下列有关氯化钠的描述正确的是( )
A. 氯化钠是重要的调味品,可以腌渍蔬菜、鱼、肉等
B. 氯化钠是人体正常生理活动所必需的,所以摄入量越多越好
C. 氯化钠可以用来配制农药波尔多液
D. 通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到纯净的氯化钠
A
2. 下列有关碳酸钠的说法正确的是( )
A. 碳酸钠的俗称是烧碱
B. 碳酸钠是发酵粉的主要成分之一
C. 碳酸钠的相对分子质量为106
D. 实验室常用碳酸钠与稀盐酸反应制取二氧化碳
C
3. 下列不能用于鉴别碳酸钙和氯化钙固体的方法是( )
A. 加入蒸馏水 B. 加入稀硫酸
C. 观察颜色 D. 加入稀盐酸
C
4. 现有下列物质:纯碱、小苏打、苛性钠、氯化钠,请选择合适物质的化学式填空。
(1)可用于制肥皂的是________。
(2)可用于治疗胃酸过多的是__________。
(3)可用来消除公路上积雪的是________。
(4)可用于玻璃、造纸、纺织和洗涤剂的生产的是________。
NaOH
NaHCO3
NaCl
Na2CO3
4. (2022巴中)我国著名的化工专家侯德榜,为纯碱和氮肥工业的发展作出了杰出贡献。侯氏制碱法的原理为:
NaCl+NH3+CO2+H2O ===== NH4Cl+NaHCO3↓、
2NaHCO3 Na2CO3+CO2↑+H2O。
(1)Na2CO3属于_____(选填“酸”“碱”或“盐”),溶于水形成的溶液显_____性, 其用途_____________________________(任写一条)。
(2)NH3中氮元素的化合价是____价。
革命文化
盐
碱
可用作洗涤剂的生产(合理即可)
-3
(3)写出碳酸钠溶液与澄清石灰水反应的化学方程式_______________________________________。
(4)NaHCO3是发酵粉的主要成分,它与厨房中食醋的主要成分反应如下:NaHCO3+CH3COOH ===== CH3COONa+X+CO2↑,则X为______(填化学式)。
H2O
Na2CO3 + 2HCl 2NaCl + CO2 ↑ + H2O
