8.4.2盐的化学性质复分解反应发生的条件课件(共22张PPT)2023-2024学年度科粤版化学九年级下册
文档属性
| 名称 | 8.4.2盐的化学性质复分解反应发生的条件课件(共22张PPT)2023-2024学年度科粤版化学九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 802.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-22 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
课时2 盐的化学性质
复分解反应发生的条件
九下 化学
科粤版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
教学环节
1. 了解盐的组成特点。
2. 认识盐的化学性质;了解硫酸根离子的检验方法。
3. 了解复分解反应发生的条件,学会判断复分解反应是否能发生。
难点
重点
学习目标
盐:指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物。
金属离子或
铵根离子
酸根离子
Ca(OH)2 HCl Fe
Na2CO3 CaCO3 Ag
NaCl CaCl2 CuSO4
以上物质中属于盐的有哪些?你能对这些盐按照组成中含有的离子对其进行分类吗?
盐的组成和化学性质
Na2CO3 CaCO3 NaCl CaCl2 CuSO4
依据盐所含阳离子种类
钠盐:NaCl、Na2CO3、
钙盐:CaCl2、CaCO3
依据盐所含酸根离子种类
盐酸盐:NaCl、CaCl2
硫酸盐:CuSO4
碳酸盐:Na2CO3、CaCO3
按照以上分类你还知道哪些其他的盐?
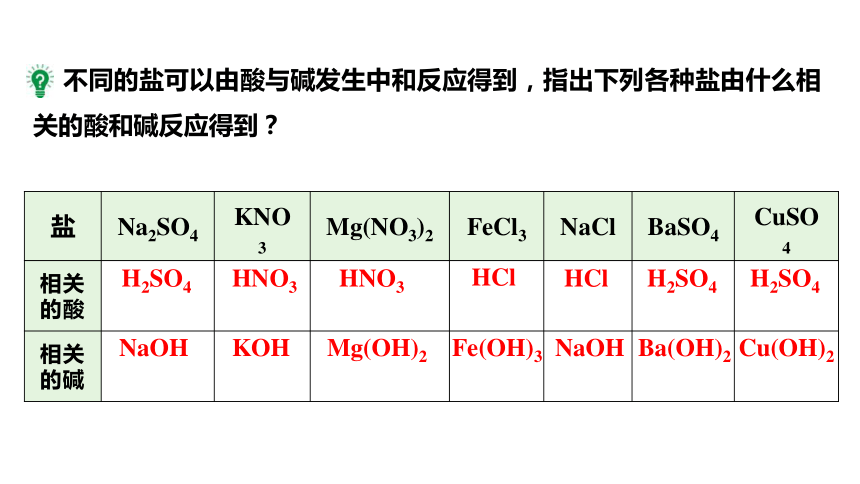
不同的盐可以由酸与碱发生中和反应得到,指出下列各种盐由什么相关的酸和碱反应得到?
盐 Na2SO4 KNO3 Mg(NO3)2 FeCl3 NaCl BaSO4 CuSO4
相关的酸
相关的碱
H2SO4
NaOH
HNO3
KOH
HNO3
Mg(OH)2
HCl
Fe(OH)3
HCl
NaOH
Ba(OH)2
H2SO4
Cu(OH)2
H2SO4
CaCO3 + 2HCl === CaCl2 + H2 CO2
AgNO3 + HCl === HNO3+ AgCl↓
盐能与酸反应:盐+酸 → 新盐+新酸
碳酸钙与盐酸的复分解反应:
硝酸银与盐酸的复分解反应:
1.盐与酸的反应
盐的复分解反应
H2O + CO2↑
(盐) (酸) (新盐) (新酸)
(盐) (酸) (新酸) (新盐)
盐能与碱反应:盐+碱 → 新碱+新盐
CuSO4 +Ca(OH)2=== Cu(OH)2↓+CaSO4
2FeCl3+3Ca(OH)2===2Fe(OH)3↓+3CaCl2
2.盐与碱的反应
硫酸铜或氯化铁跟氢氧化钙的复分解反应:
(盐) (碱) (新碱) (新盐)
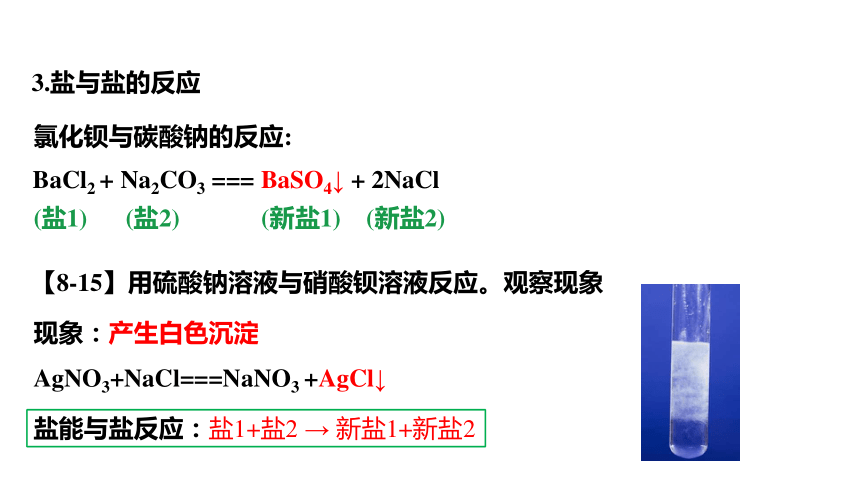
BaCl2 + Na2CO3 === BaSO4↓ + 2NaCl
盐能与盐反应:盐1+盐2 → 新盐1+新盐2
现象:产生白色沉淀
AgNO3+NaCl===NaNO3 +AgCl↓
3.盐与盐的反应
氯化钡与碳酸钠的反应:
【8-15】用硫酸钠溶液与硝酸钡溶液反应。观察现象
(盐1) (盐2) (新盐1) (新盐2)
与酸反应
新碱+新盐
与碱反应
与盐反应
盐的通性
新盐1+新盐2
新盐+新酸
盐的化学性质
【实验8-16】向硫酸钠溶液与硝酸钡溶液反应后所得有硫酸钡沉淀的试管中,滴加几滴稀硝酸,观察到的现象是 。
【实验8-17】用碳酸钠溶液代替硫酸钠溶液 ,重做上述两个实验: (1) 在碳酸钠溶液中滴入硝酸钡溶液;(2) 继续向刚才实验的试管中加入几滴稀硝酸。
白色沉淀不消失
分项 实验现象 化学方程式
实验 8 -17 (1)
实验 8 -17 (2)
白色沉淀产生
Ba(NO3)2+Na2CO3 ===BaCO3↓+2NaNO3
有气泡产生,沉淀逐渐溶解
BaCO3+2HNO3 ===Ba(NO3)2+H2O+CO2↑
硫酸钡沉淀不溶于稀硝酸。根据这一特征, 可用硝酸钡溶液鉴别硫酸和可溶性硫酸盐。
盐与酸、盐与碱、盐与盐发生的反应都是复分解反应,观察这些反应,你有什么发现?
只有当生成物物中有沉淀(难溶物)或气体或水等,才能发生复分解反应。
生成物中有气体、水或沉淀
生成物中有沉淀
生成物中有沉淀
复分解反应发生的条件
酸碱盐溶解性表(20℃)
酸、碱、盐的溶解性
1.常见的酸大多溶于水;
2.常见的碱中只有五种溶于水:
KOH、NaOH、Ba(OH)2、Ca(OH)2(微溶物)、NH3·H2O;
3.钾盐、钠盐、铵盐、硝酸盐,都能溶于水;
4.盐酸盐(也称氯化物)不溶于水的有AgCl;
5.硫酸盐不溶于水的有BaSO4;
6.碳酸盐:含钾、钠、铵根离子的碳酸盐溶于水。
根据复分解反应发生的条件,并利用课本后附录 所提供的有关酸、碱、盐溶解性的信息,判断稀硫酸与下表中的四种化合物的溶液之间是否能发生反应。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸
判断 依据
能
不能
能
能
有水生成
没有沉淀或气体或水生成
有气体、水生成
有沉淀生成
?
复分解反应的微观探析(以氢氧化钙与碳酸钠反应为例)
微观上来说:复分解反应的实质是两种化合物在水溶液中互相交换离子,只要离子之间能够互相结合生成气体、沉淀或水,反应就可以发生。
Ca2+、OH-
Na+、CO3 2-
Na+、OH-
Ca(OH)2 + Na2CO3 ===2NaOH+ CaCO3↓
CaCO3
①H+ + → H2O + CO2↑
(1)生成水:
(2)生成水和气体:
②H+ + → H2O + CO2↑
③ + OH- → NH3↑ + H2O
(3)生成沉淀:
①Ca2+ + → CaCO3↓
②Ba2+ + → BaCO3↓
③Ba2+ + → BaSO4↓
H+ + OH- → H2O
离子对在水中是否大量共存的依据
常见能生成水、气体、沉淀的离子组合
与酸反应
新碱+新盐
与碱反应
与盐反应
盐的通性
新盐1+新盐2
新盐+新酸
盐
复分解反应发生的条件
复分解反应发生的条件
有沉淀、气体或水生成
1. 下列对于盐的组成叙述正确的是( )
A. 一定含有金属元素 B. 一定含有酸根
C. 一定含有氢元素 D. 一定含有原子团
B
2.判断复分解反应是否发生,不必考虑的是( )
A.是否有水生成 B.是否有气体生成
C.是否有沉淀生成 D.金属活动性顺序
D
3. 下列物质跟锌、氯化钡溶液、氢氧化钠溶液都能发生反应的是( )
A. 稀盐酸 B. CuSO4溶液
C. K2CO3溶液 D. Ca(OH)2溶液
B
C
4.下列各组物质中,能发生复分解反应且反应后溶液总质量变小的是( )
A.铁和硫酸铜溶液
B.氢氧化钠溶液和盐酸
C.稀硫酸和氯化钡溶液
D.碳酸钠溶液和氯化钾溶液
置换反应
复分解反应;溶液质量不变
复分解反应;溶液质量变小
不反应
5. 下列选项中各溶质的溶液混合,能大量共存且形成无色溶液的是
( )
A. KMnO4、NaCl、AgNO3 B. K2CO3、CaCl2、HNO3
C. BaCl2、Cu(NO3)2、H2SO4 D. MgCl2、AlCl3、Na2SO4
D
6. 某同学学习了常见的盐后,总结出盐的化学性质如图所示。请回答下列问题。
(1)X属于______(填物质类别)。
(2)能与盐反应的金属应满足的条件是______________________________。
(3)写出一个盐与碱反应的化学方程式______________________________
_________。
酸
金属的活动性比盐中金属的活动性强
CuSO4+2NaOH=== Cu(OH)2↓+
+Na2SO4
课时2 盐的化学性质
复分解反应发生的条件
九下 化学
科粤版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
教学环节
1. 了解盐的组成特点。
2. 认识盐的化学性质;了解硫酸根离子的检验方法。
3. 了解复分解反应发生的条件,学会判断复分解反应是否能发生。
难点
重点
学习目标
盐:指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物。
金属离子或
铵根离子
酸根离子
Ca(OH)2 HCl Fe
Na2CO3 CaCO3 Ag
NaCl CaCl2 CuSO4
以上物质中属于盐的有哪些?你能对这些盐按照组成中含有的离子对其进行分类吗?
盐的组成和化学性质
Na2CO3 CaCO3 NaCl CaCl2 CuSO4
依据盐所含阳离子种类
钠盐:NaCl、Na2CO3、
钙盐:CaCl2、CaCO3
依据盐所含酸根离子种类
盐酸盐:NaCl、CaCl2
硫酸盐:CuSO4
碳酸盐:Na2CO3、CaCO3
按照以上分类你还知道哪些其他的盐?
不同的盐可以由酸与碱发生中和反应得到,指出下列各种盐由什么相关的酸和碱反应得到?
盐 Na2SO4 KNO3 Mg(NO3)2 FeCl3 NaCl BaSO4 CuSO4
相关的酸
相关的碱
H2SO4
NaOH
HNO3
KOH
HNO3
Mg(OH)2
HCl
Fe(OH)3
HCl
NaOH
Ba(OH)2
H2SO4
Cu(OH)2
H2SO4
CaCO3 + 2HCl === CaCl2 + H2 CO2
AgNO3 + HCl === HNO3+ AgCl↓
盐能与酸反应:盐+酸 → 新盐+新酸
碳酸钙与盐酸的复分解反应:
硝酸银与盐酸的复分解反应:
1.盐与酸的反应
盐的复分解反应
H2O + CO2↑
(盐) (酸) (新盐) (新酸)
(盐) (酸) (新酸) (新盐)
盐能与碱反应:盐+碱 → 新碱+新盐
CuSO4 +Ca(OH)2=== Cu(OH)2↓+CaSO4
2FeCl3+3Ca(OH)2===2Fe(OH)3↓+3CaCl2
2.盐与碱的反应
硫酸铜或氯化铁跟氢氧化钙的复分解反应:
(盐) (碱) (新碱) (新盐)
BaCl2 + Na2CO3 === BaSO4↓ + 2NaCl
盐能与盐反应:盐1+盐2 → 新盐1+新盐2
现象:产生白色沉淀
AgNO3+NaCl===NaNO3 +AgCl↓
3.盐与盐的反应
氯化钡与碳酸钠的反应:
【8-15】用硫酸钠溶液与硝酸钡溶液反应。观察现象
(盐1) (盐2) (新盐1) (新盐2)
与酸反应
新碱+新盐
与碱反应
与盐反应
盐的通性
新盐1+新盐2
新盐+新酸
盐的化学性质
【实验8-16】向硫酸钠溶液与硝酸钡溶液反应后所得有硫酸钡沉淀的试管中,滴加几滴稀硝酸,观察到的现象是 。
【实验8-17】用碳酸钠溶液代替硫酸钠溶液 ,重做上述两个实验: (1) 在碳酸钠溶液中滴入硝酸钡溶液;(2) 继续向刚才实验的试管中加入几滴稀硝酸。
白色沉淀不消失
分项 实验现象 化学方程式
实验 8 -17 (1)
实验 8 -17 (2)
白色沉淀产生
Ba(NO3)2+Na2CO3 ===BaCO3↓+2NaNO3
有气泡产生,沉淀逐渐溶解
BaCO3+2HNO3 ===Ba(NO3)2+H2O+CO2↑
硫酸钡沉淀不溶于稀硝酸。根据这一特征, 可用硝酸钡溶液鉴别硫酸和可溶性硫酸盐。
盐与酸、盐与碱、盐与盐发生的反应都是复分解反应,观察这些反应,你有什么发现?
只有当生成物物中有沉淀(难溶物)或气体或水等,才能发生复分解反应。
生成物中有气体、水或沉淀
生成物中有沉淀
生成物中有沉淀
复分解反应发生的条件
酸碱盐溶解性表(20℃)
酸、碱、盐的溶解性
1.常见的酸大多溶于水;
2.常见的碱中只有五种溶于水:
KOH、NaOH、Ba(OH)2、Ca(OH)2(微溶物)、NH3·H2O;
3.钾盐、钠盐、铵盐、硝酸盐,都能溶于水;
4.盐酸盐(也称氯化物)不溶于水的有AgCl;
5.硫酸盐不溶于水的有BaSO4;
6.碳酸盐:含钾、钠、铵根离子的碳酸盐溶于水。
根据复分解反应发生的条件,并利用课本后附录 所提供的有关酸、碱、盐溶解性的信息,判断稀硫酸与下表中的四种化合物的溶液之间是否能发生反应。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸
判断 依据
能
不能
能
能
有水生成
没有沉淀或气体或水生成
有气体、水生成
有沉淀生成
?
复分解反应的微观探析(以氢氧化钙与碳酸钠反应为例)
微观上来说:复分解反应的实质是两种化合物在水溶液中互相交换离子,只要离子之间能够互相结合生成气体、沉淀或水,反应就可以发生。
Ca2+、OH-
Na+、CO3 2-
Na+、OH-
Ca(OH)2 + Na2CO3 ===2NaOH+ CaCO3↓
CaCO3
①H+ + → H2O + CO2↑
(1)生成水:
(2)生成水和气体:
②H+ + → H2O + CO2↑
③ + OH- → NH3↑ + H2O
(3)生成沉淀:
①Ca2+ + → CaCO3↓
②Ba2+ + → BaCO3↓
③Ba2+ + → BaSO4↓
H+ + OH- → H2O
离子对在水中是否大量共存的依据
常见能生成水、气体、沉淀的离子组合
与酸反应
新碱+新盐
与碱反应
与盐反应
盐的通性
新盐1+新盐2
新盐+新酸
盐
复分解反应发生的条件
复分解反应发生的条件
有沉淀、气体或水生成
1. 下列对于盐的组成叙述正确的是( )
A. 一定含有金属元素 B. 一定含有酸根
C. 一定含有氢元素 D. 一定含有原子团
B
2.判断复分解反应是否发生,不必考虑的是( )
A.是否有水生成 B.是否有气体生成
C.是否有沉淀生成 D.金属活动性顺序
D
3. 下列物质跟锌、氯化钡溶液、氢氧化钠溶液都能发生反应的是( )
A. 稀盐酸 B. CuSO4溶液
C. K2CO3溶液 D. Ca(OH)2溶液
B
C
4.下列各组物质中,能发生复分解反应且反应后溶液总质量变小的是( )
A.铁和硫酸铜溶液
B.氢氧化钠溶液和盐酸
C.稀硫酸和氯化钡溶液
D.碳酸钠溶液和氯化钾溶液
置换反应
复分解反应;溶液质量不变
复分解反应;溶液质量变小
不反应
5. 下列选项中各溶质的溶液混合,能大量共存且形成无色溶液的是
( )
A. KMnO4、NaCl、AgNO3 B. K2CO3、CaCl2、HNO3
C. BaCl2、Cu(NO3)2、H2SO4 D. MgCl2、AlCl3、Na2SO4
D
6. 某同学学习了常见的盐后,总结出盐的化学性质如图所示。请回答下列问题。
(1)X属于______(填物质类别)。
(2)能与盐反应的金属应满足的条件是______________________________。
(3)写出一个盐与碱反应的化学方程式______________________________
_________。
酸
金属的活动性比盐中金属的活动性强
CuSO4+2NaOH=== Cu(OH)2↓+
+Na2SO4
