7.1溶解与乳化课件(共42张PPT)2023-2024学年度科粤版化学九年级下册
文档属性
| 名称 | 7.1溶解与乳化课件(共42张PPT)2023-2024学年度科粤版化学九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 44.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-22 09:48:45 | ||
图片预览











文档简介
(共42张PPT)
7.1 溶解与乳化
九下 化学
科粤版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
教学环节
1.通过不同物质的溶解实验,了解溶解时的物质形态变化,认识溶液的组成和特征。
2.知道溶液、溶质、溶剂等概念,能说出一些常见溶液的溶质和溶剂,知道水是最重要的溶剂,酒精、汽油等也是常见的溶剂。
3.知道溶解时常伴有吸热或放热现象。
4.能说出一些常见的乳化现象。
难点
重点
重点
在日常生活中和生产中,人们经常要将一种物质分散到另一种物质中。
在物质分散的过程中会产生哪些现象呢?水溶液的性质和纯水的性质有哪些不同呢?
农药 酒精 矿泉水
新知学习
溶解
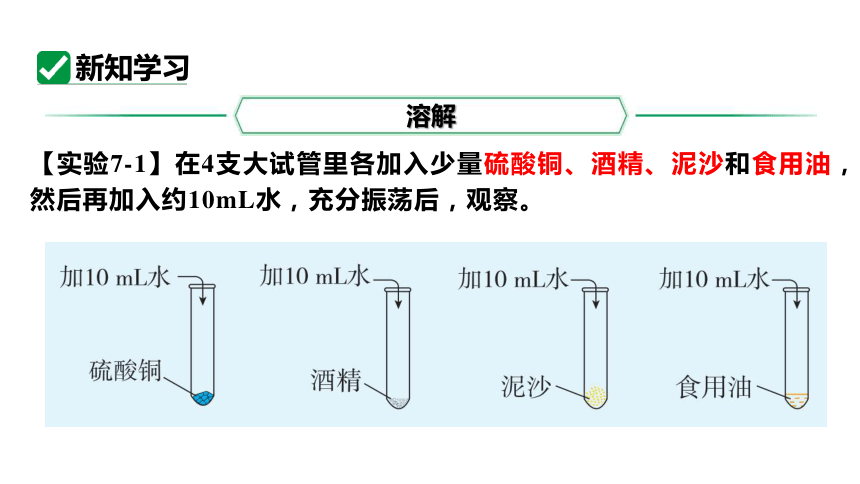
【实验7-1】在4支大试管里各加入少量硫酸铜、酒精、泥沙和食用油,然后再加入约10mL水,充分振荡后,观察。
实验 实 验 现 象
把水加入到硫酸铜中,振荡
把水加入到酒精中,振荡
把水加入到泥沙中,振荡
把水加入到食用油中,振荡
蓝色固体消失了,形成蓝色澄清液体,静置后不分层
酒精溶于水,形成无色澄清液体,静置后不分层
固体小颗粒向水中扩散,形成浑浊液体,静置后沉淀
淡黄色小液滴向水中扩散,形成浑浊液体,静置后分层
实验内容 物质是否 消失 振荡后 (浑浊/澄清) 静置后 是否分层 混合物
名称
硫酸铜
酒精
泥沙
食用油
液体不消失
浑浊
分层
固体消失
澄清
不分层
悬浊液
乳浊液
溶液
固体不消失
浑浊
分层
小液滴分散到另一种物质形成的混合物
固体小颗粒分散于另一种物质中形成的混合物
在日常生活中,你遇到过哪些悬浊液和乳浊液?
液体消失
澄清
不分层
溶液
均一的、稳定的、混合液体
溶液
定义:由一种或一种以上的物质分散到另一种物质中所形成的均一而稳
定的混合物
特征:
溶液各部分的组成、性质(包括物理性质和化学性质)完全一样
在温度等外部因素不改变的情况下,溶液不会出现分层或沉淀现象
均一性
稳定性
(1)硫酸铜晶体、氯化钠、蔗糖、食盐等溶于水中真的“消失”了吗?
议一议
蔗糖在溶液中是以分子的形式存在
氯化钠在溶液中以钠离子和氯离子的形式存在
(2)蔗糖水上半部分和下半部分是否一样甜?说明溶液具有怎样的特征?
(3)外界条件不变,氯化钠溶液长期密封保存,食盐固体会析出吗?说明溶液具有怎样的特征?
(4)实验后形成的物质有什么共同特点?
相同。说明溶液具有均一性
不会。说明溶液具有稳定性
均为混合物
溶液组成
溶剂:能溶解其他物质的物质。
溶质:被溶解的物质。
(1)一般来说,量多的液体物质为溶剂;量少的固体、液体、气体物质为溶质。
(2)如果是水和其他液体的混合溶液,一般将水当作溶剂,其他液体当作溶质。
如:酒精和水互溶时,将水当作溶剂,酒精当作溶质,溶液称为酒精的水溶液。(简称酒精溶液)
命名:“某溶质”的“某溶剂”溶液;水是溶剂时,简称“某溶质”溶液
常用的有机溶剂
溶剂 用途 危险性 注意事项
酒精 配制碘酒 易燃 不可接近火源
汽油 去除油渍 易燃 不可接近火源
香蕉水 配制油漆 易燃 不可接近火源
氯仿 有机玻璃的溶解与粘接 有害 不可接触眼睛
1.溶液的质量= 溶质的质量+溶剂的质量
2.溶液的体积≠ 溶质的体积 + 溶剂的体积
溶液、溶质和溶剂之间量的关系
(因为分子之间有间隙)
想一想
(1)均一、稳定的液体就是溶液吗?
(2)溶液一定是无色的吗?
硫酸铜溶液
高锰酸钾溶液
不一定。例如:蒸馏水、酒精
不一定。
(3)溶质一定是固体吗?
不一定。可以是液体,也可以是气体
为了加快溶质在溶剂里溶解的速率,应当采取什么措施呢?
【实验7-2】比较等量硫酸铜在水中溶解的快慢
实验操作 现象 结论
溶解速率A1____B1
溶剂温度越高,溶质溶解越快
﹤
实验操作 现象 结论
溶解速率A1____B1
溶解速率A1____B1
粉末状溶质比块状溶质在水中溶解快
>
搅拌溶剂,能使溶质的溶解变快
>
结论:升高温度、减小溶质颗粒、搅拌能加快溶质在溶剂里的溶解。
影响固体溶质溶解快慢的因素 结论
温度 温度越____,溶解越快
固体溶质颗粒的大小 颗粒越____,溶解越快
是否进行搅拌或振荡 在_____________的情况下,溶解加快
【注意】设计实验探究影响溶质溶解快慢的因素时,对比的实验间只控制一个变量。
高
小
总结
搅拌或振荡
溶液的广泛应用
农业生产上,无土栽培的植物生活在营养液中
化学实验室中的溶液
医疗上用的溶液
食用品中的溶液
1. 溶液在我们的生活中有着广泛的用途,下列物质属于溶液的是
( )
A.泥水 B.食醋
C.冰水混合物 D.牛奶
B
针对训练
2. 下列各组物质里,前者是后者的溶质的是( )
A.生石灰、石灰水
B.酒精、酒精的水溶液
C.盐酸、稀盐酸
D.二氧化碳、碳酸溶液
B
氢氧化钙
氯化氢
碳酸
衣服上的的油污通常很难洗净,使用了洗洁精之后,很容易就清洗干净了,这是什么原理呢?
乳化
【实验7-3】如图实验观察并记录现象
1.在1支试管中注入3mL水和数滴植物油,观察到的现象是
________________________。
2.剧烈振荡试管,摇匀后观察到植物油会分裂成很小的油滴,并与水混合。
3.静置一会儿,观察到的现象是_______________________________。
4.向试管里滴加洗涤剂,振荡,静置,细小的油滴和水______(会/不会)分层。
植物油与水分成上下两层
植物油与水又重新分开成上下两层
不会
乳浊液
小液滴分散到液体里形成的混合物叫做乳浊液。如水中加入油形成的是乳浊液。
特征:不均一、不稳定、静置后分层。
密度小的在上层,密度大的在下层
乳浊液不稳定,混合后不久就会分层 ,但当加入某些洗涤剂并振荡后 ,就不易分层了,像这种能使乳浊液稳定的物质称为乳化剂。乳化剂所起的作用称为乳化作用。
乳化现象
乳化和溶解都是分散,但乳化作用=溶解吗?
乳化
乳化作用
溶解
是将大颗粒的油珠变为小颗粒的液滴,最终形成乳浊液
溶解是溶质以分子或离子的形式均匀分散到溶剂中,最终形成溶液
乳化作用和溶解的比较
乳化作用的应用
乳化现象在工农业生产和日常生活中有十分广泛的应用,如:金属表面油污的清洗;各种日用洗涤剂和化妆品的配制;农药、医药制剂的合成以及纺织印染、石油开采、污水处理等都和乳化作用有关。
当洗洁精加入到油和水的混合物中,在一定程度上能将油分散到水中。这样油污就变成了小液滴随水从衣服上被冲走了
有经验的同学一定知道,汽油也能去除油污,这是是什么原理呢?与使用洗洁精清洗油污的原理有何不同呢
下列洗涤污物的方法属于乳化的是( )
A.用汽油除去衣服上的油污
B.用酒精清洗内壁有碘的试管
C.用水洗去盘子中的水果渣
D.用洗洁精清洗餐具上的油污
D
针对训练
用潮湿的手触摸食盐时,感觉温度没有明显变化,但触摸洗衣粉时,会有温热的感觉,这是为什么呢?
溶解时的吸热或放热现象
观察硝酸铵、氯化钠、氢氧化钠分别溶于水过程中的热量变化
溶质 NaCl(3 g) NH4NO3 (3 g) NaOH(3 g)
加入溶质前水的温度/C 25 25 25
溶解情况 完全溶解 完全溶解 完全溶解
溶质完全溶解时溶液的温度/C 25 21.3 32
溶质溶解时的热量变化 无变化 下降3.7/℃ 上升7/℃
结论:氯化钠溶解时溶液温度变化不明显;
硝酸铵溶解时溶液温度降低,说明溶解过程中吸收热量;
氢氧化钠溶解时溶液温度升高,说明溶解过程中放出热量。
物质在溶解过程中通常伴随着热量变化。
现象 举例
溶解时吸热,溶液温度降低 硝酸铵固体
溶解或稀释时放热,溶液温度升高 氢氧化钠固体、浓硫酸
溶解时热量变化不明显,溶液的温度基本不变 氯化钠固体
物质在溶解过程中通常伴随的两种热量变化: 放出热量、吸收热量
溶质溶解时为什么会放热或吸热呢?
溶解过程中的两种变化
溶质分子(或离子)向水中扩散
溶质分子(或离子)和水分子作用生成水合分子(或水合离子)
放出热量
扩散过程
水合过程
吸收热量
若Q吸<Q放,则溶液温度升高;
若Q吸>Q放,则溶液温度降低;
如 NH4NO3
若Q吸=Q放,则溶液温度不变。
如NaOH固体、浓硫酸
如NaCl
小琪往如图所示的烧杯中加入一种物质,轻轻搅拌后,粘在烧杯上的塑料片脱落,加入的物质可能是( )
A.食盐 B.硝酸铵
C.氢氧化钠 D.碳酸钙
C
针对训练
课堂小结
一种或几
种物质
分散
水是
常用
溶剂
溶剂
固
液
气
溶质
另一种
物质
均一稳定的
混合物
溶液
吸热:硝酸铵
放热:浓硫酸、氢氧化钠固体
溶解与乳化
物质溶解时的吸热或放热现象
无明显热现象:氯化钠
乳浊液
乳化剂
应用
乳化作用
1.下列各组物质均属于溶液的一组是 ( )
A. 食盐水、石灰水、稀硫酸 B. 稀盐酸、蒸馏水、汽水
C. 白酒、牛奶、碘酒 D. 浑浊的河水、浑浊的石灰水、医用酒精
A
2. 下列措施,不属于乳化在日常生活中应用的是( )
A. 用肥皂水洗衣服上的油渍
B. 用洗洁精洗去碗筷上残留的油渍
C. 用洗衣粉洗衣服上的污渍
D. 用盐酸清洗盛石灰水试剂瓶甁壁上的“白膜”
D
3. (2022重庆A)王亚平在太空做了油和水“难分难舍”的神奇实验:她用力摇晃装有油和水的瓶子,让油水充分混合、静置,发现油水不分层。下列说法不正确的是( )
A. 太空中水不能作溶剂
B. 在地面油水混合物会产生分层现象
C. 在不同环境中同一实验可能现象不同
D. 在地面向油水混合物中加入洗涤剂会产生乳化现象
A
4. 如图所示,下列胶头滴管内的液体滴入到锥形瓶中,不会引起气球膨胀的是( )
D
选项 A B C D
胶头滴管内液体 H2O2溶液 H2O 稀H2SO4 H2O
锥形瓶内固体 MnO2 CaO Zn NH4NO3
5.稀盐酸与一定质量的铁恰好完全反应。
(1)上述反应的化学方程式为 ______________________________;反应现象是______________________________________________ 。
(2)反应前,溶液的溶质是______ 。反应后溶液的溶质是______ ,溶液名称为_____________ 。
2HCl+Fe=== FeCl2+H2↑
铁逐渐溶解,有气泡产生,溶液由无色变为浅绿色
HCl
FeCl2
氯化亚铁溶液
7.1 溶解与乳化
九下 化学
科粤版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
教学环节
1.通过不同物质的溶解实验,了解溶解时的物质形态变化,认识溶液的组成和特征。
2.知道溶液、溶质、溶剂等概念,能说出一些常见溶液的溶质和溶剂,知道水是最重要的溶剂,酒精、汽油等也是常见的溶剂。
3.知道溶解时常伴有吸热或放热现象。
4.能说出一些常见的乳化现象。
难点
重点
重点
在日常生活中和生产中,人们经常要将一种物质分散到另一种物质中。
在物质分散的过程中会产生哪些现象呢?水溶液的性质和纯水的性质有哪些不同呢?
农药 酒精 矿泉水
新知学习
溶解
【实验7-1】在4支大试管里各加入少量硫酸铜、酒精、泥沙和食用油,然后再加入约10mL水,充分振荡后,观察。
实验 实 验 现 象
把水加入到硫酸铜中,振荡
把水加入到酒精中,振荡
把水加入到泥沙中,振荡
把水加入到食用油中,振荡
蓝色固体消失了,形成蓝色澄清液体,静置后不分层
酒精溶于水,形成无色澄清液体,静置后不分层
固体小颗粒向水中扩散,形成浑浊液体,静置后沉淀
淡黄色小液滴向水中扩散,形成浑浊液体,静置后分层
实验内容 物质是否 消失 振荡后 (浑浊/澄清) 静置后 是否分层 混合物
名称
硫酸铜
酒精
泥沙
食用油
液体不消失
浑浊
分层
固体消失
澄清
不分层
悬浊液
乳浊液
溶液
固体不消失
浑浊
分层
小液滴分散到另一种物质形成的混合物
固体小颗粒分散于另一种物质中形成的混合物
在日常生活中,你遇到过哪些悬浊液和乳浊液?
液体消失
澄清
不分层
溶液
均一的、稳定的、混合液体
溶液
定义:由一种或一种以上的物质分散到另一种物质中所形成的均一而稳
定的混合物
特征:
溶液各部分的组成、性质(包括物理性质和化学性质)完全一样
在温度等外部因素不改变的情况下,溶液不会出现分层或沉淀现象
均一性
稳定性
(1)硫酸铜晶体、氯化钠、蔗糖、食盐等溶于水中真的“消失”了吗?
议一议
蔗糖在溶液中是以分子的形式存在
氯化钠在溶液中以钠离子和氯离子的形式存在
(2)蔗糖水上半部分和下半部分是否一样甜?说明溶液具有怎样的特征?
(3)外界条件不变,氯化钠溶液长期密封保存,食盐固体会析出吗?说明溶液具有怎样的特征?
(4)实验后形成的物质有什么共同特点?
相同。说明溶液具有均一性
不会。说明溶液具有稳定性
均为混合物
溶液组成
溶剂:能溶解其他物质的物质。
溶质:被溶解的物质。
(1)一般来说,量多的液体物质为溶剂;量少的固体、液体、气体物质为溶质。
(2)如果是水和其他液体的混合溶液,一般将水当作溶剂,其他液体当作溶质。
如:酒精和水互溶时,将水当作溶剂,酒精当作溶质,溶液称为酒精的水溶液。(简称酒精溶液)
命名:“某溶质”的“某溶剂”溶液;水是溶剂时,简称“某溶质”溶液
常用的有机溶剂
溶剂 用途 危险性 注意事项
酒精 配制碘酒 易燃 不可接近火源
汽油 去除油渍 易燃 不可接近火源
香蕉水 配制油漆 易燃 不可接近火源
氯仿 有机玻璃的溶解与粘接 有害 不可接触眼睛
1.溶液的质量= 溶质的质量+溶剂的质量
2.溶液的体积≠ 溶质的体积 + 溶剂的体积
溶液、溶质和溶剂之间量的关系
(因为分子之间有间隙)
想一想
(1)均一、稳定的液体就是溶液吗?
(2)溶液一定是无色的吗?
硫酸铜溶液
高锰酸钾溶液
不一定。例如:蒸馏水、酒精
不一定。
(3)溶质一定是固体吗?
不一定。可以是液体,也可以是气体
为了加快溶质在溶剂里溶解的速率,应当采取什么措施呢?
【实验7-2】比较等量硫酸铜在水中溶解的快慢
实验操作 现象 结论
溶解速率A1____B1
溶剂温度越高,溶质溶解越快
﹤
实验操作 现象 结论
溶解速率A1____B1
溶解速率A1____B1
粉末状溶质比块状溶质在水中溶解快
>
搅拌溶剂,能使溶质的溶解变快
>
结论:升高温度、减小溶质颗粒、搅拌能加快溶质在溶剂里的溶解。
影响固体溶质溶解快慢的因素 结论
温度 温度越____,溶解越快
固体溶质颗粒的大小 颗粒越____,溶解越快
是否进行搅拌或振荡 在_____________的情况下,溶解加快
【注意】设计实验探究影响溶质溶解快慢的因素时,对比的实验间只控制一个变量。
高
小
总结
搅拌或振荡
溶液的广泛应用
农业生产上,无土栽培的植物生活在营养液中
化学实验室中的溶液
医疗上用的溶液
食用品中的溶液
1. 溶液在我们的生活中有着广泛的用途,下列物质属于溶液的是
( )
A.泥水 B.食醋
C.冰水混合物 D.牛奶
B
针对训练
2. 下列各组物质里,前者是后者的溶质的是( )
A.生石灰、石灰水
B.酒精、酒精的水溶液
C.盐酸、稀盐酸
D.二氧化碳、碳酸溶液
B
氢氧化钙
氯化氢
碳酸
衣服上的的油污通常很难洗净,使用了洗洁精之后,很容易就清洗干净了,这是什么原理呢?
乳化
【实验7-3】如图实验观察并记录现象
1.在1支试管中注入3mL水和数滴植物油,观察到的现象是
________________________。
2.剧烈振荡试管,摇匀后观察到植物油会分裂成很小的油滴,并与水混合。
3.静置一会儿,观察到的现象是_______________________________。
4.向试管里滴加洗涤剂,振荡,静置,细小的油滴和水______(会/不会)分层。
植物油与水分成上下两层
植物油与水又重新分开成上下两层
不会
乳浊液
小液滴分散到液体里形成的混合物叫做乳浊液。如水中加入油形成的是乳浊液。
特征:不均一、不稳定、静置后分层。
密度小的在上层,密度大的在下层
乳浊液不稳定,混合后不久就会分层 ,但当加入某些洗涤剂并振荡后 ,就不易分层了,像这种能使乳浊液稳定的物质称为乳化剂。乳化剂所起的作用称为乳化作用。
乳化现象
乳化和溶解都是分散,但乳化作用=溶解吗?
乳化
乳化作用
溶解
是将大颗粒的油珠变为小颗粒的液滴,最终形成乳浊液
溶解是溶质以分子或离子的形式均匀分散到溶剂中,最终形成溶液
乳化作用和溶解的比较
乳化作用的应用
乳化现象在工农业生产和日常生活中有十分广泛的应用,如:金属表面油污的清洗;各种日用洗涤剂和化妆品的配制;农药、医药制剂的合成以及纺织印染、石油开采、污水处理等都和乳化作用有关。
当洗洁精加入到油和水的混合物中,在一定程度上能将油分散到水中。这样油污就变成了小液滴随水从衣服上被冲走了
有经验的同学一定知道,汽油也能去除油污,这是是什么原理呢?与使用洗洁精清洗油污的原理有何不同呢
下列洗涤污物的方法属于乳化的是( )
A.用汽油除去衣服上的油污
B.用酒精清洗内壁有碘的试管
C.用水洗去盘子中的水果渣
D.用洗洁精清洗餐具上的油污
D
针对训练
用潮湿的手触摸食盐时,感觉温度没有明显变化,但触摸洗衣粉时,会有温热的感觉,这是为什么呢?
溶解时的吸热或放热现象
观察硝酸铵、氯化钠、氢氧化钠分别溶于水过程中的热量变化
溶质 NaCl(3 g) NH4NO3 (3 g) NaOH(3 g)
加入溶质前水的温度/C 25 25 25
溶解情况 完全溶解 完全溶解 完全溶解
溶质完全溶解时溶液的温度/C 25 21.3 32
溶质溶解时的热量变化 无变化 下降3.7/℃ 上升7/℃
结论:氯化钠溶解时溶液温度变化不明显;
硝酸铵溶解时溶液温度降低,说明溶解过程中吸收热量;
氢氧化钠溶解时溶液温度升高,说明溶解过程中放出热量。
物质在溶解过程中通常伴随着热量变化。
现象 举例
溶解时吸热,溶液温度降低 硝酸铵固体
溶解或稀释时放热,溶液温度升高 氢氧化钠固体、浓硫酸
溶解时热量变化不明显,溶液的温度基本不变 氯化钠固体
物质在溶解过程中通常伴随的两种热量变化: 放出热量、吸收热量
溶质溶解时为什么会放热或吸热呢?
溶解过程中的两种变化
溶质分子(或离子)向水中扩散
溶质分子(或离子)和水分子作用生成水合分子(或水合离子)
放出热量
扩散过程
水合过程
吸收热量
若Q吸<Q放,则溶液温度升高;
若Q吸>Q放,则溶液温度降低;
如 NH4NO3
若Q吸=Q放,则溶液温度不变。
如NaOH固体、浓硫酸
如NaCl
小琪往如图所示的烧杯中加入一种物质,轻轻搅拌后,粘在烧杯上的塑料片脱落,加入的物质可能是( )
A.食盐 B.硝酸铵
C.氢氧化钠 D.碳酸钙
C
针对训练
课堂小结
一种或几
种物质
分散
水是
常用
溶剂
溶剂
固
液
气
溶质
另一种
物质
均一稳定的
混合物
溶液
吸热:硝酸铵
放热:浓硫酸、氢氧化钠固体
溶解与乳化
物质溶解时的吸热或放热现象
无明显热现象:氯化钠
乳浊液
乳化剂
应用
乳化作用
1.下列各组物质均属于溶液的一组是 ( )
A. 食盐水、石灰水、稀硫酸 B. 稀盐酸、蒸馏水、汽水
C. 白酒、牛奶、碘酒 D. 浑浊的河水、浑浊的石灰水、医用酒精
A
2. 下列措施,不属于乳化在日常生活中应用的是( )
A. 用肥皂水洗衣服上的油渍
B. 用洗洁精洗去碗筷上残留的油渍
C. 用洗衣粉洗衣服上的污渍
D. 用盐酸清洗盛石灰水试剂瓶甁壁上的“白膜”
D
3. (2022重庆A)王亚平在太空做了油和水“难分难舍”的神奇实验:她用力摇晃装有油和水的瓶子,让油水充分混合、静置,发现油水不分层。下列说法不正确的是( )
A. 太空中水不能作溶剂
B. 在地面油水混合物会产生分层现象
C. 在不同环境中同一实验可能现象不同
D. 在地面向油水混合物中加入洗涤剂会产生乳化现象
A
4. 如图所示,下列胶头滴管内的液体滴入到锥形瓶中,不会引起气球膨胀的是( )
D
选项 A B C D
胶头滴管内液体 H2O2溶液 H2O 稀H2SO4 H2O
锥形瓶内固体 MnO2 CaO Zn NH4NO3
5.稀盐酸与一定质量的铁恰好完全反应。
(1)上述反应的化学方程式为 ______________________________;反应现象是______________________________________________ 。
(2)反应前,溶液的溶质是______ 。反应后溶液的溶质是______ ,溶液名称为_____________ 。
2HCl+Fe=== FeCl2+H2↑
铁逐渐溶解,有气泡产生,溶液由无色变为浅绿色
HCl
FeCl2
氯化亚铁溶液
