专题1《化学反应与能量变化》(含解析)强化练习2023-2024学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题1《化学反应与能量变化》(含解析)强化练习2023-2024学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 921.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-22 09:18:12 | ||
图片预览


文档简介
专题1《化学反应与能量变化》强化练习
一、单选题
1.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入 CH4的一极,其电极反应式是CH4+10OH--8e-==CO32-+7H2O;通入O2的另一极,其电极反应式是2O2+4H2O+8e-==8OH-。下列叙述不正确的是
A.正极发生还原反应
B.通入CH4的电极为负极
C.该电池使用一段时间后应补充KOH
D.燃料电池工作时,溶液中的OH-向正极移动
2.下列关于热化学反应方程式的描述中正确的是
A.稀HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则稀H2SO4和稀Ba(OH)2溶液反应的热化学方程式:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) ΔH>-57.3kJ/mol
B.CO的燃烧热是283.0kJ/mol,则:2CO2(g)=2CO(g)+O2(g) ΔH=2×(-283.0)kJ/mol
C.两个体积相同的容器中充入等量的NO2发生反应:2NO2(g) N2O4(g) ΔH<0,绝热容器中气体的颜色比铁制容器中颜色深
D.已知石墨转化为金刚石要吸热,则等量的石墨与金刚石相比总键能小
3.工业上电解饱和食盐水制备氯气,实验室常用与浓盐酸制备氯气。制备氯气时,下列装置能达到相应实验目的的是
A.电解法制氯气 B.实验室制氯气
C.除去氯气中的HCl D.氯气收集和尾气处理
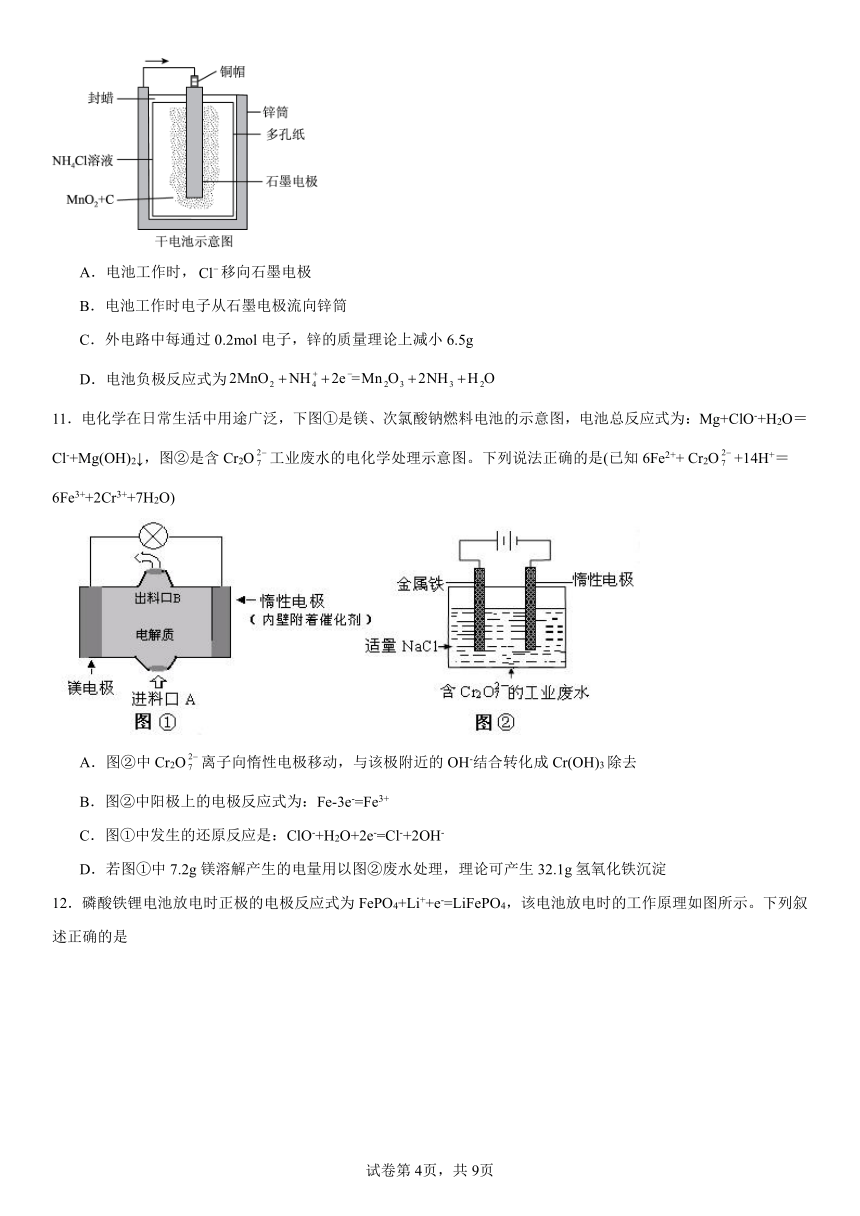
4.近日,科学家利用溴辅助氧化C2H4电催化CO2合成三乙醇胺、利用金属酞菁电催化剂上*Br相对于*OH的优先吸附,C2H4进一步氧化并与亚硝酸盐还原偶联形成三乙醇胺,串联使用两个电解槽,工作原理如图所示。
下列说法错误的是
A.X极为阳极,N极为阴极
B.膜1为阳离子交换膜
C.Y极的电极反应式为2CO2+ 8H2O+12e -= C2H4+ 12OH-
D.右侧电池中,理论上转移6mol电子时生成1molN(CH2CH2OH)3
5.利用实验器材(规格和数量不限,省略夹持装置),能够完成相应实验的有几项
实验器材 相应实验
① 量筒、温度计、烧杯、碎纸条、盖板 中和热的测定
② 烧杯、分液漏斗 用饱和溶液除去乙酸乙酯中的乙酸和乙醇
③ 量筒、玻璃捧、烧杯、容量瓶 用浓盐酸配制的稀盐酸溶液
④ 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管、石棉网 分离甲醇和甘油的混合物
⑤ 坩埚、酒精灯、玻璃棒、泥三角、三脚架 从食盐水中得到晶体
A.2项 B.3项 C.4项 D.5项
6.已知通常状况下氢气的燃烧热的为-286kJ/mol,则下列热化学方程式书写正确的是
A.
B.
C.
D.
7.将二氧化碳转化为乙烯的装置如图所示,使用的电极材料均为惰性电极。下列说法正确的是
A.a电极电势比b电极高
B.每生成乙烯,同时生成
C.左侧电极反应式为
D.移动方向为从右到左
8.甲酸常被用于橡胶、医药等工业。在一定条件下可分解生成CO 和H2O。在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法错误的是
A.途径一未使用催化剂,但途径二与途径一甲酸平衡转化率相同
B.ΔH1=ΔH2<0,Ea1= Ea2
C.途径二H+参与反应,通过改变反应途径加快反应速率
D.途径二反应的快慢由生成的速率决定
9.下列既属于氧化还原反应,又属于吸热反应的是
A.铝片与稀盐酸反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与水蒸气的反应 D.甲烷(CH4)在O2中的燃烧反应
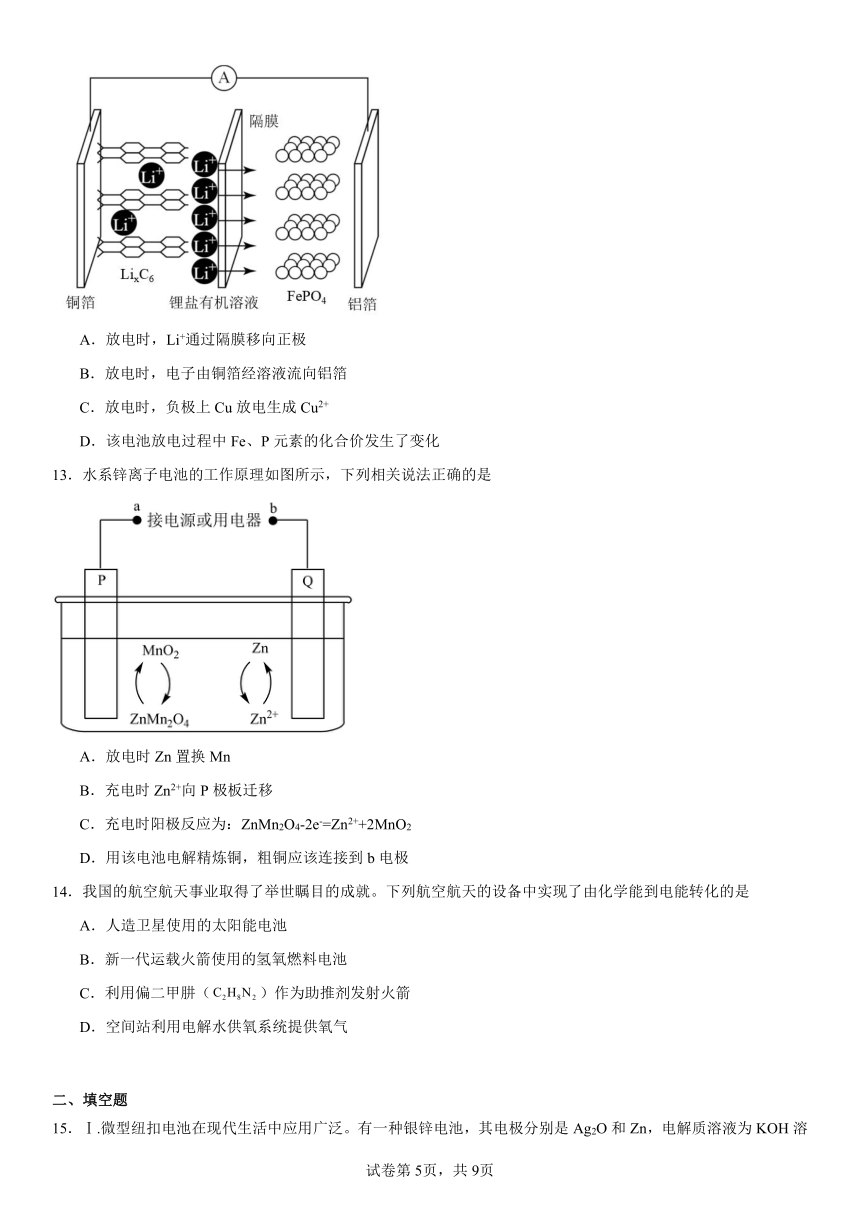
10.普通锌锰干电池的简图如图所示,该电池工作时的总反应为。下列关于锌锰干电池的说法中正确的是
A.电池工作时,移向石墨电极
B.电池工作时电子从石墨电极流向锌筒
C.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
D.电池负极反应式为
11.电化学在日常生活中用途广泛,下图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是含Cr2O工业废水的电化学处理示意图。下列说法正确的是(已知6Fe2++ Cr2O+14H+=6Fe3++2Cr3++7H2O)
A.图②中Cr2O离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B.图②中阳极上的电极反应式为:Fe-3e-=Fe3+
C.图①中发生的还原反应是:ClO-+H2O+2e-=Cl-+2OH-
D.若图①中7.2g镁溶解产生的电量用以图②废水处理,理论可产生32.1g氢氧化铁沉淀
12.磷酸铁锂电池放电时正极的电极反应式为FePO4+Li++e-=LiFePO4,该电池放电时的工作原理如图所示。下列叙述正确的是
A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铜箔经溶液流向铝箔
C.放电时,负极上Cu放电生成Cu2+
D.该电池放电过程中Fe、P元素的化合价发生了变化
13.水系锌离子电池的工作原理如图所示,下列相关说法正确的是
A.放电时Zn置换Mn
B.充电时Zn2+向P极板迁移
C.充电时阳极反应为:ZnMn2O4-2e-=Zn2++2MnO2
D.用该电池电解精炼铜,粗铜应该连接到b电极
14.我国的航空航天事业取得了举世瞩目的成就。下列航空航天的设备中实现了由化学能到电能转化的是
A.人造卫星使用的太阳能电池
B.新一代运载火箭使用的氢氧燃料电池
C.利用偏二甲肼()作为助推剂发射火箭
D.空间站利用电解水供氧系统提供氧气
二、填空题
15.Ⅰ.微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。请回答下列问题。
(1)该电池属于 电池(填“一次”或“二次”)。
(2)负极是 ,电极反应式是 。
(3)使用时,正极区的pH (填“增大”、“减小”或“不变”)。
Ⅱ.(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。(填字母)
A C(s)+H2O(g)=CO(g)+H2(g) △H>0
B NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H<0
C 2CO(g)+O2(g)=2CO2(1) △H<0
(5)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为 。
Ⅲ.乙醇(C2H5OH)燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
(6)三种乙醇燃料电池中正极反应物均为 。(填化学式)
(7)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极 (填“a”或“b”)移动。
(8)酸性乙醇燃料电池中,若电池消耗标准状况下2.24L O2,则电路中通过了的电子数目为 。
16.某蓄电池的反应为NiO2+Fe+2H2OFe(OH)2+Ni(OH)2
(1)该蓄电池放电时正极发生反应的物质是 ,正极发生的电极反应式为 。
(2)若放电时生成Fe(OH)2质量为18g,则通过外电路的电子数目是 。
(3)海水下的钢闸门常常会被腐蚀,为了保护这些钢铁设备,通常可以将它们与该蓄电池的 (填“正”或“负”)极相连,这种防腐方法称做 。
(4)室温下,用该蓄电池电解200mL饱和食盐水进行氯碱工业,当阳极产生标准状况下224mL氯气时,此时溶液的pH= (忽略溶液体积的变化)。
(5)以该蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理,可使铝制品表面形成较致密的氧化膜以更好地保护铝制品,写出铝电极上发生的电极反应式 。
17.航天燃料通常由液氧煤油,液氧液氢,偏二甲肼和四氧化二氮。请利用化学反应相关原理,回答下列问题。
(1)已知在298K时的热化学方程式:
根据上面的热化学方程式完成下列问题:
①通过计算说明等质量的、、C完全燃烧时放出热量最多的是 ,等物质的量、、C完全燃烧时放出热量最多的是 。
②若和混合气体的总物质的量为3mol,且完全燃烧放出2066.4kJ的能量,则 。
(2)“嫦娥二号”卫星使用液态四氧化二氮和液态偏二甲肼()作推进剂,燃烧产物是三种对环境无污染的气体,同时放出大量的热。已知10.0g液态偏二甲肼与液态四氧化二氮完全燃烧可放出425kJ热量,该反应的热化学方程式为 。
(3)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
若用0.15mol CO还原至(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
18.I.(1)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
Na2SO3+ KIO3+ H2SO4—— Na2SO4+ K2SO4+ I2+ H2O
①配平上面的氧化还原反应方程式,
②其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘是 mol。
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,乙硼烷燃烧热的热化学方程式为 。
II.含氰化物(有CN -)的废水危害大,CN-的含量为0.01mol/L~0.04mol/L就能毒 杀鱼类。其处理方法是用氧化法使其转化为低毒的氰酸钾(KCNO),氧化剂常用次氯酸盐;而生成的CNO-可进一步降解为能直接排放到空气中的无毒气体。近期研究将把某些导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量和性质不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物等有毒废物。
(1)二氧化钛在上述反应中的作用是 。
(2)CNO -经进一步处理后产生的两种无毒气体应该是 和 。
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为
19.应用电化学原理,解决下列问题:
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,即可观察到的现象是 ,表明铁被氧化。
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(3)装置3中甲烧杯盛放100mL0.2mol/L的NaCl溶液,乙烧杯盛放100mL0.5mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,回答下列问题:
①甲烧杯中铁电极的电极反应为 。
②乙烧杯中电解反应的离子方程式为 。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体(标准状况下)体积为 mL。
20.在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式 。
(2)已知H2O(l)=H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是 kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是 。
(4)已知N2(g)+2O2(g)=2NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)==N2(g)+2H2O (g);△H= -534kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式 。
(5)已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-543kJ/mol
1/2H2(g)+1/2F2(g)=HF(g) △H=-269kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=-242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式: 。
21.用如图所示的装置进行电解,A中盛有NaCl溶液,B中盛有饱和Na2SO4溶液,通电一会儿,发现湿润的淀粉KI试纸的D端变为蓝色。回答下列问题:
(1)电源的F端为 (填“正”或“负”)极。
(2)A中发生反应的总化学方程式为 。
(3)B中石墨电极上的电极反应式为 ;Cu电极观察到的现象是 ;一段时间后,B中溶液pH (填“升高”、“降低”或“不变”)。
(4)去掉该装置中的电源,改用导线连接,为使湿润的淀粉KI试纸的D端变为蓝色,可将 (填“A”或“B”)中的溶液换成 (填“稀硫酸”或“浓硝酸”)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.根据给出的电极反应看出,通入CH4的一极是负极,通入O2的另一极是正极。正极发生还原反应,A正确;
B.通入CH4的电极为负极,B正确;
C.对比两个电极反应,可知消耗的OH-比生成的多,所以随着反应的进行,KOH的浓度会降低,所以需要补充KOH,C正确;
D.原电池中阴离子向负极移动,OH-向负极移动,D错误。
2.C
【详解】A.稀H2SO4和稀Ba(OH)2溶液反应中有BaSO4白色沉淀生成,生成硫酸钡的过程是放热过程,所以该反应过程释放的总热量大于中和热,反应的热化学方程式应为:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) ΔH<-57.3kJ/mol,故A错误;
B. CO的燃烧热是283.0kJ/mol,一氧化碳燃烧生成二氧化碳是放热反应,其逆反应二氧化碳分解生成一氧化碳和氧气是吸热反应,则:2CO2(g)=2CO(g)+O2(g) ΔH=+2×283.0kJ/mol,故B错误;
C.C中反应是放热反应,应用容器是绝热的,所以温度升高,平衡向逆反应方向移动,NO2浓度增大,颜色加深;应用容器是铁制容器时,因为是热的良导体,传递热量,热量散失,平衡向正反应方向移动,四氧化二氮增多,颜色变浅,所以绝热容器中气体的颜色比铁制容器中颜色深,故C正确;
D.已知石墨转化为金刚石要吸热,所以石墨比金刚石稳定;破坏等量的石墨消耗的能量多,所以等量的石墨总键能大于金刚石的总键能,故D错误;
故选C。
3.D
【详解】A.当前电解池连接,铁电极做阳极,阳极反应为:,不会产生氯气,设备错误,不符题意;
B.MnO2与浓盐酸反应制氯气必须要加热,无加热装置,实验无法进行,装置错误,不符题意;
C.洗气瓶中应装饱和食盐水做除杂试剂,NaHCO3溶液无法实现Cl2中杂质HCl的去除,试剂错误,不符题意;
D.氯气可溶于水,密度大于空气,故此选择向上排空气法收集,过量氯气用NaOH溶液完全吸收,避免污染空气,描述正确,符合题意;
综上,本题选D。
4.B
【分析】Y极由CO2生成C2H4发生还原反应是阴极,X为阳极,M极Br-被氧化为Br2发生氧化反应,是阳极,N是阴极。
【详解】A.X极为阳极,N极为阴极,故A正确;
B.X极是阳极,发生4OH--4e-=O2↑+2H2O, Y极的电极反应式为2CO2+ 8H2O+12e -= C2H4+ 12OH-,Y极产生的氢氧根离子通过膜1进入X极一边失去电子,因此膜1是阴离子交换膜,可以通过氢氧根离子,故B错误;
C.Y极的电极反应式为2CO2+ 8H2O+12e -= C2H4+ 12OH-,方程式正确,故C正确;
D.生成1molN(CH2CH2OH)3,有1mol亚硝酸根离子得6mol电子生成1molNH3,理论上转移6mol电子生成1mol N(CH2CH2OH)3,故D正确;
答案选B。
5.A
【详解】①缺少环形玻璃搅拌棒;③缺少胶头滴管;⑤蒸发结晶不用坩埚而用蒸发皿,只有②、④能够完成,故A正确;
故选A。
6.B
【分析】燃烧热是指1mol物质完全燃烧生成稳定氧化物所放出的热量,通常状况下氢气的燃烧热的为-286kJ/mol,氢气的燃烧热化学方程式为:。
【详解】A.1mol氢气完全燃烧生成液态水放出的热量为286kJ,则2mol氢气完全燃烧生成液态水放出的热量为572kJ,热化学方程式为: ,A错误;
B.2mol氢气完全燃烧生成液态水放出的热量为572kJ,热化学方程式为: ,B正确;
C.氢气完全燃烧生成的稳定氧化物为液态水,则1mol氢气完全燃烧的热化学方程式为:,C错误;
D.氢气完全燃烧生成的稳定氧化物为液态水,则2mol氢气完全燃烧的热化学方程式为: ,D错误;
答案选B。
7.D
【分析】根据图知,右侧电极上OH-放电生成O2,则右侧电极为阳极,左侧电极为阴极,连接电解池阴极的电极为原电池负极、连接电解池阳极的电极为原电池正极;以此解答。
【详解】A.由分析可知,b为正极,a为负极,a电极电势比b电极低,故A错误;
B.没有说明是否为标况状态,不能用22.4L/mol计算氧气的体积,故B错误;
C.左侧为阴极,阴极上二氧化碳得电子和氢离子反应生成乙烯和水,电极反应式为2CO2+12H++12e-═C2H4+4H2O,故C错误;
D.电解池中阳离子向阴极移动,移动方向为从右到左,故D正确;
故选D。
8.B
【详解】A.催化剂可以降低活化能,因此途径一未使用催化剂,但催化剂不能改变平衡状态,所以途径二和途径一的甲酸平衡转化率相同,A正确;
B.催化剂可以降低活化能,但不能改变焓变,由于反应物的总能量高于生成物的总能量,因此ΔH1=ΔH2<0,但Ea1>Ea2,B错误;
C.途径二中反应前有氢离子,反应后还有氢离子,说明H+参与反应,通过改变反应途径加快反应速率,C正确;
D.生成的活化能高,则途径二反应的快慢由生成的速率决定,D正确;
故选B。
9.C
【详解】A.铝片与稀盐酸的反应为放热反应,故A错误;
B.Ba(OH)2 8H2O与NH4Cl的反应为吸热反应,但不是氧化还原反应,故B错误;
C.灼热的炭与水蒸气的反应为氧化还原反应,同时也是吸热反应,故C正确;
D.甲烷(CH4)在O2中的燃烧为放热反应,故D错误。
故选:C。
10.C
【分析】由已知电池的总反应可知,Zn化合价升高发生氧化反应,锌筒作为电池的负极,而MnO2化合价降低发生还原反应,石墨电极作为电池的正极,电子有负极流向正极,阳离子移向正极,阴离子移向负极。
【详解】A.电池工作时阴离子移向负极,由分析可知,锌筒作为负极,所以移向锌筒,A项错误;
B.电子由负极流向正极,应该为由锌筒流向石墨电极,B错误;
C.,0.1molZn的质量为6.5g,所以C正确;
D.负极应该失电子发生氧化反应,所以电极反应式错误, 为电池正极的电极反应式,D错误;
故答案选C。
11.D
【分析】图1是原电池,根据总反应式,Mg电极是负极,惰性电极是正极。图2是电解池,金属铁是阳极,惰性电极是阴极。
【详解】A.图②中惰性电极为阴极,Fe电极为阳极,则Cr2O离子向金属铁电极移动,与亚铁离子发生氧化还原反应生成的金属阳离子与惰性电极附近的OH-结合转化成Cr(OH)3除去,A错误;
B.图②中Fe为阳极,发生氧化反应,阳极上的电极反应式为:Fe-2e-=Fe2+,B错误;
C.该原电池中,镁作负极,负极上镁失电子发生氧化反应,负极反应为Mg-2e-=Mg2+,电池反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl-,正极上次氯酸根离子得电子发生还原反应,则总反应减去负极反应可得正极还原反应为Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓,C错误;
D.由电子守恒可知,Mg~2e-~Fe2+,由原子守恒可知Fe2+~Fe(OH)3↓,则n(Mg)=7.2g÷24g/mol=0.3mol,理论可产生氢氧化铁沉淀的质量为0.3mol×107g/mol=32.1g,D正确;
答案选D。
12.A
【详解】A.原电池放电时,阳离子移向正极,阴离子移向负极,即放电时,Li+通过隔膜移向正极,A正确;
B.该电池放电时铝箔电极为正极,铜箔电极为负极,放电时,电子由铜箔经过导线流向铝箔,电子不能进入溶液中,B错误:
C.该电池放电时铜箔电极为负极,负极上LixC6失去电子生成Li+,C错误;
D.正极的电极反应式为FePO4+Li++e-=LiFePO4,放电过程P元素的化合价未发生变化,D错误;
综上所述答案为A。
13.C
【分析】放电时Zn为负极,即Q为负极,P为正极,充电时Q为阴极,P为阳极。
【详解】A.放电时装置为原电池,负极Zn失电子生成Zn2+,正极MnO2得电子生成ZnMn2O4,没有Mn单质生成,A错误;
B.充电时装置为电解池,阳离子向阴极移动,故Zn2+向Q极板迁移,B错误;
C.充电时阳极ZnMn2O4失电子生成MnO2,反应为ZnMn2O4-2e-=Zn2++2MnO2,C正确;
D.用该电池电解精炼铜,粗铜作阳极,应该连接到正极,即a电极,D错误;
故选C。
14.B
【详解】A.人造地球卫星上的太阳能电池板是太阳能转化为电能,选项A错误;
B.氢氧燃料电池是将化学能转化为电能,选项B正确;
C.利用偏二甲肼(N2H4 )作为助推剂发射火箭,主要是化学能转化为热能,选项C错误;
D.空间站利用电解水供氧系统提供氧气是电解池的原理,是利用电能转化为化学能,选项D错误;
答案选B。
15. 一次 Zn(或锌) Zn-2e-+2OH-=ZnO+H2O 增大 C CO-2e-+4OH-=C O 32-+2H2O O2 a 0.4NA
【分析】(1)银锌纽扣电池只能使用一次;
(2)原电池工作时,负极发生氧化反应,正极发生还原反应。银锌电池反应中,锌元素从0价升高为+2价,被氧化,银元素从+1价降低为0价,被还原;
(3)正极电极反应式为:;
(4)氧化还原反应,且反应放热,才可以设计为原电池;
(5),设计成原电池,一氧化碳发生氧化反应,为电池的负极;
(6)氧气得电子发生还原反应,为正极;
(7)在电池中,阴离子向负极移动;
(8)1个氧气转移4个电子。
【详解】(1)银锌纽扣电池只能使用一次,属于一次电池;
故答案为:一次;
(2)原电池工作时,负极发生氧化反应,正极发生还原反应。银锌电池反应中,锌元素从0价升高为+2价,被氧化,银元素从+1价降低为0价,被还原,所以锌是负极,电极反应式为:;
故答案为:Zn(或锌);;
(3)正极电极反应式为: ,由电极反应式知,电池放电时,正极区溶液的增大;
故答案为:增大;
(4)A. △H>0,反应吸热, 不能设计成原电池,A错误;
B.该反应不是氧化还原反应,没有电子的转移,故不能设计成原电池,B错误;
C.该反应为氧化还原反应,且反应放热,故该反应可以设计为原电池,C正确;
答案选C;
(5),设计成原电池,一氧化碳发生氧化反应,为电池的负极,且电解质为KOH溶液,故负极电极反应式为:;
故答案为:;
(6)氧气得电子发生还原反应,为正极,故正极反应物均为氧气;
答案为:;
(7)在电池中,阴离子向负极移动,a为负极,故向电极a移动;
答案为:a;
(8)电池消耗标准状况下2.24L,即0.1mol氧气,1个氧气转移4个电子,故转移电子数为0.4NA;
故答案为:0.4NA。
16. NiO2 NiO2+2e-+2H2O= Ni(OH)2+2OH- 0.4NA 负 阴极电保护法 13 2Al+3H2O-6e-=Al2O3+6H+
【详解】(1) 原电池在放电时,负极发生氧化反应,正极发生还原反应,该蓄电池放电时正极发生反应的物质是NiO2,因为Ni的化合价降低了,正极的电极反应:NiO2+2e-+2H2O= Ni(OH)2+2OH-;
故答案为:NiO2;NiO2+2e-+2H2O= Ni(OH)2+2OH-;
(2)该蓄电池放电时生成Fe (OH) 2的质量为18g,则外电路中转移电子物质的量=0.4mol, 转移的电子数0.4NA;
故答案为:0.4NA;
(3) 作原电池正极或电解池阴极的金属被保护,作电解池阴极金属应该与电源负极相连,这种防腐方法称做阴极电保护法;
故答案为:负;阴极电保护法;
(4)电解200mL的NaCl溶液,在标准状况下,阳极收集到224mL气体时,生成氯气的物质的量为:0.01mol,2Cl-+2H2OCl2↑+H2↑+2OH-知,在标准状况下,阳极收集到224mL气体时,生成氢氧化钠的物质的量为0.02mol,则氢氧化钠的物质的量浓为:0.02mol÷0.2L=0.2mol/L,则溶液的pH值为13;
故答案为:13;
(5)根据装置分析,电解池中铝为活性电极,反应过程中铝需要钝化,铝转化为三氧化二铝,为氧化反应,电极反应式为:2Al+3H2O-6e-=Al2O3+6H+;
故答案为:2Al+3H2O-6e-=Al2O3+6H+;
17.(1) 1:2
(2)
(3) 0.3
【解析】(1)
①根据题干所给热化学方程式,可分别计算:
若质量均为1g的、、C完全燃烧,放出的热量分别为:、、,计算得分别为:142.9kJ、55.64kJ、32.79kJ,因此等质量、、C完全燃烧放出热量最多的是;
若物质的量均为1mol的、、C完全燃烧,放出的热量分别为:285.8kJ、890.3kJ、393.5kJ,即完全燃烧放出的热量最多,故答案为:H2;;
②设、物质的量分别为x、y mol,则。二者混合物燃烧放出的总热量为2066.4kJ,则有:。联立两式解得:,。因此,故答案为:1:2;
(2)
10.0g液态偏二甲肼与液态四氧化二氮完全燃烧可放出425kJ热量,则1mol液态偏二甲肼与足量的液态四氧化二化氮完全反应生成、、、放出的热量为,则热化学方程式为:;
(3)
假设两个反应分别为①、②,由①×2+②得:,反应中转移电子为;因此若用0.15mol CO还原还原至时,转移电子为,放出的热量为,故答案为:0.3;。
18. 5 2 1 5 1 1 1 KIO3 0.5mol B 2H 6(g)+3O 2(g)===B 2O 3(s)+3H 2O(l);△H=-2165kJ/mol 催化剂或催化作用 CO2 N2 5NaClO+2NaCN+2NaOH=2Na2CO3+N2↑+5NaCl+H2O
【分析】I.(1)①反应中S元素化合价由Na2SO3中+4价升高为+6价,总共升高2价,I元素化合价由KIO3中+5降低为I2中0价,总共降低10价,化合价最小公倍数为10,故Na2SO3系数为5,故I2系数为1,再结合原子守恒配平;
②氧化还原反应中所含元素化合价降低的反应物是氧化剂;依据方程式中元素化合价变化计算转移电子的数目;
(2)0.3molB2H6气体在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,则1molB2H6完全反应放出2165 kJ热量,据此书写热化学反应方程式;
II.由信息可知,发生KCN+2KOH+Cl2═KOCN+2KCl+H2O、2KOCN+4KOH+3Cl2=2CO2+N2↑+6KCl+2H2O,若氧化剂为NaClO发生5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O.
【详解】I.(1)①反应中S元素化合价由Na2SO3中+4价升高为+6价,总共升高2价,I元素化合价由KIO3中+5降低为I2中0价,总共降低10价,化合价最小公倍数为10,故Na2SO3系数为5,故I2系数为1,再结合原子守恒配平后方程式为5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O,故为:5;2;1;5;1;1;1;
②5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O反应中碘酸钾中碘元素化合价降低,所以碘酸钾为氧化剂,依据方程式可知:生成1mol碘单质,转移10mol电子,若反应中有5mol电子转移,则生成的碘单质是0.5mol;
(2)0.3molB2H6气体在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,则1molB2H6完全反应放出2165 kJ热量,则该热化学反应方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165 kJ·mol-1
II.(1)光的作用下,在小粒和溶液界面发生氧化还原反应.但小粒的质量不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物有毒废物,可知二氧化钛在上述反应中的作用是催化作用;
(2)由KCN+2KOH+Cl2═KOCN+2KCl+H2O、2KOCN+4KOH+3Cl2=2CO2+N2↑+6KCl+2H2O可知,氰化物经处理后产生的无毒气体应该是CO2、N2;
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为5NaClO+2NaCN+2NaOH=2Na2CO3+N2↑+5NaCl+H2O.
19.(1)出现蓝色沉淀
(2) 正 2Fe3++Cu=2Fe2++Cu2+
(3) Fe-2e-=Fe2+ 2Cu2++2H2O2Cu+O2↑+4H+ 224
【详解】(1)装置1为铁的吸氧腐蚀实验,石墨棒为正极,电极反应为O2+4e-+2H2O=4OH-,无锈铁钉为负极,电极反应为2Fe-4e-=2Fe2+,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到出现蓝色沉淀,说明Fe被氧化成Fe2+;答案为:出现蓝色沉淀。
(2)装置2为原电池装置,Cu为负极,电极反应为Cu-2e-=Cu2+,石墨为正极,电极反应为2Fe3++2e-=2Fe2+,该装置发生的总反应的离子方程式为Cu+2Fe3+=Cu2++2Fe2+;答案为:正;Cu+2Fe3+=Cu2++2Fe2+。
(3)装置3为电解装置,甲烧杯中盛放100mL0.2mol/LNaCl溶液,通电一段时间后停止通电,向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,石墨电极的电极反应为2H2O+2e-=H2↑+2OH-,甲烧杯中Fe为阳极,石墨电极为阴极,则直流电源的M为正极、N为负极,乙烧杯中石墨为阳极、Cu为阴极;
①甲烧杯中铁电极为阳极,Fe为活性电极,电极反应为Fe-2e-=Fe2+;答案为:Fe-2e-=Fe2+。
②乙烧杯中石墨电极的电极反应为2H2O-4e-=O2↑+4H+,Cu电极的电极反应为2Cu2++4e-=2Cu,电解反应的离子方程式为2Cu2++2H2O2Cu+O2↑+4H+;答案为:2Cu2++2H2O2Cu+O2↑+4H+。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,Cu电极的电极反应为2Cu2++4e-=2Cu,电路中通过的电子物质的量为×2=0.02mol,甲烧杯中石墨电极上产生H2,电极反应为2H2O+2e-=H2↑+2OH-,产生H2物质的量为通过电子物质的量的,产生H2物质的量为0.01mol,在标准状况下的体积为0.01mol×22.4L/mol=0.224L=224mL;答案为:224。
20. N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=-641.625kJ·mol-1 408.8 生成N2和H2O,对环境无污染 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=-1135.7kJ·mol-1 N2H4(g)+2F2(g)=N2(g)+4HF(g) △H=-1135kJ/mol
【详解】(1)已知0.4mol液态肼和足量H2O2(l)反应生成氮气和水蒸气时放出256.64kJ的热量,依据热化学方程式的书写原则,结合定量关系写出,1mol肼和过氧化氢反应生成氮气和水蒸气放出的热量==641.6KJ,所以热化学方程式为:N2H4(l)+2 H2O2(l) = N2(g)+ 4 H2O (g) △H=-641.625 kJ·mol-1;
(2)16g液态肼物质的量==0.5mol,由①N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=-641.6kJ/mol;②H2O(1)=H2O(g)△H=+44kJ/mol,结合盖斯定律,可以把②×4方向倒转得到③:4H2O(g)=4H2O(l)△H=-44×4kJ/mol=-176kJ/mol,①+③得到N2H4(1)+2H2O2(1)=N2(g)+4H2O(l);△H=-817.6kJ/mol,所以0.5mol液态肼与足量双氧水反应生成氮气和液态水时,放出的热量==408.8kJ;
故答案为:408.8;
(3)反应应用于火箭推进器,除释放出大量热量和快速生成大量气体产生巨大推力外,反应的生成物是氮气和水,很突出的优点是对环境无污染;
故答案为:产物为氮气和水,无污染;
(4)①N2(g)+2O2(g)═2NO2(g),△H=+67.7kJ·mol-1;②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534kJ·mol-1将方程式②×2-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2(-534kJ·mol-1)-(+67.7kJ·mol-1)=-1135.7kJ·mol-1;
故答案为:2N2H4(g)+2 NO2(g)═3N2(g)+4 H2O(g);△H=-1135.7kJ·mol-1;
(5)已知:①N2H4(g)+O2(g) =N2(g) +2H2O (g)△H = -543kJ/mol;②1/2H2(g) +1/2F2(g)=HF (g) △H= -269kJ/mol;③H2(g) +1/2O2(g) =H2O (g) △H= -242kJ/mol。肼和氟气反应的化学方程式为④N2H4(g) +2F2(g) = N2(g) +4HF;根据盖斯定律可得:④=①+②×4-③×2,则肼和氟气反应的热化学方程式:N2H4(g)+2F2(g)=N2(g)+4HF (g) △H =-1135kJ/mol。
21. 负 有气泡产生 不变 A 稀硫酸
【分析】电源为原电池,图中另外三个池子均为电解池(包括淀粉KI试纸),由题意知,淀粉KI试纸D端的反应为2I- - 2e- = I2,故D端为阳极,则C端为阴极,电源E端为正极,F端为负极,电解池A中Fe为阳极,Pt为阴极,电解池B中石墨为阳极,Cu为阴极。
【详解】(1)由分析知,电源F端为负极,故此处填负;
(2)A中Fe电极为阳极,电极反应为Fe-2e-=Fe2+,Pt为阴极,水产生的H+在阴极放电,电极反应为2H2O+2e-=H2↑+2OH-,叠加两极反应得总反应为;
(3)B中石墨电极为阳极,水产生的OH-在阳极放电,电极反应为2H2O-4e-=O2↑+4H+;Cu电极为阴极,水产生的H+在阴极放电,电极反应为2H2O+2e-=H2↑+2OH-,故反应现象为有气泡产生;B反应中实际为电解水,由于Na2SO4溶液显中性,水减少对其pH没有影响,故此处填不变;
(4)若将电源去掉,则可通过向A中加入酸使其形成原电池,若加入稀硫酸,则发生反应Fe+2H+=Fe2++H2↑,Fe作负极,Pt作正极,则试纸D端为电解池的阳极,发生反应2I- - 2e- = I2,出现变蓝现象,符合题意;若选浓硝酸,则Fe在浓硝酸中钝化后,Pt与浓硝酸不反应,故不能形成原电池,综上所述,此处填稀硫酸。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入 CH4的一极,其电极反应式是CH4+10OH--8e-==CO32-+7H2O;通入O2的另一极,其电极反应式是2O2+4H2O+8e-==8OH-。下列叙述不正确的是
A.正极发生还原反应
B.通入CH4的电极为负极
C.该电池使用一段时间后应补充KOH
D.燃料电池工作时,溶液中的OH-向正极移动
2.下列关于热化学反应方程式的描述中正确的是
A.稀HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则稀H2SO4和稀Ba(OH)2溶液反应的热化学方程式:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) ΔH>-57.3kJ/mol
B.CO的燃烧热是283.0kJ/mol,则:2CO2(g)=2CO(g)+O2(g) ΔH=2×(-283.0)kJ/mol
C.两个体积相同的容器中充入等量的NO2发生反应:2NO2(g) N2O4(g) ΔH<0,绝热容器中气体的颜色比铁制容器中颜色深
D.已知石墨转化为金刚石要吸热,则等量的石墨与金刚石相比总键能小
3.工业上电解饱和食盐水制备氯气,实验室常用与浓盐酸制备氯气。制备氯气时,下列装置能达到相应实验目的的是
A.电解法制氯气 B.实验室制氯气
C.除去氯气中的HCl D.氯气收集和尾气处理
4.近日,科学家利用溴辅助氧化C2H4电催化CO2合成三乙醇胺、利用金属酞菁电催化剂上*Br相对于*OH的优先吸附,C2H4进一步氧化并与亚硝酸盐还原偶联形成三乙醇胺,串联使用两个电解槽,工作原理如图所示。
下列说法错误的是
A.X极为阳极,N极为阴极
B.膜1为阳离子交换膜
C.Y极的电极反应式为2CO2+ 8H2O+12e -= C2H4+ 12OH-
D.右侧电池中,理论上转移6mol电子时生成1molN(CH2CH2OH)3
5.利用实验器材(规格和数量不限,省略夹持装置),能够完成相应实验的有几项
实验器材 相应实验
① 量筒、温度计、烧杯、碎纸条、盖板 中和热的测定
② 烧杯、分液漏斗 用饱和溶液除去乙酸乙酯中的乙酸和乙醇
③ 量筒、玻璃捧、烧杯、容量瓶 用浓盐酸配制的稀盐酸溶液
④ 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管、石棉网 分离甲醇和甘油的混合物
⑤ 坩埚、酒精灯、玻璃棒、泥三角、三脚架 从食盐水中得到晶体
A.2项 B.3项 C.4项 D.5项
6.已知通常状况下氢气的燃烧热的为-286kJ/mol,则下列热化学方程式书写正确的是
A.
B.
C.
D.
7.将二氧化碳转化为乙烯的装置如图所示,使用的电极材料均为惰性电极。下列说法正确的是
A.a电极电势比b电极高
B.每生成乙烯,同时生成
C.左侧电极反应式为
D.移动方向为从右到左
8.甲酸常被用于橡胶、医药等工业。在一定条件下可分解生成CO 和H2O。在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法错误的是
A.途径一未使用催化剂,但途径二与途径一甲酸平衡转化率相同
B.ΔH1=ΔH2<0,Ea1= Ea2
C.途径二H+参与反应,通过改变反应途径加快反应速率
D.途径二反应的快慢由生成的速率决定
9.下列既属于氧化还原反应,又属于吸热反应的是
A.铝片与稀盐酸反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与水蒸气的反应 D.甲烷(CH4)在O2中的燃烧反应
10.普通锌锰干电池的简图如图所示,该电池工作时的总反应为。下列关于锌锰干电池的说法中正确的是
A.电池工作时,移向石墨电极
B.电池工作时电子从石墨电极流向锌筒
C.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
D.电池负极反应式为
11.电化学在日常生活中用途广泛,下图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是含Cr2O工业废水的电化学处理示意图。下列说法正确的是(已知6Fe2++ Cr2O+14H+=6Fe3++2Cr3++7H2O)
A.图②中Cr2O离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B.图②中阳极上的电极反应式为:Fe-3e-=Fe3+
C.图①中发生的还原反应是:ClO-+H2O+2e-=Cl-+2OH-
D.若图①中7.2g镁溶解产生的电量用以图②废水处理,理论可产生32.1g氢氧化铁沉淀
12.磷酸铁锂电池放电时正极的电极反应式为FePO4+Li++e-=LiFePO4,该电池放电时的工作原理如图所示。下列叙述正确的是
A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铜箔经溶液流向铝箔
C.放电时,负极上Cu放电生成Cu2+
D.该电池放电过程中Fe、P元素的化合价发生了变化
13.水系锌离子电池的工作原理如图所示,下列相关说法正确的是
A.放电时Zn置换Mn
B.充电时Zn2+向P极板迁移
C.充电时阳极反应为:ZnMn2O4-2e-=Zn2++2MnO2
D.用该电池电解精炼铜,粗铜应该连接到b电极
14.我国的航空航天事业取得了举世瞩目的成就。下列航空航天的设备中实现了由化学能到电能转化的是
A.人造卫星使用的太阳能电池
B.新一代运载火箭使用的氢氧燃料电池
C.利用偏二甲肼()作为助推剂发射火箭
D.空间站利用电解水供氧系统提供氧气
二、填空题
15.Ⅰ.微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。请回答下列问题。
(1)该电池属于 电池(填“一次”或“二次”)。
(2)负极是 ,电极反应式是 。
(3)使用时,正极区的pH (填“增大”、“减小”或“不变”)。
Ⅱ.(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。(填字母)
A C(s)+H2O(g)=CO(g)+H2(g) △H>0
B NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H<0
C 2CO(g)+O2(g)=2CO2(1) △H<0
(5)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为 。
Ⅲ.乙醇(C2H5OH)燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
(6)三种乙醇燃料电池中正极反应物均为 。(填化学式)
(7)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极 (填“a”或“b”)移动。
(8)酸性乙醇燃料电池中,若电池消耗标准状况下2.24L O2,则电路中通过了的电子数目为 。
16.某蓄电池的反应为NiO2+Fe+2H2OFe(OH)2+Ni(OH)2
(1)该蓄电池放电时正极发生反应的物质是 ,正极发生的电极反应式为 。
(2)若放电时生成Fe(OH)2质量为18g,则通过外电路的电子数目是 。
(3)海水下的钢闸门常常会被腐蚀,为了保护这些钢铁设备,通常可以将它们与该蓄电池的 (填“正”或“负”)极相连,这种防腐方法称做 。
(4)室温下,用该蓄电池电解200mL饱和食盐水进行氯碱工业,当阳极产生标准状况下224mL氯气时,此时溶液的pH= (忽略溶液体积的变化)。
(5)以该蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理,可使铝制品表面形成较致密的氧化膜以更好地保护铝制品,写出铝电极上发生的电极反应式 。
17.航天燃料通常由液氧煤油,液氧液氢,偏二甲肼和四氧化二氮。请利用化学反应相关原理,回答下列问题。
(1)已知在298K时的热化学方程式:
根据上面的热化学方程式完成下列问题:
①通过计算说明等质量的、、C完全燃烧时放出热量最多的是 ,等物质的量、、C完全燃烧时放出热量最多的是 。
②若和混合气体的总物质的量为3mol,且完全燃烧放出2066.4kJ的能量,则 。
(2)“嫦娥二号”卫星使用液态四氧化二氮和液态偏二甲肼()作推进剂,燃烧产物是三种对环境无污染的气体,同时放出大量的热。已知10.0g液态偏二甲肼与液态四氧化二氮完全燃烧可放出425kJ热量,该反应的热化学方程式为 。
(3)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
若用0.15mol CO还原至(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
18.I.(1)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
Na2SO3+ KIO3+ H2SO4—— Na2SO4+ K2SO4+ I2+ H2O
①配平上面的氧化还原反应方程式,
②其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘是 mol。
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,乙硼烷燃烧热的热化学方程式为 。
II.含氰化物(有CN -)的废水危害大,CN-的含量为0.01mol/L~0.04mol/L就能毒 杀鱼类。其处理方法是用氧化法使其转化为低毒的氰酸钾(KCNO),氧化剂常用次氯酸盐;而生成的CNO-可进一步降解为能直接排放到空气中的无毒气体。近期研究将把某些导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量和性质不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物等有毒废物。
(1)二氧化钛在上述反应中的作用是 。
(2)CNO -经进一步处理后产生的两种无毒气体应该是 和 。
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为
19.应用电化学原理,解决下列问题:
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,即可观察到的现象是 ,表明铁被氧化。
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(3)装置3中甲烧杯盛放100mL0.2mol/L的NaCl溶液,乙烧杯盛放100mL0.5mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,回答下列问题:
①甲烧杯中铁电极的电极反应为 。
②乙烧杯中电解反应的离子方程式为 。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体(标准状况下)体积为 mL。
20.在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式 。
(2)已知H2O(l)=H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是 kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是 。
(4)已知N2(g)+2O2(g)=2NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)==N2(g)+2H2O (g);△H= -534kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式 。
(5)已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-543kJ/mol
1/2H2(g)+1/2F2(g)=HF(g) △H=-269kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=-242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式: 。
21.用如图所示的装置进行电解,A中盛有NaCl溶液,B中盛有饱和Na2SO4溶液,通电一会儿,发现湿润的淀粉KI试纸的D端变为蓝色。回答下列问题:
(1)电源的F端为 (填“正”或“负”)极。
(2)A中发生反应的总化学方程式为 。
(3)B中石墨电极上的电极反应式为 ;Cu电极观察到的现象是 ;一段时间后,B中溶液pH (填“升高”、“降低”或“不变”)。
(4)去掉该装置中的电源,改用导线连接,为使湿润的淀粉KI试纸的D端变为蓝色,可将 (填“A”或“B”)中的溶液换成 (填“稀硫酸”或“浓硝酸”)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.根据给出的电极反应看出,通入CH4的一极是负极,通入O2的另一极是正极。正极发生还原反应,A正确;
B.通入CH4的电极为负极,B正确;
C.对比两个电极反应,可知消耗的OH-比生成的多,所以随着反应的进行,KOH的浓度会降低,所以需要补充KOH,C正确;
D.原电池中阴离子向负极移动,OH-向负极移动,D错误。
2.C
【详解】A.稀H2SO4和稀Ba(OH)2溶液反应中有BaSO4白色沉淀生成,生成硫酸钡的过程是放热过程,所以该反应过程释放的总热量大于中和热,反应的热化学方程式应为:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) ΔH<-57.3kJ/mol,故A错误;
B. CO的燃烧热是283.0kJ/mol,一氧化碳燃烧生成二氧化碳是放热反应,其逆反应二氧化碳分解生成一氧化碳和氧气是吸热反应,则:2CO2(g)=2CO(g)+O2(g) ΔH=+2×283.0kJ/mol,故B错误;
C.C中反应是放热反应,应用容器是绝热的,所以温度升高,平衡向逆反应方向移动,NO2浓度增大,颜色加深;应用容器是铁制容器时,因为是热的良导体,传递热量,热量散失,平衡向正反应方向移动,四氧化二氮增多,颜色变浅,所以绝热容器中气体的颜色比铁制容器中颜色深,故C正确;
D.已知石墨转化为金刚石要吸热,所以石墨比金刚石稳定;破坏等量的石墨消耗的能量多,所以等量的石墨总键能大于金刚石的总键能,故D错误;
故选C。
3.D
【详解】A.当前电解池连接,铁电极做阳极,阳极反应为:,不会产生氯气,设备错误,不符题意;
B.MnO2与浓盐酸反应制氯气必须要加热,无加热装置,实验无法进行,装置错误,不符题意;
C.洗气瓶中应装饱和食盐水做除杂试剂,NaHCO3溶液无法实现Cl2中杂质HCl的去除,试剂错误,不符题意;
D.氯气可溶于水,密度大于空气,故此选择向上排空气法收集,过量氯气用NaOH溶液完全吸收,避免污染空气,描述正确,符合题意;
综上,本题选D。
4.B
【分析】Y极由CO2生成C2H4发生还原反应是阴极,X为阳极,M极Br-被氧化为Br2发生氧化反应,是阳极,N是阴极。
【详解】A.X极为阳极,N极为阴极,故A正确;
B.X极是阳极,发生4OH--4e-=O2↑+2H2O, Y极的电极反应式为2CO2+ 8H2O+12e -= C2H4+ 12OH-,Y极产生的氢氧根离子通过膜1进入X极一边失去电子,因此膜1是阴离子交换膜,可以通过氢氧根离子,故B错误;
C.Y极的电极反应式为2CO2+ 8H2O+12e -= C2H4+ 12OH-,方程式正确,故C正确;
D.生成1molN(CH2CH2OH)3,有1mol亚硝酸根离子得6mol电子生成1molNH3,理论上转移6mol电子生成1mol N(CH2CH2OH)3,故D正确;
答案选B。
5.A
【详解】①缺少环形玻璃搅拌棒;③缺少胶头滴管;⑤蒸发结晶不用坩埚而用蒸发皿,只有②、④能够完成,故A正确;
故选A。
6.B
【分析】燃烧热是指1mol物质完全燃烧生成稳定氧化物所放出的热量,通常状况下氢气的燃烧热的为-286kJ/mol,氢气的燃烧热化学方程式为:。
【详解】A.1mol氢气完全燃烧生成液态水放出的热量为286kJ,则2mol氢气完全燃烧生成液态水放出的热量为572kJ,热化学方程式为: ,A错误;
B.2mol氢气完全燃烧生成液态水放出的热量为572kJ,热化学方程式为: ,B正确;
C.氢气完全燃烧生成的稳定氧化物为液态水,则1mol氢气完全燃烧的热化学方程式为:,C错误;
D.氢气完全燃烧生成的稳定氧化物为液态水,则2mol氢气完全燃烧的热化学方程式为: ,D错误;
答案选B。
7.D
【分析】根据图知,右侧电极上OH-放电生成O2,则右侧电极为阳极,左侧电极为阴极,连接电解池阴极的电极为原电池负极、连接电解池阳极的电极为原电池正极;以此解答。
【详解】A.由分析可知,b为正极,a为负极,a电极电势比b电极低,故A错误;
B.没有说明是否为标况状态,不能用22.4L/mol计算氧气的体积,故B错误;
C.左侧为阴极,阴极上二氧化碳得电子和氢离子反应生成乙烯和水,电极反应式为2CO2+12H++12e-═C2H4+4H2O,故C错误;
D.电解池中阳离子向阴极移动,移动方向为从右到左,故D正确;
故选D。
8.B
【详解】A.催化剂可以降低活化能,因此途径一未使用催化剂,但催化剂不能改变平衡状态,所以途径二和途径一的甲酸平衡转化率相同,A正确;
B.催化剂可以降低活化能,但不能改变焓变,由于反应物的总能量高于生成物的总能量,因此ΔH1=ΔH2<0,但Ea1>Ea2,B错误;
C.途径二中反应前有氢离子,反应后还有氢离子,说明H+参与反应,通过改变反应途径加快反应速率,C正确;
D.生成的活化能高,则途径二反应的快慢由生成的速率决定,D正确;
故选B。
9.C
【详解】A.铝片与稀盐酸的反应为放热反应,故A错误;
B.Ba(OH)2 8H2O与NH4Cl的反应为吸热反应,但不是氧化还原反应,故B错误;
C.灼热的炭与水蒸气的反应为氧化还原反应,同时也是吸热反应,故C正确;
D.甲烷(CH4)在O2中的燃烧为放热反应,故D错误。
故选:C。
10.C
【分析】由已知电池的总反应可知,Zn化合价升高发生氧化反应,锌筒作为电池的负极,而MnO2化合价降低发生还原反应,石墨电极作为电池的正极,电子有负极流向正极,阳离子移向正极,阴离子移向负极。
【详解】A.电池工作时阴离子移向负极,由分析可知,锌筒作为负极,所以移向锌筒,A项错误;
B.电子由负极流向正极,应该为由锌筒流向石墨电极,B错误;
C.,0.1molZn的质量为6.5g,所以C正确;
D.负极应该失电子发生氧化反应,所以电极反应式错误, 为电池正极的电极反应式,D错误;
故答案选C。
11.D
【分析】图1是原电池,根据总反应式,Mg电极是负极,惰性电极是正极。图2是电解池,金属铁是阳极,惰性电极是阴极。
【详解】A.图②中惰性电极为阴极,Fe电极为阳极,则Cr2O离子向金属铁电极移动,与亚铁离子发生氧化还原反应生成的金属阳离子与惰性电极附近的OH-结合转化成Cr(OH)3除去,A错误;
B.图②中Fe为阳极,发生氧化反应,阳极上的电极反应式为:Fe-2e-=Fe2+,B错误;
C.该原电池中,镁作负极,负极上镁失电子发生氧化反应,负极反应为Mg-2e-=Mg2+,电池反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl-,正极上次氯酸根离子得电子发生还原反应,则总反应减去负极反应可得正极还原反应为Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓,C错误;
D.由电子守恒可知,Mg~2e-~Fe2+,由原子守恒可知Fe2+~Fe(OH)3↓,则n(Mg)=7.2g÷24g/mol=0.3mol,理论可产生氢氧化铁沉淀的质量为0.3mol×107g/mol=32.1g,D正确;
答案选D。
12.A
【详解】A.原电池放电时,阳离子移向正极,阴离子移向负极,即放电时,Li+通过隔膜移向正极,A正确;
B.该电池放电时铝箔电极为正极,铜箔电极为负极,放电时,电子由铜箔经过导线流向铝箔,电子不能进入溶液中,B错误:
C.该电池放电时铜箔电极为负极,负极上LixC6失去电子生成Li+,C错误;
D.正极的电极反应式为FePO4+Li++e-=LiFePO4,放电过程P元素的化合价未发生变化,D错误;
综上所述答案为A。
13.C
【分析】放电时Zn为负极,即Q为负极,P为正极,充电时Q为阴极,P为阳极。
【详解】A.放电时装置为原电池,负极Zn失电子生成Zn2+,正极MnO2得电子生成ZnMn2O4,没有Mn单质生成,A错误;
B.充电时装置为电解池,阳离子向阴极移动,故Zn2+向Q极板迁移,B错误;
C.充电时阳极ZnMn2O4失电子生成MnO2,反应为ZnMn2O4-2e-=Zn2++2MnO2,C正确;
D.用该电池电解精炼铜,粗铜作阳极,应该连接到正极,即a电极,D错误;
故选C。
14.B
【详解】A.人造地球卫星上的太阳能电池板是太阳能转化为电能,选项A错误;
B.氢氧燃料电池是将化学能转化为电能,选项B正确;
C.利用偏二甲肼(N2H4 )作为助推剂发射火箭,主要是化学能转化为热能,选项C错误;
D.空间站利用电解水供氧系统提供氧气是电解池的原理,是利用电能转化为化学能,选项D错误;
答案选B。
15. 一次 Zn(或锌) Zn-2e-+2OH-=ZnO+H2O 增大 C CO-2e-+4OH-=C O 32-+2H2O O2 a 0.4NA
【分析】(1)银锌纽扣电池只能使用一次;
(2)原电池工作时,负极发生氧化反应,正极发生还原反应。银锌电池反应中,锌元素从0价升高为+2价,被氧化,银元素从+1价降低为0价,被还原;
(3)正极电极反应式为:;
(4)氧化还原反应,且反应放热,才可以设计为原电池;
(5),设计成原电池,一氧化碳发生氧化反应,为电池的负极;
(6)氧气得电子发生还原反应,为正极;
(7)在电池中,阴离子向负极移动;
(8)1个氧气转移4个电子。
【详解】(1)银锌纽扣电池只能使用一次,属于一次电池;
故答案为:一次;
(2)原电池工作时,负极发生氧化反应,正极发生还原反应。银锌电池反应中,锌元素从0价升高为+2价,被氧化,银元素从+1价降低为0价,被还原,所以锌是负极,电极反应式为:;
故答案为:Zn(或锌);;
(3)正极电极反应式为: ,由电极反应式知,电池放电时,正极区溶液的增大;
故答案为:增大;
(4)A. △H>0,反应吸热, 不能设计成原电池,A错误;
B.该反应不是氧化还原反应,没有电子的转移,故不能设计成原电池,B错误;
C.该反应为氧化还原反应,且反应放热,故该反应可以设计为原电池,C正确;
答案选C;
(5),设计成原电池,一氧化碳发生氧化反应,为电池的负极,且电解质为KOH溶液,故负极电极反应式为:;
故答案为:;
(6)氧气得电子发生还原反应,为正极,故正极反应物均为氧气;
答案为:;
(7)在电池中,阴离子向负极移动,a为负极,故向电极a移动;
答案为:a;
(8)电池消耗标准状况下2.24L,即0.1mol氧气,1个氧气转移4个电子,故转移电子数为0.4NA;
故答案为:0.4NA。
16. NiO2 NiO2+2e-+2H2O= Ni(OH)2+2OH- 0.4NA 负 阴极电保护法 13 2Al+3H2O-6e-=Al2O3+6H+
【详解】(1) 原电池在放电时,负极发生氧化反应,正极发生还原反应,该蓄电池放电时正极发生反应的物质是NiO2,因为Ni的化合价降低了,正极的电极反应:NiO2+2e-+2H2O= Ni(OH)2+2OH-;
故答案为:NiO2;NiO2+2e-+2H2O= Ni(OH)2+2OH-;
(2)该蓄电池放电时生成Fe (OH) 2的质量为18g,则外电路中转移电子物质的量=0.4mol, 转移的电子数0.4NA;
故答案为:0.4NA;
(3) 作原电池正极或电解池阴极的金属被保护,作电解池阴极金属应该与电源负极相连,这种防腐方法称做阴极电保护法;
故答案为:负;阴极电保护法;
(4)电解200mL的NaCl溶液,在标准状况下,阳极收集到224mL气体时,生成氯气的物质的量为:0.01mol,2Cl-+2H2OCl2↑+H2↑+2OH-知,在标准状况下,阳极收集到224mL气体时,生成氢氧化钠的物质的量为0.02mol,则氢氧化钠的物质的量浓为:0.02mol÷0.2L=0.2mol/L,则溶液的pH值为13;
故答案为:13;
(5)根据装置分析,电解池中铝为活性电极,反应过程中铝需要钝化,铝转化为三氧化二铝,为氧化反应,电极反应式为:2Al+3H2O-6e-=Al2O3+6H+;
故答案为:2Al+3H2O-6e-=Al2O3+6H+;
17.(1) 1:2
(2)
(3) 0.3
【解析】(1)
①根据题干所给热化学方程式,可分别计算:
若质量均为1g的、、C完全燃烧,放出的热量分别为:、、,计算得分别为:142.9kJ、55.64kJ、32.79kJ,因此等质量、、C完全燃烧放出热量最多的是;
若物质的量均为1mol的、、C完全燃烧,放出的热量分别为:285.8kJ、890.3kJ、393.5kJ,即完全燃烧放出的热量最多,故答案为:H2;;
②设、物质的量分别为x、y mol,则。二者混合物燃烧放出的总热量为2066.4kJ,则有:。联立两式解得:,。因此,故答案为:1:2;
(2)
10.0g液态偏二甲肼与液态四氧化二氮完全燃烧可放出425kJ热量,则1mol液态偏二甲肼与足量的液态四氧化二化氮完全反应生成、、、放出的热量为,则热化学方程式为:;
(3)
假设两个反应分别为①、②,由①×2+②得:,反应中转移电子为;因此若用0.15mol CO还原还原至时,转移电子为,放出的热量为,故答案为:0.3;。
18. 5 2 1 5 1 1 1 KIO3 0.5mol B 2H 6(g)+3O 2(g)===B 2O 3(s)+3H 2O(l);△H=-2165kJ/mol 催化剂或催化作用 CO2 N2 5NaClO+2NaCN+2NaOH=2Na2CO3+N2↑+5NaCl+H2O
【分析】I.(1)①反应中S元素化合价由Na2SO3中+4价升高为+6价,总共升高2价,I元素化合价由KIO3中+5降低为I2中0价,总共降低10价,化合价最小公倍数为10,故Na2SO3系数为5,故I2系数为1,再结合原子守恒配平;
②氧化还原反应中所含元素化合价降低的反应物是氧化剂;依据方程式中元素化合价变化计算转移电子的数目;
(2)0.3molB2H6气体在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,则1molB2H6完全反应放出2165 kJ热量,据此书写热化学反应方程式;
II.由信息可知,发生KCN+2KOH+Cl2═KOCN+2KCl+H2O、2KOCN+4KOH+3Cl2=2CO2+N2↑+6KCl+2H2O,若氧化剂为NaClO发生5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O.
【详解】I.(1)①反应中S元素化合价由Na2SO3中+4价升高为+6价,总共升高2价,I元素化合价由KIO3中+5降低为I2中0价,总共降低10价,化合价最小公倍数为10,故Na2SO3系数为5,故I2系数为1,再结合原子守恒配平后方程式为5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O,故为:5;2;1;5;1;1;1;
②5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O反应中碘酸钾中碘元素化合价降低,所以碘酸钾为氧化剂,依据方程式可知:生成1mol碘单质,转移10mol电子,若反应中有5mol电子转移,则生成的碘单质是0.5mol;
(2)0.3molB2H6气体在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,则1molB2H6完全反应放出2165 kJ热量,则该热化学反应方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165 kJ·mol-1
II.(1)光的作用下,在小粒和溶液界面发生氧化还原反应.但小粒的质量不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物有毒废物,可知二氧化钛在上述反应中的作用是催化作用;
(2)由KCN+2KOH+Cl2═KOCN+2KCl+H2O、2KOCN+4KOH+3Cl2=2CO2+N2↑+6KCl+2H2O可知,氰化物经处理后产生的无毒气体应该是CO2、N2;
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为5NaClO+2NaCN+2NaOH=2Na2CO3+N2↑+5NaCl+H2O.
19.(1)出现蓝色沉淀
(2) 正 2Fe3++Cu=2Fe2++Cu2+
(3) Fe-2e-=Fe2+ 2Cu2++2H2O2Cu+O2↑+4H+ 224
【详解】(1)装置1为铁的吸氧腐蚀实验,石墨棒为正极,电极反应为O2+4e-+2H2O=4OH-,无锈铁钉为负极,电极反应为2Fe-4e-=2Fe2+,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到出现蓝色沉淀,说明Fe被氧化成Fe2+;答案为:出现蓝色沉淀。
(2)装置2为原电池装置,Cu为负极,电极反应为Cu-2e-=Cu2+,石墨为正极,电极反应为2Fe3++2e-=2Fe2+,该装置发生的总反应的离子方程式为Cu+2Fe3+=Cu2++2Fe2+;答案为:正;Cu+2Fe3+=Cu2++2Fe2+。
(3)装置3为电解装置,甲烧杯中盛放100mL0.2mol/LNaCl溶液,通电一段时间后停止通电,向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,石墨电极的电极反应为2H2O+2e-=H2↑+2OH-,甲烧杯中Fe为阳极,石墨电极为阴极,则直流电源的M为正极、N为负极,乙烧杯中石墨为阳极、Cu为阴极;
①甲烧杯中铁电极为阳极,Fe为活性电极,电极反应为Fe-2e-=Fe2+;答案为:Fe-2e-=Fe2+。
②乙烧杯中石墨电极的电极反应为2H2O-4e-=O2↑+4H+,Cu电极的电极反应为2Cu2++4e-=2Cu,电解反应的离子方程式为2Cu2++2H2O2Cu+O2↑+4H+;答案为:2Cu2++2H2O2Cu+O2↑+4H+。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,Cu电极的电极反应为2Cu2++4e-=2Cu,电路中通过的电子物质的量为×2=0.02mol,甲烧杯中石墨电极上产生H2,电极反应为2H2O+2e-=H2↑+2OH-,产生H2物质的量为通过电子物质的量的,产生H2物质的量为0.01mol,在标准状况下的体积为0.01mol×22.4L/mol=0.224L=224mL;答案为:224。
20. N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=-641.625kJ·mol-1 408.8 生成N2和H2O,对环境无污染 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=-1135.7kJ·mol-1 N2H4(g)+2F2(g)=N2(g)+4HF(g) △H=-1135kJ/mol
【详解】(1)已知0.4mol液态肼和足量H2O2(l)反应生成氮气和水蒸气时放出256.64kJ的热量,依据热化学方程式的书写原则,结合定量关系写出,1mol肼和过氧化氢反应生成氮气和水蒸气放出的热量==641.6KJ,所以热化学方程式为:N2H4(l)+2 H2O2(l) = N2(g)+ 4 H2O (g) △H=-641.625 kJ·mol-1;
(2)16g液态肼物质的量==0.5mol,由①N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=-641.6kJ/mol;②H2O(1)=H2O(g)△H=+44kJ/mol,结合盖斯定律,可以把②×4方向倒转得到③:4H2O(g)=4H2O(l)△H=-44×4kJ/mol=-176kJ/mol,①+③得到N2H4(1)+2H2O2(1)=N2(g)+4H2O(l);△H=-817.6kJ/mol,所以0.5mol液态肼与足量双氧水反应生成氮气和液态水时,放出的热量==408.8kJ;
故答案为:408.8;
(3)反应应用于火箭推进器,除释放出大量热量和快速生成大量气体产生巨大推力外,反应的生成物是氮气和水,很突出的优点是对环境无污染;
故答案为:产物为氮气和水,无污染;
(4)①N2(g)+2O2(g)═2NO2(g),△H=+67.7kJ·mol-1;②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534kJ·mol-1将方程式②×2-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2(-534kJ·mol-1)-(+67.7kJ·mol-1)=-1135.7kJ·mol-1;
故答案为:2N2H4(g)+2 NO2(g)═3N2(g)+4 H2O(g);△H=-1135.7kJ·mol-1;
(5)已知:①N2H4(g)+O2(g) =N2(g) +2H2O (g)△H = -543kJ/mol;②1/2H2(g) +1/2F2(g)=HF (g) △H= -269kJ/mol;③H2(g) +1/2O2(g) =H2O (g) △H= -242kJ/mol。肼和氟气反应的化学方程式为④N2H4(g) +2F2(g) = N2(g) +4HF;根据盖斯定律可得:④=①+②×4-③×2,则肼和氟气反应的热化学方程式:N2H4(g)+2F2(g)=N2(g)+4HF (g) △H =-1135kJ/mol。
21. 负 有气泡产生 不变 A 稀硫酸
【分析】电源为原电池,图中另外三个池子均为电解池(包括淀粉KI试纸),由题意知,淀粉KI试纸D端的反应为2I- - 2e- = I2,故D端为阳极,则C端为阴极,电源E端为正极,F端为负极,电解池A中Fe为阳极,Pt为阴极,电解池B中石墨为阳极,Cu为阴极。
【详解】(1)由分析知,电源F端为负极,故此处填负;
(2)A中Fe电极为阳极,电极反应为Fe-2e-=Fe2+,Pt为阴极,水产生的H+在阴极放电,电极反应为2H2O+2e-=H2↑+2OH-,叠加两极反应得总反应为;
(3)B中石墨电极为阳极,水产生的OH-在阳极放电,电极反应为2H2O-4e-=O2↑+4H+;Cu电极为阴极,水产生的H+在阴极放电,电极反应为2H2O+2e-=H2↑+2OH-,故反应现象为有气泡产生;B反应中实际为电解水,由于Na2SO4溶液显中性,水减少对其pH没有影响,故此处填不变;
(4)若将电源去掉,则可通过向A中加入酸使其形成原电池,若加入稀硫酸,则发生反应Fe+2H+=Fe2++H2↑,Fe作负极,Pt作正极,则试纸D端为电解池的阳极,发生反应2I- - 2e- = I2,出现变蓝现象,符合题意;若选浓硝酸,则Fe在浓硝酸中钝化后,Pt与浓硝酸不反应,故不能形成原电池,综上所述,此处填稀硫酸。
答案第1页,共2页
答案第1页,共2页
