专题2《化学反应速率与化学平衡》单元检测题(含解析)2023---2024学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题2《化学反应速率与化学平衡》单元检测题(含解析)2023---2024学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 601.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-22 09:37:16 | ||
图片预览



文档简介
专题2《化学反应速率与化学平衡》
一、单选题
1.下列说法中正确的是
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大的,非自发反应一定是熵减小的
C.熵增加且放热的反应在任何温度下都能自发进行
D.化学反应能否自发进行,与反应焓变和熵变有关。当△H-T△S>0时,反应自发
2.可逆反应 ,同时符合下列两图中各曲线变化规律,则下列判断正确的是
A. B.
C. D.
3.与在催化剂作用下可以合成甲醇,发生如下反应:
I.
II.
将一定量的与通入某密闭容器,催化反应相同时间,测得不同温度下的转化率、的产率如图所示(图中虚线表示相同条件下的平衡转化率随温度的变化)。下列有关说法正确的是
A.反应
B.250℃前,的产率随温度的升高而增大,说明平衡时升高温度反应I向正反应方向进行
C.250℃后,随温度升高的产率不断减小,可能是因为催化剂对反应I的活性降低
D.保持其他条件不变,220℃时使用高效催化剂能使转化率从a点的值升至b点
4.下列叙述与图像对应符合的是
A.图A:对于达到平衡状态的,在时刻充入了一定的,平衡逆向移动
B.图B:,
C.图C:该图像表示的方程式为
D.图D:对于反应,y可表示Y的百分含量
5.周期表中ⅥA族元素及其化合物应用广泛。是常见的氧化剂和助燃剂。催化氧化是工业制硫酸的重要反应之一(中和热为)。Se(硒)是重要的工业原材料与动物体必须营养素。提取Se的主要原材料为电解铜产生的阳极泥。可通过阳极泥硫酸化焙烧提取Se,硫酸化焙烧提取Se的步骤主要分为两步:第一步焙烧,硫酸将单质Se氧化为。第二步还原吸收,在水中将转化为单质Se。对于反应,下列有关说法不正确的是
A.该反应为放热反应 B.上述反应的平衡常数
C.使用催化剂能缩短该反应到达平衡的时间 D.增大体系的压强能提高的反应速率
6.下列说法中正确的是
A.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
B.100mL的2mol·L-1盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
C.用铁片和稀硫酸反应制取氢气时,改用铁片与浓硫酸反应可以加快产生氢气的速率
D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
7.T℃时,体积均为0.5L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g)2C(g) △H=-QkJ·mol-1 (Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如表,下列叙述中正确的是
容器编号 起始时各物质的物质的量/mol 达到平衡时体系能量的变化
A B C
① 2 1 0 0.75QkJ
② 0.4 0.2 1.6
A.容器②中达到平衡时放出的热量为0.05QkJ
B.向容器①中通入氦气,平衡时A的转化率变大
C.其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于
D.容器①②中反应的平衡常数值均为18
8.将一定量纯净的X置于某10L容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:,实验测得不同温度下的分解平衡常数列于下表,下列说法中正确的是
温度(℃) 15.0 25.0 30.0 35.0
K/() 0.205 1.64 4.68 10.8
A.该反应△H<0
B.35℃时,平衡时X分解了0.03mol
C.若在恒温下,压缩容器体积,再次达平衡后,X的物质的量比原平衡小
D.若气体密度不再随时间变化表示反应还未达平衡状态
9.“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是
A.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
B.增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快
C.对于有气体参加的反应通过压缩容器增大压强,可使单位体积内活化分子增多,反应速率加快
D.活化分子之间的碰撞一定是有效碰撞
10.一定温度下,在某一刚性容器中,加入1molCO和1mol发生反应:,达到平衡时测得与的物质的量之和占气体总物质的量百分比为40%,下列说法不正确的是
A.平衡时,
B.达到平衡时的压强与起始时的压强之比为1∶1
C.CO与的平衡转化率均为50%
D.加入合适的催化剂可以加快化学反应速率使该反应更快达到平衡状态
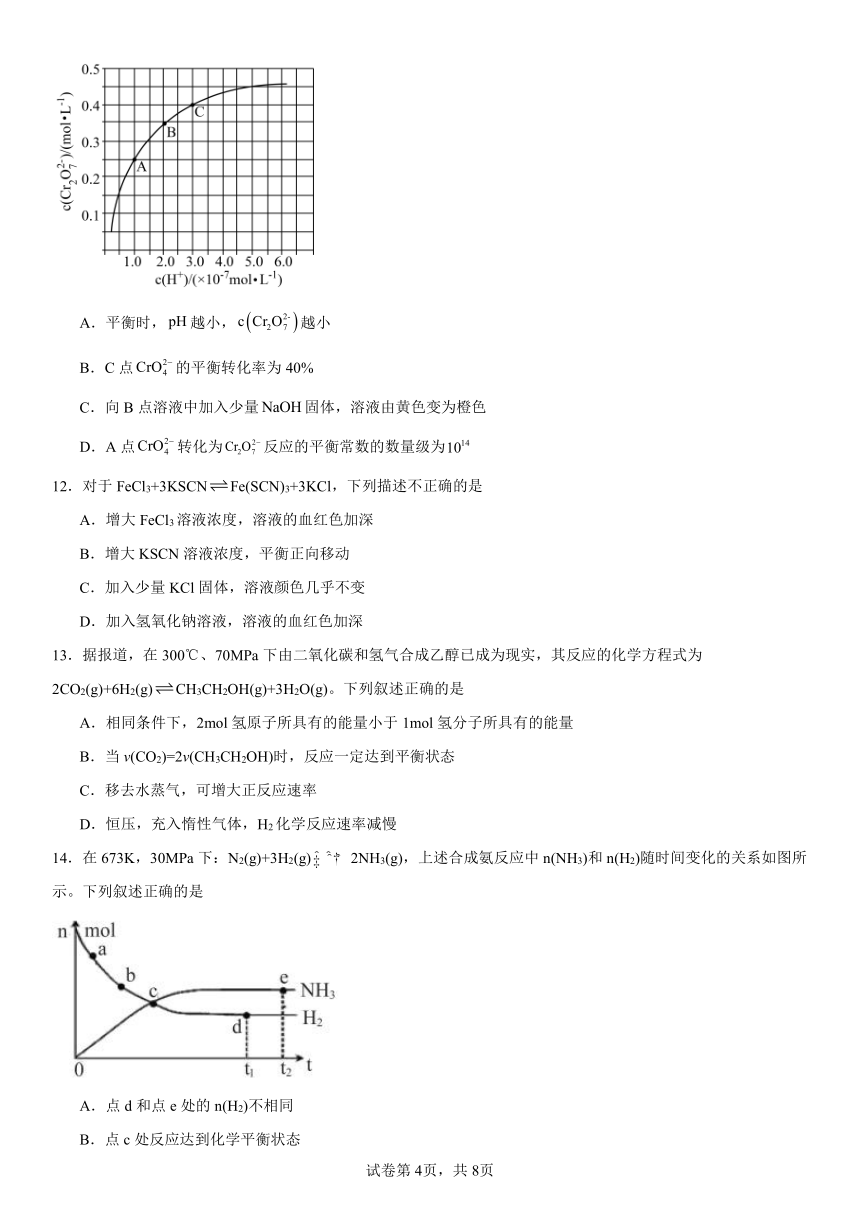
11.已知,25℃时调节初始浓度为的溶液的,测定平衡时溶液中和(单位为),获得如图所示的曲线。下列说法正确的是
A.平衡时,越小,越小
B.C点的平衡转化率为40%
C.向B点溶液中加入少量固体,溶液由黄色变为橙色
D.A点转化为反应的平衡常数的数量级为
12.对于FeCl3+3KSCNFe(SCN)3+3KCl,下列描述不正确的是
A.增大FeCl3溶液浓度,溶液的血红色加深
B.增大KSCN溶液浓度,平衡正向移动
C.加入少量KCl固体,溶液颜色几乎不变
D.加入氢氧化钠溶液,溶液的血红色加深
13.据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)。下列叙述正确的是
A.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
B.当v(CO2)=2v(CH3CH2OH)时,反应一定达到平衡状态
C.移去水蒸气,可增大正反应速率
D.恒压,充入惰性气体,H2化学反应速率减慢
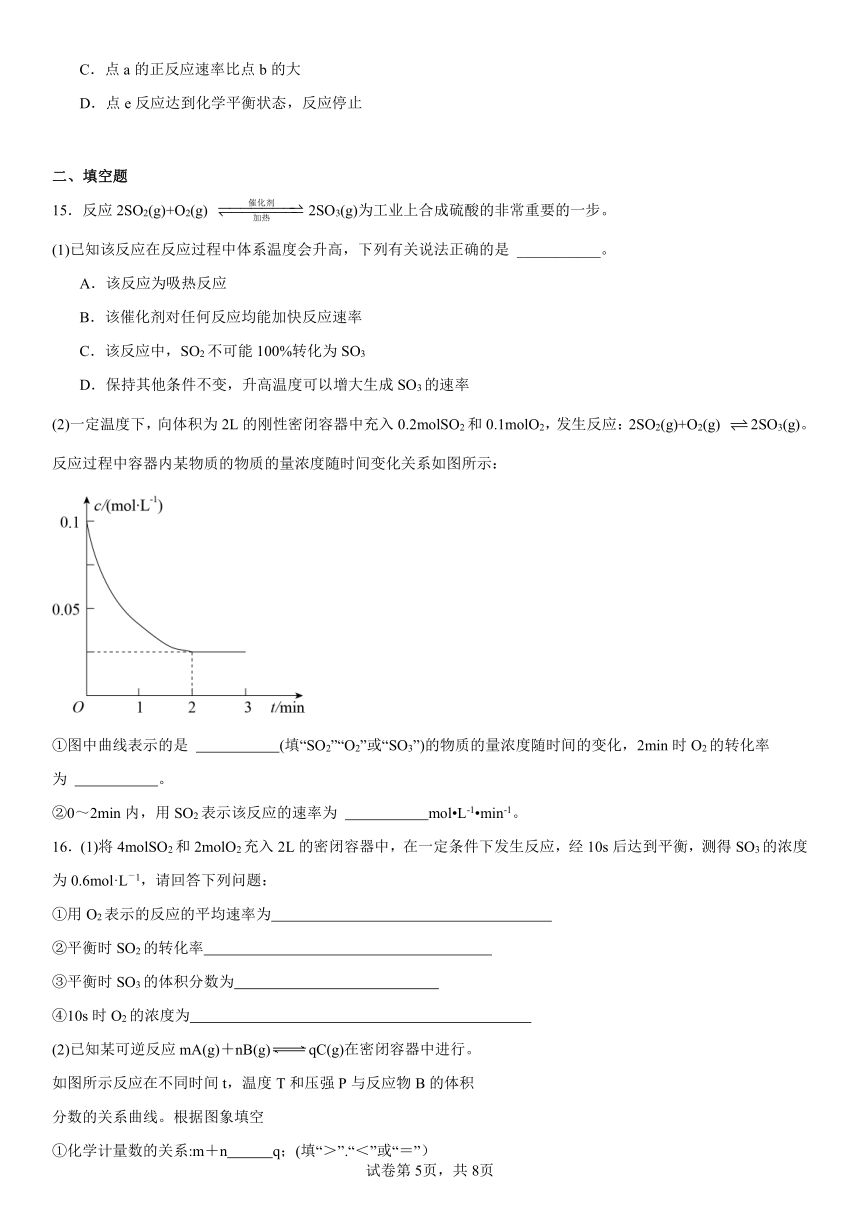
14.在673K,30MPa下:N2(g)+3H2(g)2NH3(g),上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
A.点d和点e处的n(H2)不相同
B.点c处反应达到化学平衡状态
C.点a的正反应速率比点b的大
D.点e反应达到化学平衡状态,反应停止
二、填空题
15.反应2SO2(g)+O2(g) 2SO3(g)为工业上合成硫酸的非常重要的一步。
(1)已知该反应在反应过程中体系温度会升高,下列有关说法正确的是 ___________。
A.该反应为吸热反应
B.该催化剂对任何反应均能加快反应速率
C.该反应中,SO2不可能100%转化为SO3
D.保持其他条件不变,升高温度可以增大生成SO3的速率
(2)一定温度下,向体积为2L的刚性密闭容器中充入0.2molSO2和0.1molO2,发生反应:2SO2(g)+O2(g) 2SO3(g)。反应过程中容器内某物质的物质的量浓度随时间变化关系如图所示:
①图中曲线表示的是 (填“SO2”“O2”或“SO3”)的物质的量浓度随时间的变化,2min时O2的转化率为 。
②0~2min内,用SO2表示该反应的速率为 mol L-1 min-1。
16.(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol·L-1,请回答下列问题:
①用O2表示的反应的平均速率为
②平衡时SO2的转化率
③平衡时SO3的体积分数为
④10s时O2的浓度为
(2)已知某可逆反应mA(g)+nB(g)qC(g)在密闭容器中进行。
如图所示反应在不同时间t,温度T和压强P与反应物B的体积
分数的关系曲线。根据图象填空
①化学计量数的关系:m+n q;(填“>”.“<”或“=”)
②该反应的正反应为 反应。(填“吸热”或“放热”)
(3)在FeCl3+3KSCN Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡 移动。
②在溶液中加入少量的KCl固体,平衡 移动。
17.回答下列问题:
(1)硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+O2(g)SO3(g) △H=-98kJ mol-1。当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图所示。反应在5.0MPa、550℃时的α= ,判断的依据是 。影响α的因素有 。
(2)乙烷在一定条件可发生如下反应:C2H6(g)C2H4(g)+H2(g) △H=+137kJ mol-1。提高该反应平衡转化率的方法有 、 。
18.完成下列问题。
(1)甲醇是21世纪应用最广泛的清洁燃料之一,通过以下反应可以制备甲醇:CO(g)+2H2(g)=CH3OH(1) △H=?
已知:2H2(g)+O2(g)=2H2O(1) △H=-571.6kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ·mol-1
2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) △H=-1453.0kJ·mol-1
则制备甲醇反应的△H= kJ·mol-1
(2)将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应3A(g)+B(g) xC(g)+2D(g),经过4min时,测得D的浓度为0.8mol/L,c(A):c(B)=3;5,C的反应速率是0.1mol·L-1·min-1,则x的值是 ,A在4min时的浓度是 ,B的平均反应速率是 。
(3)肼(N2H4)-空气燃料电池是一种环保的碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是 。
19.300℃时,将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8molD。
(1)300℃时,该反应的平衡常数表达式为:K= 。已知K300℃”或“<”)。
(2)在2min末时,B的平衡浓度为 ,D的平均反应速率为 。
(3)若温度不变,缩小容器容积,则A的转化率 (填“增大”“减小”或“不变”),原因是 。
(4)如果在相同的条件下,上述反应从逆反应方向开始,开始时加入C、D各1mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B mol。
20.(1)工业合成氨的反应原理为N2(g)+3H2(g)2NH3(g) ΔH= 92.4 kJ/mol。该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有 (填字母代号)。
a.增大压强 b.升高温度 c.增大N2浓度
d.及时移走生成物NH3 e.使用高效催化剂
(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示。
①用离子方程式表示Na2CrO4溶液中发生的转化反应 。
②由图可知,溶液酸性减弱,CrO42-的平衡转化率 (填“增大”、“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为 。
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH 0(填“大于”“小于”或“等于”)。
21.一定温度下,将3 mol A气体和1 mol B气体通入一容积固定为2 L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g),请填写下列空白:
(1)反应1 min时测得剩余1.8 mol A,C的浓度为0.4 mol/L,则1 min内,B的平均反应速率为 ;x为 。
(2)若反应经2 min达到平衡,平衡时C的浓度 0.8 mol/L(填“大于”、“小于”或“等于”)
(3)能加快反应速率的措施是 。
①升高温度
②容器体积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar
④使用催化剂
⑤将容器体积缩小一半
(4)能够说明该反应达到平衡的标志是 。
A.容器内混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.A、B的浓度之比为3:1
D.单位时间内断开3n mol A-A键的同时生成n mol B-B
E.v(A)=3v(B)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.ΔH-TΔS<0时反应即可自发,吸热反应ΔH>0、若ΔS>0,导致ΔH-TΔS<0即可自发,例如氢氧化钡晶体和氯化铵晶体反应是吸热反应,在室温下即可自发,A错误;
B.ΔH-TΔS<0时反应即可自发,放热反应ΔH<0、若ΔS<0,导致ΔH-TΔS<0即可自发,例如氨气和氯化氢化合为氯化铵晶体的反应是熵减的放热反应,在室温下即可自发, B错误;
C. 熵增加且放热的反应ΔH<0、若ΔS>0,则必然使ΔH-TΔS<0,在任何温度下都能自发进行,C正确;
D. 化学反应能否自发进行,与反应焓变和熵变有关,当△H-T△S<0时,反应自发,D错误;
答案选C。
2.B
【详解】由‘先拐先平数值大’,则T2>T1,温度升高,C%减小,说明平衡向逆向移动,该反应是放热反应,;增大压强,正反应速率的变化程度比逆反应速率的大,且v正>v逆,则增大压强,平衡正向移动,说明,故选:B。
3.C
【详解】A.已知I. ,II. ,根据盖斯定律,由I- II得反应,选项A错误;
B.250℃前,反应还没达到平衡,升高温度的产率增大,不能说明平衡时升高温度反应I向正反应方向进行,选项B错误;
C.250℃后,随着温度升高,C'H3OH的产率减小,说明升高温度抑制了反应的进行,可能是因为催化剂对反应I的活性降低,选项C正确;
D.催化剂不能使平衡移动,故不能增大转化率,选项D错误;
答案选C。
4.B
【详解】A.图A,如果在t0时刻充入了一定的NH3,逆反应速率瞬间增大,正反应速率瞬间不变,v(正)应与平衡点相连,故A错误;
B.增大压强,反应速率增大,升高温度,反应速率增大,故先达到平衡,由先拐先平知p2>p1,T1>T2,压强增大平衡正向进行,C的百分含量增大,图像符合,升温平衡逆向进行,C%含量减小,图像符合,故B正确;
C.从图像可知到t1时刻,A的浓度减少:(2.0 1.2)mol/L=0.8mol/L,B的浓度增加0.4mol/L,C的浓度增加1.2mol/L,反应为可逆反应,根据浓度变化之比等于化学计量数之比确定化学反应方程式为:2A B+3C,故C错误;
D.由D中方程式看出,温度升高,平衡将逆向移动,Y的百分含量将增大,图像不符合,故D错误;
故选:B。
5.B
【详解】A.大多数的化合反应和氧化还原反应为放热反应,该反应既属于化合反应又属于氧化还原反应,所以该反应为烦热反应,故A正确;
B.平衡常数:各生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值是个常数,则反应的平衡常数,故B错误;
C.催化剂可降低反应的活化能,加快化学反应速率,从而缩短平衡所需的时间,故C正确;
D.反应为气体参加的反应,增大压强使浓度增大,反应速率加快,故D正确;
答案选B。
6.D
【详解】A.不管反应是放热反应还是吸热反应,升高温度,反应速率都加快,A错误;
B.盐酸与锌反应,加入适量的氯化钠溶液,Na+和Cl-对反应速率没有影响,但溶液的体积增大,H+浓度减小,所以生成氢气的速率变小,B错误;
C.常温下铁片与浓硫酸发生钝化,不会产生氢气,C错误;
D.2CO+2NO N2+2CO2,减小压强,反应速率减慢,D正确;
正确答案选D。
7.D
【分析】当2molA参与反应时放出QkJ的热量,故当放出0.75QkJ的热量时,容器①中参加反应的A的物质的量=2mol×=1.5mol,则:
恒温恒容下,②中完全转化到方程式左边可以得到2molA、1molB,容器①、②反应为完全等效平衡,平衡时各组分的物质的量相等,②中A的起始物质的量为0.4mol,小于平衡时的0.5mol。
【详解】A.②中反应吸收热量,容器①、②反应为完全等效平衡,平衡时B的物质的量相等,则②中吸收的热量为(0.25-0.2)mol×Q kJ/mol=0.05QkJ,故A项错误;
B.恒容条件下,向容器①中通入氦气,各组分的浓度不变,平衡不移动,平衡时A的转化率不变,故B项错误;
C.平衡时①、②中C的体积分数为,其他条件不变,若容器②保持恒容绝热,随反应进行,温度降低,反应向生成C的方向移动,生成2molC时,混合气体减小1mol,则达到平衡时C的体积分数大于,故C项错误;
D.由于温度相等,①②中平衡常数 ,故D项正确;
答案选D。
8.B
【详解】A.由表可知温度越高,平衡常数K越大,所以△H >0,选项A错误;
B.35℃平衡常数为10.8×10-8,假设反应开始时X的物质的量是a mol,反应消耗了b mol,则达到平衡时n(Y)=2b mol,n(Z)=b mol,K=c2(Y) c(Z)=×10-8,解得b=0.03 mol,即X分解了0.03 mol,选项B正确;
C.该反应的正反应是气体体积增大的反应,压缩容器体积,相当于增大压强,化学平衡向气体体积减小的逆向移动,所以再次达平衡后,n(X)比原平衡大,选项C错误;
D.反应X(s)2Y(g)+Z(g)在恒容密闭容器中进行,Y和Z都是气体,而X是固体,若反应未达到平衡状态,则气体的质量会增大,气体的密度也会增大,所以若气体密度不再随时间变化时,表示反应达平衡状态,选项D错误;
答案选B。
9.D
【详解】A、催化剂降低反应的活化能,可增大单位体积内活化分子数以及活化分子个数,从而使有效碰撞次数增大,因而增大反应速率,A正确;
B、增大反应物浓度,可增大单位体积内活化分子的个数,从而使有效碰撞次数增大,反应速率增大,B正确;
C、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大单位体积内活化分子的个数,从而使有效碰撞次数增大,反应速率加快,C正确;
D、活化分子之间的碰撞不一定都是有效的,只有能引起化学反应的碰撞才是有些碰撞,D不正确;
答案选D。
10.C
【分析】设平衡时反应了x molCO,根据三段式:,则,解得x=0.4,据此分析作答。
【详解】A.平衡时,反应了0.4mol的水,故剩余的水为0.6mol,生成的为0.4mol,A项正确;
B.由于容器体积不变,该反应为一个反应前后气体化学计量数之和相等的反应,在气体物质的量不变的情况下,反应前后压强相等,为1∶1,B项正确;
C.通过计算可知,平衡时反应了0.4molCO,所以CO与的平衡转化率均为40%,C项错误;
D.添加合适的催化剂有利于加快反应速率,可以使反应更快达到平衡状态,D项正确;
答案选C。
11.D
【详解】A.由,可知为反应物,若越小,则越大,平衡正向移动,即越大,故A错;
B.由三段式C点平衡时,则的转化率,故B错;
C.向B点溶液中加入少量固体,会消耗氢离子,则平衡逆向移动,则溶液黄色变深,橙色变浅,故C错;
D.由三段式可得A点的平衡常数,故D正确;
答案选D。
12.D
【分析】反应FeCl3+3KSCNFe(SCN)3+3KCl的实质为:Fe3++3SCN-Fe(SCN)3,然后根据平衡移动原理分析解答。
【详解】A.增大FeCl3溶液浓度,即增大反应物Fe3+的浓度,化学平衡正向移动,导致Fe(SCN)3浓度增大,因此溶液血红色加深,A正确;
B.增大KSCN溶液浓度,即增大反应物SCN-的浓度,化学平衡正向移动,Fe(SCN)3浓度增大,因此溶液血红色加深,B正确;
C.加入KCl固体,其电离产生的K+、Cl-离子不参加化学反应,因此对化学平衡移动无影响,化学平衡不移动,反应体系中各种微粒浓度不变,因此溶液颜色几乎不变,C正确;
D.氢氧化钠与氯化铁反应生成Fe(OH)3沉淀,导致溶液中c(Fe3+)减小,使化学平衡逆向移动,Fe(SCN)3浓度降低,溶液的血红色变浅,D错误;
故合理选项是D。
13.D
【详解】A.氢原子结合生成氢气分子,氢原子之间形成化学键释放能量,则2 mol氢原子所具有的能量高于1 mol氢分子所具有的能量,A错误;
B.未指出反应速率的正、逆,因此不能判断反应是否处于平衡状态,B错误;
C.移去水蒸气的瞬间,正反应速率不变,逆反应速率减小,由于正反应速率大于逆反应速率,化学平衡正向移动,反应物浓度减小,正反应速率减小,C错误;
D.恒压,充入惰性气体,则容器体积增大,H2的浓度减小,反应速率减慢,D正确;
综上所述答案为D。
14.C
【详解】A.点d和点e所在直线平行,说明各物质的物质的量已经不再发生变化,化学反应达到平衡状态,两点对应的n(N2)相同,故A项错误;
B.化学反应达到平衡时各物质的物质的量将不再发生变化,而c点之后氨气和氢气的物质的量仍在变化,则点c处反应未达到平衡状态,故B项错误;
C.曲线斜率表示化学反应速率,a点比b点要陡,则点a的正反应速率比点b的大,故C项正确;
D.化学平衡是一种动态的平衡状态,正逆反应速率相等,而非停止,故D项错误。
综上所述,本题正确答案为C。
15.(1)CD
(2) SO2 75% 0.0375
【详解】(1)A.该反应在反应过程中体系温度会升高,故该反应为放热反应,A错误;
B.催化剂针对特定反应有催化效果,不会对任何反应均具有催化效果,B错误;
C.二氧化硫与氧气的反应为可逆反应,SO2不可能100%转化为SO3,C正确;
D.保持其他条件不变,升高温度,化学反应速率加快,D正确;
故选CD;
(2)①随反应进行,图象中物质的量的浓度减小,故该物质为反应物,体积为2L的刚性密闭容器中充入0.2molSO2和0.1molO2,起始时二氧化硫的浓度为 ,氧气的物质的量浓度为 ,故图中曲线表示的是SO2;2min时,二氧化硫的浓度为0.025mol/L,则二氧化硫的反应量为 ,根据化学反应方程式,氧气的反应量为0.075mol,故2min时O2的转化率为 ;
②有以上分析可知,二氧化硫的反应量为0.15mol,故用SO2表示该反应的速率为 。
16. 0.03mol/(L s) 30% 22.2 % 0.7mol/L < 吸热 正向 不
【分析】(1)在一定温度下,将4mol SO2与2molO2放入2L的密闭容器中,c(SO2)=2mol/L,c(O2)=1mol/L,经10s后达到平衡,测得SO3的浓度为0.6mol L-1;
设转化的氧气的物质的量浓度为x,则
2SO2 +O2 2SO3
开始(mol L-1) 2 1 0
转化(mol L-1) 2x x 2x
平衡(mol L-1) 2-2x 1-x 2x
平衡时测得SO3的浓度为0.6mol L-1;据以上分析进行计算。
(2)根据“先拐先平,数值大”原则,采取定一议二得到温度和压强的大小关系,根据图示,结合压强和B的含量的关系判断方程式前后的系数和大小关系,根据温度和B的含量的关系,确定化学反应的吸放热情况;
(3)根据平衡移动原理分析,改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动;
①加入少量KSCN固体,反应中SCN-浓度增大;
②根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变。
【详解】在一定温度下,将4mol SO2与2molO2放入2L的密闭容器中,c(SO2)=2mol/L,c(O2)=1mol/L,经10s后达到平衡,测得SO3的浓度为0.6mol L-1;设转化的氧气的物质的量浓度为x,则
2SO2 + O2 2SO3
开始(mol L-1) 2 1 0
转化(mol L-1) 2x x 2x
平衡(mol L-1) 2-2x 1-x 2x
平衡时测得SO3的浓度为0.6mol L-1;所以2x=0.6mol L-1,计算得出x=0.3mol L-1;
(1)①10s内氧气的浓度变化为△c(O2)=0.3mol L-1,所以v(O2)= c/t=0.3/10=0.03mol/(L s);
答案是:0.03mol/(L s);
②平衡时SO2的转化率为:消耗量/起始量×100%=0.6/2×100%=30%;
答案是:30%;
③平衡时的容器内的总浓度为:2-2x+1-x+2x=2.7mol L-1,所以平衡时SO3的体积分数0.6/2.7×100%=22.2%;
答案是:22.2%;
④平衡时氧气的浓度:1-0.3=0.7mol L-1;
答案是:0.7mol L-1;
(2)定压强相同,比较温度不同时,即比较曲线T1、P2与曲线T2、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的温度高,所以T1> T2,定温度相同,比较压强不同时,即比较曲线T1、P1与曲线T1、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的压强高,所以P1< P2;
①压强P1< P2,由图知压强越大,B的含量越高,所以平衡向逆反应进行,增大压强,平衡向体积减小的方向移动,所以m+n答案是:<;
②温度T1> T2,由图知温度越高,B的含量越低,所以平衡向正反应进行,升高温度,平衡向吸热方向移动,故正反应为吸热反应;
因答案是:吸热。
(3)①加入少量KSCN固体,反应中SCN-浓度增大,平衡向正向移动;
答案是:正向;
②加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,K+和Cl-不参加反应,平衡不移动;
答案是:不。
17.(1) 0.975 该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa=p2,所以p1=5.0MPa 温度、压强和反应物的起始浓度(组成)
(2) 升高温度 减小压强(增大体积)
【详解】(1)5.0 MPa、550℃时,α=0.975。该反应正向为气体分子数减小的反应,温度相同时增大压强,化学平衡向正向移动,SO2的平衡转化率(α)增大,5.0MPa>2.5MPa=p2,故p1=5.0MPa。故判断依据:该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa=p2,所以p1=5.0MPa;影响α的因素:由图像可得温度升高,α减小,压强增大,α增大。另外起始充入的SO2与O2的物质的量之比影响SO2的平衡转化率,故影响因素为温度、压强和反应物的起始浓度(组成)。
(2)由于该反应为吸热反应、且为气体分子数增大的反应,因此可通过升高温度、减小压强(增大体积)等提高该反应的平衡转化率。
18.(1)
(2) 1
(3)
【详解】(1)根据盖斯定律,制备甲醇反应的
(2)经过4min时,测得D的浓度为0.8mol/L,用D表示的化学反应速率为:,而C的反应速率是0.1mol·L-1·min-1,反应速率之比等于化学计量数之比,故x=1,化学方程式为:3A(g)+B(g) C(g)+2D(g),设起始A和B的物质的量为amol,4min时D的浓度为0.8mol/L,即物质的量为1.6mol,可列出三段式: ,经过4min c(A):c(B)=3;5,即,故a=4.8mol,4min时A的物质的量为(4.8-2.4)mol=2.4mol,浓度为,由三段式可知B的物质的量变化量为0.8mol,反应速率为:;
(3)燃料电池中氧气在正极反应,燃料在负极反应,故负极的电极反应式为:。
19.(1) ; >;
(2) 0.8 mol·L-1; 0.2 mol·L-1·min-1 ;
(3) 不变; 反应前后气体分子数不变,压强对平衡无影响;
(4)1.5。
【详解】(1)化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则,K300℃ 0;答案为:;>;
(2)由已知可得三段式:,由上述计算可知,平衡时B的物质的量为1.6mol,所以B的平衡浓度为c(B)=1.6mol 2L=0.8mol/L;平衡时D的物质的量为0.8mol, 所以,用D表示的平均反应速率;答案为:0.8 mol·L-1;0.2 mol·L-1·min-1;
(3)由方程式可知,气体的化学计量数之和前后相等,则反应前后气体体积不变,压强对平衡无影响,缩小容器容积,则A的转化率不变;答案为:不变;反应前后气体分子数不变,压强对平衡无影响;
(4)将C、D的量折算成A、B的量,则相当于加入1.5molA和0.5molB,容器体积固定,若浓度相同,则说明起始时物质的量相等,故B还应加入2mol-0.5mol=1.5mol ;答案为:1.5。
20. acd 2CrO42-+2H+H2O+Cr2O72- 减小 1×107 小于
【详解】⑴a选项,增大压强,平衡正向移动,转化率增大,故a正确
b选项,升高温度,平衡逆向移动,转化率减小,故b错误
c选项,增大N2浓度,平衡正向移动,转化率增大,故c正确;
d选项,及时移走生成物NH3,平衡正向移动,转化率增大,故d正确;
e选择,使用高效催化剂,平衡不移动,转化率不变,故e错误;
综上所述,答案为acd;
⑵①用离子方程式表示Na2CrO4溶液中发生的转化2CrO42-+2H+H2O+Cr2O72-,故答案为2CrO42-+2H+H2O+Cr2O72-;
②由图可知,溶液酸性减弱,氢离子浓度降低,平衡逆向移动,CrO42-的平衡转化率减小,根据A点数据,计算出该转化反应的平衡常数为
2CrO42- + 2H+ H2O(g) + Cr2O72-
起始量 1.0 mol/L 0 0 0
转化量 0.5mol/L 0.5mol/L 0.25mol/L 0.25mol/L
平衡量 0.5mol/L 1×10-7mol/L 0.25mol/L
,
故答案为减小;1×107;
③升高温度,平衡向吸热反应移动,溶液中CrO42-的平衡转化率减小,说明平衡逆向移动即逆向为吸热反应,正向为放热反应,则该反应的ΔH<0,故答案为小于。
21. 0.2 mol/(L·min) 2 小于 ①④⑤ BD
【分析】(1)先计算v(A)、v(C),然后根据速率比等于计量数的比计算出v(B)及x的值;
(2)根据浓度对化学反应速率的影响分析判断;
(3)根据化学反应速率的影响因素分析判断;
(4)根据平衡状态的特征分析判断。
【详解】(1)在体积固定为2 L的密闭容器中通入3 mol A和1 mol B气体,发生反应:3A(g)+B(g)xC(g),反应1 min时测得剩余1.8 mol A,则△n(A)=(3 -1.8)mol=1.2 mol,△c(A)==0.6 mol/L,所以v(A)==0.6 mol/(L·min)。由于v(A):v(B)=3:1,所以v(B)=v(A)=×0.6 mol/(L·min)=0.2 mol/(L·min);反应开始时未通入C物质,在1 min内C的浓度为0.4 mol/L,则v(C)===0.4 mol/(L·min),由于v(A):v(C)=3:x,则0.6 mol/(L·min):0.4 mol/(L·min)= 3:x,解得x=2;
(2)在第1 min内C的浓度变化了0.4 mol/L,若化学反应速率不变,则第2 min末,C的浓度应该为0.8 mol/L。由于随着反应的进行,反应物的浓度逐渐减小,化学反应速率会逐渐减小,因此若反应经2 min达到平衡,则平衡时C的浓度小于0.8 mol/L;
(3)在其它条件不变时,①若升高温度,化学反应速率加快,①符合题意;
②容器体积不变,充入惰性气体Ar,不能改变任何一种反应物的浓度,化学反应速率不变,②不符合题意;
③容器压强不变,充入惰性气体Ar,必然会使容器的容积扩大,使反应物的浓度减小,化学反应速率减小,③不符合题意;
④使用催化剂可以大大加快化学反应速率,④符合题意;
⑤将容器体积缩小一半,反应物浓度增大,化学反应速率加快,⑤符合题意;
故合理选项是①④⑤;
(4) A.反应混合物都是气体,气体的质量不变;反应在恒容密闭容器中进行,气体的体积不变,则容器内混合气体的密度始终保持不变,因此不能根据密度不变判断反应是否处于平衡状态,A不符合题意;
B.该反应是反应前后气体体积改变的反应,若容器内混合气体的压强保持不变,则气体的物质的量不变,反应达到平衡状态,B符合题意;
C.A、B加入的物质的量的比是3:1,二者反应的物质的量的比是3:1,因此无论反应是否达到平衡,A、B的浓度之比始终是3:1,因此不能据此判断反应是否处于平衡状态,C不符合题意;
D.单位时间内断开3n mol A-A键就会断裂的n mol B-B,还同时生成n mol B-B,说明物质B的浓度不变,则反应处于平衡状态,D符合题意;
E.v(A)=3v(B)中未指明速率是正反应速率还是逆反应速率,因此不能据此判断反应是否处于平衡状态,E不符合题意;
故合理选项是BD。
【点睛】本题考查了化学反应速率的计算、关系、影响因素及化学平衡状态的判断。掌握有关概念、平衡状态的特征及化学反应速率与化学方程式中计量数的关系是解题关键。题目考查了学生对基础知识的掌握与应用能力。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列说法中正确的是
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大的,非自发反应一定是熵减小的
C.熵增加且放热的反应在任何温度下都能自发进行
D.化学反应能否自发进行,与反应焓变和熵变有关。当△H-T△S>0时,反应自发
2.可逆反应 ,同时符合下列两图中各曲线变化规律,则下列判断正确的是
A. B.
C. D.
3.与在催化剂作用下可以合成甲醇,发生如下反应:
I.
II.
将一定量的与通入某密闭容器,催化反应相同时间,测得不同温度下的转化率、的产率如图所示(图中虚线表示相同条件下的平衡转化率随温度的变化)。下列有关说法正确的是
A.反应
B.250℃前,的产率随温度的升高而增大,说明平衡时升高温度反应I向正反应方向进行
C.250℃后,随温度升高的产率不断减小,可能是因为催化剂对反应I的活性降低
D.保持其他条件不变,220℃时使用高效催化剂能使转化率从a点的值升至b点
4.下列叙述与图像对应符合的是
A.图A:对于达到平衡状态的,在时刻充入了一定的,平衡逆向移动
B.图B:,
C.图C:该图像表示的方程式为
D.图D:对于反应,y可表示Y的百分含量
5.周期表中ⅥA族元素及其化合物应用广泛。是常见的氧化剂和助燃剂。催化氧化是工业制硫酸的重要反应之一(中和热为)。Se(硒)是重要的工业原材料与动物体必须营养素。提取Se的主要原材料为电解铜产生的阳极泥。可通过阳极泥硫酸化焙烧提取Se,硫酸化焙烧提取Se的步骤主要分为两步:第一步焙烧,硫酸将单质Se氧化为。第二步还原吸收,在水中将转化为单质Se。对于反应,下列有关说法不正确的是
A.该反应为放热反应 B.上述反应的平衡常数
C.使用催化剂能缩短该反应到达平衡的时间 D.增大体系的压强能提高的反应速率
6.下列说法中正确的是
A.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
B.100mL的2mol·L-1盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
C.用铁片和稀硫酸反应制取氢气时,改用铁片与浓硫酸反应可以加快产生氢气的速率
D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
7.T℃时,体积均为0.5L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g)2C(g) △H=-QkJ·mol-1 (Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如表,下列叙述中正确的是
容器编号 起始时各物质的物质的量/mol 达到平衡时体系能量的变化
A B C
① 2 1 0 0.75QkJ
② 0.4 0.2 1.6
A.容器②中达到平衡时放出的热量为0.05QkJ
B.向容器①中通入氦气,平衡时A的转化率变大
C.其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于
D.容器①②中反应的平衡常数值均为18
8.将一定量纯净的X置于某10L容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:,实验测得不同温度下的分解平衡常数列于下表,下列说法中正确的是
温度(℃) 15.0 25.0 30.0 35.0
K/() 0.205 1.64 4.68 10.8
A.该反应△H<0
B.35℃时,平衡时X分解了0.03mol
C.若在恒温下,压缩容器体积,再次达平衡后,X的物质的量比原平衡小
D.若气体密度不再随时间变化表示反应还未达平衡状态
9.“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是
A.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
B.增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快
C.对于有气体参加的反应通过压缩容器增大压强,可使单位体积内活化分子增多,反应速率加快
D.活化分子之间的碰撞一定是有效碰撞
10.一定温度下,在某一刚性容器中,加入1molCO和1mol发生反应:,达到平衡时测得与的物质的量之和占气体总物质的量百分比为40%,下列说法不正确的是
A.平衡时,
B.达到平衡时的压强与起始时的压强之比为1∶1
C.CO与的平衡转化率均为50%
D.加入合适的催化剂可以加快化学反应速率使该反应更快达到平衡状态
11.已知,25℃时调节初始浓度为的溶液的,测定平衡时溶液中和(单位为),获得如图所示的曲线。下列说法正确的是
A.平衡时,越小,越小
B.C点的平衡转化率为40%
C.向B点溶液中加入少量固体,溶液由黄色变为橙色
D.A点转化为反应的平衡常数的数量级为
12.对于FeCl3+3KSCNFe(SCN)3+3KCl,下列描述不正确的是
A.增大FeCl3溶液浓度,溶液的血红色加深
B.增大KSCN溶液浓度,平衡正向移动
C.加入少量KCl固体,溶液颜色几乎不变
D.加入氢氧化钠溶液,溶液的血红色加深
13.据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)。下列叙述正确的是
A.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
B.当v(CO2)=2v(CH3CH2OH)时,反应一定达到平衡状态
C.移去水蒸气,可增大正反应速率
D.恒压,充入惰性气体,H2化学反应速率减慢
14.在673K,30MPa下:N2(g)+3H2(g)2NH3(g),上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
A.点d和点e处的n(H2)不相同
B.点c处反应达到化学平衡状态
C.点a的正反应速率比点b的大
D.点e反应达到化学平衡状态,反应停止
二、填空题
15.反应2SO2(g)+O2(g) 2SO3(g)为工业上合成硫酸的非常重要的一步。
(1)已知该反应在反应过程中体系温度会升高,下列有关说法正确的是 ___________。
A.该反应为吸热反应
B.该催化剂对任何反应均能加快反应速率
C.该反应中,SO2不可能100%转化为SO3
D.保持其他条件不变,升高温度可以增大生成SO3的速率
(2)一定温度下,向体积为2L的刚性密闭容器中充入0.2molSO2和0.1molO2,发生反应:2SO2(g)+O2(g) 2SO3(g)。反应过程中容器内某物质的物质的量浓度随时间变化关系如图所示:
①图中曲线表示的是 (填“SO2”“O2”或“SO3”)的物质的量浓度随时间的变化,2min时O2的转化率为 。
②0~2min内,用SO2表示该反应的速率为 mol L-1 min-1。
16.(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol·L-1,请回答下列问题:
①用O2表示的反应的平均速率为
②平衡时SO2的转化率
③平衡时SO3的体积分数为
④10s时O2的浓度为
(2)已知某可逆反应mA(g)+nB(g)qC(g)在密闭容器中进行。
如图所示反应在不同时间t,温度T和压强P与反应物B的体积
分数的关系曲线。根据图象填空
①化学计量数的关系:m+n q;(填“>”.“<”或“=”)
②该反应的正反应为 反应。(填“吸热”或“放热”)
(3)在FeCl3+3KSCN Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡 移动。
②在溶液中加入少量的KCl固体,平衡 移动。
17.回答下列问题:
(1)硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+O2(g)SO3(g) △H=-98kJ mol-1。当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图所示。反应在5.0MPa、550℃时的α= ,判断的依据是 。影响α的因素有 。
(2)乙烷在一定条件可发生如下反应:C2H6(g)C2H4(g)+H2(g) △H=+137kJ mol-1。提高该反应平衡转化率的方法有 、 。
18.完成下列问题。
(1)甲醇是21世纪应用最广泛的清洁燃料之一,通过以下反应可以制备甲醇:CO(g)+2H2(g)=CH3OH(1) △H=?
已知:2H2(g)+O2(g)=2H2O(1) △H=-571.6kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ·mol-1
2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) △H=-1453.0kJ·mol-1
则制备甲醇反应的△H= kJ·mol-1
(2)将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应3A(g)+B(g) xC(g)+2D(g),经过4min时,测得D的浓度为0.8mol/L,c(A):c(B)=3;5,C的反应速率是0.1mol·L-1·min-1,则x的值是 ,A在4min时的浓度是 ,B的平均反应速率是 。
(3)肼(N2H4)-空气燃料电池是一种环保的碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是 。
19.300℃时,将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8molD。
(1)300℃时,该反应的平衡常数表达式为:K= 。已知K300℃
(2)在2min末时,B的平衡浓度为 ,D的平均反应速率为 。
(3)若温度不变,缩小容器容积,则A的转化率 (填“增大”“减小”或“不变”),原因是 。
(4)如果在相同的条件下,上述反应从逆反应方向开始,开始时加入C、D各1mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B mol。
20.(1)工业合成氨的反应原理为N2(g)+3H2(g)2NH3(g) ΔH= 92.4 kJ/mol。该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有 (填字母代号)。
a.增大压强 b.升高温度 c.增大N2浓度
d.及时移走生成物NH3 e.使用高效催化剂
(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示。
①用离子方程式表示Na2CrO4溶液中发生的转化反应 。
②由图可知,溶液酸性减弱,CrO42-的平衡转化率 (填“增大”、“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为 。
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH 0(填“大于”“小于”或“等于”)。
21.一定温度下,将3 mol A气体和1 mol B气体通入一容积固定为2 L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g),请填写下列空白:
(1)反应1 min时测得剩余1.8 mol A,C的浓度为0.4 mol/L,则1 min内,B的平均反应速率为 ;x为 。
(2)若反应经2 min达到平衡,平衡时C的浓度 0.8 mol/L(填“大于”、“小于”或“等于”)
(3)能加快反应速率的措施是 。
①升高温度
②容器体积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar
④使用催化剂
⑤将容器体积缩小一半
(4)能够说明该反应达到平衡的标志是 。
A.容器内混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.A、B的浓度之比为3:1
D.单位时间内断开3n mol A-A键的同时生成n mol B-B
E.v(A)=3v(B)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.ΔH-TΔS<0时反应即可自发,吸热反应ΔH>0、若ΔS>0,导致ΔH-TΔS<0即可自发,例如氢氧化钡晶体和氯化铵晶体反应是吸热反应,在室温下即可自发,A错误;
B.ΔH-TΔS<0时反应即可自发,放热反应ΔH<0、若ΔS<0,导致ΔH-TΔS<0即可自发,例如氨气和氯化氢化合为氯化铵晶体的反应是熵减的放热反应,在室温下即可自发, B错误;
C. 熵增加且放热的反应ΔH<0、若ΔS>0,则必然使ΔH-TΔS<0,在任何温度下都能自发进行,C正确;
D. 化学反应能否自发进行,与反应焓变和熵变有关,当△H-T△S<0时,反应自发,D错误;
答案选C。
2.B
【详解】由‘先拐先平数值大’,则T2>T1,温度升高,C%减小,说明平衡向逆向移动,该反应是放热反应,;增大压强,正反应速率的变化程度比逆反应速率的大,且v正>v逆,则增大压强,平衡正向移动,说明,故选:B。
3.C
【详解】A.已知I. ,II. ,根据盖斯定律,由I- II得反应,选项A错误;
B.250℃前,反应还没达到平衡,升高温度的产率增大,不能说明平衡时升高温度反应I向正反应方向进行,选项B错误;
C.250℃后,随着温度升高,C'H3OH的产率减小,说明升高温度抑制了反应的进行,可能是因为催化剂对反应I的活性降低,选项C正确;
D.催化剂不能使平衡移动,故不能增大转化率,选项D错误;
答案选C。
4.B
【详解】A.图A,如果在t0时刻充入了一定的NH3,逆反应速率瞬间增大,正反应速率瞬间不变,v(正)应与平衡点相连,故A错误;
B.增大压强,反应速率增大,升高温度,反应速率增大,故先达到平衡,由先拐先平知p2>p1,T1>T2,压强增大平衡正向进行,C的百分含量增大,图像符合,升温平衡逆向进行,C%含量减小,图像符合,故B正确;
C.从图像可知到t1时刻,A的浓度减少:(2.0 1.2)mol/L=0.8mol/L,B的浓度增加0.4mol/L,C的浓度增加1.2mol/L,反应为可逆反应,根据浓度变化之比等于化学计量数之比确定化学反应方程式为:2A B+3C,故C错误;
D.由D中方程式看出,温度升高,平衡将逆向移动,Y的百分含量将增大,图像不符合,故D错误;
故选:B。
5.B
【详解】A.大多数的化合反应和氧化还原反应为放热反应,该反应既属于化合反应又属于氧化还原反应,所以该反应为烦热反应,故A正确;
B.平衡常数:各生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值是个常数,则反应的平衡常数,故B错误;
C.催化剂可降低反应的活化能,加快化学反应速率,从而缩短平衡所需的时间,故C正确;
D.反应为气体参加的反应,增大压强使浓度增大,反应速率加快,故D正确;
答案选B。
6.D
【详解】A.不管反应是放热反应还是吸热反应,升高温度,反应速率都加快,A错误;
B.盐酸与锌反应,加入适量的氯化钠溶液,Na+和Cl-对反应速率没有影响,但溶液的体积增大,H+浓度减小,所以生成氢气的速率变小,B错误;
C.常温下铁片与浓硫酸发生钝化,不会产生氢气,C错误;
D.2CO+2NO N2+2CO2,减小压强,反应速率减慢,D正确;
正确答案选D。
7.D
【分析】当2molA参与反应时放出QkJ的热量,故当放出0.75QkJ的热量时,容器①中参加反应的A的物质的量=2mol×=1.5mol,则:
恒温恒容下,②中完全转化到方程式左边可以得到2molA、1molB,容器①、②反应为完全等效平衡,平衡时各组分的物质的量相等,②中A的起始物质的量为0.4mol,小于平衡时的0.5mol。
【详解】A.②中反应吸收热量,容器①、②反应为完全等效平衡,平衡时B的物质的量相等,则②中吸收的热量为(0.25-0.2)mol×Q kJ/mol=0.05QkJ,故A项错误;
B.恒容条件下,向容器①中通入氦气,各组分的浓度不变,平衡不移动,平衡时A的转化率不变,故B项错误;
C.平衡时①、②中C的体积分数为,其他条件不变,若容器②保持恒容绝热,随反应进行,温度降低,反应向生成C的方向移动,生成2molC时,混合气体减小1mol,则达到平衡时C的体积分数大于,故C项错误;
D.由于温度相等,①②中平衡常数 ,故D项正确;
答案选D。
8.B
【详解】A.由表可知温度越高,平衡常数K越大,所以△H >0,选项A错误;
B.35℃平衡常数为10.8×10-8,假设反应开始时X的物质的量是a mol,反应消耗了b mol,则达到平衡时n(Y)=2b mol,n(Z)=b mol,K=c2(Y) c(Z)=×10-8,解得b=0.03 mol,即X分解了0.03 mol,选项B正确;
C.该反应的正反应是气体体积增大的反应,压缩容器体积,相当于增大压强,化学平衡向气体体积减小的逆向移动,所以再次达平衡后,n(X)比原平衡大,选项C错误;
D.反应X(s)2Y(g)+Z(g)在恒容密闭容器中进行,Y和Z都是气体,而X是固体,若反应未达到平衡状态,则气体的质量会增大,气体的密度也会增大,所以若气体密度不再随时间变化时,表示反应达平衡状态,选项D错误;
答案选B。
9.D
【详解】A、催化剂降低反应的活化能,可增大单位体积内活化分子数以及活化分子个数,从而使有效碰撞次数增大,因而增大反应速率,A正确;
B、增大反应物浓度,可增大单位体积内活化分子的个数,从而使有效碰撞次数增大,反应速率增大,B正确;
C、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大单位体积内活化分子的个数,从而使有效碰撞次数增大,反应速率加快,C正确;
D、活化分子之间的碰撞不一定都是有效的,只有能引起化学反应的碰撞才是有些碰撞,D不正确;
答案选D。
10.C
【分析】设平衡时反应了x molCO,根据三段式:,则,解得x=0.4,据此分析作答。
【详解】A.平衡时,反应了0.4mol的水,故剩余的水为0.6mol,生成的为0.4mol,A项正确;
B.由于容器体积不变,该反应为一个反应前后气体化学计量数之和相等的反应,在气体物质的量不变的情况下,反应前后压强相等,为1∶1,B项正确;
C.通过计算可知,平衡时反应了0.4molCO,所以CO与的平衡转化率均为40%,C项错误;
D.添加合适的催化剂有利于加快反应速率,可以使反应更快达到平衡状态,D项正确;
答案选C。
11.D
【详解】A.由,可知为反应物,若越小,则越大,平衡正向移动,即越大,故A错;
B.由三段式C点平衡时,则的转化率,故B错;
C.向B点溶液中加入少量固体,会消耗氢离子,则平衡逆向移动,则溶液黄色变深,橙色变浅,故C错;
D.由三段式可得A点的平衡常数,故D正确;
答案选D。
12.D
【分析】反应FeCl3+3KSCNFe(SCN)3+3KCl的实质为:Fe3++3SCN-Fe(SCN)3,然后根据平衡移动原理分析解答。
【详解】A.增大FeCl3溶液浓度,即增大反应物Fe3+的浓度,化学平衡正向移动,导致Fe(SCN)3浓度增大,因此溶液血红色加深,A正确;
B.增大KSCN溶液浓度,即增大反应物SCN-的浓度,化学平衡正向移动,Fe(SCN)3浓度增大,因此溶液血红色加深,B正确;
C.加入KCl固体,其电离产生的K+、Cl-离子不参加化学反应,因此对化学平衡移动无影响,化学平衡不移动,反应体系中各种微粒浓度不变,因此溶液颜色几乎不变,C正确;
D.氢氧化钠与氯化铁反应生成Fe(OH)3沉淀,导致溶液中c(Fe3+)减小,使化学平衡逆向移动,Fe(SCN)3浓度降低,溶液的血红色变浅,D错误;
故合理选项是D。
13.D
【详解】A.氢原子结合生成氢气分子,氢原子之间形成化学键释放能量,则2 mol氢原子所具有的能量高于1 mol氢分子所具有的能量,A错误;
B.未指出反应速率的正、逆,因此不能判断反应是否处于平衡状态,B错误;
C.移去水蒸气的瞬间,正反应速率不变,逆反应速率减小,由于正反应速率大于逆反应速率,化学平衡正向移动,反应物浓度减小,正反应速率减小,C错误;
D.恒压,充入惰性气体,则容器体积增大,H2的浓度减小,反应速率减慢,D正确;
综上所述答案为D。
14.C
【详解】A.点d和点e所在直线平行,说明各物质的物质的量已经不再发生变化,化学反应达到平衡状态,两点对应的n(N2)相同,故A项错误;
B.化学反应达到平衡时各物质的物质的量将不再发生变化,而c点之后氨气和氢气的物质的量仍在变化,则点c处反应未达到平衡状态,故B项错误;
C.曲线斜率表示化学反应速率,a点比b点要陡,则点a的正反应速率比点b的大,故C项正确;
D.化学平衡是一种动态的平衡状态,正逆反应速率相等,而非停止,故D项错误。
综上所述,本题正确答案为C。
15.(1)CD
(2) SO2 75% 0.0375
【详解】(1)A.该反应在反应过程中体系温度会升高,故该反应为放热反应,A错误;
B.催化剂针对特定反应有催化效果,不会对任何反应均具有催化效果,B错误;
C.二氧化硫与氧气的反应为可逆反应,SO2不可能100%转化为SO3,C正确;
D.保持其他条件不变,升高温度,化学反应速率加快,D正确;
故选CD;
(2)①随反应进行,图象中物质的量的浓度减小,故该物质为反应物,体积为2L的刚性密闭容器中充入0.2molSO2和0.1molO2,起始时二氧化硫的浓度为 ,氧气的物质的量浓度为 ,故图中曲线表示的是SO2;2min时,二氧化硫的浓度为0.025mol/L,则二氧化硫的反应量为 ,根据化学反应方程式,氧气的反应量为0.075mol,故2min时O2的转化率为 ;
②有以上分析可知,二氧化硫的反应量为0.15mol,故用SO2表示该反应的速率为 。
16. 0.03mol/(L s) 30% 22.2 % 0.7mol/L < 吸热 正向 不
【分析】(1)在一定温度下,将4mol SO2与2molO2放入2L的密闭容器中,c(SO2)=2mol/L,c(O2)=1mol/L,经10s后达到平衡,测得SO3的浓度为0.6mol L-1;
设转化的氧气的物质的量浓度为x,则
2SO2 +O2 2SO3
开始(mol L-1) 2 1 0
转化(mol L-1) 2x x 2x
平衡(mol L-1) 2-2x 1-x 2x
平衡时测得SO3的浓度为0.6mol L-1;据以上分析进行计算。
(2)根据“先拐先平,数值大”原则,采取定一议二得到温度和压强的大小关系,根据图示,结合压强和B的含量的关系判断方程式前后的系数和大小关系,根据温度和B的含量的关系,确定化学反应的吸放热情况;
(3)根据平衡移动原理分析,改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动;
①加入少量KSCN固体,反应中SCN-浓度增大;
②根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变。
【详解】在一定温度下,将4mol SO2与2molO2放入2L的密闭容器中,c(SO2)=2mol/L,c(O2)=1mol/L,经10s后达到平衡,测得SO3的浓度为0.6mol L-1;设转化的氧气的物质的量浓度为x,则
2SO2 + O2 2SO3
开始(mol L-1) 2 1 0
转化(mol L-1) 2x x 2x
平衡(mol L-1) 2-2x 1-x 2x
平衡时测得SO3的浓度为0.6mol L-1;所以2x=0.6mol L-1,计算得出x=0.3mol L-1;
(1)①10s内氧气的浓度变化为△c(O2)=0.3mol L-1,所以v(O2)= c/t=0.3/10=0.03mol/(L s);
答案是:0.03mol/(L s);
②平衡时SO2的转化率为:消耗量/起始量×100%=0.6/2×100%=30%;
答案是:30%;
③平衡时的容器内的总浓度为:2-2x+1-x+2x=2.7mol L-1,所以平衡时SO3的体积分数0.6/2.7×100%=22.2%;
答案是:22.2%;
④平衡时氧气的浓度:1-0.3=0.7mol L-1;
答案是:0.7mol L-1;
(2)定压强相同,比较温度不同时,即比较曲线T1、P2与曲线T2、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的温度高,所以T1> T2,定温度相同,比较压强不同时,即比较曲线T1、P1与曲线T1、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的压强高,所以P1< P2;
①压强P1< P2,由图知压强越大,B的含量越高,所以平衡向逆反应进行,增大压强,平衡向体积减小的方向移动,所以m+n
②温度T1> T2,由图知温度越高,B的含量越低,所以平衡向正反应进行,升高温度,平衡向吸热方向移动,故正反应为吸热反应;
因答案是:吸热。
(3)①加入少量KSCN固体,反应中SCN-浓度增大,平衡向正向移动;
答案是:正向;
②加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,K+和Cl-不参加反应,平衡不移动;
答案是:不。
17.(1) 0.975 该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa=p2,所以p1=5.0MPa 温度、压强和反应物的起始浓度(组成)
(2) 升高温度 减小压强(增大体积)
【详解】(1)5.0 MPa、550℃时,α=0.975。该反应正向为气体分子数减小的反应,温度相同时增大压强,化学平衡向正向移动,SO2的平衡转化率(α)增大,5.0MPa>2.5MPa=p2,故p1=5.0MPa。故判断依据:该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa=p2,所以p1=5.0MPa;影响α的因素:由图像可得温度升高,α减小,压强增大,α增大。另外起始充入的SO2与O2的物质的量之比影响SO2的平衡转化率,故影响因素为温度、压强和反应物的起始浓度(组成)。
(2)由于该反应为吸热反应、且为气体分子数增大的反应,因此可通过升高温度、减小压强(增大体积)等提高该反应的平衡转化率。
18.(1)
(2) 1
(3)
【详解】(1)根据盖斯定律,制备甲醇反应的
(2)经过4min时,测得D的浓度为0.8mol/L,用D表示的化学反应速率为:,而C的反应速率是0.1mol·L-1·min-1,反应速率之比等于化学计量数之比,故x=1,化学方程式为:3A(g)+B(g) C(g)+2D(g),设起始A和B的物质的量为amol,4min时D的浓度为0.8mol/L,即物质的量为1.6mol,可列出三段式: ,经过4min c(A):c(B)=3;5,即,故a=4.8mol,4min时A的物质的量为(4.8-2.4)mol=2.4mol,浓度为,由三段式可知B的物质的量变化量为0.8mol,反应速率为:;
(3)燃料电池中氧气在正极反应,燃料在负极反应,故负极的电极反应式为:。
19.(1) ; >;
(2) 0.8 mol·L-1; 0.2 mol·L-1·min-1 ;
(3) 不变; 反应前后气体分子数不变,压强对平衡无影响;
(4)1.5。
【详解】(1)化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则,K300℃
(2)由已知可得三段式:,由上述计算可知,平衡时B的物质的量为1.6mol,所以B的平衡浓度为c(B)=1.6mol 2L=0.8mol/L;平衡时D的物质的量为0.8mol, 所以,用D表示的平均反应速率;答案为:0.8 mol·L-1;0.2 mol·L-1·min-1;
(3)由方程式可知,气体的化学计量数之和前后相等,则反应前后气体体积不变,压强对平衡无影响,缩小容器容积,则A的转化率不变;答案为:不变;反应前后气体分子数不变,压强对平衡无影响;
(4)将C、D的量折算成A、B的量,则相当于加入1.5molA和0.5molB,容器体积固定,若浓度相同,则说明起始时物质的量相等,故B还应加入2mol-0.5mol=1.5mol ;答案为:1.5。
20. acd 2CrO42-+2H+H2O+Cr2O72- 减小 1×107 小于
【详解】⑴a选项,增大压强,平衡正向移动,转化率增大,故a正确
b选项,升高温度,平衡逆向移动,转化率减小,故b错误
c选项,增大N2浓度,平衡正向移动,转化率增大,故c正确;
d选项,及时移走生成物NH3,平衡正向移动,转化率增大,故d正确;
e选择,使用高效催化剂,平衡不移动,转化率不变,故e错误;
综上所述,答案为acd;
⑵①用离子方程式表示Na2CrO4溶液中发生的转化2CrO42-+2H+H2O+Cr2O72-,故答案为2CrO42-+2H+H2O+Cr2O72-;
②由图可知,溶液酸性减弱,氢离子浓度降低,平衡逆向移动,CrO42-的平衡转化率减小,根据A点数据,计算出该转化反应的平衡常数为
2CrO42- + 2H+ H2O(g) + Cr2O72-
起始量 1.0 mol/L 0 0 0
转化量 0.5mol/L 0.5mol/L 0.25mol/L 0.25mol/L
平衡量 0.5mol/L 1×10-7mol/L 0.25mol/L
,
故答案为减小;1×107;
③升高温度,平衡向吸热反应移动,溶液中CrO42-的平衡转化率减小,说明平衡逆向移动即逆向为吸热反应,正向为放热反应,则该反应的ΔH<0,故答案为小于。
21. 0.2 mol/(L·min) 2 小于 ①④⑤ BD
【分析】(1)先计算v(A)、v(C),然后根据速率比等于计量数的比计算出v(B)及x的值;
(2)根据浓度对化学反应速率的影响分析判断;
(3)根据化学反应速率的影响因素分析判断;
(4)根据平衡状态的特征分析判断。
【详解】(1)在体积固定为2 L的密闭容器中通入3 mol A和1 mol B气体,发生反应:3A(g)+B(g)xC(g),反应1 min时测得剩余1.8 mol A,则△n(A)=(3 -1.8)mol=1.2 mol,△c(A)==0.6 mol/L,所以v(A)==0.6 mol/(L·min)。由于v(A):v(B)=3:1,所以v(B)=v(A)=×0.6 mol/(L·min)=0.2 mol/(L·min);反应开始时未通入C物质,在1 min内C的浓度为0.4 mol/L,则v(C)===0.4 mol/(L·min),由于v(A):v(C)=3:x,则0.6 mol/(L·min):0.4 mol/(L·min)= 3:x,解得x=2;
(2)在第1 min内C的浓度变化了0.4 mol/L,若化学反应速率不变,则第2 min末,C的浓度应该为0.8 mol/L。由于随着反应的进行,反应物的浓度逐渐减小,化学反应速率会逐渐减小,因此若反应经2 min达到平衡,则平衡时C的浓度小于0.8 mol/L;
(3)在其它条件不变时,①若升高温度,化学反应速率加快,①符合题意;
②容器体积不变,充入惰性气体Ar,不能改变任何一种反应物的浓度,化学反应速率不变,②不符合题意;
③容器压强不变,充入惰性气体Ar,必然会使容器的容积扩大,使反应物的浓度减小,化学反应速率减小,③不符合题意;
④使用催化剂可以大大加快化学反应速率,④符合题意;
⑤将容器体积缩小一半,反应物浓度增大,化学反应速率加快,⑤符合题意;
故合理选项是①④⑤;
(4) A.反应混合物都是气体,气体的质量不变;反应在恒容密闭容器中进行,气体的体积不变,则容器内混合气体的密度始终保持不变,因此不能根据密度不变判断反应是否处于平衡状态,A不符合题意;
B.该反应是反应前后气体体积改变的反应,若容器内混合气体的压强保持不变,则气体的物质的量不变,反应达到平衡状态,B符合题意;
C.A、B加入的物质的量的比是3:1,二者反应的物质的量的比是3:1,因此无论反应是否达到平衡,A、B的浓度之比始终是3:1,因此不能据此判断反应是否处于平衡状态,C不符合题意;
D.单位时间内断开3n mol A-A键就会断裂的n mol B-B,还同时生成n mol B-B,说明物质B的浓度不变,则反应处于平衡状态,D符合题意;
E.v(A)=3v(B)中未指明速率是正反应速率还是逆反应速率,因此不能据此判断反应是否处于平衡状态,E不符合题意;
故合理选项是BD。
【点睛】本题考查了化学反应速率的计算、关系、影响因素及化学平衡状态的判断。掌握有关概念、平衡状态的特征及化学反应速率与化学方程式中计量数的关系是解题关键。题目考查了学生对基础知识的掌握与应用能力。
答案第1页,共2页
答案第1页,共2页
