宁夏银川市贺兰县2023-2024学年高二上学期第三阶段考试化学试题(含答案)
文档属性
| 名称 | 宁夏银川市贺兰县2023-2024学年高二上学期第三阶段考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-22 10:06:16 | ||
图片预览



文档简介
贺兰县2023-2024学年高二上学期第三阶段考试
(化学)
可能用到的相对原子质量:H-1 O-16 Na-23 Cu-64
一、选择题(每题只有一个答案,每题3分,共计16x3=48分)
1.化学与生活息息相关。下列叙述错误的是( )
A.热的碳酸钠溶液可用于去除餐具的油污
B.明矾作净水剂,可用于自来水的杀菌消毒
C.农村推广风力发电、光伏发电有利于“碳达峰、碳中和”
D.电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极保护法
2.下列化学用语表达正确的是( )
A.氮原子的价电子轨道表示式:
B.质量数为127的碘原子:
C.的结构示意图:
D.的电子式:
3.下列有关热化学方程式的叙述正确的是( )
A.已知则氢气的燃烧热为
B.已知,则金刚石比石墨稳定
C.含的稀溶液与足量稀盐酸完全中和,放出的热量,则该反应的热化学方程式为:
D.已知;,则
4.下列表述正确的是( )
A.碳酸氯钠溶液的水解反应:
B.用铜电极电解饱和氯化钠溶液:
C.氢硫酸的电离方程式:
D.向氢氧化镁饱和溶液中滴加氯化铁溶液,出现红褐色沉淀
5.在一定条件下,合成氨反应,反应达到平衡后,下列说法正确的是( )(
A.升高温度,正反应速率加快,逆反应速率减小,平衡正向移动
B.增大压强,平衡正向移动
C.减小反应物浓度,平衡正向移动
D.加入催化剂,对逆反应的反应速率影响更大,平衡正向移动
6.设为阿伏加德罗常数的值。下列说法正确的是( )
A.溶液中数目为
B.熔融中含有的离子数为
C.粗铜精炼中阳极质量减小时,转移电子数目为
D.常温下,的溶液中含有数目为
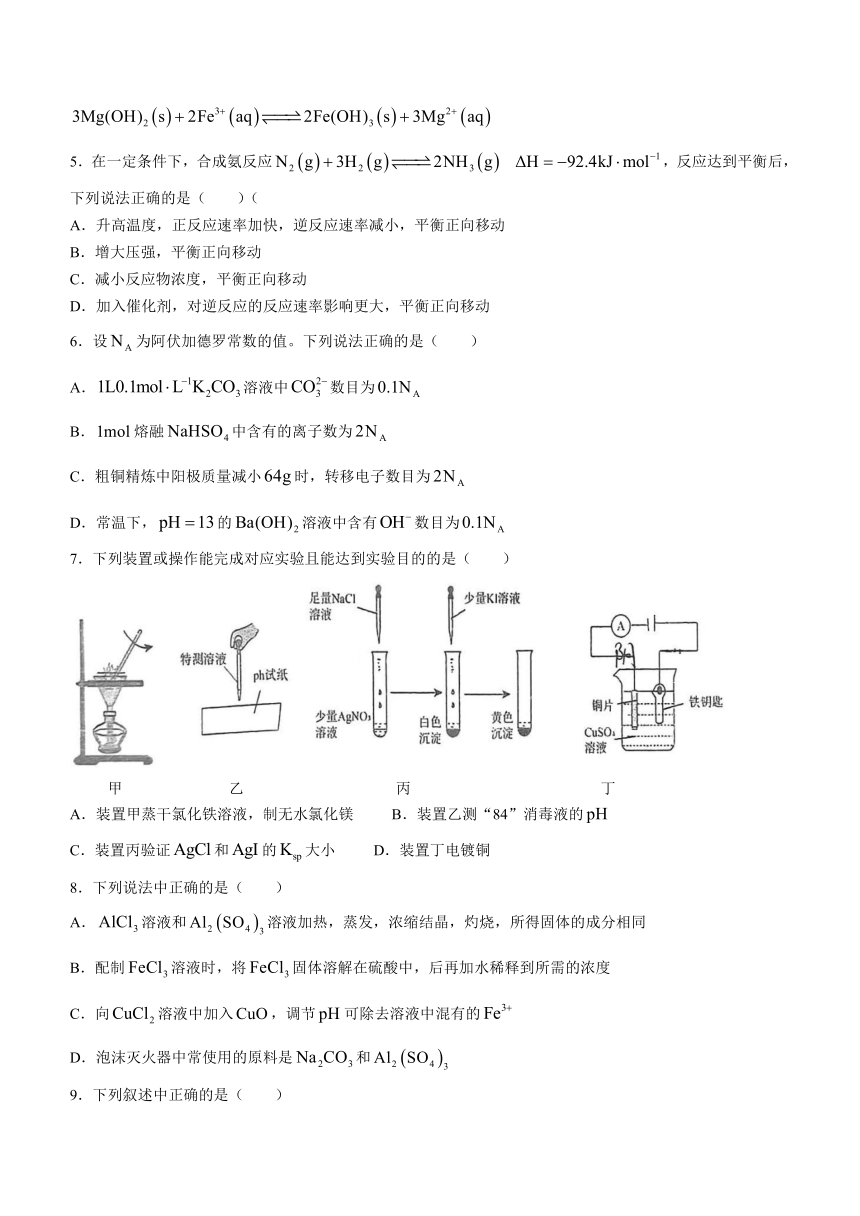
7.下列装置或操作能完成对应实验且能达到实验目的的是( )
甲 乙 丙 丁
A.装置甲蒸干氯化铁溶液,制无水氯化镁 B.装置乙测“84”消毒液的
C.装置丙验证和的大小 D.装置丁电镀铜
8.下列说法中正确的是( )
A.溶液和溶液加热,蒸发,浓缩结晶,灼烧,所得固体的成分相同
B.配制溶液时,将固体溶解在硫酸中,后再加水稀释到所需的浓度
C.向溶液中加入,调节可除去溶液中混有的
D.泡沫灭火器中常使用的原料是和
9.下列叙述中正确的是( )
A.焰色反应属于化学变化
B.外加电流法保护钢构件,钢构件与直流电源负极相连
C.金属的化学腐蚀比电化学腐蚀更普遍
D.钠原子核外电子排布由时,原子释放能量
10.下列有关原子核外电子排布的说法,正确的是( )
A.基态原子核外电子占据的最高能级的电子云轮廓图为球形
B.违反了洪特规则,是激发态原子的电子排布
C.不符合泡利原理
D.基态铜原子的电子排布式:
11.时,某氯化铵溶液,下列说法正确的是( )
A. B.
C. D.
12.时,已知在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
A.时,的
B.图中点对应的溶液是饱和溶液,两点对应的溶液都是不饱和溶液
C.向a点的溶液中加入少量固体,有固体析出
D.要使点移动到点可以降低温度
13.原电池原理的发现是化学对人类的一项重大贡献。关于如图所示原电池(盐桥中装有含琼胶的饱和溶液)的说法正确的是( )
A.正极上的反应为 B.铜电极为负极
C.盐桥中移向铜极 D.银电极区的通过盐桥移向铜电极区
14.手机使用的锂电池以质量轻、能量高而备受关注,目前已成功研制出多种锂电池。某种锂电池的总反应是。下列说法正确的是( )
A.是负极,电极反应为
B.电池工作时,电子由正极通过外电路流向负极
C.电池内部产生的向锂电极移动
D.钠比锂更活泼,相同质量的钠作电极比锂提供的电能更多
15.如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )
A.氯碱工业中,若在Y电极附近滴入几滴酚酞溶液,则溶液呈红色
B.电解精炼铜时,Z溶液中的浓度不变
C.在铁片上镀铜时,Y是铜
D.制取金属铝时,Z是熔融的氯化铝
16.空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池,其工作原理如下图,有关说法正确的是( )
A.极上发生的电极反应式:
B.左端装置中化学能转化为电能,右端装置中电能转化为化学能
C.极上进行还原反应,右端装置中的可以通过隔膜进入
D.当有电子转移时,极产生标准状况下
二、非选择题(每空2分,共计52分)
17.(每空2分,共14分)金、银、铜、铁、铝和钛均是人类大量生产和使用的金属。回答与上述金属原子结构有关的问题:
(1)上述金属中属于主族元素的有_______(填写元素符号)。
(2)基态中能量最高的能级是_______,基态所有电子占有_______种不同的空间运动状态。
成为阳离子时首先失去_______轨道电子,的基态的核外电子排布式为_______。
(3)钛被称为继铁、铝之后的第三金属。基态钛原子价层电子排布图为_______。
(4)将乙炔通入溶液生成红棕色沉淀。基态核外电子化排布式为_______。
18.(每空2分,共12分)下列电解池均以石墨为电极,溶液体积为,浓度均为,通电一段时间后,甲池的,请回答以下问题:
(1)装置乙中电解总反应方程式为:______________。
(2)电解一段时间后,要恢复原溶液,向电解池中分别加入:装置甲_______装置乙_______。
(3)为了测定市售白醋的总酸量(g100mL),某实验小组设计如下实验流程。
①“量取白醋样品”用到的量取仪器是_______。
②用的标准液进行“酸碱中和滴定”,实验记录如下
滴定次数 1 2 3 4
(待测白醋) 20.00 20.00 20.00 20.00
15.95 15.00 15.05 14.95
计算该待测白醋溶液的浓度为_______。
③“酸碱中和商定”过程中,下列操作会使实验结果偏大的是_______。
A.未用标准溶液润洗滴定管
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加入少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
19.(每空2分,共12分)回答下列问题
(1)已知时有关弱酸的电离平衡常数:
弱酸化学式
电离平衡常数
①同温度下,等物质的量浓度的下列溶液,值最小的是_______(填序号)。
a. b. c.
②时将溶液和溶液分别与溶液混合。
反应结束后所得两溶液中,_______(填“>”、“<”“>”或“=”)
(2)煤燃烧的烟气也含氮氧化物,用催化还原生成无毒的可以消除氮氧化物的污染。
已知:
在常温下,催化还原的热化学方程式______________。
(3)电池可以提升能量利用率。下图是利用甲烷燃料电池电解的氯化铜溶液的装置示意图,请回答下列问题:
①甲烷燃料电池的负极反应式是______________;
②当A中消耗氧气时,B中_______极(填a或b)增重_______g。
20.(每空2分,共14分)某炼铜厂烟道灰的主要成分为锌、锰、铁、铜的单质及氧化物,一种回收利用烟道灰的工艺流程如图所示:
已知:①常温下,;
②离子浓度小于等于时认为沉淀完全;。
回答下列问题:
(1)“碱浸”时,被浸出转化为中元素的化合价为_______。
(2)“沉锌”时防止碱性过强生成,可采取的措施为_______(任写一条)。
(3)滤渣Ⅱ的主要成分为_______(填化学式)。
(4)“除铁”时先加入过量的溶液将氧化为,发生反应的离子方程式为_______;然后再调节溶液的为,若此时,则的取值范围为_______。
(5)“氧化沉锰”过程中,经氧化转化为,该反应中氯化剂和还原剂的物质的量之比为_______;基态锰原子的价层电子排布式为_______。
参考答案
第一部分:选择题
题号 1 2 3 4 5 6 7 8
答案 B A C D B B C C
题号 9 10 11 12 13 14 15 16
答案 B C D C B C A D
第二部分:非选择题
17.(每空2分,共14分)
(1)Al (2)3d ; 15; 4s ;
(3) (4)
18.(每空2分,共12分)
(1)①. (或离子方程式)
(2)①. 气体 ②. Ag2O
(3)①. 酸式滴定管 ②. 0.075 ③. AB
19.(每空2分,共12分)
(1)①. a ②. >
(2)CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-898.1kJ mol-1
(3)①. CH4+10OH--8e-=+7H2O ②. b 25.6
20.(每空2分,共14分)
(1)+2 (2)适当降低碳酸钠溶液的浓度
(3)Fe Cu (4) ①. H2O2+2Fe2+2H+=2Fe3++2H2O ②. 3.2≤b<8
(5)①. 1:2 ②. 3d54s2
(化学)
可能用到的相对原子质量:H-1 O-16 Na-23 Cu-64
一、选择题(每题只有一个答案,每题3分,共计16x3=48分)
1.化学与生活息息相关。下列叙述错误的是( )
A.热的碳酸钠溶液可用于去除餐具的油污
B.明矾作净水剂,可用于自来水的杀菌消毒
C.农村推广风力发电、光伏发电有利于“碳达峰、碳中和”
D.电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极保护法
2.下列化学用语表达正确的是( )
A.氮原子的价电子轨道表示式:
B.质量数为127的碘原子:
C.的结构示意图:
D.的电子式:
3.下列有关热化学方程式的叙述正确的是( )
A.已知则氢气的燃烧热为
B.已知,则金刚石比石墨稳定
C.含的稀溶液与足量稀盐酸完全中和,放出的热量,则该反应的热化学方程式为:
D.已知;,则
4.下列表述正确的是( )
A.碳酸氯钠溶液的水解反应:
B.用铜电极电解饱和氯化钠溶液:
C.氢硫酸的电离方程式:
D.向氢氧化镁饱和溶液中滴加氯化铁溶液,出现红褐色沉淀
5.在一定条件下,合成氨反应,反应达到平衡后,下列说法正确的是( )(
A.升高温度,正反应速率加快,逆反应速率减小,平衡正向移动
B.增大压强,平衡正向移动
C.减小反应物浓度,平衡正向移动
D.加入催化剂,对逆反应的反应速率影响更大,平衡正向移动
6.设为阿伏加德罗常数的值。下列说法正确的是( )
A.溶液中数目为
B.熔融中含有的离子数为
C.粗铜精炼中阳极质量减小时,转移电子数目为
D.常温下,的溶液中含有数目为
7.下列装置或操作能完成对应实验且能达到实验目的的是( )
甲 乙 丙 丁
A.装置甲蒸干氯化铁溶液,制无水氯化镁 B.装置乙测“84”消毒液的
C.装置丙验证和的大小 D.装置丁电镀铜
8.下列说法中正确的是( )
A.溶液和溶液加热,蒸发,浓缩结晶,灼烧,所得固体的成分相同
B.配制溶液时,将固体溶解在硫酸中,后再加水稀释到所需的浓度
C.向溶液中加入,调节可除去溶液中混有的
D.泡沫灭火器中常使用的原料是和
9.下列叙述中正确的是( )
A.焰色反应属于化学变化
B.外加电流法保护钢构件,钢构件与直流电源负极相连
C.金属的化学腐蚀比电化学腐蚀更普遍
D.钠原子核外电子排布由时,原子释放能量
10.下列有关原子核外电子排布的说法,正确的是( )
A.基态原子核外电子占据的最高能级的电子云轮廓图为球形
B.违反了洪特规则,是激发态原子的电子排布
C.不符合泡利原理
D.基态铜原子的电子排布式:
11.时,某氯化铵溶液,下列说法正确的是( )
A. B.
C. D.
12.时,已知在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
A.时,的
B.图中点对应的溶液是饱和溶液,两点对应的溶液都是不饱和溶液
C.向a点的溶液中加入少量固体,有固体析出
D.要使点移动到点可以降低温度
13.原电池原理的发现是化学对人类的一项重大贡献。关于如图所示原电池(盐桥中装有含琼胶的饱和溶液)的说法正确的是( )
A.正极上的反应为 B.铜电极为负极
C.盐桥中移向铜极 D.银电极区的通过盐桥移向铜电极区
14.手机使用的锂电池以质量轻、能量高而备受关注,目前已成功研制出多种锂电池。某种锂电池的总反应是。下列说法正确的是( )
A.是负极,电极反应为
B.电池工作时,电子由正极通过外电路流向负极
C.电池内部产生的向锂电极移动
D.钠比锂更活泼,相同质量的钠作电极比锂提供的电能更多
15.如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )
A.氯碱工业中,若在Y电极附近滴入几滴酚酞溶液,则溶液呈红色
B.电解精炼铜时,Z溶液中的浓度不变
C.在铁片上镀铜时,Y是铜
D.制取金属铝时,Z是熔融的氯化铝
16.空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池,其工作原理如下图,有关说法正确的是( )
A.极上发生的电极反应式:
B.左端装置中化学能转化为电能,右端装置中电能转化为化学能
C.极上进行还原反应,右端装置中的可以通过隔膜进入
D.当有电子转移时,极产生标准状况下
二、非选择题(每空2分,共计52分)
17.(每空2分,共14分)金、银、铜、铁、铝和钛均是人类大量生产和使用的金属。回答与上述金属原子结构有关的问题:
(1)上述金属中属于主族元素的有_______(填写元素符号)。
(2)基态中能量最高的能级是_______,基态所有电子占有_______种不同的空间运动状态。
成为阳离子时首先失去_______轨道电子,的基态的核外电子排布式为_______。
(3)钛被称为继铁、铝之后的第三金属。基态钛原子价层电子排布图为_______。
(4)将乙炔通入溶液生成红棕色沉淀。基态核外电子化排布式为_______。
18.(每空2分,共12分)下列电解池均以石墨为电极,溶液体积为,浓度均为,通电一段时间后,甲池的,请回答以下问题:
(1)装置乙中电解总反应方程式为:______________。
(2)电解一段时间后,要恢复原溶液,向电解池中分别加入:装置甲_______装置乙_______。
(3)为了测定市售白醋的总酸量(g100mL),某实验小组设计如下实验流程。
①“量取白醋样品”用到的量取仪器是_______。
②用的标准液进行“酸碱中和滴定”,实验记录如下
滴定次数 1 2 3 4
(待测白醋) 20.00 20.00 20.00 20.00
15.95 15.00 15.05 14.95
计算该待测白醋溶液的浓度为_______。
③“酸碱中和商定”过程中,下列操作会使实验结果偏大的是_______。
A.未用标准溶液润洗滴定管
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加入少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
19.(每空2分,共12分)回答下列问题
(1)已知时有关弱酸的电离平衡常数:
弱酸化学式
电离平衡常数
①同温度下,等物质的量浓度的下列溶液,值最小的是_______(填序号)。
a. b. c.
②时将溶液和溶液分别与溶液混合。
反应结束后所得两溶液中,_______(填“>”、“<”“>”或“=”)
(2)煤燃烧的烟气也含氮氧化物,用催化还原生成无毒的可以消除氮氧化物的污染。
已知:
在常温下,催化还原的热化学方程式______________。
(3)电池可以提升能量利用率。下图是利用甲烷燃料电池电解的氯化铜溶液的装置示意图,请回答下列问题:
①甲烷燃料电池的负极反应式是______________;
②当A中消耗氧气时,B中_______极(填a或b)增重_______g。
20.(每空2分,共14分)某炼铜厂烟道灰的主要成分为锌、锰、铁、铜的单质及氧化物,一种回收利用烟道灰的工艺流程如图所示:
已知:①常温下,;
②离子浓度小于等于时认为沉淀完全;。
回答下列问题:
(1)“碱浸”时,被浸出转化为中元素的化合价为_______。
(2)“沉锌”时防止碱性过强生成,可采取的措施为_______(任写一条)。
(3)滤渣Ⅱ的主要成分为_______(填化学式)。
(4)“除铁”时先加入过量的溶液将氧化为,发生反应的离子方程式为_______;然后再调节溶液的为,若此时,则的取值范围为_______。
(5)“氧化沉锰”过程中,经氧化转化为,该反应中氯化剂和还原剂的物质的量之比为_______;基态锰原子的价层电子排布式为_______。
参考答案
第一部分:选择题
题号 1 2 3 4 5 6 7 8
答案 B A C D B B C C
题号 9 10 11 12 13 14 15 16
答案 B C D C B C A D
第二部分:非选择题
17.(每空2分,共14分)
(1)Al (2)3d ; 15; 4s ;
(3) (4)
18.(每空2分,共12分)
(1)①. (或离子方程式)
(2)①. 气体 ②. Ag2O
(3)①. 酸式滴定管 ②. 0.075 ③. AB
19.(每空2分,共12分)
(1)①. a ②. >
(2)CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-898.1kJ mol-1
(3)①. CH4+10OH--8e-=+7H2O ②. b 25.6
20.(每空2分,共14分)
(1)+2 (2)适当降低碳酸钠溶液的浓度
(3)Fe Cu (4) ①. H2O2+2Fe2+2H+=2Fe3++2H2O ②. 3.2≤b<8
(5)①. 1:2 ②. 3d54s2
同课章节目录
