黑龙江省大庆市龙凤区2023-2024学年高一上学期期末考试化学试题(含答案)
文档属性
| 名称 | 黑龙江省大庆市龙凤区2023-2024学年高一上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-22 10:47:58 | ||
图片预览




文档简介
大庆市龙凤区2023-2024学年高一上学期期末考试
化学学科试题
2024.01.03—2024.01.04
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Fe-56 Cu-64
说明:1.请将答案填涂在答题卡的指定区域内。
2.满分100分,考试时间75分钟。
一、选择题(本大题共15小题,每小题只有一个选项符合题意,每小题3分,共45分)
1.2023年诺贝尔化学奖授予了三位在发现和合成量子点方面作出贡献的科学家,碳量子点是由尺寸小于10nm的碳纳米颗粒组成,主要含碳、氢、氧元素,具有显著的荧光性能,下列有关碳量子点的说法正确的是( )
A.碳量子点粒子直径介于1~100nm,是一种胶体
B.碳量子点的荧光性能属于丁达尔效应
C.碳量子点的粒子直径小于滤纸的孔径,能透过滤纸
D.碳量子点和金刚石是碳元素的同素异形体
2.2016年IUPAC将第117号元素命名为Ts(中文名“”,音tián),Ts的最外层电子数是7。下列说法中,不正确的是( )
A.Ts是第七周期第ⅦA族元素
B.中子数为176的Ts,其核素符号是
C.Ts的同位素原子具有相同的电子数
D.Ts在同族元素中非金属性最弱
3.下列物质的转化在给定条件下能实现的是( )
A.
B.
C.
D.溶液
4.设为阿伏加德罗常数的值,下列说法正确的是( )
A.固体中含有的阳离子数为
B.标准状况下,中水分子的数目为
C.0.5mol/L的溶液中,含有个数为
D.18g重水()中所含中子数为
5.下列离子方程式正确的是( )
A.氯气溶于水配制氯水:
B.稀硝酸与过量的铁屑反应:
C.向溶液中加入过量稀氨水:
D.向溶液中逐滴加入溶液至溶液恰好呈中性:
6.下列各组离子在指定溶液中能大量共存的( )
A.无色透明的溶液中:、、、
B.无色酚酞试液呈红色的溶液中:、、、
C.含有大量的溶液:、、、
D.与铝粉反应放出的溶液:、、、
7.某离子反应中涉及、、、、、六种微粒。其中的数目随时间变化的曲线如图所示。下列判断正确的是( )
A.该反应的还原剂是
B.消耗,转移6mol电子
C.是氧化产物
D.氧化剂与还原剂的物质的量之比为3:2
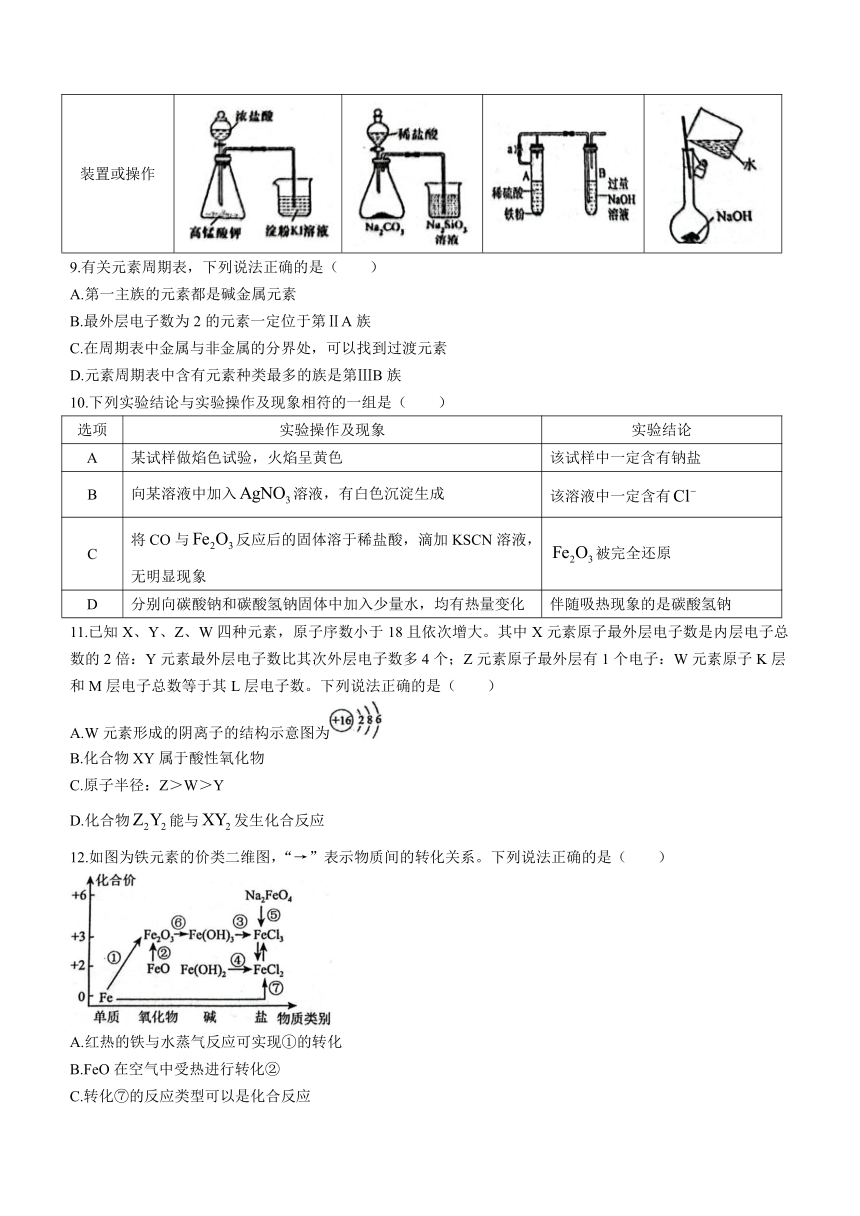
8.用下列装置或操作进行相应实验,能达到实验目的的是( )
选项 A B C D
目的 探究氧化性: 验证非金属性: 制备 配制的NaOH溶液
装置或操作
9.有关元素周期表,下列说法正确的是( )
A.第一主族的元素都是碱金属元素
B.最外层电子数为2的元素一定位于第ⅡA族
C.在周期表中金属与非金属的分界处,可以找到过渡元素
D.元素周期表中含有元素种类最多的族是第ⅢB族
10.下列实验结论与实验操作及现象相符的一组是( )
选项 实验操作及现象 实验结论
A 某试样做焰色试验,火焰呈黄色 该试样中一定含有钠盐
B 向某溶液中加入溶液,有白色沉淀生成 该溶液中一定含有
C 将CO与反应后的固体溶于稀盐酸,滴加KSCN溶液,无明显现象 被完全还原
D 分别向碳酸钠和碳酸氢钠固体中加入少量水,均有热量变化 伴随吸热现象的是碳酸氢钠
11.已知X、Y、Z、W四种元素,原子序数小于18且依次增大。其中X元素原子最外层电子数是内层电子总数的2倍:Y元素最外层电子数比其次外层电子数多4个;Z元素原子最外层有1个电子:W元素原子K层和M层电子总数等于其L层电子数。下列说法正确的是( )
A.W元素形成的阴离子的结构示意图为
B.化合物XY属于酸性氧化物
C.原子半径:Z>W>Y
D.化合物能与发生化合反应
12.如图为铁元素的价类二维图,“→”表示物质间的转化关系。下列说法正确的是( )
A.红热的铁与水蒸气反应可实现①的转化
B.FeO在空气中受热进行转化②
C.转化⑦的反应类型可以是化合反应
D.溶于稀硝酸可实现转化④
13.化合物()可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期主族元素,原子序数依次增加,且加和为21。Z为地壳中含量最高的元素,分子的总电子数为奇数,常温下为气体。下列叙述正确的是( )
A.W、X、Y、Z的单质常温下均为气体
B.简单气态氢化物的稳定性:Y>Z
C.X的氟化物中,各原子最外层均满足8电子稳定结构
D.W、Y、Z三种元素可形成离子化合物
14.数字化实验将传感器、数据采集器和计算机相连,可利用信息技术对化学实验进行数据的采集和分析。如图是数字化实验得到的光照过程中氯水的pH变化情况。有关氯水下列有关说法正确的是( )
A.光照过程氯水颜色变浅的原因是溶解度降低逸出
B.可用pH试纸粗略测量氯水的pH
C.上述实验光照过程中氯水的导电能力增强
D.向溶液中滴加氯水有气泡产生,说明氯水中含有HClO
15.5.76g某部分氧化的Fe、Cu合金样品(氧化产物为、CuO),经如下处理,下列说法正确的是( )
A.V=448
B.样品中Fe的质量为2.14g
C.未氧化前Fe元素的质量分数约为38.89%
D.样品中CuO的质量为3.52g
二、非选择题(本大题共4小题,共55分)
16.(14分)下表为元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
(1)上述元素中,非金属性最强的是________(填元素名称),最高价氧化物对应水化物酸性最强的是________(写出酸的化学式)。
(2)①单质在空气中加热,发生反应的化学方程式为________。
(3)⑤、⑥、⑧的简单离子半径的由大到小的顺序为:________(用离子符号表示)。
(4)元素⑩在周期表中的位置为________。
(5)②、④两种元素能形成一种温室气体,写出该物质的电子式________,由元素⑦和⑨形成某物质,请用电子式表示该物质的形成过程________。
(6)用一个化学方程式证明元素⑧和⑨的非金属性强弱关系________。
17.(13分)高铁酸钾()是一种新型高效的水处理剂,在碱性溶液中较稳定。工业上有干法与湿法两种制备高铁酸钾的方法,
(1)高铁酸钾()具有________性,可以用于杀菌消毒,其在消毒后可形成胶体,常用于处理饮用水。
(2)干法制备高铁酸钾()时先制备高铁酸钠(),制备过程中发生的反应为,该反应中氧化剂是________(填化学式)。每生成转移电子的物质的量为________mol。
(3)湿法制备高铁酸钾的流程如下图
①过程Ⅱ为碱性条件下制备高铁酸钠()。补全过程Ⅱ中发生反应的离子方程式,并用单线桥表示电子转移的情况:
________________________________________________
②过程Ⅲ的反应能够发生的原因是________。
③湿法制备时,不同的温度下,不同质量浓度的对生成率有不同影响,由图可知工业生产中最佳条件(温度和的质量浓度)为________(填选项符号)。
a. 24℃, b.26℃, c.28℃, d.22℃,
18.(14分)已知氯气与强碱溶液反应时,产物受温度的影响。实验室中利用如图装置(部分装置省略)制备和NaClO,并探究其氧化还原性质。
回答下列问题:
(1)仪器a的名称是________。
(2)装置A制备氯气的离子方程式为________。装置B中的试剂为________.
(3)装置C中发生反应的化学方程式________.
(4)、KCl的溶解度曲线如下图所示,反应结束取出C中试管内制得的热饱和溶液,经________,________,洗涤,干燥,得到晶体。
(5)推测装置D使用冰水的原因________。
(6)在40℃条件下,将一定量的通入一定量的NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和,已知和的物质的量之比为11:1,则此过程中氧化剂和还原剂的物质的量之比为________。
(7)探究和NaClO的氧化能力
操作:向1号()和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力________NaClO。(填“大于”或“小于”)
19.(14分)由硫铁矿烧渣(主要成分为、、和)得到绿矾(),然后制取透明氧化铁颜料的流程如下:
已知:①透明氧化铁又称纳米氧化铁,粒子直径极其微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(),难溶于水;
②“还原”时,能将中的硫元素氧化为+6价。
回答下列问题:
(1)“酸溶”时用到的480mL0.5mol/L的稀硫酸需要用18.4mol/L浓硫酸配制,配制时所需的玻璃仪器除量筒、烧杯、玻璃棒外,还需要________、________,需要用量筒量取浓硫酸的体积为________,配制溶液操作中,若定容时俯视刻度线,则所配稀硫酸的浓度________(填“偏大”、“偏小”或“无影响”)。
(2)“滤渣”中的主要成分有过量的和________(填化学式)。
(3)“还原”过程中涉及的离子方程式为________。
(4)流程中“”环节的目的是________。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到色泽纯正的氢氧化铁,而且还可以________。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知的吸光度A(对特定波长光的吸收程度)与标准溶液浓度的关系如图所示:
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红()的质量分数为________%(保留小数点后一位)。
大庆市龙凤区2023-2024学年高一上学期期末考试
参考答案
一、选择题(本大题共15小题,每小题只有一个选项符合题意,每小题3分,共45分)
1 2 3 4 5 6 7 8 9 10
C B B A C B D A D D
11 12 13 14 15
C C D C A
二、非选择题(4道小题,共计55分,除标注外每空2分)
16.(14分)
(1)氟(1分) (1分) (2)
(3) (4)第四周期第VIII族
(5)
(6)
17.(13分)(1)(强)氧化性 (2) 5
(3)①(单线桥答案略,配平2分,单线桥1分)
②的溶解度小于 ③b
18.(14分)(1)分液漏斗(1分)
(2) 饱和食盐水(1分)
(3)
(4)冷却结晶 过滤(每空1分)
(5)防止温度过高,引发副反应,使产物中混有
(6)11:3 (7)小于
19.(14分)(1)500mL容量瓶、胶头滴管(各1分) 13.6mL 偏大(1分)
(2)(1分) (3)
(3)除去溶液中的,得到纯净的溶液
(5)形成细小的氢氧化铁颗粒
(6)23.1
化学学科试题
2024.01.03—2024.01.04
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Fe-56 Cu-64
说明:1.请将答案填涂在答题卡的指定区域内。
2.满分100分,考试时间75分钟。
一、选择题(本大题共15小题,每小题只有一个选项符合题意,每小题3分,共45分)
1.2023年诺贝尔化学奖授予了三位在发现和合成量子点方面作出贡献的科学家,碳量子点是由尺寸小于10nm的碳纳米颗粒组成,主要含碳、氢、氧元素,具有显著的荧光性能,下列有关碳量子点的说法正确的是( )
A.碳量子点粒子直径介于1~100nm,是一种胶体
B.碳量子点的荧光性能属于丁达尔效应
C.碳量子点的粒子直径小于滤纸的孔径,能透过滤纸
D.碳量子点和金刚石是碳元素的同素异形体
2.2016年IUPAC将第117号元素命名为Ts(中文名“”,音tián),Ts的最外层电子数是7。下列说法中,不正确的是( )
A.Ts是第七周期第ⅦA族元素
B.中子数为176的Ts,其核素符号是
C.Ts的同位素原子具有相同的电子数
D.Ts在同族元素中非金属性最弱
3.下列物质的转化在给定条件下能实现的是( )
A.
B.
C.
D.溶液
4.设为阿伏加德罗常数的值,下列说法正确的是( )
A.固体中含有的阳离子数为
B.标准状况下,中水分子的数目为
C.0.5mol/L的溶液中,含有个数为
D.18g重水()中所含中子数为
5.下列离子方程式正确的是( )
A.氯气溶于水配制氯水:
B.稀硝酸与过量的铁屑反应:
C.向溶液中加入过量稀氨水:
D.向溶液中逐滴加入溶液至溶液恰好呈中性:
6.下列各组离子在指定溶液中能大量共存的( )
A.无色透明的溶液中:、、、
B.无色酚酞试液呈红色的溶液中:、、、
C.含有大量的溶液:、、、
D.与铝粉反应放出的溶液:、、、
7.某离子反应中涉及、、、、、六种微粒。其中的数目随时间变化的曲线如图所示。下列判断正确的是( )
A.该反应的还原剂是
B.消耗,转移6mol电子
C.是氧化产物
D.氧化剂与还原剂的物质的量之比为3:2
8.用下列装置或操作进行相应实验,能达到实验目的的是( )
选项 A B C D
目的 探究氧化性: 验证非金属性: 制备 配制的NaOH溶液
装置或操作
9.有关元素周期表,下列说法正确的是( )
A.第一主族的元素都是碱金属元素
B.最外层电子数为2的元素一定位于第ⅡA族
C.在周期表中金属与非金属的分界处,可以找到过渡元素
D.元素周期表中含有元素种类最多的族是第ⅢB族
10.下列实验结论与实验操作及现象相符的一组是( )
选项 实验操作及现象 实验结论
A 某试样做焰色试验,火焰呈黄色 该试样中一定含有钠盐
B 向某溶液中加入溶液,有白色沉淀生成 该溶液中一定含有
C 将CO与反应后的固体溶于稀盐酸,滴加KSCN溶液,无明显现象 被完全还原
D 分别向碳酸钠和碳酸氢钠固体中加入少量水,均有热量变化 伴随吸热现象的是碳酸氢钠
11.已知X、Y、Z、W四种元素,原子序数小于18且依次增大。其中X元素原子最外层电子数是内层电子总数的2倍:Y元素最外层电子数比其次外层电子数多4个;Z元素原子最外层有1个电子:W元素原子K层和M层电子总数等于其L层电子数。下列说法正确的是( )
A.W元素形成的阴离子的结构示意图为
B.化合物XY属于酸性氧化物
C.原子半径:Z>W>Y
D.化合物能与发生化合反应
12.如图为铁元素的价类二维图,“→”表示物质间的转化关系。下列说法正确的是( )
A.红热的铁与水蒸气反应可实现①的转化
B.FeO在空气中受热进行转化②
C.转化⑦的反应类型可以是化合反应
D.溶于稀硝酸可实现转化④
13.化合物()可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期主族元素,原子序数依次增加,且加和为21。Z为地壳中含量最高的元素,分子的总电子数为奇数,常温下为气体。下列叙述正确的是( )
A.W、X、Y、Z的单质常温下均为气体
B.简单气态氢化物的稳定性:Y>Z
C.X的氟化物中,各原子最外层均满足8电子稳定结构
D.W、Y、Z三种元素可形成离子化合物
14.数字化实验将传感器、数据采集器和计算机相连,可利用信息技术对化学实验进行数据的采集和分析。如图是数字化实验得到的光照过程中氯水的pH变化情况。有关氯水下列有关说法正确的是( )
A.光照过程氯水颜色变浅的原因是溶解度降低逸出
B.可用pH试纸粗略测量氯水的pH
C.上述实验光照过程中氯水的导电能力增强
D.向溶液中滴加氯水有气泡产生,说明氯水中含有HClO
15.5.76g某部分氧化的Fe、Cu合金样品(氧化产物为、CuO),经如下处理,下列说法正确的是( )
A.V=448
B.样品中Fe的质量为2.14g
C.未氧化前Fe元素的质量分数约为38.89%
D.样品中CuO的质量为3.52g
二、非选择题(本大题共4小题,共55分)
16.(14分)下表为元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
(1)上述元素中,非金属性最强的是________(填元素名称),最高价氧化物对应水化物酸性最强的是________(写出酸的化学式)。
(2)①单质在空气中加热,发生反应的化学方程式为________。
(3)⑤、⑥、⑧的简单离子半径的由大到小的顺序为:________(用离子符号表示)。
(4)元素⑩在周期表中的位置为________。
(5)②、④两种元素能形成一种温室气体,写出该物质的电子式________,由元素⑦和⑨形成某物质,请用电子式表示该物质的形成过程________。
(6)用一个化学方程式证明元素⑧和⑨的非金属性强弱关系________。
17.(13分)高铁酸钾()是一种新型高效的水处理剂,在碱性溶液中较稳定。工业上有干法与湿法两种制备高铁酸钾的方法,
(1)高铁酸钾()具有________性,可以用于杀菌消毒,其在消毒后可形成胶体,常用于处理饮用水。
(2)干法制备高铁酸钾()时先制备高铁酸钠(),制备过程中发生的反应为,该反应中氧化剂是________(填化学式)。每生成转移电子的物质的量为________mol。
(3)湿法制备高铁酸钾的流程如下图
①过程Ⅱ为碱性条件下制备高铁酸钠()。补全过程Ⅱ中发生反应的离子方程式,并用单线桥表示电子转移的情况:
________________________________________________
②过程Ⅲ的反应能够发生的原因是________。
③湿法制备时,不同的温度下,不同质量浓度的对生成率有不同影响,由图可知工业生产中最佳条件(温度和的质量浓度)为________(填选项符号)。
a. 24℃, b.26℃, c.28℃, d.22℃,
18.(14分)已知氯气与强碱溶液反应时,产物受温度的影响。实验室中利用如图装置(部分装置省略)制备和NaClO,并探究其氧化还原性质。
回答下列问题:
(1)仪器a的名称是________。
(2)装置A制备氯气的离子方程式为________。装置B中的试剂为________.
(3)装置C中发生反应的化学方程式________.
(4)、KCl的溶解度曲线如下图所示,反应结束取出C中试管内制得的热饱和溶液,经________,________,洗涤,干燥,得到晶体。
(5)推测装置D使用冰水的原因________。
(6)在40℃条件下,将一定量的通入一定量的NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和,已知和的物质的量之比为11:1,则此过程中氧化剂和还原剂的物质的量之比为________。
(7)探究和NaClO的氧化能力
操作:向1号()和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力________NaClO。(填“大于”或“小于”)
19.(14分)由硫铁矿烧渣(主要成分为、、和)得到绿矾(),然后制取透明氧化铁颜料的流程如下:
已知:①透明氧化铁又称纳米氧化铁,粒子直径极其微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(),难溶于水;
②“还原”时,能将中的硫元素氧化为+6价。
回答下列问题:
(1)“酸溶”时用到的480mL0.5mol/L的稀硫酸需要用18.4mol/L浓硫酸配制,配制时所需的玻璃仪器除量筒、烧杯、玻璃棒外,还需要________、________,需要用量筒量取浓硫酸的体积为________,配制溶液操作中,若定容时俯视刻度线,则所配稀硫酸的浓度________(填“偏大”、“偏小”或“无影响”)。
(2)“滤渣”中的主要成分有过量的和________(填化学式)。
(3)“还原”过程中涉及的离子方程式为________。
(4)流程中“”环节的目的是________。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到色泽纯正的氢氧化铁,而且还可以________。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知的吸光度A(对特定波长光的吸收程度)与标准溶液浓度的关系如图所示:
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红()的质量分数为________%(保留小数点后一位)。
大庆市龙凤区2023-2024学年高一上学期期末考试
参考答案
一、选择题(本大题共15小题,每小题只有一个选项符合题意,每小题3分,共45分)
1 2 3 4 5 6 7 8 9 10
C B B A C B D A D D
11 12 13 14 15
C C D C A
二、非选择题(4道小题,共计55分,除标注外每空2分)
16.(14分)
(1)氟(1分) (1分) (2)
(3) (4)第四周期第VIII族
(5)
(6)
17.(13分)(1)(强)氧化性 (2) 5
(3)①(单线桥答案略,配平2分,单线桥1分)
②的溶解度小于 ③b
18.(14分)(1)分液漏斗(1分)
(2) 饱和食盐水(1分)
(3)
(4)冷却结晶 过滤(每空1分)
(5)防止温度过高,引发副反应,使产物中混有
(6)11:3 (7)小于
19.(14分)(1)500mL容量瓶、胶头滴管(各1分) 13.6mL 偏大(1分)
(2)(1分) (3)
(3)除去溶液中的,得到纯净的溶液
(5)形成细小的氢氧化铁颗粒
(6)23.1
同课章节目录
