河北省沧州市吴桥县2023-2024学年高二上学期期末考试化学试题(含解析)
文档属性
| 名称 | 河北省沧州市吴桥县2023-2024学年高二上学期期末考试化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-22 11:12:38 | ||
图片预览



文档简介
绝密★启用前
吴桥县2023-2024学年高二上学期期末考试
化学
班级__________姓名____________
注意事项:
1.答卷前,考生务必将自己的姓名、班级和考号填写在答题卡上.
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号.回答非选择题时,将答案写在答题卡上.写在本试卷上无效.
3.考试结束后,将本试卷和答题卡一并交回.
可能用到的相对原子质量:H 1 C 12 O 16
一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.下列生活中常见设备工作时,将化学能转化为电能的是( )
A.锂离子电池放电 B.太阳能集热器 C.冶炼金属钠 D.天然气燃烧
2.化学与生产、生活息息相关,下列措施的目的是加快反应速率的是( )
A.将肉制品放在冰柜中 B.在食品包装袋内放置小袋铁粉
C.制作面包、蛋糕时添加一定量的膨松剂 D.用锌与稀硫酸反应制氢气时滴加少量溶液
3.“天宫课堂”授课时,将小苏打和醋酸混合,得到过饱和醋酸钠溶液的“液体球”,结晶后得到了热的“冰球”.下列说法正确的是( )
A.醋酸钠是弱电解质
B.常温下,醋酸钠溶液的
C.过饱和醋酸钠溶液结晶形成热的“冰球”的过程放热
D.过饱和醋酸钠溶液性质较稳定,不易析出晶体
4.下列物质的用途或事实与盐类的水解无关的是( )
A.将溶于水并加热制备 B.用溶液处理锅炉水垢中的
C.用明矾作净水剂 D.沸水中滴加少量溶液制备胶体
5.原子结构模型的演变经历了五个主要阶段,1911年提出原子核式结构模型的科学家是( )
A.道尔顿 B.汤姆生 C.卢瑟福 D.玻尔
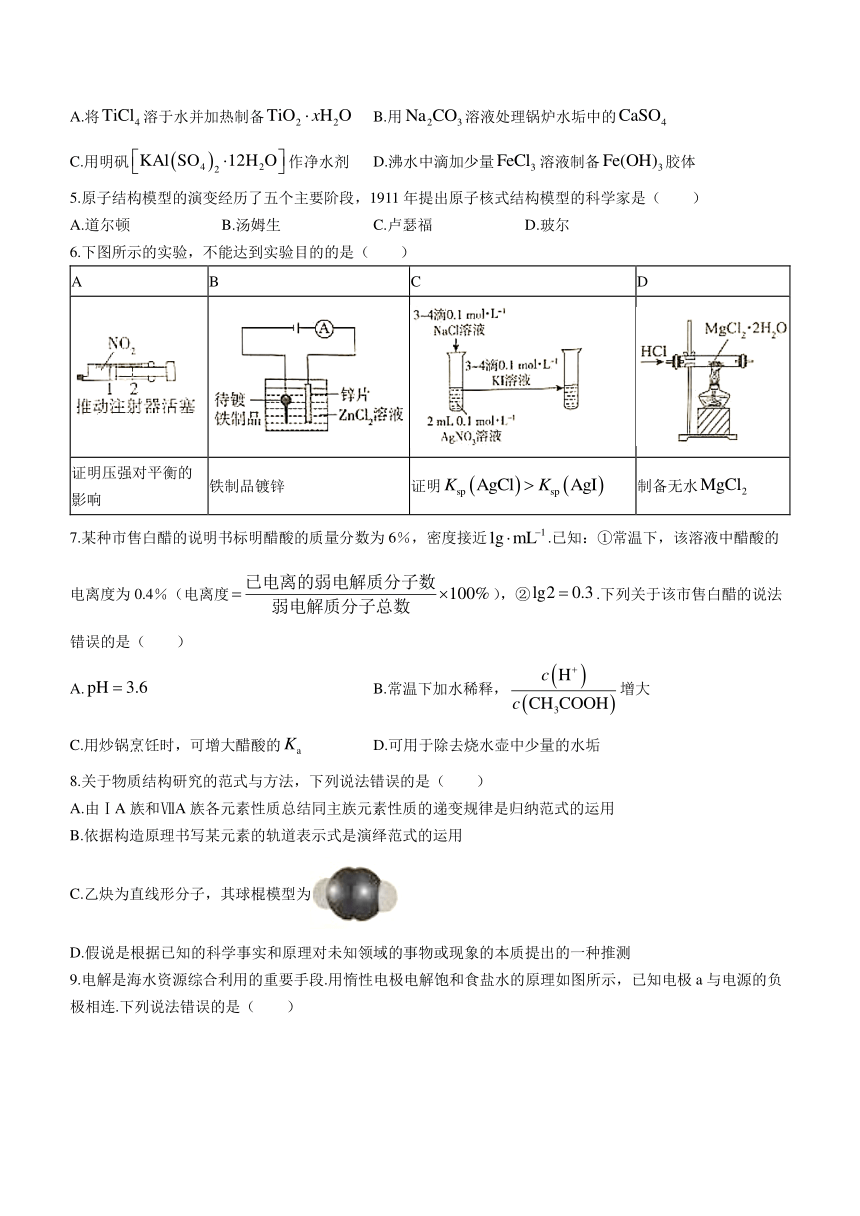
6.下图所示的实验,不能达到实验目的的是( )
A B C D
证明压强对平衡的影响 铁制品镀锌 证明 制备无水
7.某种市售白醋的说明书标明醋酸的质量分数为6%,密度接近.已知:①常温下,该溶液中醋酸的电离度为0.4%(电离度),②.下列关于该市售白醋的说法错误的是( )
A. B.常温下加水稀释,增大
C.用炒锅烹饪时,可增大醋酸的 D.可用于除去烧水壶中少量的水垢
8.关于物质结构研究的范式与方法,下列说法错误的是( )
A.由ⅠA族和ⅦA族各元素性质总结同主族元素性质的递变规律是归纳范式的运用
B.依据构造原理书写某元素的轨道表示式是演绎范式的运用
C.乙炔为直线形分子,其球棍模型为
D.假说是根据已知的科学事实和原理对未知领域的事物或现象的本质提出的一种推测
9.电解是海水资源综合利用的重要手段.用惰性电极电解饱和食盐水的原理如图所示,已知电极a与电源的负极相连.下列说法错误的是( )
A.气体X为 B.b电极的电极反应式为
C.气体X和Y可用于工业制盐酸 D.通过离子交换膜向电极b方向移动
10.某温度下,向含有固体的饱和溶液中加入几滴的盐酸,下列说法错误的是( )
A.溶液中不变 B.固体的质量增大
C.的溶解度减小 D.的不变
11.25℃时,几种弱酸的电离平衡常数如表所示,下列离子方程式书写错误的是( )
弱酸
, ,
A.向溶液中通入少量:
B.向溶液中滴加少量溶液:
C.向溶液中通入足量:
D.向溶液中滴加溶液:
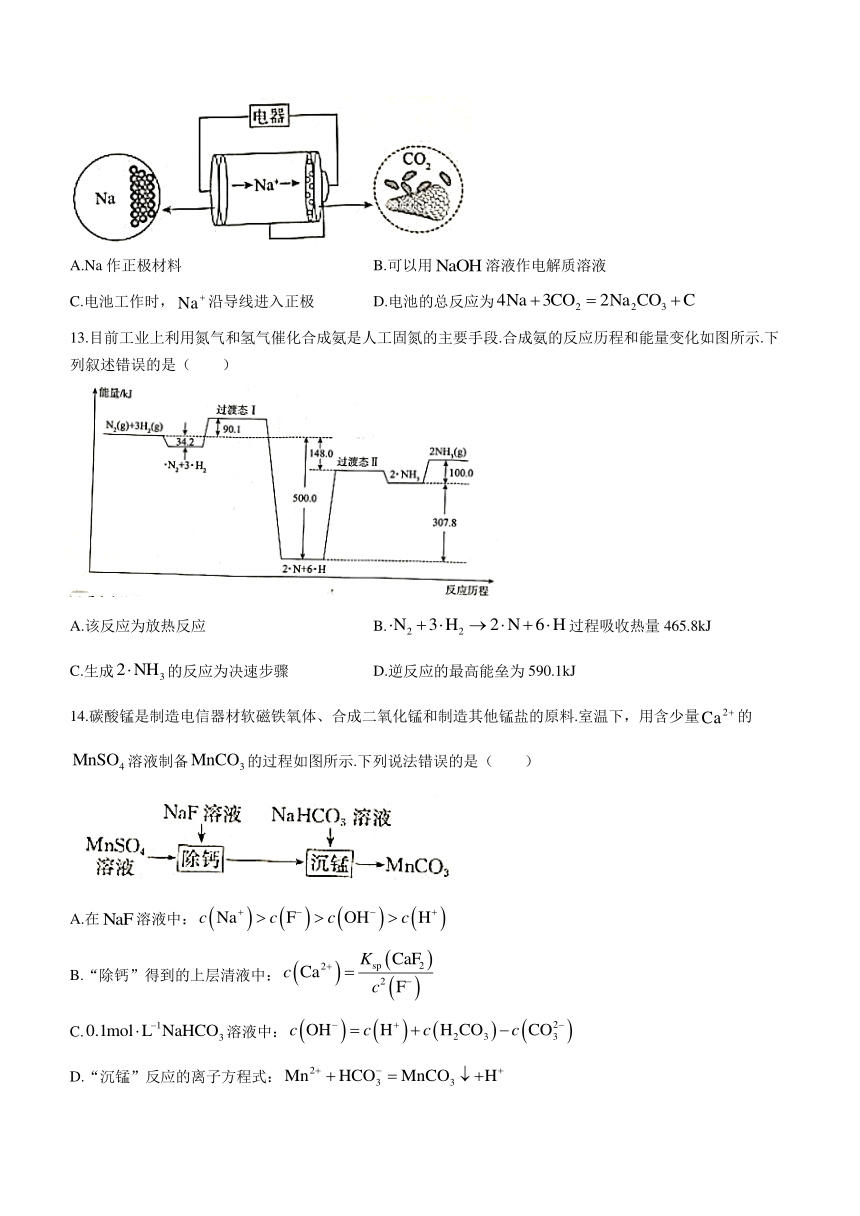
12.火星大气中含有大量,一种有参加反应的新型全固态电池有望成为火星探测器的供电器,其工作原理如图所示,该电池以金属钠和碳纳米管作为两极,下列关于该电池的说法正确的是( )
A.Na作正极材料 B.可以用溶液作电解质溶液
C.电池工作时,沿导线进入正极 D.电池的总反应为
13.目前工业上利用氮气和氢气催化合成氨是人工固氮的主要手段.合成氨的反应历程和能量变化如图所示.下列叙述错误的是( )
A.该反应为放热反应 B.过程吸收热量465.8kJ
C.生成的反应为决速步骤 D.逆反应的最高能垒为590.1kJ
14.碳酸锰是制造电信器材软磁铁氧体、合成二氧化锰和制造其他锰盐的原料.室温下,用含少量的溶液制备的过程如图所示.下列说法错误的是( )
A.在溶液中:
B.“除钙”得到的上层清液中:
C.溶液中:
D.“沉锰”反应的离子方程式:
二、非选择题:本题共4小题,共58分.
15.(15分)某实验小组同学探究常温下氨水和醋酸的性质,查阅资料:,,该小组同学在实验室进行如下实验操作.回答下列问题:
(1)用pH试纸测定氨水的pH约为11,用化学用语说明氨水显碱性的原因:______________,测定醋酸的pH约为______________.
(2)将氨水与醋酸混合,充分反应后测定溶液的pH_________(填“>”“=”“<”)7,说明原因:________________________.
(3)测定溶液的__________.,向醋酸中滴加溶液,所得溶液的pH__________(填“>”“=”“<”)7,用化学用语说明原因:______________________________,将所得溶液中的离子浓度从大到小排列:____________________.
(4)若向氨水中加入稀硫酸至溶液的,此时溶液中,则_____________.
16.(14分)黑火药的主要成分为木炭(C)、硫黄(S)和火硝.请回答下列问题.
(1)基态碳原子的电子排布式为_______________.
(2)下列轨道表示式能表示基态氮原子的核外电子排布的是____________(填标号).
A. B.
C. D.
(3)C、N、O三种元素的第一电离能由大到小的顺序为_________________________.
(4)Se元素位于第4周期,与O、S同主族.
①基态Se原子中具有___________种运动状态不同的电子.其中能量最高的电子占据轨道的形状为__________.
②O、S、Se三种元素的电负性依次____________(填“增大”或“减小”).
(5)用铂丝蘸取溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰呈紫色,从微观角度解释产生该现象的原因是____________________________.第4周期元素的基态原子中,与基态K原子具有相同最外层电子数的是__________(填元素符号).
17.(14分)含铂、铑等活性成分的催化剂能促使汽车尾气中的和转化为无毒气体.回答下列问题:
(1)已知:①
②
将汽车尾气中的和在催化剂作用下转化为无毒气体的化学方程式为,该反应的____________,写出该反应的平衡常数与反应①和②的平衡常数(和)的关系式:________________________.
(2)为了测定在催化剂作用下的反应速率,某温度下,用传感器测得不同时间的浓度如表所示:
时间/min 0 0.5 1 1.5 2 3
0
0~1min内的平均反应速率____________.0~0.5min和0.5~1min时间段内反应速率变化的主要原因是_________________________________________.
(3)为了分别验证不同条件对化学反应速率的影响,某同学设计了三组实验,部分实验条件已经填在下面实验设计表格中.
实验编号 T/℃ 催化剂类型
Ⅰ 320 铂铑
Ⅱ 稀土
Ⅲ 260 铂铑
①实验Ⅰ和Ⅱ的目的是______________________,______________.
②实验Ⅱ和Ⅲ的目的是_____________________,__________,___________.
18.(15分)草酸是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性溶液发生反应:.某兴趣小组设计了测定硬水中钙离子的浓度的转化流程,如图所示,回答下列问题:
(1)盛装酸性标准溶液应用_________(填“酸式”或“碱式”)滴定管,注入酸性标准溶液之前,滴定管需要_________、洗涤和润洗.
(2)若用25.00mL滴定管进行实验,当滴定管中的液面在刻度“10.00”处时,管内液体的体积__________(填标号).
A.等于10.00mL B.等于15.00mL C.小于15.00mL D.大于15.00mL
(3)写出“沉淀”反应的离子方程式:______________________________.
(4)“滴定”时判断滴定终点的依据是________________________________________.
(5)本实验滴定管起点和终点的液面位置如图所示,则滴定过程中消耗的酸性标准溶液为_________mL.该硬水样品中的物质的量浓度为___________.
(6)下列操作会使测得的硬水样品中浓度偏高的是_________(填标号).
A.滴定管未用标准溶液润洗 B.盛放草酸溶液的锥形瓶没有干燥
C.滴定前仰视读数并记录数据 D.草酸钙沉淀洗涤不充分
高二化学参考答案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 A D C B C C A C D A C D B D
1.A 解析:锂离子电池放电将化学能转化为电能,A项正确;太阳能集热器将太阳能转化为热能,B项错误;冶炼金属钠是电解原理,将电能转化为化学能,C项错误;天然气燃烧时,将化学能转化为热能,D项错误.
[命题意图]该题以生活中常见设备为载体,考查能量的转化形式等考点.
2.D 解析:将肉制品放在冰柜中,可降低温度,减缓肉制品腐烂速率,A项错误;在食品包装袋内放置小袋铁粉可防止食品被氧化,且能吸收水分,B项错误;制作面包、蛋糕时添加一定量的膨松剂可使其疏松柔软,与改变化学反应速率无关,C项错误;氧化性:,先发生反应,Zn与Cu在稀硫酸中形成原电池,可加快生成的速率,D项正确.
[命题意图]该题以生活中常见化学现象或应用为载体,考查影响化学反应速率的因素等考点.
3.C 解析:醋酸钠属于盐,是强电解质,A项错误;常温下,醋酸钠在溶液中水解:,所以醋酸钠溶液的,B项错误;溶液结晶形成晶体放热,C项正确;过饱和醋酸钠溶液不稳定,易析出晶体,D项错误.
[命题意图]该题以“天宫课堂”为载体,考查强、弱电解质的概念,以及盐的水解、溶解平衡等考点.
4.B 解析:利用在热水中强烈的水解作用可制得:,A项不符合题意;利用沉淀的转化反应,用溶液处理水垢中的,使转化为疏松、易溶于酸的:,B项符合题意;明矾溶于水,水解生成的胶体有很强的吸附作用,可用于净水,C项不符合题意;可利用的水解反应制备胶体,D项不符合题意.
[命题意图]该题以常见物质性质的应用为载体,考查盐的水解、沉淀的转化等考点.
5.C 解析:原子结构模型的演变经历了五个主要阶段:1803年,道尔顿提出实心球模型;1904年,汤姆生提出“葡萄干面包式”模型;1911年,卢瑟福提出原子核式结构模型;1913年,玻尔提出轨道模型;20世纪初,科学家们提出了量子力学的原子结构模型.答案为C.
[命题意图]本题以原子结构模型的演变历程创设情境,考查人类对原子结构的认识过程.
6.C 解析:,向左推动注射器活塞,气体颜色变深,之后,颜色又变浅,说明加压,平衡正向移动,A项不符合题意;阳极:,阴极:,能在铁制品上镀锌,B项不符合题意;,据题图可知,有剩余,再向其中加入溶液,生成,是过量的与反应生成黄色沉淀,不能证明,C项符合题意;由晶体蒸干制备无水,需要在气流中进行,以抑制水解,D项不符合题意.
[命题意图]该题以常见基本实验装置为载体,考查压强对化学平衡的影响、电镀原理、的比较及盐的水解等考点.
7.A 解析:据题意,该醋酸溶液的物质的量浓度:.,,A项错误;,,常温下加水稀释,减小,不变,增大,则增大,B项正确;醋酸电离吸热,用炒锅烹饪时,温度升高,可增大醋酸的,C项正确;醋酸可与水垢的主要成分反应生成可溶性醋酸盐,如与醋酸反应生成可溶于水的,D项正确.
[命题意图]该题以市售白醋为载体,考查影响醋酸电离平衡的因素、电离平衡常数的计算与应用等考点.
8.C 解析:由ⅠA族和ⅦA族各元素性质总结同主族元素性质的递变规律,是由个别到一般的过程,是归纳范式的运用,A项正确;依据构造原理书写某元素的轨道表示式,是由一般到个别的过程,是演绎范式的运用,B项正确;乙炔为直线形分子,其球棍模型为,其空间填充模型为,C项错误;在探索微观世界的过程中,科学家们常通过提出假说来把握物质的结构及特点,不断拓展认识的新领域,假说是根据已知的科学事实和原理对未知领域的事物或现象的本质提出的一种推测,D项正确.
[命题意图]本题以物质结构研究的实例为素材,考查物质结构研究的范式与方法,涉及归纳范式、演绎范式、模型方法、科学假设与论证等考点.
9.D 解析:电极a与电源的负极相连,为阴极,电极反应式为,则气体X为,A项正确;电极b为阳极,电极反应式为,B项正确;可与反应生成,工业上可用该反应制盐酸,C项正确;电解池工作时,通过阳离子交换膜向电极a方向移动,进入阴极区,D项错误.
[命题意图]该题以电解饱和食盐水为载体,考查产物判断、电极反应式正误判断、物质用途、离子交换膜等电化学考点.
10.A 解析:加入几滴的盐酸,溶液中增大,又会析出固体,溶液中减小,A项错误,B项正确;又析出固体,所以的溶解度减小,C项正确;温度不变,不变,D项正确.
[命题意图]该题以的溶解平衡为载体,考查影响沉淀溶解平衡的因素、溶解度的概念等考点.
11.C 解析:据表中数据可知电离出能力:.则与反应一定生成和,A项正确;溶液与少量溶液反应生成,B项正确;有强氧化性,可氧化,C项错误;向溶液中滴加溶液生成气体,D项正确.
[命题意图]该题以常见弱酸的电离平衡常数为载体,考查弱酸的电离和盐的水解相关考点.
12.D 解析:钠作负极材料,碳纳米管作正极材料,A项错误;Na能与水反应,电解质溶液不可以是水溶液,B项错误;电池工作时,电子沿导线进入正极,C项错误;Na可与发生氧化还原反应生成,反应方程式为,D项正确.
[命题意图]该题以新型电池为载体,考查原电池原理的相关考点.
13.B 解析:据题图可知,反应物的总能量高于生成物的总能量,A项正确;据题图可知,过程放出热量,B项错误;反应过程中,生成的反应能垒最高,所以该反应为决速步骤,C项正确;逆反应的最高能垒为,D项正确.
[命题意图]该题以合成氨的反应历程和能量变化为载体,考查反应机理的相关考点.
14.D 解析:在溶液中可发生水解:,溶液中,,A项正确;,则,B项正确;溶液中,质子守恒:,C项正确;“沉锰”反应的离子方程式为,D项错误.
[命题意图]以的制备流程为载体,考查溶液中离子平衡的相关考点.
15.答案:(1)(1分) 3(2分)
(2)=(1分) 氨水与醋酸恰好反应生成,和的水解程度相同(2分)
(3)13(2分) >(1分) (2分)
(2分)
(4)(2分)
解析:(1)是弱电解质,可电离出,所以溶液显碱性.据信息可知,浓度相同的醋酸与氨水电离程度相同,所以醋酸的约为3.
(2)氨水与醋酸混合恰好反应生成,和的水解程度相同,所以溶液的.
(3),,.醋酸与溶液恰好反应生成,是强碱弱酸盐,,溶液的,所得溶液中离子浓度:.
(4)向氨水中加入稀硫酸至溶液的,电荷守恒关系为,若,则.
[命题意图]该题以氨水和醋酸为载体,考查弱电解质的电离平衡、盐的水解平衡、的计算、溶液中离子浓度大小比较及电荷守恒的应用等考点.
16.答案:(1)(2分)
(2)C(2分)
(3)(2分)
(4)①34(1分) 纺锤形(哑铃形)(1分) ②减小(2分)
(5)电子从能量较高的轨道跃迁到能量较低的轨道时,以光能的形式释放出能量(2分,其他合理答案也给分)Cr、Cu(2分,部分作答给1分,多答、错答不给分)
解析:(1)根据构造原理分析,基态碳原子的电子排布式为.
(2)根据构造原理分析,基态氮原子的轨道表示式为,C项正确.
(3)根据同周期元素第一电离能的变化规律,三种元素的第一电离能由大到小的顺序为.
(4)①基态Se原子的电子排布式为,核外共有34个电子,因此具有34种运动状态不同的电子.其中能量最高的电子位于4p轨道,轨道形状为纺锤形(哑铃形).
②根据同主族元素电负性变化规律,O、S、Se三种元素的电负性依次减小.
(5)电子从能量较高的轨道跃迁到能量较低的轨道时,以光能的形式释放出能量,使火焰产生特殊颜色,称为焰色反应.第4周期元素的基态原子中,与基态K原子具有相同最外层电子数的是Cr、Cu.
[命题意图]本题以黑火药的成分创设情境,考查原子结构与元素性质的基础知识,涉及电子排布式、轨道表示式、第一电离能、电负性、核外电子运动状态、原子轨道形状、焰色反应原理等考点.
17.答案:(1)(2分) (2分)
(2)(1分) 反应物浓度减小,正反应速率逐渐减小(2分)
(3)①探究温度对反应速率的影响(2分) (1分)
②探究不同催化剂对反应速率的影响(2分) 260(1分) (1分)
解析:(1)据题意,.,,.
(2)据表中数据可知,内的平均反应速率.随着反应的进行,反应物的浓度减小,正反应速率减小.
(3)①据表中数据可知,实验Ⅰ和Ⅲ的目的是探究温度对反应速率的影响,所以.②实验Ⅱ和Ⅲ的目的是探究不同催化剂对反应速率的影响,,.
[命题意图]该题以汽车尾气的催化处理为载体,考查盖斯定律的应用、化学平衡常数、化学反应速率的计算及影响因素、实验方案设计等考点.
18.答案:(1)酸式(1分) 检漏(2分)
(2)D(2分)
(3)(2分)
(4)最后加入半滴酸性高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不变为无色(2分)
(5)19.20(2分) (2分,答也给分)
(6)AD(2分)
解析:(1)酸性溶液应盛装在酸式滴定管中,滴定管在使用前要检查是否漏液.
(2)滴定管下端有一段无刻度,所以管内液体的体积大于.
(3)“沉淀”反应的离子方程式为.
(4)据信息可知,用酸性溶液滴定时,被还原为而褪色,所以当最后加入半滴酸性高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不变为无色时,反应达到滴定终点.
(5)据图示可知消耗酸性标准溶液的体积为.据,则,.
(6)滴定管未用标准溶液润洗,消耗酸性溶液的体积偏大,会导致测定结果偏高,A项正确;盛放草酸溶液的锥形瓶没有干燥对测定结果无影响,B项错误;滴定前仰视读数并记录数据,读取的消耗酸性溶液的体积偏小,导致测定结果偏低,C项错误;草酸钙沉淀洗涤不充分,会有残留,导致测定结果偏高,D项正确.
[命题意图]该题以测定硬水中钙离子的浓度为载体,考查滴定实验的应用、误差分析、氧化还原反应、离子反应及化学计算等考点.
吴桥县2023-2024学年高二上学期期末考试
化学
班级__________姓名____________
注意事项:
1.答卷前,考生务必将自己的姓名、班级和考号填写在答题卡上.
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号.回答非选择题时,将答案写在答题卡上.写在本试卷上无效.
3.考试结束后,将本试卷和答题卡一并交回.
可能用到的相对原子质量:H 1 C 12 O 16
一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.下列生活中常见设备工作时,将化学能转化为电能的是( )
A.锂离子电池放电 B.太阳能集热器 C.冶炼金属钠 D.天然气燃烧
2.化学与生产、生活息息相关,下列措施的目的是加快反应速率的是( )
A.将肉制品放在冰柜中 B.在食品包装袋内放置小袋铁粉
C.制作面包、蛋糕时添加一定量的膨松剂 D.用锌与稀硫酸反应制氢气时滴加少量溶液
3.“天宫课堂”授课时,将小苏打和醋酸混合,得到过饱和醋酸钠溶液的“液体球”,结晶后得到了热的“冰球”.下列说法正确的是( )
A.醋酸钠是弱电解质
B.常温下,醋酸钠溶液的
C.过饱和醋酸钠溶液结晶形成热的“冰球”的过程放热
D.过饱和醋酸钠溶液性质较稳定,不易析出晶体
4.下列物质的用途或事实与盐类的水解无关的是( )
A.将溶于水并加热制备 B.用溶液处理锅炉水垢中的
C.用明矾作净水剂 D.沸水中滴加少量溶液制备胶体
5.原子结构模型的演变经历了五个主要阶段,1911年提出原子核式结构模型的科学家是( )
A.道尔顿 B.汤姆生 C.卢瑟福 D.玻尔
6.下图所示的实验,不能达到实验目的的是( )
A B C D
证明压强对平衡的影响 铁制品镀锌 证明 制备无水
7.某种市售白醋的说明书标明醋酸的质量分数为6%,密度接近.已知:①常温下,该溶液中醋酸的电离度为0.4%(电离度),②.下列关于该市售白醋的说法错误的是( )
A. B.常温下加水稀释,增大
C.用炒锅烹饪时,可增大醋酸的 D.可用于除去烧水壶中少量的水垢
8.关于物质结构研究的范式与方法,下列说法错误的是( )
A.由ⅠA族和ⅦA族各元素性质总结同主族元素性质的递变规律是归纳范式的运用
B.依据构造原理书写某元素的轨道表示式是演绎范式的运用
C.乙炔为直线形分子,其球棍模型为
D.假说是根据已知的科学事实和原理对未知领域的事物或现象的本质提出的一种推测
9.电解是海水资源综合利用的重要手段.用惰性电极电解饱和食盐水的原理如图所示,已知电极a与电源的负极相连.下列说法错误的是( )
A.气体X为 B.b电极的电极反应式为
C.气体X和Y可用于工业制盐酸 D.通过离子交换膜向电极b方向移动
10.某温度下,向含有固体的饱和溶液中加入几滴的盐酸,下列说法错误的是( )
A.溶液中不变 B.固体的质量增大
C.的溶解度减小 D.的不变
11.25℃时,几种弱酸的电离平衡常数如表所示,下列离子方程式书写错误的是( )
弱酸
, ,
A.向溶液中通入少量:
B.向溶液中滴加少量溶液:
C.向溶液中通入足量:
D.向溶液中滴加溶液:
12.火星大气中含有大量,一种有参加反应的新型全固态电池有望成为火星探测器的供电器,其工作原理如图所示,该电池以金属钠和碳纳米管作为两极,下列关于该电池的说法正确的是( )
A.Na作正极材料 B.可以用溶液作电解质溶液
C.电池工作时,沿导线进入正极 D.电池的总反应为
13.目前工业上利用氮气和氢气催化合成氨是人工固氮的主要手段.合成氨的反应历程和能量变化如图所示.下列叙述错误的是( )
A.该反应为放热反应 B.过程吸收热量465.8kJ
C.生成的反应为决速步骤 D.逆反应的最高能垒为590.1kJ
14.碳酸锰是制造电信器材软磁铁氧体、合成二氧化锰和制造其他锰盐的原料.室温下,用含少量的溶液制备的过程如图所示.下列说法错误的是( )
A.在溶液中:
B.“除钙”得到的上层清液中:
C.溶液中:
D.“沉锰”反应的离子方程式:
二、非选择题:本题共4小题,共58分.
15.(15分)某实验小组同学探究常温下氨水和醋酸的性质,查阅资料:,,该小组同学在实验室进行如下实验操作.回答下列问题:
(1)用pH试纸测定氨水的pH约为11,用化学用语说明氨水显碱性的原因:______________,测定醋酸的pH约为______________.
(2)将氨水与醋酸混合,充分反应后测定溶液的pH_________(填“>”“=”“<”)7,说明原因:________________________.
(3)测定溶液的__________.,向醋酸中滴加溶液,所得溶液的pH__________(填“>”“=”“<”)7,用化学用语说明原因:______________________________,将所得溶液中的离子浓度从大到小排列:____________________.
(4)若向氨水中加入稀硫酸至溶液的,此时溶液中,则_____________.
16.(14分)黑火药的主要成分为木炭(C)、硫黄(S)和火硝.请回答下列问题.
(1)基态碳原子的电子排布式为_______________.
(2)下列轨道表示式能表示基态氮原子的核外电子排布的是____________(填标号).
A. B.
C. D.
(3)C、N、O三种元素的第一电离能由大到小的顺序为_________________________.
(4)Se元素位于第4周期,与O、S同主族.
①基态Se原子中具有___________种运动状态不同的电子.其中能量最高的电子占据轨道的形状为__________.
②O、S、Se三种元素的电负性依次____________(填“增大”或“减小”).
(5)用铂丝蘸取溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰呈紫色,从微观角度解释产生该现象的原因是____________________________.第4周期元素的基态原子中,与基态K原子具有相同最外层电子数的是__________(填元素符号).
17.(14分)含铂、铑等活性成分的催化剂能促使汽车尾气中的和转化为无毒气体.回答下列问题:
(1)已知:①
②
将汽车尾气中的和在催化剂作用下转化为无毒气体的化学方程式为,该反应的____________,写出该反应的平衡常数与反应①和②的平衡常数(和)的关系式:________________________.
(2)为了测定在催化剂作用下的反应速率,某温度下,用传感器测得不同时间的浓度如表所示:
时间/min 0 0.5 1 1.5 2 3
0
0~1min内的平均反应速率____________.0~0.5min和0.5~1min时间段内反应速率变化的主要原因是_________________________________________.
(3)为了分别验证不同条件对化学反应速率的影响,某同学设计了三组实验,部分实验条件已经填在下面实验设计表格中.
实验编号 T/℃ 催化剂类型
Ⅰ 320 铂铑
Ⅱ 稀土
Ⅲ 260 铂铑
①实验Ⅰ和Ⅱ的目的是______________________,______________.
②实验Ⅱ和Ⅲ的目的是_____________________,__________,___________.
18.(15分)草酸是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性溶液发生反应:.某兴趣小组设计了测定硬水中钙离子的浓度的转化流程,如图所示,回答下列问题:
(1)盛装酸性标准溶液应用_________(填“酸式”或“碱式”)滴定管,注入酸性标准溶液之前,滴定管需要_________、洗涤和润洗.
(2)若用25.00mL滴定管进行实验,当滴定管中的液面在刻度“10.00”处时,管内液体的体积__________(填标号).
A.等于10.00mL B.等于15.00mL C.小于15.00mL D.大于15.00mL
(3)写出“沉淀”反应的离子方程式:______________________________.
(4)“滴定”时判断滴定终点的依据是________________________________________.
(5)本实验滴定管起点和终点的液面位置如图所示,则滴定过程中消耗的酸性标准溶液为_________mL.该硬水样品中的物质的量浓度为___________.
(6)下列操作会使测得的硬水样品中浓度偏高的是_________(填标号).
A.滴定管未用标准溶液润洗 B.盛放草酸溶液的锥形瓶没有干燥
C.滴定前仰视读数并记录数据 D.草酸钙沉淀洗涤不充分
高二化学参考答案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 A D C B C C A C D A C D B D
1.A 解析:锂离子电池放电将化学能转化为电能,A项正确;太阳能集热器将太阳能转化为热能,B项错误;冶炼金属钠是电解原理,将电能转化为化学能,C项错误;天然气燃烧时,将化学能转化为热能,D项错误.
[命题意图]该题以生活中常见设备为载体,考查能量的转化形式等考点.
2.D 解析:将肉制品放在冰柜中,可降低温度,减缓肉制品腐烂速率,A项错误;在食品包装袋内放置小袋铁粉可防止食品被氧化,且能吸收水分,B项错误;制作面包、蛋糕时添加一定量的膨松剂可使其疏松柔软,与改变化学反应速率无关,C项错误;氧化性:,先发生反应,Zn与Cu在稀硫酸中形成原电池,可加快生成的速率,D项正确.
[命题意图]该题以生活中常见化学现象或应用为载体,考查影响化学反应速率的因素等考点.
3.C 解析:醋酸钠属于盐,是强电解质,A项错误;常温下,醋酸钠在溶液中水解:,所以醋酸钠溶液的,B项错误;溶液结晶形成晶体放热,C项正确;过饱和醋酸钠溶液不稳定,易析出晶体,D项错误.
[命题意图]该题以“天宫课堂”为载体,考查强、弱电解质的概念,以及盐的水解、溶解平衡等考点.
4.B 解析:利用在热水中强烈的水解作用可制得:,A项不符合题意;利用沉淀的转化反应,用溶液处理水垢中的,使转化为疏松、易溶于酸的:,B项符合题意;明矾溶于水,水解生成的胶体有很强的吸附作用,可用于净水,C项不符合题意;可利用的水解反应制备胶体,D项不符合题意.
[命题意图]该题以常见物质性质的应用为载体,考查盐的水解、沉淀的转化等考点.
5.C 解析:原子结构模型的演变经历了五个主要阶段:1803年,道尔顿提出实心球模型;1904年,汤姆生提出“葡萄干面包式”模型;1911年,卢瑟福提出原子核式结构模型;1913年,玻尔提出轨道模型;20世纪初,科学家们提出了量子力学的原子结构模型.答案为C.
[命题意图]本题以原子结构模型的演变历程创设情境,考查人类对原子结构的认识过程.
6.C 解析:,向左推动注射器活塞,气体颜色变深,之后,颜色又变浅,说明加压,平衡正向移动,A项不符合题意;阳极:,阴极:,能在铁制品上镀锌,B项不符合题意;,据题图可知,有剩余,再向其中加入溶液,生成,是过量的与反应生成黄色沉淀,不能证明,C项符合题意;由晶体蒸干制备无水,需要在气流中进行,以抑制水解,D项不符合题意.
[命题意图]该题以常见基本实验装置为载体,考查压强对化学平衡的影响、电镀原理、的比较及盐的水解等考点.
7.A 解析:据题意,该醋酸溶液的物质的量浓度:.,,A项错误;,,常温下加水稀释,减小,不变,增大,则增大,B项正确;醋酸电离吸热,用炒锅烹饪时,温度升高,可增大醋酸的,C项正确;醋酸可与水垢的主要成分反应生成可溶性醋酸盐,如与醋酸反应生成可溶于水的,D项正确.
[命题意图]该题以市售白醋为载体,考查影响醋酸电离平衡的因素、电离平衡常数的计算与应用等考点.
8.C 解析:由ⅠA族和ⅦA族各元素性质总结同主族元素性质的递变规律,是由个别到一般的过程,是归纳范式的运用,A项正确;依据构造原理书写某元素的轨道表示式,是由一般到个别的过程,是演绎范式的运用,B项正确;乙炔为直线形分子,其球棍模型为,其空间填充模型为,C项错误;在探索微观世界的过程中,科学家们常通过提出假说来把握物质的结构及特点,不断拓展认识的新领域,假说是根据已知的科学事实和原理对未知领域的事物或现象的本质提出的一种推测,D项正确.
[命题意图]本题以物质结构研究的实例为素材,考查物质结构研究的范式与方法,涉及归纳范式、演绎范式、模型方法、科学假设与论证等考点.
9.D 解析:电极a与电源的负极相连,为阴极,电极反应式为,则气体X为,A项正确;电极b为阳极,电极反应式为,B项正确;可与反应生成,工业上可用该反应制盐酸,C项正确;电解池工作时,通过阳离子交换膜向电极a方向移动,进入阴极区,D项错误.
[命题意图]该题以电解饱和食盐水为载体,考查产物判断、电极反应式正误判断、物质用途、离子交换膜等电化学考点.
10.A 解析:加入几滴的盐酸,溶液中增大,又会析出固体,溶液中减小,A项错误,B项正确;又析出固体,所以的溶解度减小,C项正确;温度不变,不变,D项正确.
[命题意图]该题以的溶解平衡为载体,考查影响沉淀溶解平衡的因素、溶解度的概念等考点.
11.C 解析:据表中数据可知电离出能力:.则与反应一定生成和,A项正确;溶液与少量溶液反应生成,B项正确;有强氧化性,可氧化,C项错误;向溶液中滴加溶液生成气体,D项正确.
[命题意图]该题以常见弱酸的电离平衡常数为载体,考查弱酸的电离和盐的水解相关考点.
12.D 解析:钠作负极材料,碳纳米管作正极材料,A项错误;Na能与水反应,电解质溶液不可以是水溶液,B项错误;电池工作时,电子沿导线进入正极,C项错误;Na可与发生氧化还原反应生成,反应方程式为,D项正确.
[命题意图]该题以新型电池为载体,考查原电池原理的相关考点.
13.B 解析:据题图可知,反应物的总能量高于生成物的总能量,A项正确;据题图可知,过程放出热量,B项错误;反应过程中,生成的反应能垒最高,所以该反应为决速步骤,C项正确;逆反应的最高能垒为,D项正确.
[命题意图]该题以合成氨的反应历程和能量变化为载体,考查反应机理的相关考点.
14.D 解析:在溶液中可发生水解:,溶液中,,A项正确;,则,B项正确;溶液中,质子守恒:,C项正确;“沉锰”反应的离子方程式为,D项错误.
[命题意图]以的制备流程为载体,考查溶液中离子平衡的相关考点.
15.答案:(1)(1分) 3(2分)
(2)=(1分) 氨水与醋酸恰好反应生成,和的水解程度相同(2分)
(3)13(2分) >(1分) (2分)
(2分)
(4)(2分)
解析:(1)是弱电解质,可电离出,所以溶液显碱性.据信息可知,浓度相同的醋酸与氨水电离程度相同,所以醋酸的约为3.
(2)氨水与醋酸混合恰好反应生成,和的水解程度相同,所以溶液的.
(3),,.醋酸与溶液恰好反应生成,是强碱弱酸盐,,溶液的,所得溶液中离子浓度:.
(4)向氨水中加入稀硫酸至溶液的,电荷守恒关系为,若,则.
[命题意图]该题以氨水和醋酸为载体,考查弱电解质的电离平衡、盐的水解平衡、的计算、溶液中离子浓度大小比较及电荷守恒的应用等考点.
16.答案:(1)(2分)
(2)C(2分)
(3)(2分)
(4)①34(1分) 纺锤形(哑铃形)(1分) ②减小(2分)
(5)电子从能量较高的轨道跃迁到能量较低的轨道时,以光能的形式释放出能量(2分,其他合理答案也给分)Cr、Cu(2分,部分作答给1分,多答、错答不给分)
解析:(1)根据构造原理分析,基态碳原子的电子排布式为.
(2)根据构造原理分析,基态氮原子的轨道表示式为,C项正确.
(3)根据同周期元素第一电离能的变化规律,三种元素的第一电离能由大到小的顺序为.
(4)①基态Se原子的电子排布式为,核外共有34个电子,因此具有34种运动状态不同的电子.其中能量最高的电子位于4p轨道,轨道形状为纺锤形(哑铃形).
②根据同主族元素电负性变化规律,O、S、Se三种元素的电负性依次减小.
(5)电子从能量较高的轨道跃迁到能量较低的轨道时,以光能的形式释放出能量,使火焰产生特殊颜色,称为焰色反应.第4周期元素的基态原子中,与基态K原子具有相同最外层电子数的是Cr、Cu.
[命题意图]本题以黑火药的成分创设情境,考查原子结构与元素性质的基础知识,涉及电子排布式、轨道表示式、第一电离能、电负性、核外电子运动状态、原子轨道形状、焰色反应原理等考点.
17.答案:(1)(2分) (2分)
(2)(1分) 反应物浓度减小,正反应速率逐渐减小(2分)
(3)①探究温度对反应速率的影响(2分) (1分)
②探究不同催化剂对反应速率的影响(2分) 260(1分) (1分)
解析:(1)据题意,.,,.
(2)据表中数据可知,内的平均反应速率.随着反应的进行,反应物的浓度减小,正反应速率减小.
(3)①据表中数据可知,实验Ⅰ和Ⅲ的目的是探究温度对反应速率的影响,所以.②实验Ⅱ和Ⅲ的目的是探究不同催化剂对反应速率的影响,,.
[命题意图]该题以汽车尾气的催化处理为载体,考查盖斯定律的应用、化学平衡常数、化学反应速率的计算及影响因素、实验方案设计等考点.
18.答案:(1)酸式(1分) 检漏(2分)
(2)D(2分)
(3)(2分)
(4)最后加入半滴酸性高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不变为无色(2分)
(5)19.20(2分) (2分,答也给分)
(6)AD(2分)
解析:(1)酸性溶液应盛装在酸式滴定管中,滴定管在使用前要检查是否漏液.
(2)滴定管下端有一段无刻度,所以管内液体的体积大于.
(3)“沉淀”反应的离子方程式为.
(4)据信息可知,用酸性溶液滴定时,被还原为而褪色,所以当最后加入半滴酸性高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不变为无色时,反应达到滴定终点.
(5)据图示可知消耗酸性标准溶液的体积为.据,则,.
(6)滴定管未用标准溶液润洗,消耗酸性溶液的体积偏大,会导致测定结果偏高,A项正确;盛放草酸溶液的锥形瓶没有干燥对测定结果无影响,B项错误;滴定前仰视读数并记录数据,读取的消耗酸性溶液的体积偏小,导致测定结果偏低,C项错误;草酸钙沉淀洗涤不充分,会有残留,导致测定结果偏高,D项正确.
[命题意图]该题以测定硬水中钙离子的浓度为载体,考查滴定实验的应用、误差分析、氧化还原反应、离子反应及化学计算等考点.
同课章节目录
