4.4.1化学方程式的意义及书写课件(共50张PPT)2023-2024学年度科粤版化学九年级上册
文档属性
| 名称 | 4.4.1化学方程式的意义及书写课件(共50张PPT)2023-2024学年度科粤版化学九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 29.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-22 00:00:00 | ||
图片预览







文档简介
(共50张PPT)
九上 化学
科粤版
4.4.1 化学方程式的意义及书写
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
教学环节
1. 了解化学方程式的表示方法及意义
2. 能正确书写化学方程式,初步学会化学方程式的配平方法
3. 能提取信息,书写陌生化学方程式
学习目标
难点
重点
新课引入
衣
食
行
化学
化学
变化
住
如何用化学语言表示这些变化呢?
新知学习
回顾电解水实验
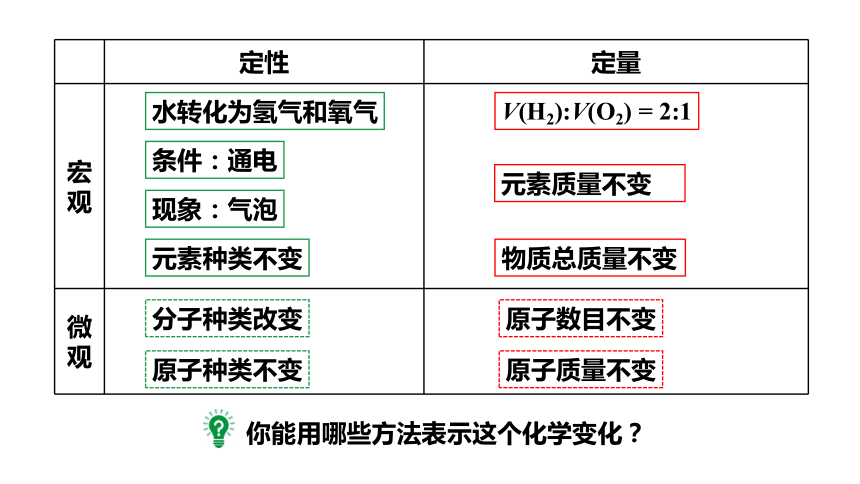
结合实验现象和对化学反应的认识,你能获取和分析得到关于反应的哪些信息?
水转化为氢气和氧气
条件:通电
现象:气泡
V(H2):V(O2) = 2:1
通过观察得到
基于对化学反应的认识分析得到
元素种类不变
分子种类改变
原子种类不变
原子数目不变
物质总质量不变
原子质量不变
元素质量不变
定性 定量
宏观
微观
元素种类不变
分子种类改变
原子种类不变
原子数目不变
水转化为氢气和氧气
条件:通电
现象:气泡
原子质量不变
物质总质量不变
V(H2):V(O2) = 2:1
元素质量不变
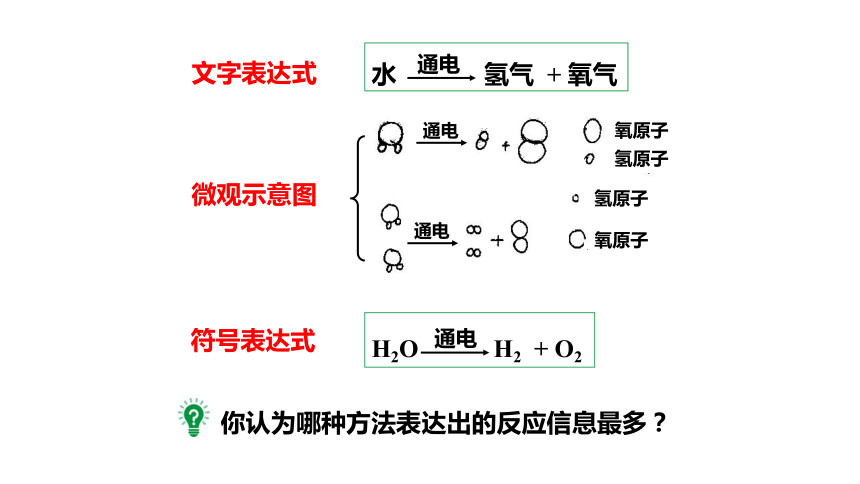
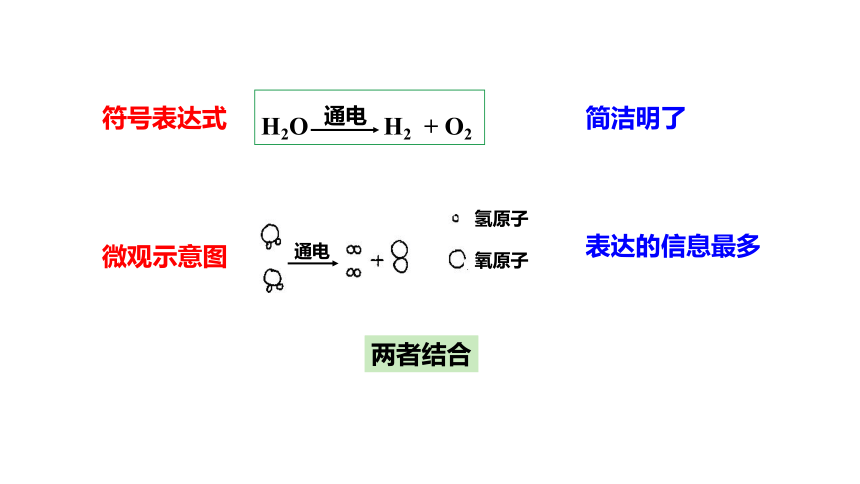
你能用哪些方法表示这个化学变化?
水 氢气 + 氧气
通电
H2O H2 + O2
通电
文字表达式
微观示意图
符号表达式
你认为哪种方法表达出的反应信息最多?
通电
通电
氧原子
氢原子
氧原子
氢原子
水 氢气 + 氧气
通电
水转化为氢气和氧气
条件:通电
文字表达式
通电
氧原子
氢原子
通电
氧原子
氢原子
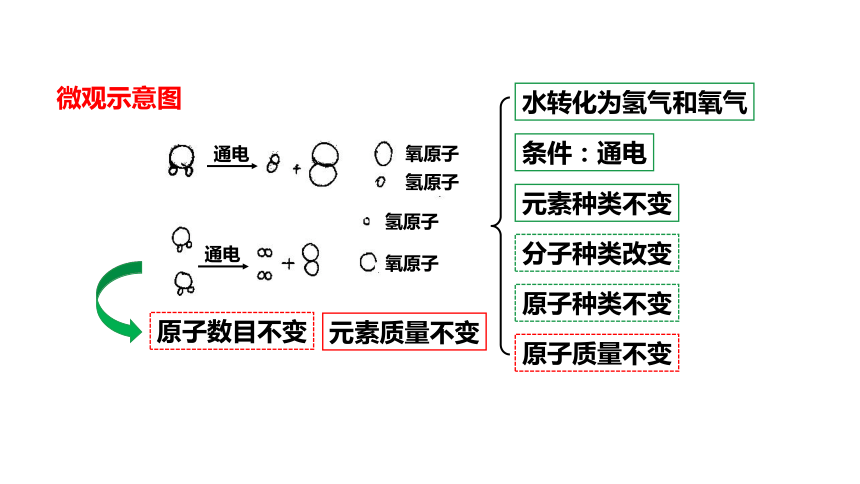
元素种类不变
分子种类改变
原子种类不变
水转化为氢气和氧气
条件:通电
原子数目不变
原子质量不变
元素质量不变
微观示意图
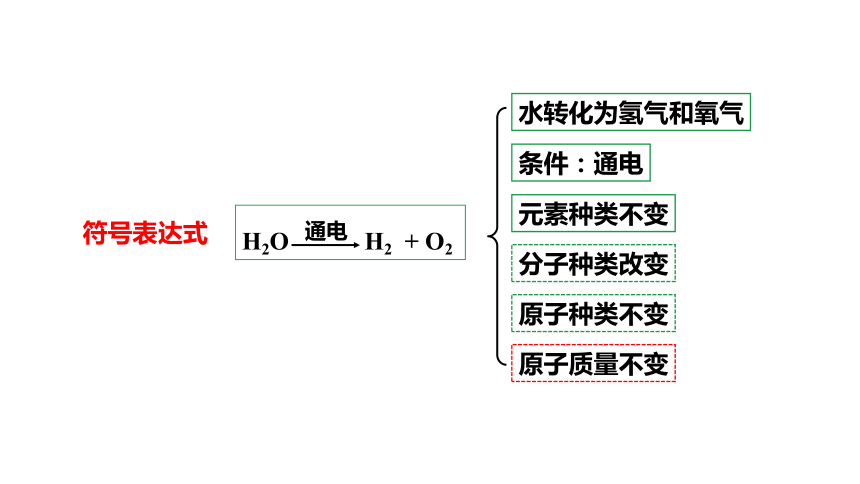
H2O H2 + O2
通电
符号表达式
元素种类不变
分子种类改变
原子种类不变
水转化为氢气和氧气
条件:通电
原子质量不变
H2O H2 + O2
通电
符号表达式
通电
氧原子
氢原子
微观示意图
表达的信息最多
简洁明了
两者结合
H2O H2 + O2
通电
2
2
1
2
2
1
化学计量数:表示反应中分子个数比
氢原子
氧原子
通电
V(H2) : V(O2) = 2 : 1
2H2O 2H2 + O2
通电
资料卡片
在相同条件下,气体体积比等于分子个数比。
这个实验的现象是两极都有大量气泡产生,如何表示反应中有气体生成呢?
气体放出
气体符号
沉淀析出
沉淀符号
当生成物中有气体,而反应物中没有气体时,在气态生成物的化学式右边标“↑”。
溶液中的反应,生成物有难溶性固体,即沉淀,则需在该生成物的化学式右边标“↓”。
以客观事实为基础
2.遵守质量守恒定律
↑
↑
2H2O 2H2 + O2
通电
用化学式表示
化学反应的式子
化学方程式
化学式
元素符号
表示
化学反应
表示
物质组成
表示
元素
化学方程式
Ⅰ 什么是化学方程式
↑
↑
2H2O 2H2 + O2
通电
化学方程式的意义
定性:水在通电条件下生成氢气和氧气
定量:
微粒个数比
2 : 2 : 1
物质质量比
2n×18
2n×2
n×32
:
:
36 : 4 : 32
相对原子质量
H 1 O 16
定性 定量
宏观
微观
元素种类不变
分子种类改变
原子种类不变
原子数目、质量不变
水转化为氢气和氧气
条件:通电
现象:气泡
物质总质量不变
V(H2):V(O2) = 2:1
元素质量不变
分子个数比2:2:1
m(H2O):m(H2):m(O2) = 36:4:32
化学方程式的意义
表示反应物、生成物之间的粒子个数比
表示反应物、生成物和反应条件
质的方面
表示反应物和生成物间的质量比
量的方面
即化学式前面的化学计量数之比
各物质之间的质量比=相对分子质量(或相对原子质量)与化学计量数的乘积之比
归纳
反应物是氢气和氧气,生成物是水,反应条件是点燃
质的方面
量的方面
2H2 + O2 2H2O
粒子个数比 2 ︰ 1 ︰ 2
点燃
2H2 + O2 2H2O
质量比(2×2)︰(16×2)︰[2×(2+16)]
即 1 ︰ 8 ︰ 9
2H2 + O2 2H2O
点燃
点燃
小试牛刀
化学方程式的读法:
质的方面
量的方面
C +
O2 ======
点燃
CO2
(以 为例)
粒子方面:在点燃的条件下,每1个碳原子和1个氧分子反应生成1个二氧化碳分子
碳和氧气在点燃的条件下生成二氧化碳
质量方面:在点燃的条件下,每12份质量的碳和32份质量 的氧气恰好完全反应,生成44份质量的二氧化碳
化学变化
化学方程式
客观事实
质量守恒
描 述
书写原则
书写原则
含义
体 现
小结
针对训练
1. 关于化学反应方程式 的理解,正确的是( )
A.反应前后分子总数保持不变
B.该反应的反应物是五氧化二磷
C.每四份质量的磷和五份质量的氧气完全反应
D. 在点燃的条件下,磷和氧气反应生成五氧化二磷
D
4P +
5O2
2P2O5
磷和氧气
160
改变
124
复习回顾:木炭在氧气中燃烧
Ⅱ 怎样书写化学方程式
C + O2
CO2
判断生成物的依据是什么?
澄清石灰水变浑浊
木炭在氧气中燃烧
反应条件
是什么?
加热?
燃烧?
X
点燃
气体
气体
氢气和氧气反应生成水
点燃
H2 + O2
H2O
H原子个数 2 2
O原子个数 2 1
H2 + O2
点燃
H2O + O
不符合客观事实
氢气和氧气反应生成水
点燃
H2 + O2
H2O
氢气和氧气反应生成水
点燃
H2 + O2
H2O
不符合客观事实
H2 + O2
点燃
H2O2
配平
“平”:每一种元素的原子总数相等。
不能,因为改动化学式,就改变了物质,而不符合客观事实。
“配”:在式子左右两边的化学式前配上适当的化学计量数。
配平时能否改动化学式右下角的数字,为什么?
在化学方程式中有一种元素在多种物质中出现,且式子两边该元素的原子总数目为一奇一偶,这时就可以考虑用奇数配偶法。先变奇数为偶数,再观察配平。
化学方程式配平方法
奇数配偶法
先将H2O中氧原子变成偶数,在H2O前面配“2”,然后配平H原子,在H2前面配“2”,最后检查化学方程式是否配平。即
H2 + O2 → H2O
2H2 + O2 2H2O
点燃
2个O原子
1个O原子
最小公倍数法
P + O2 P2O5
点燃
P + O2 P2O5
点燃
4
最小公倍数:2×5=10
2O
P + O2 P2O5
点燃
5O
2
5
设1法
C2H2 + O2 CO2 + H2O
点燃
C2H2 + O2 CO2 + H2O
点燃
1
1
2
×2
×2
×2
×2
C2H2 + O2 CO2 + H2O
点燃
2
5
4
2
小结
描述反应的
客观事实
(1)反应物和生成物
(2)反应条件
(3)气体或沉淀符号
(4)配平
(5)检查
遵循
质量守恒定律
课堂练习
判断下列化学方程式的书写是否正确?若有误,请纠正。
1.红磷在氧气中燃烧
点燃
2.铁丝在氧气中燃烧
氧化铁
四氧化三铁
Fe + O2
点燃
Fe3O4
2
3
3.加热高锰酸钾制氧气
↑
K原子个数 1 2
Mn原子个数 1 1 1
O原子个数 4 4 2 2
KMnO4 K2MnO4 + MnO2 + O2 ↑
△
2
4.分解过氧化氢制氧气
↑
H2O2 H2O + O2
MnO2
H原子个数 2 2
O原子个数 2 1 2
2
2
书写化学方程式注意事项
1.反应物和生成物化学式书写正确。
2.反应条件要写准确。
3.气体和沉淀符号使用要正确。
4.注意配平时,不能改动化学式,只能调整化学式前的化学计量数。
小结
课堂练习
根据文字表达式书写化学方程式
2.氢氧化钠 + 硫酸铜 氢氧化铜 + 硫酸钠
1.铁 + 硫酸铜 铜 + 硫酸亚铁
Fe + CuSO4 Cu + FeSO4
↓
×
NaOH + CuSO4 Cu(OH)2 + Na2SO4
↓
符号“↑” 和“↓” 的使用
如果反应物和生成物中都有气体,气体生成物就不注“↑”。同理,溶液中的反应若反应物和生成物
中都有固体,固体生成物也不注“↓”。
如: S + O2 SO2
点燃
“无中生有”时使用
2
Na个数
OH个数
Cu个数
SO4个数
1 2
1 2
1 1
1 1
↓
NaOH + CuSO4 Cu(OH)2 + Na2SO4
课堂练习
书写陌生化学方程式
1. 火折子堪称古代“打火机”。简易的火折子是将纸卷点燃后,使其半灭(仅剩火星),装入竹筒中保存。需要点火时打开竹筒盖,向其中吹气,使纸复燃。火折子中含有火硝(KNO3),受热后可分解为氧气和亚硝酸钾(KNO2)。该反应的化学方程式为
KNO3 KNO2 + O2
↑
2
2
△
CO2 + H2 CH3OH + H2O
2.烟道气中含有大量CO2,经“捕捉”可用于生产尿素、甲醇(CH3OH)
等产品。用“捕捉”的CO2生产甲醇,反应的微观示意图如下,反应的化学方程式是
3
一定条件
书写陌生化学方程式的解题策略
小结
(1)反应物和生成物
(2)反应条件
(3)气体或沉淀符号
(4)配平
(5)检查
文字信息
图形信息
写
标
配
查
针对训练
1.下列化学方程式书写完全正确的是( )
A. 2S+3O2 2SO3
B. HgO Hg+O2↑
C. 2NaOH+H2SO4 ==== Na2SO4+2H2O
D. CuSO4+2NaOH ==== Na2SO4+Cu(OH)2
C
不符合客观事实
未配平
氢氧化铜是沉淀,无沉淀符号
课堂小结
化学方程式
客观事实
质量守恒
书写
原则
书写
步骤
写
标
配
查
观察法
最小公倍数法
奇数配偶法
设1法
……
化学变化
描 述
含义
体 现
随堂检测
1.根据化学方程式,不能获得的信息是( )
A.反应中的反应物和生成物
B.反应发生所需要的条件
C.化学反应的快慢
D.反应中各物质的质量关系
C
通过化学方程式,可得到的信息有①反应物、生成物和反应条件;②反应中各物质的质量关系;③反应中各粒子的数量关系。
2. 配平下列化学方程式:
(1) Al + Fe3O4 Fe + Al2O3
(2) Fe2O3 + H2 Fe + H2O
(3) Fe2O3 + CO Fe + CO2
3
4
8
9
2
3
3
2
3
3
最小公倍数法
设1法
观察法
3. (2021宜昌节选)化学发展史上,中国科学家取得了很多伟大成就。
(1)磷的最早发现者:西汉刘安在《淮南子》中写道:“老槐生火,久血为磷。”描写的是磷自燃,请写出磷(P4)自燃的化学方程式____________________。
(2)制碱工业先驱者:侯德榜发明了“侯氏联合制碱法”,其中一个反应是将碳酸氢钠煅烧生成碳酸钠、二氧化碳和水,该反应的化学方程式为____________________________________。
中华优秀传统文化
2NaHCO3 Na2CO3 + H2O + CO2↑
P4 + 5O2 2P2O5
4. A、B、C、D表示4种物质,其微观示意图见下表。
反应前 反应后
A B C D 已知:A和B在催化剂作用下反应可生成C和D。请写出该反应的化学方程式____________________________。
2CO + 2NO 2CO2 + N2
表示碳原子
表示氮原子
表示氧原子
九上 化学
科粤版
4.4.1 化学方程式的意义及书写
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
教学环节
1. 了解化学方程式的表示方法及意义
2. 能正确书写化学方程式,初步学会化学方程式的配平方法
3. 能提取信息,书写陌生化学方程式
学习目标
难点
重点
新课引入
衣
食
行
化学
化学
变化
住
如何用化学语言表示这些变化呢?
新知学习
回顾电解水实验
结合实验现象和对化学反应的认识,你能获取和分析得到关于反应的哪些信息?
水转化为氢气和氧气
条件:通电
现象:气泡
V(H2):V(O2) = 2:1
通过观察得到
基于对化学反应的认识分析得到
元素种类不变
分子种类改变
原子种类不变
原子数目不变
物质总质量不变
原子质量不变
元素质量不变
定性 定量
宏观
微观
元素种类不变
分子种类改变
原子种类不变
原子数目不变
水转化为氢气和氧气
条件:通电
现象:气泡
原子质量不变
物质总质量不变
V(H2):V(O2) = 2:1
元素质量不变
你能用哪些方法表示这个化学变化?
水 氢气 + 氧气
通电
H2O H2 + O2
通电
文字表达式
微观示意图
符号表达式
你认为哪种方法表达出的反应信息最多?
通电
通电
氧原子
氢原子
氧原子
氢原子
水 氢气 + 氧气
通电
水转化为氢气和氧气
条件:通电
文字表达式
通电
氧原子
氢原子
通电
氧原子
氢原子
元素种类不变
分子种类改变
原子种类不变
水转化为氢气和氧气
条件:通电
原子数目不变
原子质量不变
元素质量不变
微观示意图
H2O H2 + O2
通电
符号表达式
元素种类不变
分子种类改变
原子种类不变
水转化为氢气和氧气
条件:通电
原子质量不变
H2O H2 + O2
通电
符号表达式
通电
氧原子
氢原子
微观示意图
表达的信息最多
简洁明了
两者结合
H2O H2 + O2
通电
2
2
1
2
2
1
化学计量数:表示反应中分子个数比
氢原子
氧原子
通电
V(H2) : V(O2) = 2 : 1
2H2O 2H2 + O2
通电
资料卡片
在相同条件下,气体体积比等于分子个数比。
这个实验的现象是两极都有大量气泡产生,如何表示反应中有气体生成呢?
气体放出
气体符号
沉淀析出
沉淀符号
当生成物中有气体,而反应物中没有气体时,在气态生成物的化学式右边标“↑”。
溶液中的反应,生成物有难溶性固体,即沉淀,则需在该生成物的化学式右边标“↓”。
以客观事实为基础
2.遵守质量守恒定律
↑
↑
2H2O 2H2 + O2
通电
用化学式表示
化学反应的式子
化学方程式
化学式
元素符号
表示
化学反应
表示
物质组成
表示
元素
化学方程式
Ⅰ 什么是化学方程式
↑
↑
2H2O 2H2 + O2
通电
化学方程式的意义
定性:水在通电条件下生成氢气和氧气
定量:
微粒个数比
2 : 2 : 1
物质质量比
2n×18
2n×2
n×32
:
:
36 : 4 : 32
相对原子质量
H 1 O 16
定性 定量
宏观
微观
元素种类不变
分子种类改变
原子种类不变
原子数目、质量不变
水转化为氢气和氧气
条件:通电
现象:气泡
物质总质量不变
V(H2):V(O2) = 2:1
元素质量不变
分子个数比2:2:1
m(H2O):m(H2):m(O2) = 36:4:32
化学方程式的意义
表示反应物、生成物之间的粒子个数比
表示反应物、生成物和反应条件
质的方面
表示反应物和生成物间的质量比
量的方面
即化学式前面的化学计量数之比
各物质之间的质量比=相对分子质量(或相对原子质量)与化学计量数的乘积之比
归纳
反应物是氢气和氧气,生成物是水,反应条件是点燃
质的方面
量的方面
2H2 + O2 2H2O
粒子个数比 2 ︰ 1 ︰ 2
点燃
2H2 + O2 2H2O
质量比(2×2)︰(16×2)︰[2×(2+16)]
即 1 ︰ 8 ︰ 9
2H2 + O2 2H2O
点燃
点燃
小试牛刀
化学方程式的读法:
质的方面
量的方面
C +
O2 ======
点燃
CO2
(以 为例)
粒子方面:在点燃的条件下,每1个碳原子和1个氧分子反应生成1个二氧化碳分子
碳和氧气在点燃的条件下生成二氧化碳
质量方面:在点燃的条件下,每12份质量的碳和32份质量 的氧气恰好完全反应,生成44份质量的二氧化碳
化学变化
化学方程式
客观事实
质量守恒
描 述
书写原则
书写原则
含义
体 现
小结
针对训练
1. 关于化学反应方程式 的理解,正确的是( )
A.反应前后分子总数保持不变
B.该反应的反应物是五氧化二磷
C.每四份质量的磷和五份质量的氧气完全反应
D. 在点燃的条件下,磷和氧气反应生成五氧化二磷
D
4P +
5O2
2P2O5
磷和氧气
160
改变
124
复习回顾:木炭在氧气中燃烧
Ⅱ 怎样书写化学方程式
C + O2
CO2
判断生成物的依据是什么?
澄清石灰水变浑浊
木炭在氧气中燃烧
反应条件
是什么?
加热?
燃烧?
X
点燃
气体
气体
氢气和氧气反应生成水
点燃
H2 + O2
H2O
H原子个数 2 2
O原子个数 2 1
H2 + O2
点燃
H2O + O
不符合客观事实
氢气和氧气反应生成水
点燃
H2 + O2
H2O
氢气和氧气反应生成水
点燃
H2 + O2
H2O
不符合客观事实
H2 + O2
点燃
H2O2
配平
“平”:每一种元素的原子总数相等。
不能,因为改动化学式,就改变了物质,而不符合客观事实。
“配”:在式子左右两边的化学式前配上适当的化学计量数。
配平时能否改动化学式右下角的数字,为什么?
在化学方程式中有一种元素在多种物质中出现,且式子两边该元素的原子总数目为一奇一偶,这时就可以考虑用奇数配偶法。先变奇数为偶数,再观察配平。
化学方程式配平方法
奇数配偶法
先将H2O中氧原子变成偶数,在H2O前面配“2”,然后配平H原子,在H2前面配“2”,最后检查化学方程式是否配平。即
H2 + O2 → H2O
2H2 + O2 2H2O
点燃
2个O原子
1个O原子
最小公倍数法
P + O2 P2O5
点燃
P + O2 P2O5
点燃
4
最小公倍数:2×5=10
2O
P + O2 P2O5
点燃
5O
2
5
设1法
C2H2 + O2 CO2 + H2O
点燃
C2H2 + O2 CO2 + H2O
点燃
1
1
2
×2
×2
×2
×2
C2H2 + O2 CO2 + H2O
点燃
2
5
4
2
小结
描述反应的
客观事实
(1)反应物和生成物
(2)反应条件
(3)气体或沉淀符号
(4)配平
(5)检查
遵循
质量守恒定律
课堂练习
判断下列化学方程式的书写是否正确?若有误,请纠正。
1.红磷在氧气中燃烧
点燃
2.铁丝在氧气中燃烧
氧化铁
四氧化三铁
Fe + O2
点燃
Fe3O4
2
3
3.加热高锰酸钾制氧气
↑
K原子个数 1 2
Mn原子个数 1 1 1
O原子个数 4 4 2 2
KMnO4 K2MnO4 + MnO2 + O2 ↑
△
2
4.分解过氧化氢制氧气
↑
H2O2 H2O + O2
MnO2
H原子个数 2 2
O原子个数 2 1 2
2
2
书写化学方程式注意事项
1.反应物和生成物化学式书写正确。
2.反应条件要写准确。
3.气体和沉淀符号使用要正确。
4.注意配平时,不能改动化学式,只能调整化学式前的化学计量数。
小结
课堂练习
根据文字表达式书写化学方程式
2.氢氧化钠 + 硫酸铜 氢氧化铜 + 硫酸钠
1.铁 + 硫酸铜 铜 + 硫酸亚铁
Fe + CuSO4 Cu + FeSO4
↓
×
NaOH + CuSO4 Cu(OH)2 + Na2SO4
↓
符号“↑” 和“↓” 的使用
如果反应物和生成物中都有气体,气体生成物就不注“↑”。同理,溶液中的反应若反应物和生成物
中都有固体,固体生成物也不注“↓”。
如: S + O2 SO2
点燃
“无中生有”时使用
2
Na个数
OH个数
Cu个数
SO4个数
1 2
1 2
1 1
1 1
↓
NaOH + CuSO4 Cu(OH)2 + Na2SO4
课堂练习
书写陌生化学方程式
1. 火折子堪称古代“打火机”。简易的火折子是将纸卷点燃后,使其半灭(仅剩火星),装入竹筒中保存。需要点火时打开竹筒盖,向其中吹气,使纸复燃。火折子中含有火硝(KNO3),受热后可分解为氧气和亚硝酸钾(KNO2)。该反应的化学方程式为
KNO3 KNO2 + O2
↑
2
2
△
CO2 + H2 CH3OH + H2O
2.烟道气中含有大量CO2,经“捕捉”可用于生产尿素、甲醇(CH3OH)
等产品。用“捕捉”的CO2生产甲醇,反应的微观示意图如下,反应的化学方程式是
3
一定条件
书写陌生化学方程式的解题策略
小结
(1)反应物和生成物
(2)反应条件
(3)气体或沉淀符号
(4)配平
(5)检查
文字信息
图形信息
写
标
配
查
针对训练
1.下列化学方程式书写完全正确的是( )
A. 2S+3O2 2SO3
B. HgO Hg+O2↑
C. 2NaOH+H2SO4 ==== Na2SO4+2H2O
D. CuSO4+2NaOH ==== Na2SO4+Cu(OH)2
C
不符合客观事实
未配平
氢氧化铜是沉淀,无沉淀符号
课堂小结
化学方程式
客观事实
质量守恒
书写
原则
书写
步骤
写
标
配
查
观察法
最小公倍数法
奇数配偶法
设1法
……
化学变化
描 述
含义
体 现
随堂检测
1.根据化学方程式,不能获得的信息是( )
A.反应中的反应物和生成物
B.反应发生所需要的条件
C.化学反应的快慢
D.反应中各物质的质量关系
C
通过化学方程式,可得到的信息有①反应物、生成物和反应条件;②反应中各物质的质量关系;③反应中各粒子的数量关系。
2. 配平下列化学方程式:
(1) Al + Fe3O4 Fe + Al2O3
(2) Fe2O3 + H2 Fe + H2O
(3) Fe2O3 + CO Fe + CO2
3
4
8
9
2
3
3
2
3
3
最小公倍数法
设1法
观察法
3. (2021宜昌节选)化学发展史上,中国科学家取得了很多伟大成就。
(1)磷的最早发现者:西汉刘安在《淮南子》中写道:“老槐生火,久血为磷。”描写的是磷自燃,请写出磷(P4)自燃的化学方程式____________________。
(2)制碱工业先驱者:侯德榜发明了“侯氏联合制碱法”,其中一个反应是将碳酸氢钠煅烧生成碳酸钠、二氧化碳和水,该反应的化学方程式为____________________________________。
中华优秀传统文化
2NaHCO3 Na2CO3 + H2O + CO2↑
P4 + 5O2 2P2O5
4. A、B、C、D表示4种物质,其微观示意图见下表。
反应前 反应后
A B C D 已知:A和B在催化剂作用下反应可生成C和D。请写出该反应的化学方程式____________________________。
2CO + 2NO 2CO2 + N2
表示碳原子
表示氮原子
表示氧原子
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
