4.4.2根据化学方程式进行计算课件(共48张PPT)2023-2024学年度科粤版化学九年级上册
文档属性
| 名称 | 4.4.2根据化学方程式进行计算课件(共48张PPT)2023-2024学年度科粤版化学九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-22 00:00:00 | ||
图片预览







文档简介
(共48张PPT)
九上 化学
科粤版
4.4.2 根据化学方程式进行计算
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
教学环节
1.了解化学方程式计算的意义
2.初步掌握化学方程式的简单计算
3.掌握化学方程式计算的规范格式和解题方法
学习目标
难点
重点
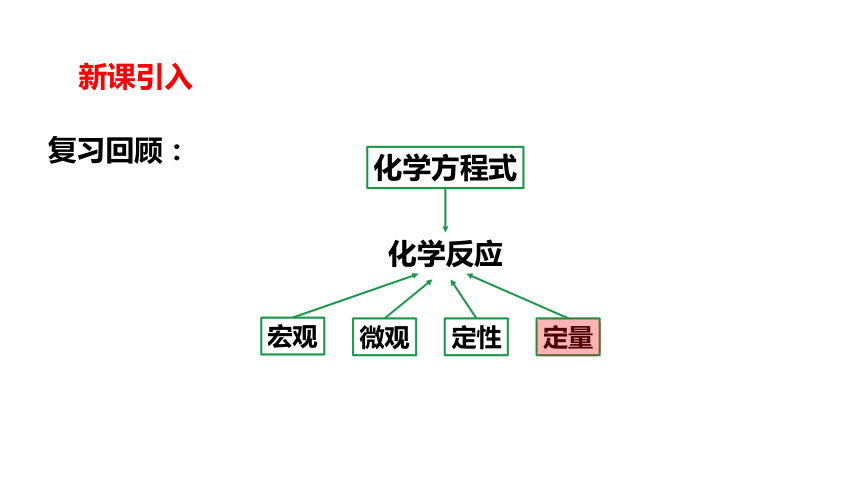
新课引入
化学反应
宏观
微观
定性
定量
化学方程式
复习回顾:
化学反应中的定量关系
微观
微粒个数比
物质质量比
2 2 1
2×18
2×2
1×32
36 ∶ 4 ∶ 32
9 ∶ 1 ∶ 8
宏观
∶
∶
∶
∶
H2O H2 + O2
通电
2
2
↑
↑
相对原子质量 H 1 O 16
复习回顾
练习1 测定空气中氧气含量实验中,为了使瓶内的氧气充分完全反应,应该加入足量的红磷。如何在实验开始前确认红磷是否足量?
应用质量比解决问题
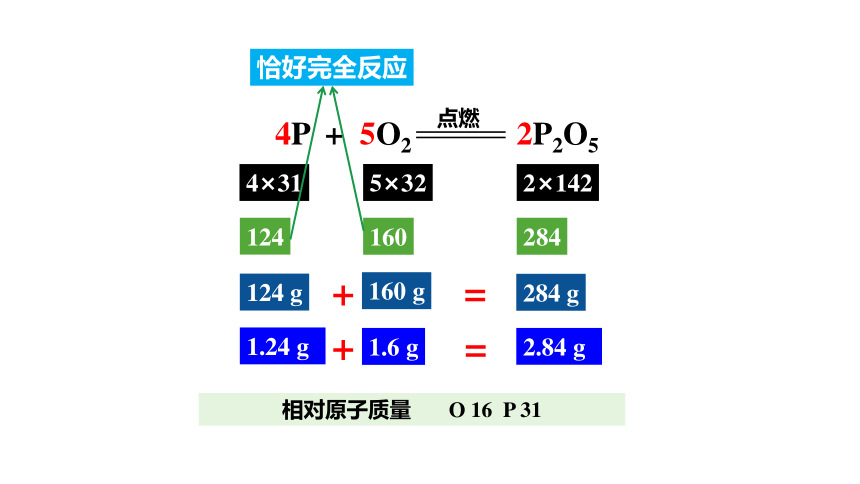
相对原子质量 O 16 P 31
新知学习
相对原子质量 O 16 P 31
4P + 5O2 2P2O5
点燃
4×31
5×32
124
160
1.6 g
1.24 g
恰好完全反应
2×142
284
124 g
160 g
2.84 g
284 g
+
+
=
=
1.寻找质量比的方法
已知任意某一物质质量,求出恰好完全反应时其他物质的质量
2.质量比的应用
化学方程式中,用化学计量数乘以相对分子质量
化学反应中的质量比
小结
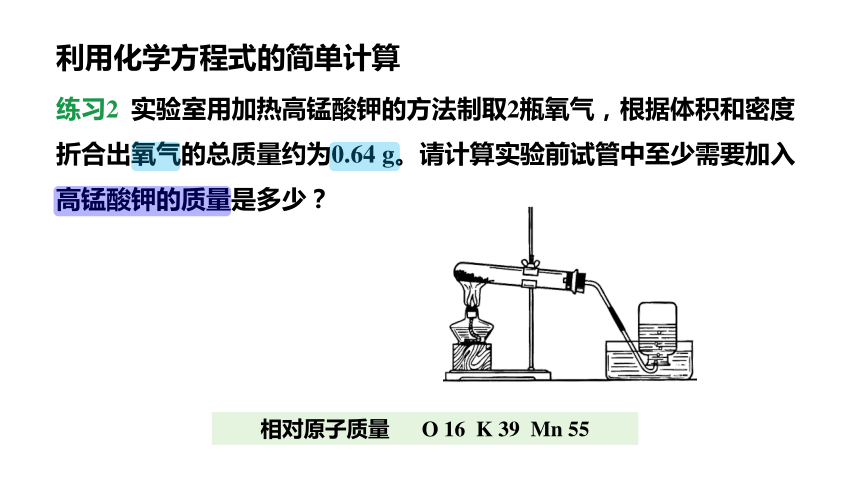
练习2 实验室用加热高锰酸钾的方法制取2瓶氧气,根据体积和密度折合出氧气的总质量约为0.64 g。请计算实验前试管中至少需要加入高锰酸钾的质量是多少?
利用化学方程式的简单计算
相对原子质量 O 16 K 39 Mn 55
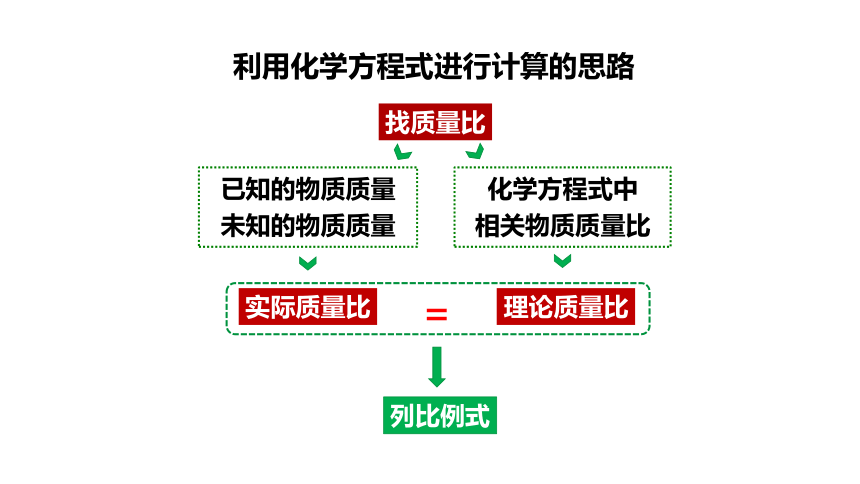
利用化学方程式进行计算的思路
实际质量比
找质量比
列比例式
化学方程式中
相关物质质量比
已知的物质质量
未知的物质质量
理论质量比
=
利用化学方程式的简单计算
相对原子质量 O 16 K 39 Mn 55
2KMnO4 K2MnO4 + MnO2 + O2
△
解:设需要高锰酸钾的质量为x。
↑
练习2
2×158
32
0.64 g
x
2×158
32
0.64 g
x
=
x = 6.32 g
答:至少需要加入6.32 g高锰酸钾。
设
写
列
解
答
理论质量比
实际质量比
练习3 若实验室用过氧化氢溶液制取2瓶氧气,根据体积和密度折合出氧气的总质量约为0.64 g。求反应中实际消耗的过氧化氢质量。
利用化学方程式的简单计算
相对原子质量 H 1 O 16
甲同学
相对原子质量 H 1 O 16
相对原子质量 H 1 O 16
乙同学
2×(2+32)
2×34
相对原子质量 H 1 O 16
先约分
后计算
丙同学
审题分析
找质量比
列比例式
解出未知
写出答案
设
写
列
解
答
小结
丙烷(C3H8)是液化石油气的主要成分之一,燃烧前后分子种类变化微观示意图如下。
根据图示回答:
已知反应物甲消耗的质量为22 kg,求反应中消耗乙的质量为 。
相对原子质量 H 1 C 12 O 16
例题1
氢原子
氧原子
碳原子
点燃
甲
乙
丙
丁
例题1
氢原子
氧原子
碳原子
点燃
甲
乙
丙
丁
丙烷(C3H8)是液化石油气的主要成分之一,燃烧前后分子种类变化微观示意图如下。
根据图示回答:
已知反应物甲消耗的质量为22 kg,求反应中消耗乙的质量为 。
例题1
该微观示意图并未定量显示出物质的微粒个数比
例题1
C3H8 + O2
点燃
CO2 + H2O
44 5×32
5
3
4
22 kg x
x = 80 kg
答:消耗乙的质量为80 kg。
解:设消耗乙的质量为x。
审题分析
找质量比
列比例式
解出未知
写出答案
设
写
列
解
答
注意
正确书写化学方程式
液氢是火箭升空的常用燃料。若火箭升空至少要携带100 kg液氢,充分燃烧才能获得足够的能量。试计算100 kg液氢完全燃烧后产生水的质量是多少?
例题2
相对原子质量 H 1 O 16
例题2
解法1
已知
未知
例题2
解法2
液氢质量
水中氢元素的质量
反应后
H元素质量
反应前
H元素质量
例题2
解法1
解法2
化学变化中存在的质量关系
参加化学反应的各物质的质量总和
= 反应后生成的各物质的质量总和
各物质之间存在固定的质量比
反应前后元素的质量守恒
质量关系
若火箭升空时携带了100 kg 液氢,火箭助燃仓中填充1000 kg 液氧。待充分反应后,求产生水的质量是多少?
例题3
相对原子质量 H 1 O 16
例题3
100 kg + 1000 kg = 1100 kg
例题2的计算结果
?
液氢质量并未增加,生成水的质量为什么增加了呢?问题出在哪里?
例题3
2H2 + O2 2H2O
点燃
2×2
32
100 kg
x = 800 kg
答:消耗液氧的质量为800 kg。
x
解:设消耗液氧的质量为x。
例题3
100 kg + 1000 kg = 1100 kg
800 kg
不能计算在内
200 kg
参加了反应
未参加反应
100 kg + 800 kg = 900 kg
经分析,参加反应的液氧质量为800 kg
例题3
2×2
100 kg
解:经分析,100 kg液氢全部参加了反应
2×18
x
x = 900 kg
答:生成水的质量为900 kg。
设生成水的质量为x。
2H2 + O2 2H2O
点燃
例题3
32
800 kg
解:经分析,800 kg液氧参加了反应
2×18
x
x = 900 kg
答:生成水的质量为900 kg。
设生成水的质量为x。
2H2 + O2 2H2O
点燃
审题分析
找质量比
列比例式
解出未知
写出答案
设
写
列
解
答
注意
正确书写化学方程式
选择数据
参加了反应/反应生成的物质质量
贝壳中含有大量碳酸钙,对废弃贝壳资源化利用的有效途径之一是高温煅烧贝壳,生产主要成分为氧化钙的建筑材料,发生反应的化学方程式是:
某工厂回收了200 t废弃贝壳,其中碳酸钙的质量分数是91%,则理论上可生产氧化钙的质量是多少?
例题4
CaCO3 CaO + CO2↑
相对原子质量 H 1 C 12 O 16 Ca 40
例题4
CaCO3 CaO + CO2↑
未知
已知
100
56
?
x
贝壳
91%
碳酸钙
9%
其他杂质
200 t
200 t×91%
200 t×91%
例题4
解:设生成氧化钙的质量为x。
x = 101.92 t
答:生成氧化钙的质量为101.92 t。
CaCO3 CaO + CO2↑
100
56
x
200 t×91%
审题分析
找质量比
列比例式
解出未知
写出答案
设
写
列
解
答
注意
正确书写化学方程式
选择数据
参加了反应/反应生成的物质质量
纯净物质量
课堂小结
审题分析
找质量比
列比例式
解出未知
写出答案
设
写
列
解
答
正确书写化学方程式
选择数据
参加了反应/反应生成的纯净物质量
1. 在反应2Mg+O2 2MgO中镁、氧气、氧化镁的质量比为( )
A.48:32:80
B.24:32:40
C.24:32:64
D.24:32:80
A
随堂检测
2. 2021年10月16号,神舟十三号搭载三名航天员成功发射。航天员在空间站内所需的氧气,一部分通过货运飞船或者补给飞船从地面运送上天,另一部分则在空间站上通过电解水来获取。请回答:
(1)工业上用分离液态空气的方法制取氧气,主要是利用了液氮、液氧的_____不同。
(2)用电解水制取96g氧气,理论上需要水的质量(写出计算过程)。
创新题 中国科技
沸点
解:设理论上需要水的质量为x
2H2O O2↑ + 2H2↑
36 32
x 96g
答:理论上需要水的质量为108g。
x = 108g
3. 测定空气中氧气含量的实验中,为了使瓶内的氧气完全反应,应该加入足量的红磷。若已知瓶内氧气体积约为44.8 mL,则实验前至少应在燃烧匙中加入红磷的质量是多少?计算结果保留一位小数。(已知常温常压下,氧气密度为1.429 g·L-1 )
解:根据质量 = 密度 × 体积得:
氧气质量 = 1.429 g·L-1 × 44.8×10-3 L
≈ 0.064g
设加入红磷的质量为x
4P + 5O2 2P2O5↑
124 160
x 0.064g
答:实验前至少应在燃烧匙中加入红磷的质量是0.0496g。
x = 0.0496g
4.加热27.5g氯酸钾和二氧化锰的混合物,剩余固体物质的质量随时间变化如图所示,求:
(1)制得氧气的质量;
(2)剩余固体物质中含有哪些物质 ?它们的质量各是多少?
固体质量/g
时间/min
t1
17.9
27.5
(1)解:由图可知,制得的氧气质量为27.5 g - 17.9 g = 9.6 g。
2KClO3 2KCl + 3O2↑
MnO2
(2)解:设生成氯化钾的量为x。
149
96
x
9.6g
=
x = 14.9 g
则MnO2的质量为17.9 g - 14.9 g = 3 g
答:剩余固体含有生成的氯化钾及二氧化锰,氯化钾质量为14.9g,二氧化锰质量为3g。
149
96
x
9.6g
5.实验室用加热KMnO4制取氧气,现将31.6g KMnO4放入大试管中进行加热,并在不同时刻测定试管内剩余固体的质量,质量变化如下表所示。
反应时间/min 1.0 2.0 3.0 4.0 5.0 6.0
剩余固体质量/g 30.8 30.0 29.2 28.4 28.4 m
根据图表回答:
(1)m 的值是多少?
(1)解:由表中数据可知,第5.0min时,剩余固体质量不发生改变,
则 m 的值为28.4。
反应时间/min 1.0 2.0 3.0 4.0 5.0 6.0
剩余固体质量/g 30.8 30.0 29.2 28.4 28.4 m
根据图表回答:
(2)充分反应后得到氧气的质量为多少?
(3)反应后得到MnO2的质量为多少?
(2)解:充分反应后得到氧气的质量为31.6g-28.4g=3.2g。
答:反应后得到 MnO2的质量为8.7g。
(3)解:设反应后得到 MnO2的质量为x。
32
3.2g
x
=
87
32
3.2g
x
x
=
8.7g
2KMnO4 K2MnO4+MnO2+O2↑
87
九上 化学
科粤版
4.4.2 根据化学方程式进行计算
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
教学环节
1.了解化学方程式计算的意义
2.初步掌握化学方程式的简单计算
3.掌握化学方程式计算的规范格式和解题方法
学习目标
难点
重点
新课引入
化学反应
宏观
微观
定性
定量
化学方程式
复习回顾:
化学反应中的定量关系
微观
微粒个数比
物质质量比
2 2 1
2×18
2×2
1×32
36 ∶ 4 ∶ 32
9 ∶ 1 ∶ 8
宏观
∶
∶
∶
∶
H2O H2 + O2
通电
2
2
↑
↑
相对原子质量 H 1 O 16
复习回顾
练习1 测定空气中氧气含量实验中,为了使瓶内的氧气充分完全反应,应该加入足量的红磷。如何在实验开始前确认红磷是否足量?
应用质量比解决问题
相对原子质量 O 16 P 31
新知学习
相对原子质量 O 16 P 31
4P + 5O2 2P2O5
点燃
4×31
5×32
124
160
1.6 g
1.24 g
恰好完全反应
2×142
284
124 g
160 g
2.84 g
284 g
+
+
=
=
1.寻找质量比的方法
已知任意某一物质质量,求出恰好完全反应时其他物质的质量
2.质量比的应用
化学方程式中,用化学计量数乘以相对分子质量
化学反应中的质量比
小结
练习2 实验室用加热高锰酸钾的方法制取2瓶氧气,根据体积和密度折合出氧气的总质量约为0.64 g。请计算实验前试管中至少需要加入高锰酸钾的质量是多少?
利用化学方程式的简单计算
相对原子质量 O 16 K 39 Mn 55
利用化学方程式进行计算的思路
实际质量比
找质量比
列比例式
化学方程式中
相关物质质量比
已知的物质质量
未知的物质质量
理论质量比
=
利用化学方程式的简单计算
相对原子质量 O 16 K 39 Mn 55
2KMnO4 K2MnO4 + MnO2 + O2
△
解:设需要高锰酸钾的质量为x。
↑
练习2
2×158
32
0.64 g
x
2×158
32
0.64 g
x
=
x = 6.32 g
答:至少需要加入6.32 g高锰酸钾。
设
写
列
解
答
理论质量比
实际质量比
练习3 若实验室用过氧化氢溶液制取2瓶氧气,根据体积和密度折合出氧气的总质量约为0.64 g。求反应中实际消耗的过氧化氢质量。
利用化学方程式的简单计算
相对原子质量 H 1 O 16
甲同学
相对原子质量 H 1 O 16
相对原子质量 H 1 O 16
乙同学
2×(2+32)
2×34
相对原子质量 H 1 O 16
先约分
后计算
丙同学
审题分析
找质量比
列比例式
解出未知
写出答案
设
写
列
解
答
小结
丙烷(C3H8)是液化石油气的主要成分之一,燃烧前后分子种类变化微观示意图如下。
根据图示回答:
已知反应物甲消耗的质量为22 kg,求反应中消耗乙的质量为 。
相对原子质量 H 1 C 12 O 16
例题1
氢原子
氧原子
碳原子
点燃
甲
乙
丙
丁
例题1
氢原子
氧原子
碳原子
点燃
甲
乙
丙
丁
丙烷(C3H8)是液化石油气的主要成分之一,燃烧前后分子种类变化微观示意图如下。
根据图示回答:
已知反应物甲消耗的质量为22 kg,求反应中消耗乙的质量为 。
例题1
该微观示意图并未定量显示出物质的微粒个数比
例题1
C3H8 + O2
点燃
CO2 + H2O
44 5×32
5
3
4
22 kg x
x = 80 kg
答:消耗乙的质量为80 kg。
解:设消耗乙的质量为x。
审题分析
找质量比
列比例式
解出未知
写出答案
设
写
列
解
答
注意
正确书写化学方程式
液氢是火箭升空的常用燃料。若火箭升空至少要携带100 kg液氢,充分燃烧才能获得足够的能量。试计算100 kg液氢完全燃烧后产生水的质量是多少?
例题2
相对原子质量 H 1 O 16
例题2
解法1
已知
未知
例题2
解法2
液氢质量
水中氢元素的质量
反应后
H元素质量
反应前
H元素质量
例题2
解法1
解法2
化学变化中存在的质量关系
参加化学反应的各物质的质量总和
= 反应后生成的各物质的质量总和
各物质之间存在固定的质量比
反应前后元素的质量守恒
质量关系
若火箭升空时携带了100 kg 液氢,火箭助燃仓中填充1000 kg 液氧。待充分反应后,求产生水的质量是多少?
例题3
相对原子质量 H 1 O 16
例题3
100 kg + 1000 kg = 1100 kg
例题2的计算结果
?
液氢质量并未增加,生成水的质量为什么增加了呢?问题出在哪里?
例题3
2H2 + O2 2H2O
点燃
2×2
32
100 kg
x = 800 kg
答:消耗液氧的质量为800 kg。
x
解:设消耗液氧的质量为x。
例题3
100 kg + 1000 kg = 1100 kg
800 kg
不能计算在内
200 kg
参加了反应
未参加反应
100 kg + 800 kg = 900 kg
经分析,参加反应的液氧质量为800 kg
例题3
2×2
100 kg
解:经分析,100 kg液氢全部参加了反应
2×18
x
x = 900 kg
答:生成水的质量为900 kg。
设生成水的质量为x。
2H2 + O2 2H2O
点燃
例题3
32
800 kg
解:经分析,800 kg液氧参加了反应
2×18
x
x = 900 kg
答:生成水的质量为900 kg。
设生成水的质量为x。
2H2 + O2 2H2O
点燃
审题分析
找质量比
列比例式
解出未知
写出答案
设
写
列
解
答
注意
正确书写化学方程式
选择数据
参加了反应/反应生成的物质质量
贝壳中含有大量碳酸钙,对废弃贝壳资源化利用的有效途径之一是高温煅烧贝壳,生产主要成分为氧化钙的建筑材料,发生反应的化学方程式是:
某工厂回收了200 t废弃贝壳,其中碳酸钙的质量分数是91%,则理论上可生产氧化钙的质量是多少?
例题4
CaCO3 CaO + CO2↑
相对原子质量 H 1 C 12 O 16 Ca 40
例题4
CaCO3 CaO + CO2↑
未知
已知
100
56
?
x
贝壳
91%
碳酸钙
9%
其他杂质
200 t
200 t×91%
200 t×91%
例题4
解:设生成氧化钙的质量为x。
x = 101.92 t
答:生成氧化钙的质量为101.92 t。
CaCO3 CaO + CO2↑
100
56
x
200 t×91%
审题分析
找质量比
列比例式
解出未知
写出答案
设
写
列
解
答
注意
正确书写化学方程式
选择数据
参加了反应/反应生成的物质质量
纯净物质量
课堂小结
审题分析
找质量比
列比例式
解出未知
写出答案
设
写
列
解
答
正确书写化学方程式
选择数据
参加了反应/反应生成的纯净物质量
1. 在反应2Mg+O2 2MgO中镁、氧气、氧化镁的质量比为( )
A.48:32:80
B.24:32:40
C.24:32:64
D.24:32:80
A
随堂检测
2. 2021年10月16号,神舟十三号搭载三名航天员成功发射。航天员在空间站内所需的氧气,一部分通过货运飞船或者补给飞船从地面运送上天,另一部分则在空间站上通过电解水来获取。请回答:
(1)工业上用分离液态空气的方法制取氧气,主要是利用了液氮、液氧的_____不同。
(2)用电解水制取96g氧气,理论上需要水的质量(写出计算过程)。
创新题 中国科技
沸点
解:设理论上需要水的质量为x
2H2O O2↑ + 2H2↑
36 32
x 96g
答:理论上需要水的质量为108g。
x = 108g
3. 测定空气中氧气含量的实验中,为了使瓶内的氧气完全反应,应该加入足量的红磷。若已知瓶内氧气体积约为44.8 mL,则实验前至少应在燃烧匙中加入红磷的质量是多少?计算结果保留一位小数。(已知常温常压下,氧气密度为1.429 g·L-1 )
解:根据质量 = 密度 × 体积得:
氧气质量 = 1.429 g·L-1 × 44.8×10-3 L
≈ 0.064g
设加入红磷的质量为x
4P + 5O2 2P2O5↑
124 160
x 0.064g
答:实验前至少应在燃烧匙中加入红磷的质量是0.0496g。
x = 0.0496g
4.加热27.5g氯酸钾和二氧化锰的混合物,剩余固体物质的质量随时间变化如图所示,求:
(1)制得氧气的质量;
(2)剩余固体物质中含有哪些物质 ?它们的质量各是多少?
固体质量/g
时间/min
t1
17.9
27.5
(1)解:由图可知,制得的氧气质量为27.5 g - 17.9 g = 9.6 g。
2KClO3 2KCl + 3O2↑
MnO2
(2)解:设生成氯化钾的量为x。
149
96
x
9.6g
=
x = 14.9 g
则MnO2的质量为17.9 g - 14.9 g = 3 g
答:剩余固体含有生成的氯化钾及二氧化锰,氯化钾质量为14.9g,二氧化锰质量为3g。
149
96
x
9.6g
5.实验室用加热KMnO4制取氧气,现将31.6g KMnO4放入大试管中进行加热,并在不同时刻测定试管内剩余固体的质量,质量变化如下表所示。
反应时间/min 1.0 2.0 3.0 4.0 5.0 6.0
剩余固体质量/g 30.8 30.0 29.2 28.4 28.4 m
根据图表回答:
(1)m 的值是多少?
(1)解:由表中数据可知,第5.0min时,剩余固体质量不发生改变,
则 m 的值为28.4。
反应时间/min 1.0 2.0 3.0 4.0 5.0 6.0
剩余固体质量/g 30.8 30.0 29.2 28.4 28.4 m
根据图表回答:
(2)充分反应后得到氧气的质量为多少?
(3)反应后得到MnO2的质量为多少?
(2)解:充分反应后得到氧气的质量为31.6g-28.4g=3.2g。
答:反应后得到 MnO2的质量为8.7g。
(3)解:设反应后得到 MnO2的质量为x。
32
3.2g
x
=
87
32
3.2g
x
x
=
8.7g
2KMnO4 K2MnO4+MnO2+O2↑
87
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
