第四章 化学反应与电能(含解析) 章末检测题 2023-2024学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 第四章 化学反应与电能(含解析) 章末检测题 2023-2024学年高二化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 897.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-22 20:22:41 | ||
图片预览




文档简介
第四章 化学反应与电能 章末检测题 2023-2024学年高二化学人教版(2019)选择性必修1
一、选择题
1.银锌电池是一种常见化学电源,其反应原理:,其工作示意图如下。下列说法错误的是( )
A.Zn电极是电源的负极
B.电池工作一段时间后,电极质量减轻
C.电解质溶液中的移向电极
D.Zn电极上发生的反应:
2.如图是以稀硫酸为电解质溶液的原电池装置,下列叙述正确的是( )
A.电解质溶液中的H+向铜极移动
B.铜片为负极,有气泡,发生还原反应
C.锌片为正极,质量不变,发生氧化反应
D.电子流动方向:锌极→导线→铜极→电解质溶液→锌极
3.原电池原理的发现和各种电池装置的发明,改变了人们的生活方式。下列关于如图所示原电池装置的说法不正确的是( )
A.化学能转化为电能的依据是:电流表指针偏转
B.Zn为原电池的负极
C.电子从Cu经导线流向Zn
D.Cu上的电极反应:2H++2e- = H2↑
4.如图为发光二极管连接柠檬电池装置,下列说法不正确的是( )
A.铁环作负极
B.电子由Fe环经导线流向发光二极管
C.负极的电极反应为:Fe-2e-=Fe2+
D.柠檬可替换成葡萄糖溶液
5.下列设备工作时,将化学能转化为电能的是( )
A.碱性锌锰干电池 B.燃气灶 C.砷化镓太阳电池 D.风力发电
A.A B.B C.C D.D
6.电解KCl和NaNO3溶液可以得到KNO3溶液,电解装置如图所示,下列说法正确的是( )
A.X为负极,F溶液为NaNO3溶液
B.电解一段时间,往Pt(I)附近滴入酚酞,溶液变红
C.电解的总反应为2H2O 2H2↑ + O2↑
D.理论上,当得到0.1molKNO3时,Pt(II)上生成标准状况下1.12L气体
7.关于二次电池铅蓄电池的说法中错误的是( )
A.在放电时,该电池的负极质量增加
B.在放电时,电池中硫酸的浓度减小
C.当两极物质都转化为PbSO4时,铅蓄电池将停止工作
D.在放电时,正极发生的反应是:Pb+ =PbSO4+2e-
8.我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示.下列说法错误的是( )
A.a极区 和 的浓度会影响 分解效率
B.能量转化方式主要为“光能→化学能→电能”
C.该装置的总反应为
D.为使电池持续放电,应选用质子交换膜
9.下图原电池装置中,用盐桥连接两烧杯中的电解质溶液。盐桥中阳、阴离子的电迁移率应尽可能地相近。(电迁移率用表示,单位:)。下列有关说法错误的是
阳离子 阴离子 已知:左、右烧杯中溶液体积相同
4.07 4.61
5.19 7.40
6.59 7.91
7.62 8.27
A.盐桥中的电解质可以为
B.盐桥中的阳离子进入右侧烧杯溶液中
C.电流计读数不变时,向右侧烧杯中加入硫酸铁固体,指针会继续偏转
D.电池反应一段时间后,测得左侧溶液中增加了,则右侧溶液中为
10.利用如图装置进行实验(U形管为耐压试管),开始时,a、b两处液面相平,密封好,放置一段时间。下列说法错误的是( )
A.铁丝的腐蚀速率:
B.一段时间后,a管液面高于b管液面
C.a管溶液的增大,b管溶液的减小
D.a、b两管中发生相同的电极反应为
11.我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:
3CO2+4Na 2Na2CO3+C。下列说法错误的是( )
A.放电时, 向负极移动
B.充电时,负载碳纳米管的镍网上发生氧化反应
C.放电时,正极反应为:3CO2+4e-=2 +C
D.充电时,正极反应为:Na++e-=Na
12.有机物电化学合成是化学研究的重要方向。下图所示电解装置可以生成葡萄糖酸C6H12O7)和山梨醇(C6H14O6)。葡萄糖酸再与CaCO3反应可以生产补钙剂葡萄糖酸钙。
下列说法错误的是( )
A.a为电源正极,a连接的惰性电极发生反应为:2Br--2e-=Br2
B.在电解质溶液1中,葡萄糖被HBrO还原成葡萄糖酸
C.阳极区的H+通过阳离子交换膜向阴极区移动
D.阴极反应为:C6H12O6+2H++2e-=C6H14O6
二、非选择题
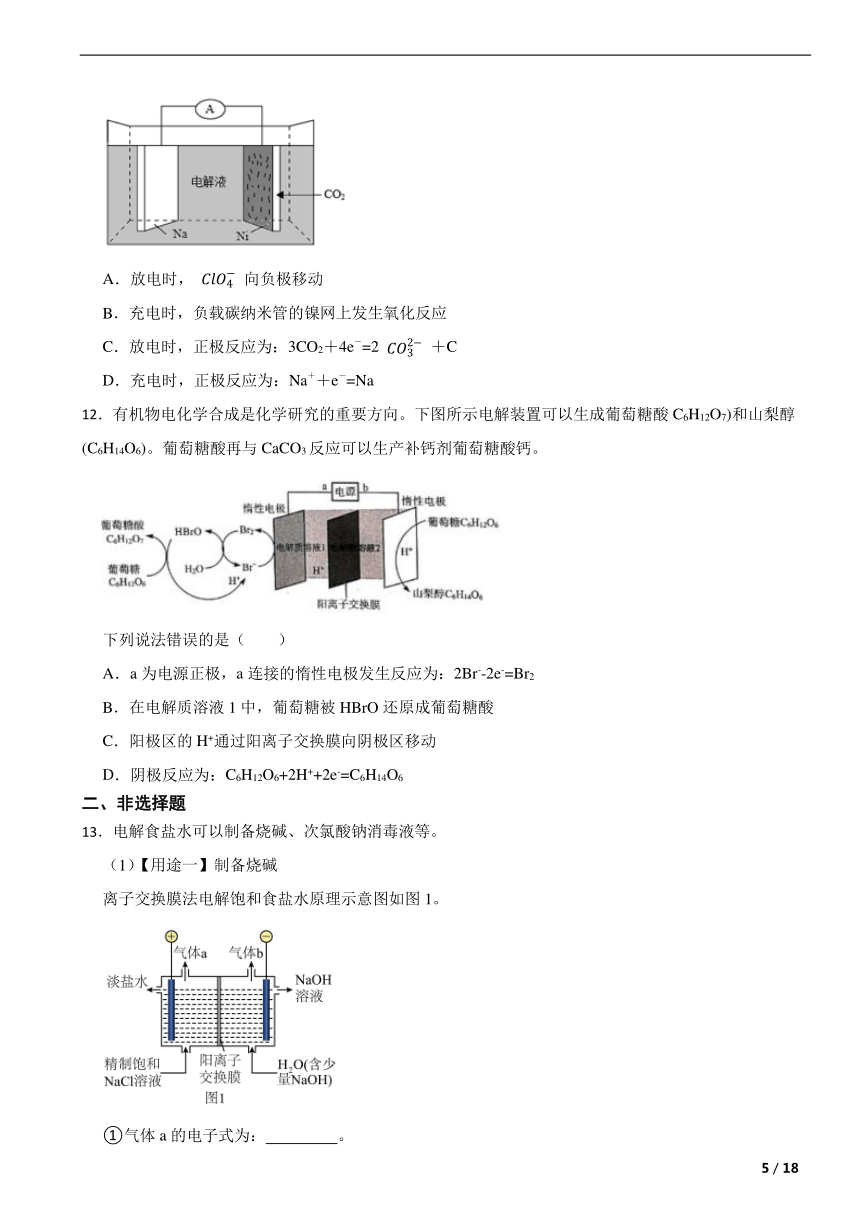
13.电解食盐水可以制备烧碱、次氯酸钠消毒液等。
(1)【用途一】制备烧碱
离子交换膜法电解饱和食盐水原理示意图如图1。
①气体a的电子式为: 。
②结合电极反应式解释阴极区得到溶液的原因 。
(2)【用途二】制备次氯酸钠溶液
采用无隔膜电解槽,电解3%~5%的溶液,可制备溶液。控制较低温度,适宜电压电解制备溶液原理示意图如图2。
已知:与次氯酸盐相比,次氯酸具有更强的氧化性。
电解食盐水制备溶液总反应的化学方程式为 。
(3)研究发现,电解制备溶液时,中性溶液为宜,若初始过高()或过低()都会降低的浓度。分析可能原因:
①过高,阳极会发生放电,导致电解效率降低,电极反应为 。
②过低,产生影响的可能原因:
假设过低时,导致溶解度 ,生成的减少。
假设过低时,浓度增大氧化,生成和。
I.查阅文献,假设b成立。相应反应的离子方程式为 。
Ⅱ.若通过检测反应前后溶液酸性的变化证实假设b成立,实验操作和现象为:取溶液, 。可供选择的试剂和仪器:a.稀硫酸| b.稀盐酸| c.石蕊溶液 d.计
14.习近平总书记在科学家座谈会上指出“好奇心是人的天性,对科学兴趣的引导和培养要从娃娃抓起”。某化学兴趣小组为培养同学们对科学探究的兴趣,设计图1所示实验来探究 与Cu2+的反应:
已知:氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水
回答下列问题:
(1)若用CuSO4·5H2O配制100 mL 1 mol/LCuSO4溶液,需用托盘天平称取CuSO4·5H2O的质量为 。甲同学在定容时采用上图2方式观察,则所配制的CuSO4溶液浓度 (填“偏高”或“偏低”)。
(2)将操作2后生成的无色气体通入氯化铁溶液, (填实验现象),说明该气体为SO2,反应的离子方程式为 。
(3)操作2后生成的白色沉淀为 (填化学式),生成该沉淀和无色气体的反应离子方程式为 。
(4)根据氧化还原反应的规律,乙同学推测操作2中涉及 与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于 ,用图3装置(a、b均为石墨电极)进行实验验证。
①K闭合时,一段时间后指针几乎归零。
②向U型管右管添加 ,a电极为 极,产生的现象证实了其推测,其中不同于图1操作2后的现象是 。
(5)基于(4)实验,乙同学得出进一步猜想:物质的氧化性和还原性与 有关。该同学用图3装置再次进行实验,以丰富验证该猜想的证据。与(4)实验对比,不同的操作是向U型管左管添加 。
15.利用电化学方法可以将有效地转化为(其中C元素的化合价为价),装置如图1所示。
(1)在该装置中,左侧电极为 (填“阴极”或“阳极”)。
(2)装置工作时,阴极除有生成外,还可能生成副产物降低电解效率。
已知:电解效率
①副产物可能是 (写出一种即可)。
②标准状况下,当阳极生成氧气体积为时,测得整个阴极区内的,电解效率为 (忽略电解前后溶液的体积变化)。
(3)研究表明,溶液会影响转化为的效率。如图2是 (以计)在水溶液中各种存在形式的物质的量分数随变化的情况。
①时,几乎未转化为,此时在溶液中的主要存在形式为 。
②时,的转化效率较高,溶液中相应的电极反应式为 。
16.CO2是廉价的碳资源,将其甲烷化具有重要意义。
热化学转化法:原理为CO2(g)+4H2(g) CH4(g)+2H2O(g)△H
(1)每生成0.4mol CH4(g),放出66kJ的热量。则△H= ;
(2)其他条件不变,压强对CO2的转化率及CH4的选择性的影响如图所示。CH4的选择性= ×100%,CO2甲烷化反应选择0.1MPa (1个大气压)而不选择更高压强的原因是 。
电化学转化法:在多晶Cu催化下,电解CO2制备CH4的原理如图所示。
(3)铂电极上产生的气体为 (填化学式);
(4)电解结束时阴、阳极室的KHCO3溶液的浓度基本保持不变。在电解过程中, 移向 (填“阴”或“阳” )极室。写出阴极的电极反应式 ;
(5)电解过程中应持续通入CO2,同时温度应控制在10℃左右,使CO2优先于H+在电极上发生反应。该电解过程不在室温下进行的原因是 。
答案解析部分
1.【答案】D
【解析】【解答】A.由分析可知,Zn电极是电源的负极,故A不符合题意;
B.电极反应为,故电池工作一段时间后,质量减轻,故B不符合题意;
C.原电池中阳离子向正极运动,电解质溶液中的移向电极,故C不符合题意;
D.锌电极上发生的反应生成氢氧化锌:,故D符合题意;
故答案为:D。
【分析】新型电池的判断:
1、化合价升高的为负极,失去电子,化合价降低的为正极,得到电子;
2、电极反应式的书写要注意,负极反应为负极材料失去电子化合价升高,正极反应为正极材料得到电子化合价降低,且要根据电解质溶液的酸碱性判断,酸性溶液不能出现氢氧根,碱性溶液不能出现氢离子,且电极反应式要满足原子守恒。
2.【答案】A
【解析】【解答】A. 以稀硫酸为电解质溶液的原电池装置,锌做负极,铜做正极,电解质溶液中的H+向铜极移动,得电子生成氢气,故A符合题意;
B. 铜片为正极,有气泡,发生还原反应,故B不符合题意;
C. 锌片为负极,失电子发生氧化反应,质量减小,故C不符合题意;
D.锌做负极,铜做正极,所以电子流动方向:锌极→导线→铜极,不经过电解质溶液,故D不符合题意;
故答案为:A
【分析】原电池口诀,溶液中阴阳离子流向为:“阳正阴负”;电子流向为:负极流向正极,同时电子不通过电解质溶液,即“电子不下水,离子不上岸”
3.【答案】C
【解析】【解答】A.原电池就是将化学能转化为电能,电流表内指针偏转则证明由电流通过,A正确;
B.由分析可知,Zn为原电池的负极 ,B正确;
C.导线内:电子流向为电子:负极向正极,C错误;
D.正极:H化合价降低,得到电子,发生还原反应,电极反应为: 2H++2e-=H2↑,D正确。
故答案为:C。
【分析】本题主要考查原电池的原理和应用。
首先分析该原电池装置。
电极:Cu极和Zn极,电解质溶液:稀硫酸,形成闭合回路。活泼型抢的金属做负极。所以负极为Zn极,正极为Cu极。
负极:Zn化合价升高,失去电子,发生氧化反应,电极反应为:Zn-2e-=Zn2+;
正极:H化合价降低,得到电子,发生还原反应,电极反应为: 2H++2e-=H2↑。
原电池电极判断:
负极:电子流出的一极;化合价升高的一极;发生氧化反应的一极;活泼性相对较强金属的一极;
正极:电子流入的一极;化合价降低的一极;发生还原反应的一极;相对不活泼的金属或其它导体的一极;
阳极:发生氧化反应的电极;
阴极:发生还原反应的电极;
电子流向判断:
在原电池中,外电路为电子导电,电解质溶液中为离子导电。
阳离子向正极移动;阴离子向负极移动。
电流:正极向负极
电子:负极向正极
4.【答案】D
【解析】【解答】A.铁比铜活泼,故铁做负极,A不符合题意
B.电子由导线从负极流向正极,B不符合题意
C.负极的反应为 Fe-2e-=Fe2+ ,故C不符合题意
D.葡萄糖为非电解质,不能替换,故D符合题意
故答案为:D
【分析】原电池必须要有电解质溶液。
5.【答案】A
【解析】【解答】A.碱性锌锰干电池主要将化学能转化为电能,故A符合题意;
B.燃气灶通过燃料燃烧,主要将化学能转化为热能,故B不符合题意;
C.砷化镓太阳电池将太阳能转化为电能,故C不符合题意;
D.风力发电将风能转化为电能,故D不符合题意。
故答案为:A。
【分析】将化学能转化为电能的装置为原电池装置,结合选项所给设备进行分析即可。
6.【答案】D
【解析】【解答】A.由上述分析可知E为氯化钾溶液,氯离子在阳极Pt片(I)发生氧化反应,Pt片(I)为阳极,则X为正极,故A不符合题意;
B.氯离子在Pt片(I)发生氧化反应生成氯气逸出,水电离产生的氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,则Pt片(Ⅱ)附近氢氧根离子浓度大于氢离子浓度,显碱性,加入酚酞溶液显红色,故B不符合题意;
C.阴极为氯离子放电,阳极为氢离子放电,氯离子在Pt片(I)阳极发生氧化反应失去电子生成氯气,阴极氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,电解方程式为:H2O+2KCl 2KOH+H2↑+Cl2↑,故C不符合题意;
D.当得到0.1molKNO3时,则有0.1mol钾离子透过阳离子交换膜,则转移0.1mol电子,阳极电极反应式:2Cl--2e-=Cl2↑,转移0.1mol电子生成0.05mol氯气,标况下体积为0.05mol×22.4L/mol=1.12L,故D符合题意;
故答案为:D。
【分析】电解KCl和NaNO3溶液可以得到KNO3溶液,依据图中硝酸钾的出口,结合B为阳离子交换膜可知,E为氯化钾溶液,F为硝酸钠溶液,阴极上氯离子放电,阳极为氢离子放电,氯离子在阳极Pt片(I)上发生氧化反应失去电子生成氯气,氢离子在阴极Pt片(Ⅱ)上得到电子发生还原反应生成氢气,据此分析解答。
7.【答案】D
【解析】【解答】A.放电时,负极发生的反应为Pb-2e+SO42-=PbSO4,质量增加,故A不符合题意;
B.放电时消耗硫酸,导致浓度降低,故B不符合题意;
C.正极和负极产物均得到硫酸铅,当两电极均是硫酸铅时,停止工作,故C不符合题意;
D.放电时正极是PbO2+2e+4H++SO42-=2H2O+PbSO4,故D符合题意;
故答案为:D
【分析】根据铅蓄电池总反应是Pb+PbO2+2H2SO4=2H2O+2PbSO4,负极:Pb-2e+SO42-=PbSO4,正极:PbO2+2e+4H++SO42-=2H2O+PbSO4,结合选项即可判断。
8.【答案】B
【解析】【解答】A.负极区利用氧化性强的铁离子捕获H2S得到S,三价铁离子为催化剂,铁离子和亚铁离子的浓度会影响硫化氢分解效率,A项不符合题意;
B.该制氢工艺中光能转化为电能,最终转化为化学能,B项符合题意;
C.该装置发生的有关反应为 、 、 ,这三个反应相加,结合反应条件得到总反应为 ,C项不符合题意;
D.氢离子由a极区产生通过交换膜流动到b极,故为使电池持续放电,应选用质子交换膜,D项不符合题意;
故答案为:B。
【分析】A.根据a区的反应流程即可判断铁离子将硫化氢氧化为硫单质,因此铁离子浓度影响硫化氢的分解效率
B.根据反应的流程是光能转化为电能,电能转化为化学能
C.根据发生的反应即可写出总的反应
D.根据a极可以产生质子而b极消耗质子因此可以加入质子交换膜实现持续放电
9.【答案】A
【解析】【解答】A.在盐桥中,为维持两个烧杯中溶液的电荷平衡,两个盐桥中阴阳离子的迁移率应尽可能接近,由表格可知,钾离子和氯离子以及硝酸根离子的迁移率最接近,硫酸亚铁和硫酸铁由于水解会显酸性,硝酸根离子在酸性条件下具有强氧化性,可将电解质溶液中的亚铁离子氧化,所以应选择氯化钾作为电解质,A符合题意;
B.电流表显示电子由铁电极流向石墨电极,则铁电极为负极,石墨电极为正极,盐桥中阳离子向正极移动,则盐桥中的阳离子进入石墨电极溶液中,B不符合题意;
C.电流计读数不变时,说明右侧三价铁反应完,此时向右侧烧杯中加入硫酸铁固体,则三价铁可以继续参与反应,指针会继续偏转,C不符合题意;
D.铁电极发生的反应为:Fe-2e-=Fe2+,石墨电极发生的反应为:2Fe3++2e-=2Fe2+,当铁电极溶液中c(Fe2+)增加了0.01 mol·L 1时,由电极反应可知,转移的电子的物质的量浓度为0.02 mol·L 1,根据石墨电极的电极反应可计算得出石墨电极增加的c(Fe2+)为0.02 mol·L 1,原溶液中c(Fe2+)为0.05 mol·L 1,所以反应后c(Fe2+)=0.02 mol·L 1+0.05 mol·L 1=0.07 mol·L 1,D不符合题意;
故答案为:A。
【分析】A.在盐桥中,为维持两个烧杯中溶液的电荷平衡,两个盐桥中阴阳离子的迁移率应尽可能接近,由表格可知,钾离子和氯离子以及硝酸根离子的迁移率最接近,但硝酸根离子在酸性条件下具有强氧化性,会氧化亚铁离子;
B.阴离子向负极移动,阳离子向正极定向移动;
C.依据平衡移动原理分析;
D.闭合电路中,转移离子所带电荷总数等于转移的电子总数。
10.【答案】C
【解析】【解答】A.a管电解质溶液为中性,发生吸氧腐蚀,b管电解质溶液为稀硫酸,发生析氢腐蚀,氢离子浓度大,所以腐蚀速率,A不符合题意;
B.a发生吸氧腐蚀,吸收氧气,气体体积会减少,b发生析氢腐蚀,产生氢气气体体积会变大,所以一段时间后,a管液面高于b管液面,B不符合题意;
C.a中产生OH-,pH会变大,b中消耗氢离子,pH也会变大,C符合题意;
D.金属的腐蚀,都是金属做负极,失去电子发生氧化反应,所以,a、b两管中负极的电极反应均为,D不符合题意;
故答案为:C。
【分析】A、稀硫酸和铁反应的速率更快;
B、a中氧气变少,b中氢气增大,由于压强影响a液面更高;
C、a中发生吸氧腐蚀生成氢氧根,b中发生析氢腐蚀消耗氢离子;
D、铁作为负极,失去电子形成亚铁离子。
11.【答案】D
【解析】【解答】A.放电时为原电池装置,阴离子向负极移动,故A不符合题意;
B.放电时Ni网上CO2被还原,则充电时镍网上发生氧化反应,故B不符合题意;
C.放电时,CO2在Ni电极上被还原,为正极,根据总反应可知电极反应为3CO2+4e-=2 +C,故C不符合题意;
D.充电时为电解池,电解池没有正负极,而是阴阳极,原放电时的正极为电解池的阳极,碳被氧化生成CO2,故D符合题意;
故答案为:D。
【分析】根据总反应可知放电时Na被氧化,作负极,CO2被还原,所以Ni电极为正极。
12.【答案】B
【解析】【解答】A.根据上述分析,a为电源正极,发生氧化反应,a连接的惰性电极发生的反应为:2Br--2e-=Br2,故A不符合题意;
B.根据图示,在电解质溶液1中,HBrO被还原为Br-,则葡萄糖被HBrO氧化成葡萄糖酸,故B符合题意;
C.在电解池中,阳极区的H+通过阳离子交换膜向阴极区移动,故C不符合题意;
D.阴极上C6H12O6得到电子生成C6H14O6,发生还原反应,电极反应为C6H12O6+2H++2e-=C6H14O6,故D不符合题意;
故答案为:B。
【分析】根据图示,在与电源a极相连电极上Br-失去电子生成Br2,发生氧化反应,则该电极为阳极,在与电源b极相连电极上C6H12O6得到电子生成C6H14O6,发生还原反应,则该电极为阴极,因此a为电源正极,b为电源负极,据此分析解答。
13.【答案】(1);在阴极区水得电子生成氢气和氢氧根,电极反应为: ,钠离子通过阳离子交换膜迁移到阴极区,故在阴极区生成NaOH溶液
(2)
(3);减小;;取NaClO溶液,用pH计分别测量初始溶液和滴入适量稀硫酸后溶液的pH值,若开始时溶液的pH值大于7,滴入适量的稀硫酸后,溶液的pH值小于7,则假设成立
【解析】【解答】(1)根据分析,气体a为Cl2,电子式为:;在阴极区水得电子生成氢气和氢氧根,电极反应为:,钠离子通过阳离子交换膜迁移到阴极区,故在阴极区生成NaOH溶液;
(2)根据分析,电解食盐水制备溶液总反应的化学方程式为:;
(3)①过高,阳极会发生放电,导致电解效率降低,电极反应为:;
②过低,产生影响的可能原因:
假设过低时,溶液中氢离子浓度大,氯气与水的反应受到抑制,导致溶解度减小,生成的减少;
假设过低时,浓度增大氧化,生成和,根据氧化还原反应配平,离子反应为:;
NaClO溶液显碱性,且具有强氧化性,不能向其中加入稀盐酸,会发生氧化还原反应生成氯气,降低pH值只能选用稀硫酸。先用pH计测得溶液的pH值大于7,滴入适量的稀硫酸后,部分次氯酸钠与硫酸反应生成次氯酸,次氯酸与次氯酸根发生氧化还原反应生成氯离子、氯酸根和氢离子,溶液酸性增强,pH计测得溶液的pH值小于7,则假设成立。故取NaClO溶液,用pH计分别测量初始溶液和滴入适量稀硫酸后溶液的pH值,若开始时溶液的pH值大于7,滴入适量的稀硫酸后,溶液的pH值小于7,则假设成立。
【分析】(1)根据放电顺序和电极产物分析;
(2)根据电解反应物和产物分析;
(3)①过高,阳极会发生放电;
②氯气与水的反应是可逆反应;根据反应物和生成物的化学式,利用原子守恒、得失电子守恒、电荷守恒分析;依据中和反应和实验室制氯气的原理设计。
14.【答案】(1)25.0 g;偏低
(2)溶液由黄色变浅绿色(或黄色变浅);
(3)CuCl;
(4)KCl固体;负极;指针偏转
(5)浓度;BaCl2固体(或其他合理答案)
【解析】【解答】(1)在100 mL 1 mol/LCuSO4溶液中含有溶质CuSO4的物质的量n(CuSO4)=1 mol/L×0.1 L=0.1 mol,根据Cu元素守恒,可知需CuSO4·5H2O的质量m(CuSO4·5H2O)=0.1 mol×250 g/mol=25.0 g;
若在配制溶液定容时仰视刻度线,则容量瓶中凹液面最低处高于刻度线,溶液体积偏大,由于溶质的物质的量不变,根据物质的量浓度定义式可知配制的溶液的浓度偏低;
(2)向KHSO3溶液中加入CuSO4溶液,溶液显蓝色,无其它明显变化,然后加入KCl固体,反应产生白色沉淀和无色气体,Cu2+得到电子被还原为Cu+,Cu+与溶液中的Cl-结合白色沉淀是CuCl,则 失去电子被氧化为 ,同时产生H+,H+与溶液中的 反应产生SO2气体。SO2具有还原性,与FeCl3溶液发生氧化还原反应,产生H2SO4、HCl、FeCl2,使溶液由红色变为浅绿色,该反应的离子方程式为: ;
(3)根据(2)分析可知生成的白色沉淀是CuCl,则生成该沉淀和无色气体的离子方程式为: ;
(4)若是由于外加Cl-导致Cu+的还原性弱于 ,可根据如图装置验证:当一段时间后指针归零后,向U型管右管添加加入KCl固体,此时溶液中Cl-浓度增大,若a为负极,电流表指针发生偏转,同时看到左侧电极有气体产生,右侧电极附近有白色沉淀产生,就可证实其推测;
(5)基于(4)实验,乙同学得出进一步猜想:物质的氧化性和还原性与物质的浓度有关。
若 反应产生 ,则反应后向左侧溶液中加入含有Ba2+的物质,应该产生BaSO4白色沉淀,而 与Ba2+不能发生反应。故该同学用图3装置再次进行实验,以丰富验证该猜想的证据。与(4)实验对比,不同的操作是可以向U型管左管添加BaCl2固体。
【分析】(1)根据m=计算即可,定容时仰视读数,导致体积偏大,浓度偏低
(2)二氧化硫具有还原性,而铁离子具有氧化性,发生氧化还原反应变色,因此黄色变为浅绿色,根据氧化还原反应即可写出离子方程式
(3)根据题意加入氯化钾后产生沉淀,而氯化亚铜是白色固体难溶于水,根据反应物和生成物即可写出方程式
(4)根据题意 外加Cl-导致Cu+的还原性弱于 ,因此引入氯离子即可进行实验,因此亚硫酸氢根做负极,a为负极,形成原电池,导致指针偏转
(5)浓硝酸和稀硝酸的氧化性不同,且浓度大氧化性强,因此可以考虑物质的氧化性与浓度有关,增加氯离子的浓度即可
15.【答案】(1)阳极
(2)H2 (或CO等其它合理答案);85%
(3)CO;2O + HCO+2e-= HCOO- + 2OH- (或3HCO+ 2e- = HCOO- + 2CO+ H2O)
【解析】【解答】(1)右侧通入CO2,得电子被还原生成HCOO-,所以右侧Pt电极为阴极,则左侧Pt电极为阳极;
(2)①右侧Pt电极即阴极上的副产物会降低电解效率,阴极上CO2被还原,其还原产物还可能为CO或其他低价态的C元素,会降低效率,或者溶液中水电离出的氢离子被还原生成H2也会降低电解效率;
②阳极水电离出氢氧根放电生成氧气,电解反应式2H2O – 4e- = O2 + 4H+,标况下224mL氧气的物质的量为=0.01mol,转移0.04mol电子,1个CO2转化为HCOO-转移2个电子,所以电解效率为=85%;
(3)①据图可知当pH>12时,CO2在溶液中的主要存在形式为CO;
②据图可知当pH=8.5时,CO2在溶液中的主要存在形式为HCO,HCO得电子被还原成HCOO-,电解反应式为H2O + HCO+2e-= HCOO- + 2OH- (或3HCO+ 2e- = HCOO- + 2CO+ H2O)。
【分析】(1)反应中元素化合价升高,做阳极,元素化合价降低,为阴极;
(2)①考虑发生副反应;
②依据得失电子守恒;
(3)①根据图像分析;
②根据图像,利用反应物和产物的化学式书写。
16.【答案】(1)-165kJ/mol
(2)在0.1MPa,CO2的转化率及CH4的选择性较高,加压CO2的转化率及CH4的选择性变化不大,且加压会增大投资和能耗
(3)CO2、O2
(4)阳;9CO2+8e-+6H2O=CH4+8
(5)温度太高,不利于CO2的溶解
【解析】【解答】(1)反应发生CO2(g)+4H2(g) CH4(g)+2H2O(g),若生成0.4mol CH4(g),放出66kJ的热量则产生1 mol甲烷气体时,放出热量为Q= 66kJ× =165kJ,故该反应的反应热△H=-165kJ/mol;
(2)在0.1MPa,CO2的转化率及CH4的选择性较高,加压CO2的转化率及CH4的选择性变化不大,且加压会增大投资和能耗,因此选择条件是0.1MPa;
(3)Pt电极为阳极,在阳极上溶液中水电离产生的OH-失去电子,发生氧化反应产生O2,OH-放电,破坏了附近水的电离平衡,产生H+,使附近溶液中c(H+)增大,H+与附近溶液中的 反应产生CO2气体,故铂电极上产生的气体为CO2、O2;
(4)采用电化学转化法,在多晶Cu催化下,电解CO2制备CH4时,多晶Cu为阴极,CO2得到电子变为CH4,结合电解质溶液成分,可知阴极的电极反应式为:9CO2+8e-+6H2O=CH4+8 ;
(5)电解过程中应持续通入CO2,同时温度应控制在10℃左右,使CO2优先于H+在电极上发生反应。该电解过程不在室温下进行的原因是因为温度升高,CO2在溶液中的溶解度会降低,不利于CO2的溶解及发生还原反应。
【分析】(1)根据反应放出的热量与反应的物质呈正比计算;
(2)在0.1MPa,CO2的转化率及CH4的选择性较高,加压CO2的转化率及CH4的选择性变化不大;
(3)多晶Cu作阴极,CO2得到电子变为CH4逸出;铂电极为阳极,溶液中OH-失去电子变为O2,反应产生的H+与HCO3-反应产生CO2;根据阳极发生氧化反应,阴极上发生还原反应,溶液中阴离子HCO3-向阳极定向移动,结合温度对气体溶解度的影响分析判断。
1 / 1
一、选择题
1.银锌电池是一种常见化学电源,其反应原理:,其工作示意图如下。下列说法错误的是( )
A.Zn电极是电源的负极
B.电池工作一段时间后,电极质量减轻
C.电解质溶液中的移向电极
D.Zn电极上发生的反应:
2.如图是以稀硫酸为电解质溶液的原电池装置,下列叙述正确的是( )
A.电解质溶液中的H+向铜极移动
B.铜片为负极,有气泡,发生还原反应
C.锌片为正极,质量不变,发生氧化反应
D.电子流动方向:锌极→导线→铜极→电解质溶液→锌极
3.原电池原理的发现和各种电池装置的发明,改变了人们的生活方式。下列关于如图所示原电池装置的说法不正确的是( )
A.化学能转化为电能的依据是:电流表指针偏转
B.Zn为原电池的负极
C.电子从Cu经导线流向Zn
D.Cu上的电极反应:2H++2e- = H2↑
4.如图为发光二极管连接柠檬电池装置,下列说法不正确的是( )
A.铁环作负极
B.电子由Fe环经导线流向发光二极管
C.负极的电极反应为:Fe-2e-=Fe2+
D.柠檬可替换成葡萄糖溶液
5.下列设备工作时,将化学能转化为电能的是( )
A.碱性锌锰干电池 B.燃气灶 C.砷化镓太阳电池 D.风力发电
A.A B.B C.C D.D
6.电解KCl和NaNO3溶液可以得到KNO3溶液,电解装置如图所示,下列说法正确的是( )
A.X为负极,F溶液为NaNO3溶液
B.电解一段时间,往Pt(I)附近滴入酚酞,溶液变红
C.电解的总反应为2H2O 2H2↑ + O2↑
D.理论上,当得到0.1molKNO3时,Pt(II)上生成标准状况下1.12L气体
7.关于二次电池铅蓄电池的说法中错误的是( )
A.在放电时,该电池的负极质量增加
B.在放电时,电池中硫酸的浓度减小
C.当两极物质都转化为PbSO4时,铅蓄电池将停止工作
D.在放电时,正极发生的反应是:Pb+ =PbSO4+2e-
8.我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示.下列说法错误的是( )
A.a极区 和 的浓度会影响 分解效率
B.能量转化方式主要为“光能→化学能→电能”
C.该装置的总反应为
D.为使电池持续放电,应选用质子交换膜
9.下图原电池装置中,用盐桥连接两烧杯中的电解质溶液。盐桥中阳、阴离子的电迁移率应尽可能地相近。(电迁移率用表示,单位:)。下列有关说法错误的是
阳离子 阴离子 已知:左、右烧杯中溶液体积相同
4.07 4.61
5.19 7.40
6.59 7.91
7.62 8.27
A.盐桥中的电解质可以为
B.盐桥中的阳离子进入右侧烧杯溶液中
C.电流计读数不变时,向右侧烧杯中加入硫酸铁固体,指针会继续偏转
D.电池反应一段时间后,测得左侧溶液中增加了,则右侧溶液中为
10.利用如图装置进行实验(U形管为耐压试管),开始时,a、b两处液面相平,密封好,放置一段时间。下列说法错误的是( )
A.铁丝的腐蚀速率:
B.一段时间后,a管液面高于b管液面
C.a管溶液的增大,b管溶液的减小
D.a、b两管中发生相同的电极反应为
11.我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:
3CO2+4Na 2Na2CO3+C。下列说法错误的是( )
A.放电时, 向负极移动
B.充电时,负载碳纳米管的镍网上发生氧化反应
C.放电时,正极反应为:3CO2+4e-=2 +C
D.充电时,正极反应为:Na++e-=Na
12.有机物电化学合成是化学研究的重要方向。下图所示电解装置可以生成葡萄糖酸C6H12O7)和山梨醇(C6H14O6)。葡萄糖酸再与CaCO3反应可以生产补钙剂葡萄糖酸钙。
下列说法错误的是( )
A.a为电源正极,a连接的惰性电极发生反应为:2Br--2e-=Br2
B.在电解质溶液1中,葡萄糖被HBrO还原成葡萄糖酸
C.阳极区的H+通过阳离子交换膜向阴极区移动
D.阴极反应为:C6H12O6+2H++2e-=C6H14O6
二、非选择题
13.电解食盐水可以制备烧碱、次氯酸钠消毒液等。
(1)【用途一】制备烧碱
离子交换膜法电解饱和食盐水原理示意图如图1。
①气体a的电子式为: 。
②结合电极反应式解释阴极区得到溶液的原因 。
(2)【用途二】制备次氯酸钠溶液
采用无隔膜电解槽,电解3%~5%的溶液,可制备溶液。控制较低温度,适宜电压电解制备溶液原理示意图如图2。
已知:与次氯酸盐相比,次氯酸具有更强的氧化性。
电解食盐水制备溶液总反应的化学方程式为 。
(3)研究发现,电解制备溶液时,中性溶液为宜,若初始过高()或过低()都会降低的浓度。分析可能原因:
①过高,阳极会发生放电,导致电解效率降低,电极反应为 。
②过低,产生影响的可能原因:
假设过低时,导致溶解度 ,生成的减少。
假设过低时,浓度增大氧化,生成和。
I.查阅文献,假设b成立。相应反应的离子方程式为 。
Ⅱ.若通过检测反应前后溶液酸性的变化证实假设b成立,实验操作和现象为:取溶液, 。可供选择的试剂和仪器:a.稀硫酸| b.稀盐酸| c.石蕊溶液 d.计
14.习近平总书记在科学家座谈会上指出“好奇心是人的天性,对科学兴趣的引导和培养要从娃娃抓起”。某化学兴趣小组为培养同学们对科学探究的兴趣,设计图1所示实验来探究 与Cu2+的反应:
已知:氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水
回答下列问题:
(1)若用CuSO4·5H2O配制100 mL 1 mol/LCuSO4溶液,需用托盘天平称取CuSO4·5H2O的质量为 。甲同学在定容时采用上图2方式观察,则所配制的CuSO4溶液浓度 (填“偏高”或“偏低”)。
(2)将操作2后生成的无色气体通入氯化铁溶液, (填实验现象),说明该气体为SO2,反应的离子方程式为 。
(3)操作2后生成的白色沉淀为 (填化学式),生成该沉淀和无色气体的反应离子方程式为 。
(4)根据氧化还原反应的规律,乙同学推测操作2中涉及 与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于 ,用图3装置(a、b均为石墨电极)进行实验验证。
①K闭合时,一段时间后指针几乎归零。
②向U型管右管添加 ,a电极为 极,产生的现象证实了其推测,其中不同于图1操作2后的现象是 。
(5)基于(4)实验,乙同学得出进一步猜想:物质的氧化性和还原性与 有关。该同学用图3装置再次进行实验,以丰富验证该猜想的证据。与(4)实验对比,不同的操作是向U型管左管添加 。
15.利用电化学方法可以将有效地转化为(其中C元素的化合价为价),装置如图1所示。
(1)在该装置中,左侧电极为 (填“阴极”或“阳极”)。
(2)装置工作时,阴极除有生成外,还可能生成副产物降低电解效率。
已知:电解效率
①副产物可能是 (写出一种即可)。
②标准状况下,当阳极生成氧气体积为时,测得整个阴极区内的,电解效率为 (忽略电解前后溶液的体积变化)。
(3)研究表明,溶液会影响转化为的效率。如图2是 (以计)在水溶液中各种存在形式的物质的量分数随变化的情况。
①时,几乎未转化为,此时在溶液中的主要存在形式为 。
②时,的转化效率较高,溶液中相应的电极反应式为 。
16.CO2是廉价的碳资源,将其甲烷化具有重要意义。
热化学转化法:原理为CO2(g)+4H2(g) CH4(g)+2H2O(g)△H
(1)每生成0.4mol CH4(g),放出66kJ的热量。则△H= ;
(2)其他条件不变,压强对CO2的转化率及CH4的选择性的影响如图所示。CH4的选择性= ×100%,CO2甲烷化反应选择0.1MPa (1个大气压)而不选择更高压强的原因是 。
电化学转化法:在多晶Cu催化下,电解CO2制备CH4的原理如图所示。
(3)铂电极上产生的气体为 (填化学式);
(4)电解结束时阴、阳极室的KHCO3溶液的浓度基本保持不变。在电解过程中, 移向 (填“阴”或“阳” )极室。写出阴极的电极反应式 ;
(5)电解过程中应持续通入CO2,同时温度应控制在10℃左右,使CO2优先于H+在电极上发生反应。该电解过程不在室温下进行的原因是 。
答案解析部分
1.【答案】D
【解析】【解答】A.由分析可知,Zn电极是电源的负极,故A不符合题意;
B.电极反应为,故电池工作一段时间后,质量减轻,故B不符合题意;
C.原电池中阳离子向正极运动,电解质溶液中的移向电极,故C不符合题意;
D.锌电极上发生的反应生成氢氧化锌:,故D符合题意;
故答案为:D。
【分析】新型电池的判断:
1、化合价升高的为负极,失去电子,化合价降低的为正极,得到电子;
2、电极反应式的书写要注意,负极反应为负极材料失去电子化合价升高,正极反应为正极材料得到电子化合价降低,且要根据电解质溶液的酸碱性判断,酸性溶液不能出现氢氧根,碱性溶液不能出现氢离子,且电极反应式要满足原子守恒。
2.【答案】A
【解析】【解答】A. 以稀硫酸为电解质溶液的原电池装置,锌做负极,铜做正极,电解质溶液中的H+向铜极移动,得电子生成氢气,故A符合题意;
B. 铜片为正极,有气泡,发生还原反应,故B不符合题意;
C. 锌片为负极,失电子发生氧化反应,质量减小,故C不符合题意;
D.锌做负极,铜做正极,所以电子流动方向:锌极→导线→铜极,不经过电解质溶液,故D不符合题意;
故答案为:A
【分析】原电池口诀,溶液中阴阳离子流向为:“阳正阴负”;电子流向为:负极流向正极,同时电子不通过电解质溶液,即“电子不下水,离子不上岸”
3.【答案】C
【解析】【解答】A.原电池就是将化学能转化为电能,电流表内指针偏转则证明由电流通过,A正确;
B.由分析可知,Zn为原电池的负极 ,B正确;
C.导线内:电子流向为电子:负极向正极,C错误;
D.正极:H化合价降低,得到电子,发生还原反应,电极反应为: 2H++2e-=H2↑,D正确。
故答案为:C。
【分析】本题主要考查原电池的原理和应用。
首先分析该原电池装置。
电极:Cu极和Zn极,电解质溶液:稀硫酸,形成闭合回路。活泼型抢的金属做负极。所以负极为Zn极,正极为Cu极。
负极:Zn化合价升高,失去电子,发生氧化反应,电极反应为:Zn-2e-=Zn2+;
正极:H化合价降低,得到电子,发生还原反应,电极反应为: 2H++2e-=H2↑。
原电池电极判断:
负极:电子流出的一极;化合价升高的一极;发生氧化反应的一极;活泼性相对较强金属的一极;
正极:电子流入的一极;化合价降低的一极;发生还原反应的一极;相对不活泼的金属或其它导体的一极;
阳极:发生氧化反应的电极;
阴极:发生还原反应的电极;
电子流向判断:
在原电池中,外电路为电子导电,电解质溶液中为离子导电。
阳离子向正极移动;阴离子向负极移动。
电流:正极向负极
电子:负极向正极
4.【答案】D
【解析】【解答】A.铁比铜活泼,故铁做负极,A不符合题意
B.电子由导线从负极流向正极,B不符合题意
C.负极的反应为 Fe-2e-=Fe2+ ,故C不符合题意
D.葡萄糖为非电解质,不能替换,故D符合题意
故答案为:D
【分析】原电池必须要有电解质溶液。
5.【答案】A
【解析】【解答】A.碱性锌锰干电池主要将化学能转化为电能,故A符合题意;
B.燃气灶通过燃料燃烧,主要将化学能转化为热能,故B不符合题意;
C.砷化镓太阳电池将太阳能转化为电能,故C不符合题意;
D.风力发电将风能转化为电能,故D不符合题意。
故答案为:A。
【分析】将化学能转化为电能的装置为原电池装置,结合选项所给设备进行分析即可。
6.【答案】D
【解析】【解答】A.由上述分析可知E为氯化钾溶液,氯离子在阳极Pt片(I)发生氧化反应,Pt片(I)为阳极,则X为正极,故A不符合题意;
B.氯离子在Pt片(I)发生氧化反应生成氯气逸出,水电离产生的氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,则Pt片(Ⅱ)附近氢氧根离子浓度大于氢离子浓度,显碱性,加入酚酞溶液显红色,故B不符合题意;
C.阴极为氯离子放电,阳极为氢离子放电,氯离子在Pt片(I)阳极发生氧化反应失去电子生成氯气,阴极氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,电解方程式为:H2O+2KCl 2KOH+H2↑+Cl2↑,故C不符合题意;
D.当得到0.1molKNO3时,则有0.1mol钾离子透过阳离子交换膜,则转移0.1mol电子,阳极电极反应式:2Cl--2e-=Cl2↑,转移0.1mol电子生成0.05mol氯气,标况下体积为0.05mol×22.4L/mol=1.12L,故D符合题意;
故答案为:D。
【分析】电解KCl和NaNO3溶液可以得到KNO3溶液,依据图中硝酸钾的出口,结合B为阳离子交换膜可知,E为氯化钾溶液,F为硝酸钠溶液,阴极上氯离子放电,阳极为氢离子放电,氯离子在阳极Pt片(I)上发生氧化反应失去电子生成氯气,氢离子在阴极Pt片(Ⅱ)上得到电子发生还原反应生成氢气,据此分析解答。
7.【答案】D
【解析】【解答】A.放电时,负极发生的反应为Pb-2e+SO42-=PbSO4,质量增加,故A不符合题意;
B.放电时消耗硫酸,导致浓度降低,故B不符合题意;
C.正极和负极产物均得到硫酸铅,当两电极均是硫酸铅时,停止工作,故C不符合题意;
D.放电时正极是PbO2+2e+4H++SO42-=2H2O+PbSO4,故D符合题意;
故答案为:D
【分析】根据铅蓄电池总反应是Pb+PbO2+2H2SO4=2H2O+2PbSO4,负极:Pb-2e+SO42-=PbSO4,正极:PbO2+2e+4H++SO42-=2H2O+PbSO4,结合选项即可判断。
8.【答案】B
【解析】【解答】A.负极区利用氧化性强的铁离子捕获H2S得到S,三价铁离子为催化剂,铁离子和亚铁离子的浓度会影响硫化氢分解效率,A项不符合题意;
B.该制氢工艺中光能转化为电能,最终转化为化学能,B项符合题意;
C.该装置发生的有关反应为 、 、 ,这三个反应相加,结合反应条件得到总反应为 ,C项不符合题意;
D.氢离子由a极区产生通过交换膜流动到b极,故为使电池持续放电,应选用质子交换膜,D项不符合题意;
故答案为:B。
【分析】A.根据a区的反应流程即可判断铁离子将硫化氢氧化为硫单质,因此铁离子浓度影响硫化氢的分解效率
B.根据反应的流程是光能转化为电能,电能转化为化学能
C.根据发生的反应即可写出总的反应
D.根据a极可以产生质子而b极消耗质子因此可以加入质子交换膜实现持续放电
9.【答案】A
【解析】【解答】A.在盐桥中,为维持两个烧杯中溶液的电荷平衡,两个盐桥中阴阳离子的迁移率应尽可能接近,由表格可知,钾离子和氯离子以及硝酸根离子的迁移率最接近,硫酸亚铁和硫酸铁由于水解会显酸性,硝酸根离子在酸性条件下具有强氧化性,可将电解质溶液中的亚铁离子氧化,所以应选择氯化钾作为电解质,A符合题意;
B.电流表显示电子由铁电极流向石墨电极,则铁电极为负极,石墨电极为正极,盐桥中阳离子向正极移动,则盐桥中的阳离子进入石墨电极溶液中,B不符合题意;
C.电流计读数不变时,说明右侧三价铁反应完,此时向右侧烧杯中加入硫酸铁固体,则三价铁可以继续参与反应,指针会继续偏转,C不符合题意;
D.铁电极发生的反应为:Fe-2e-=Fe2+,石墨电极发生的反应为:2Fe3++2e-=2Fe2+,当铁电极溶液中c(Fe2+)增加了0.01 mol·L 1时,由电极反应可知,转移的电子的物质的量浓度为0.02 mol·L 1,根据石墨电极的电极反应可计算得出石墨电极增加的c(Fe2+)为0.02 mol·L 1,原溶液中c(Fe2+)为0.05 mol·L 1,所以反应后c(Fe2+)=0.02 mol·L 1+0.05 mol·L 1=0.07 mol·L 1,D不符合题意;
故答案为:A。
【分析】A.在盐桥中,为维持两个烧杯中溶液的电荷平衡,两个盐桥中阴阳离子的迁移率应尽可能接近,由表格可知,钾离子和氯离子以及硝酸根离子的迁移率最接近,但硝酸根离子在酸性条件下具有强氧化性,会氧化亚铁离子;
B.阴离子向负极移动,阳离子向正极定向移动;
C.依据平衡移动原理分析;
D.闭合电路中,转移离子所带电荷总数等于转移的电子总数。
10.【答案】C
【解析】【解答】A.a管电解质溶液为中性,发生吸氧腐蚀,b管电解质溶液为稀硫酸,发生析氢腐蚀,氢离子浓度大,所以腐蚀速率,A不符合题意;
B.a发生吸氧腐蚀,吸收氧气,气体体积会减少,b发生析氢腐蚀,产生氢气气体体积会变大,所以一段时间后,a管液面高于b管液面,B不符合题意;
C.a中产生OH-,pH会变大,b中消耗氢离子,pH也会变大,C符合题意;
D.金属的腐蚀,都是金属做负极,失去电子发生氧化反应,所以,a、b两管中负极的电极反应均为,D不符合题意;
故答案为:C。
【分析】A、稀硫酸和铁反应的速率更快;
B、a中氧气变少,b中氢气增大,由于压强影响a液面更高;
C、a中发生吸氧腐蚀生成氢氧根,b中发生析氢腐蚀消耗氢离子;
D、铁作为负极,失去电子形成亚铁离子。
11.【答案】D
【解析】【解答】A.放电时为原电池装置,阴离子向负极移动,故A不符合题意;
B.放电时Ni网上CO2被还原,则充电时镍网上发生氧化反应,故B不符合题意;
C.放电时,CO2在Ni电极上被还原,为正极,根据总反应可知电极反应为3CO2+4e-=2 +C,故C不符合题意;
D.充电时为电解池,电解池没有正负极,而是阴阳极,原放电时的正极为电解池的阳极,碳被氧化生成CO2,故D符合题意;
故答案为:D。
【分析】根据总反应可知放电时Na被氧化,作负极,CO2被还原,所以Ni电极为正极。
12.【答案】B
【解析】【解答】A.根据上述分析,a为电源正极,发生氧化反应,a连接的惰性电极发生的反应为:2Br--2e-=Br2,故A不符合题意;
B.根据图示,在电解质溶液1中,HBrO被还原为Br-,则葡萄糖被HBrO氧化成葡萄糖酸,故B符合题意;
C.在电解池中,阳极区的H+通过阳离子交换膜向阴极区移动,故C不符合题意;
D.阴极上C6H12O6得到电子生成C6H14O6,发生还原反应,电极反应为C6H12O6+2H++2e-=C6H14O6,故D不符合题意;
故答案为:B。
【分析】根据图示,在与电源a极相连电极上Br-失去电子生成Br2,发生氧化反应,则该电极为阳极,在与电源b极相连电极上C6H12O6得到电子生成C6H14O6,发生还原反应,则该电极为阴极,因此a为电源正极,b为电源负极,据此分析解答。
13.【答案】(1);在阴极区水得电子生成氢气和氢氧根,电极反应为: ,钠离子通过阳离子交换膜迁移到阴极区,故在阴极区生成NaOH溶液
(2)
(3);减小;;取NaClO溶液,用pH计分别测量初始溶液和滴入适量稀硫酸后溶液的pH值,若开始时溶液的pH值大于7,滴入适量的稀硫酸后,溶液的pH值小于7,则假设成立
【解析】【解答】(1)根据分析,气体a为Cl2,电子式为:;在阴极区水得电子生成氢气和氢氧根,电极反应为:,钠离子通过阳离子交换膜迁移到阴极区,故在阴极区生成NaOH溶液;
(2)根据分析,电解食盐水制备溶液总反应的化学方程式为:;
(3)①过高,阳极会发生放电,导致电解效率降低,电极反应为:;
②过低,产生影响的可能原因:
假设过低时,溶液中氢离子浓度大,氯气与水的反应受到抑制,导致溶解度减小,生成的减少;
假设过低时,浓度增大氧化,生成和,根据氧化还原反应配平,离子反应为:;
NaClO溶液显碱性,且具有强氧化性,不能向其中加入稀盐酸,会发生氧化还原反应生成氯气,降低pH值只能选用稀硫酸。先用pH计测得溶液的pH值大于7,滴入适量的稀硫酸后,部分次氯酸钠与硫酸反应生成次氯酸,次氯酸与次氯酸根发生氧化还原反应生成氯离子、氯酸根和氢离子,溶液酸性增强,pH计测得溶液的pH值小于7,则假设成立。故取NaClO溶液,用pH计分别测量初始溶液和滴入适量稀硫酸后溶液的pH值,若开始时溶液的pH值大于7,滴入适量的稀硫酸后,溶液的pH值小于7,则假设成立。
【分析】(1)根据放电顺序和电极产物分析;
(2)根据电解反应物和产物分析;
(3)①过高,阳极会发生放电;
②氯气与水的反应是可逆反应;根据反应物和生成物的化学式,利用原子守恒、得失电子守恒、电荷守恒分析;依据中和反应和实验室制氯气的原理设计。
14.【答案】(1)25.0 g;偏低
(2)溶液由黄色变浅绿色(或黄色变浅);
(3)CuCl;
(4)KCl固体;负极;指针偏转
(5)浓度;BaCl2固体(或其他合理答案)
【解析】【解答】(1)在100 mL 1 mol/LCuSO4溶液中含有溶质CuSO4的物质的量n(CuSO4)=1 mol/L×0.1 L=0.1 mol,根据Cu元素守恒,可知需CuSO4·5H2O的质量m(CuSO4·5H2O)=0.1 mol×250 g/mol=25.0 g;
若在配制溶液定容时仰视刻度线,则容量瓶中凹液面最低处高于刻度线,溶液体积偏大,由于溶质的物质的量不变,根据物质的量浓度定义式可知配制的溶液的浓度偏低;
(2)向KHSO3溶液中加入CuSO4溶液,溶液显蓝色,无其它明显变化,然后加入KCl固体,反应产生白色沉淀和无色气体,Cu2+得到电子被还原为Cu+,Cu+与溶液中的Cl-结合白色沉淀是CuCl,则 失去电子被氧化为 ,同时产生H+,H+与溶液中的 反应产生SO2气体。SO2具有还原性,与FeCl3溶液发生氧化还原反应,产生H2SO4、HCl、FeCl2,使溶液由红色变为浅绿色,该反应的离子方程式为: ;
(3)根据(2)分析可知生成的白色沉淀是CuCl,则生成该沉淀和无色气体的离子方程式为: ;
(4)若是由于外加Cl-导致Cu+的还原性弱于 ,可根据如图装置验证:当一段时间后指针归零后,向U型管右管添加加入KCl固体,此时溶液中Cl-浓度增大,若a为负极,电流表指针发生偏转,同时看到左侧电极有气体产生,右侧电极附近有白色沉淀产生,就可证实其推测;
(5)基于(4)实验,乙同学得出进一步猜想:物质的氧化性和还原性与物质的浓度有关。
若 反应产生 ,则反应后向左侧溶液中加入含有Ba2+的物质,应该产生BaSO4白色沉淀,而 与Ba2+不能发生反应。故该同学用图3装置再次进行实验,以丰富验证该猜想的证据。与(4)实验对比,不同的操作是可以向U型管左管添加BaCl2固体。
【分析】(1)根据m=计算即可,定容时仰视读数,导致体积偏大,浓度偏低
(2)二氧化硫具有还原性,而铁离子具有氧化性,发生氧化还原反应变色,因此黄色变为浅绿色,根据氧化还原反应即可写出离子方程式
(3)根据题意加入氯化钾后产生沉淀,而氯化亚铜是白色固体难溶于水,根据反应物和生成物即可写出方程式
(4)根据题意 外加Cl-导致Cu+的还原性弱于 ,因此引入氯离子即可进行实验,因此亚硫酸氢根做负极,a为负极,形成原电池,导致指针偏转
(5)浓硝酸和稀硝酸的氧化性不同,且浓度大氧化性强,因此可以考虑物质的氧化性与浓度有关,增加氯离子的浓度即可
15.【答案】(1)阳极
(2)H2 (或CO等其它合理答案);85%
(3)CO;2O + HCO+2e-= HCOO- + 2OH- (或3HCO+ 2e- = HCOO- + 2CO+ H2O)
【解析】【解答】(1)右侧通入CO2,得电子被还原生成HCOO-,所以右侧Pt电极为阴极,则左侧Pt电极为阳极;
(2)①右侧Pt电极即阴极上的副产物会降低电解效率,阴极上CO2被还原,其还原产物还可能为CO或其他低价态的C元素,会降低效率,或者溶液中水电离出的氢离子被还原生成H2也会降低电解效率;
②阳极水电离出氢氧根放电生成氧气,电解反应式2H2O – 4e- = O2 + 4H+,标况下224mL氧气的物质的量为=0.01mol,转移0.04mol电子,1个CO2转化为HCOO-转移2个电子,所以电解效率为=85%;
(3)①据图可知当pH>12时,CO2在溶液中的主要存在形式为CO;
②据图可知当pH=8.5时,CO2在溶液中的主要存在形式为HCO,HCO得电子被还原成HCOO-,电解反应式为H2O + HCO+2e-= HCOO- + 2OH- (或3HCO+ 2e- = HCOO- + 2CO+ H2O)。
【分析】(1)反应中元素化合价升高,做阳极,元素化合价降低,为阴极;
(2)①考虑发生副反应;
②依据得失电子守恒;
(3)①根据图像分析;
②根据图像,利用反应物和产物的化学式书写。
16.【答案】(1)-165kJ/mol
(2)在0.1MPa,CO2的转化率及CH4的选择性较高,加压CO2的转化率及CH4的选择性变化不大,且加压会增大投资和能耗
(3)CO2、O2
(4)阳;9CO2+8e-+6H2O=CH4+8
(5)温度太高,不利于CO2的溶解
【解析】【解答】(1)反应发生CO2(g)+4H2(g) CH4(g)+2H2O(g),若生成0.4mol CH4(g),放出66kJ的热量则产生1 mol甲烷气体时,放出热量为Q= 66kJ× =165kJ,故该反应的反应热△H=-165kJ/mol;
(2)在0.1MPa,CO2的转化率及CH4的选择性较高,加压CO2的转化率及CH4的选择性变化不大,且加压会增大投资和能耗,因此选择条件是0.1MPa;
(3)Pt电极为阳极,在阳极上溶液中水电离产生的OH-失去电子,发生氧化反应产生O2,OH-放电,破坏了附近水的电离平衡,产生H+,使附近溶液中c(H+)增大,H+与附近溶液中的 反应产生CO2气体,故铂电极上产生的气体为CO2、O2;
(4)采用电化学转化法,在多晶Cu催化下,电解CO2制备CH4时,多晶Cu为阴极,CO2得到电子变为CH4,结合电解质溶液成分,可知阴极的电极反应式为:9CO2+8e-+6H2O=CH4+8 ;
(5)电解过程中应持续通入CO2,同时温度应控制在10℃左右,使CO2优先于H+在电极上发生反应。该电解过程不在室温下进行的原因是因为温度升高,CO2在溶液中的溶解度会降低,不利于CO2的溶解及发生还原反应。
【分析】(1)根据反应放出的热量与反应的物质呈正比计算;
(2)在0.1MPa,CO2的转化率及CH4的选择性较高,加压CO2的转化率及CH4的选择性变化不大;
(3)多晶Cu作阴极,CO2得到电子变为CH4逸出;铂电极为阳极,溶液中OH-失去电子变为O2,反应产生的H+与HCO3-反应产生CO2;根据阳极发生氧化反应,阴极上发生还原反应,溶液中阴离子HCO3-向阳极定向移动,结合温度对气体溶解度的影响分析判断。
1 / 1
