第二章《化学反应的方向、限度与速率》测试题(含解析)2023---2024学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第二章《化学反应的方向、限度与速率》测试题(含解析)2023---2024学年上学期高二化学鲁科版(2019)选择性必修1 | 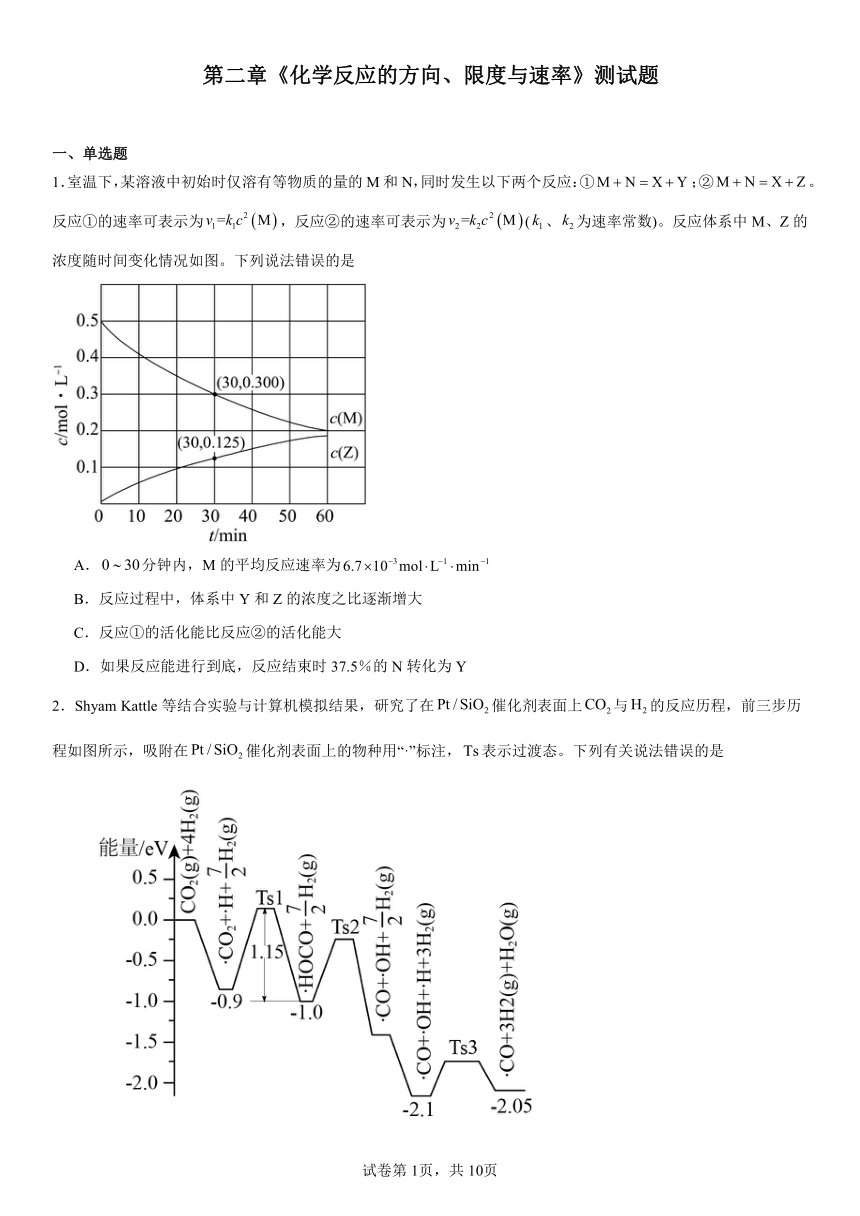 | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-23 13:40:32 | ||
图片预览





文档简介
第二章《化学反应的方向、限度与速率》测试题
一、单选题
1.室温下,某溶液中初始时仅溶有等物质的量的M和N,同时发生以下两个反应:①;②。反应①的速率可表示为,反应②的速率可表示为(、为速率常数)。反应体系中M、Z的浓度随时间变化情况如图。下列说法错误的是
A.分钟内,M的平均反应速率为
B.反应过程中,体系中Y和Z的浓度之比逐渐增大
C.反应①的活化能比反应②的活化能大
D.如果反应能进行到底,反应结束时37.5%的N转化为Y
2.Shyam Kattle等结合实验与计算机模拟结果,研究了在催化剂表面上与的反应历程,前三步历程如图所示,吸附在催化剂表面上的物种用“·”标注,表示过渡态。下列有关说法错误的是
A.物质被吸附在催化剂表面形成过渡态的过程是吸热的
B.形成过渡态的活化能为
C.前三步总反应的
D.反应历程中能量变化最大的反应方程式为
3.汽车尾气处理的反应为2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-746kJ·mol-1。下列说法正确的是
A.升高温度可使v(正)增大、v(逆)减小
B.使用高效催化剂可提高该反应的反应热
C.反应达到化学平衡状态时,v(正)(NO)=2v(逆)(N2)
D.CO和CO2的物质的量相等时,反应达到化学平衡状态
4.一定温度下,将2mol和1mol充入一定容密闭容器中,在催化剂存在下进行反应:,下列说法不正确的是
A.该反应的二氧化硫可全部转化为三氧化硫
B.反应过程中和物质的量之和不变
C.通过调控反应条件,可以提高该反应进行的程度
D.达到平衡时,容器内压强不再改变
5.由下列生产或实验得出的相应结论不正确的是
事实 结论
A 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 当其他条件不变时,升高反应温度,化学反应速率加快
B 工业合成氨,在400~500°C比室温更适合合成氨的反应 升高温度提高平衡转化率
C 在容积可变的密闭容器中发生反应:2NH3(g)N2H4(l)+H2(g),把容积的体积缩小一半 正、逆反应速率均加快
D 向A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 当其他条件不变时,催化剂可以改变化学反应速率
A.A B.B C.C D.D
6.四个体积相同的密闭容器中在一定条件下发生反应:2SO2+O22 SO3.反应开始时,反应速率最大的是。
容 器 温 度 SO2(mol) O2(mol) 催化剂
A 500℃ 10 5 —
B 500℃ 10 5 V2O5
C 450℃ 8 5 —
D 500℃ 8 5 —
A.A B.B C.C D.D
7.在300mL的密闭容器中,加入镍粉并充入一定量的CO气体,一定条件下发生反应:,已知该反应的平衡常数与温度的关系如表所示。下列说法不正确的是
温度(℃) 25 80 230
平衡常数/ 2
A.上述生成的反应为放热反应
B.25℃时反应的平衡常数为
C.80℃反应达到平衡时,测得,则的平衡浓度为
D.在80℃时,测得某时刻、CO的浓度均为,则此时
8.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法不正确的是( )
A.化学反应的历程一般为:
B.CH4+CO2→CH3COOH过程中,只有C-H键发生断裂
C.①→②放出能量并形成了C-C键
D.催化剂能增大活化分子百分数从而加快了该反应的速率
9.已知化合物A与在一定条件下反应生成化合物B与,其反应历程如图所示,其中TS表示过渡态,I表示中间体。下列说法正确的是
A.TS2所在的基元反应中活化分子百分数最大
B.该历程中的最大能垒(活化能)
C.使用催化剂只降低正反应的活化能,反应的焓变不变
D.反应达到平衡状态后,升温使平衡逆向移动
10.在容积为的恒容密闭容器中充入和,在不同温度下反应合成甲醇:,反应相同时间时的转化率与温度的关系如图所示。若保持温度为,分别按Ⅱ和Ⅲ中的不同方式向容器中投入反应物,发生上述反应,相关信息如下表。
编号 起始物质的量/ 平衡转化率
Ⅰ 1 3 0 0
Ⅱ 2 6 0 0
Ⅲ 0.4 2 0.2 0.4 —
下列说法正确的是
A.反应在高温下能自发进行
B.Ⅱ中反应达到平衡时,
C.时,反应的平衡常数为
D.Ⅲ中反应达到平衡前,v(正)>v(逆)
11.在373K时,把0.5molN2O4气通入体积为5L的恒容真空密闭容器中立即出现红棕色,反应进行到2s时,NO2的浓度为0.02mol/L,在60s时体系达到平衡,此时容器内压强为开始压强的1.6倍。下列说法正确的是
A.前2svN2O4=0.01mol/L·s
B.2s时体系内压强为开始时的1.1倍
C.平衡时体系内含N2O40.25mol
D.平衡时若压缩容器体积可提高N2O4的转化率
12.一定温度下向2L体积固定的密闭容器中通入两种物质发生化学反应,反应中各物质(均为气体)的物质的量随时间变化如图所示。下列说法正确的是( )
A.该反应的化学方程式为3B+4D 6A+2C
B.6s前任意时间点,正反应速率一定大于逆反应速率
C.反应进行到6s时达到化学平衡状态,此时无论改变什么条件平衡状态都不会变化
D.当容器内气体密度保不变时,就说明反应达到平衡状态了
13.工业合成氨气需要选择合适的温度来兼顾化学反应速率及产率,科学家研制出了Ti-H-Fe双温区催化剂,其催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
A.该反应正反应的活化能高于逆反应的活化能
B.该反应的反应速率由过程④⑤决定
C.①②③在高温区发生,④⑤在低温区发生
D.增大Fe用量,不能改变反应的焓变,但可以提高N2的平衡转化率
二、填空题
14.对于反应,压强或温度对C的质量分数的影响如图所示:
(1)若m、n表示不同温度,则m (填“>”或“<”)n,正反应为 (填“放热”或“吸热”)反应。
(2)若m、n表示不同压强,则m (填“>”或“<”)n, (填“<”“>”或“=”)。
(3)b曲线的OG段比a曲线的OH段陡的原因是 。
(4)a曲线的HE段高于b曲线的GF段的原因是 。
15.烟气中含有的高浓度SO2、氮氧化物有害物质及酸性废水中的,在排放前必须进行脱硫、脱硝、脱氮处理。
(1)H2Y2-是乙二胺四乙酸根离子,与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。其吸收原理:
FeY2-(aq)+NO(g) FeY2-(NO)(aq) ΔH<0。将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如图1所示。时间越长,NO吸收率越低的原因是 。
(2)H2O2在催化剂α-FeOOH的表面上,分解产生·OH。·OH较H2O2和O2更易与烟气中的NO、SO2发生反应。反应后所得产物的离子色谱如图2所示。
①写出·OH氧化NO反应的化学方程式: 。
②当H2O2浓度一定时,NO的脱除效率与温度的关系如图3所示。升温至80℃以上,大量汽化的H2O2能使NO的脱除效率显著提高的原因是 ,温度高于180℃,NO的脱除效率降低的原因是 。
(3)用H2消除酸性废水中的是一种常用的电化学方法。其反应原理如图4所示。
请结合上述反应过程用合适的文字描述Fe(III)、Fe(II)在其中的作用: 。
16.t℃时,将3 mol A和2 mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) 2C(g),2 min时反应达到平衡状态(温度不变),测得C的浓度为0.2 mol/L,请填写下列空白:
(1)该过程用A表示的反应速率为:v(A)= ;该温度下该反应的化学平衡常数表达式为 。
(2)比较达到平衡时,A、B两反应物的转化率:α(A) α(B)(填“>”、“=”或“<”)。
(3)判断反应达到平衡状态的依据是(填字母序号) 。
A.生成C的速率与消耗B的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.A的质量分数不再发生变化
(4)若升高温度,再次达平衡时,平衡常数数值变大,则该反应的 H 0(填“>”、“=”或“<”)。
(5)若保持温度不变时,继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,则化学反应速率会 (填“加快”、“减慢”或“不变”),化学平衡将 (填“正反应方向移动”、“逆反应方向移动”或“不移动”)。
17.甲醇是一种重要的化工原料又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g)CH3OH(g),CO的平衡转化率与温度,压强的关系如图1所示。
由图可判断△H 0,A、B两点对应的平衡常数关系是KA KB(填“>、<、=”)。
(2)某温度下,充分反应后,达到平衡时测得c(CO)=0.02mol/L,则此温度下的平衡常数K= 。
(3)我国在甲醇燃料电池技术方面获得新突破,组装出自呼吸电池及主动式电池。其工作原理如图2所示。该电池工作时,c口通入的物质为 (填化学式);电池负极的电极反应式为 。
18.硝酸工业中产生的是一种大气污染物,可以通过如下反应处理:
(1)已知:;;;。则 。
(2)在一定温度下,向体积为2L的密闭容器中充入4、2。
①若为恒容密闭容器,在10min时达到平衡状态,压强为原来的,该反应的平衡常数为 (保留2位有效数字);此时NO的转化率a%;平衡后,向恒容密闭容器中再充入2、1,重新达到平衡时,的转化率将 (填“增大”、“不变”或“减小”)。
②若为恒压密闭容器,平衡后的转化率为b%,则a% b%(填“<”、“=”或“>”)。
19.已知800℃时,化学反应CO(g)+H2O(g)CO2(g)+H2(g)达到平衡,K=1.试推断在下列情况下该平衡移动的方向,填入下表:
序号 CO/mol·L 1 H2O/mol·L 1 CO2/mol·L 1 H2/mol·L 1 平衡移动的方向
1 0.3 0.5 0.4 0.4
2 1.0 0.3 0.5 0.6
3 0.8 1.6 0.7 1.7
20.在恒温恒容的密闭容器中,通入xmol N2和ymol H2发生反应N2+ 3H22NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
⑴通过计算说明起始充入N2和H2的物质的量分别为:x= ,y= 。
⑵若起始加入N2、H2和NH3的物质的量分别为amol、bmol、cmol,达平衡时各物质的含量与上述平衡完全相同。
①若c=2,在相同的条件下达平衡时,该反应吸收的热量为 kJ。
②若维持反应向正反应方向进行,则起始时c的取值范围为 。
21.CO是一种常用的还原剂。一定条件下,反应的速率方程为(k为速率常数,只与温度、催化剂有关,与浓度无关)。某温度下,该反应在不同浓度下反应速率如下表所示:
反应速率
① 0.10 0.10 v
② 0.20 0.10
③ 0.20 0.20
(1)根据表中测定结果,下列推断正确的是_______(填字母)。
A.a=1、b=2 B.a=1、b=1 C.a=2、b=2 D.a=2、b=1
(2)改变下列一个条件,反应速率增大的是_______(填字母)。
A.降温 B.缩小体积 C.加入催化剂 D.减压
22.能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是 (填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO2CO2+N2 H<0.为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s 0 1 2 3 4 5
C(NO)(×10-4mol·L-1) 10.0 4.50 2.50 1.50 1.00 1.00
C(CO)(×10-3mol·L-1) 3.60 3.05 2.85 2.75 2.70 2.70
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
前2s内的平均反应速率v(N2)= ;达到平衡时,NO的转化率为 ,气相中NO所占的体积分数为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】由图可知,M的起始浓度为0.5mol/L,反应①的速率,反应②的速率,k1、k2为速率常数,则同一反应体系中反应①、②的速率之比始终不变,所以Y、Z的浓度变化之比始终不变;①;②,则体系中始终有c(Y)+c(Z)=△c(A),由图可知,30min时△c(M)=0.5mol/L-0.300mol/L=0.2mol/L,c(Z)=0.125mol/L,则c(Y)=0.2mol/L-0.125mol/L=0.075mol/L,即反应开始后,体系中Y和Z的浓度之比为0.075mol/L:0.125mol/L=3:5;结合反应的活化能与反应速率关系比较反应①、②的活化能大小,根据和转化率公式计算反应速率和转化率,据此分析解答。
【详解】A.由图可知,30min时△c(M)=0.5mol/L-0.300mol/L=0.2mol/L,M的平均反应速率为,故A正确;
B. 反应①的速率,反应②的速率,k1、k2为速率常数,则同一反应体系中反应①、②的速率之比始终不变,所以Y、Z的浓度变化之比始终不变,故B错误;
C. 由图可知,30min时△c(M)=0.5mol/L-0.300mol/L=0.2mol/L,c(Z)=0.125mol/L,则c(Y)=△c(M )-c(Z)=0.2mol/L-0.125mol/L=0.075mol/L,则v(Y):v(Z)=0.075mol/L:0.125mol/L=3:5,即v(Y)<v(Z)、v1<v2,反应的活化能越高,反应速率越慢,所以反应①的活化能大于反应②的活化能,故C正确;
D. 由上述分析可知,体系中Y和Z的浓度之比为3:5,所以反应能进行到底时,c(Y)+c(Z)=0.5mol/L,则c(Z)=×0.5mol/L=0.3125mol/L,c(Y)= ×0.5mol/L=0.1875mol·L-1,反应结束时A转化为Z的转化率为,故D正确;
故选B。
2.D
【分析】利用反应前后能量的变化,分析反应的反应热,据此分析。
【详解】A.由图可知,被吸附在催化剂表面的物质形成过渡态的过程是吸热的,A正确;
B.从图中能量差可知,过渡态的能量为,则该步的活化能为,B正确;
C.根据图示首尾能量数据可知,该过程的总能量降低了2. 05 eV,前三步的总反应的,C正确;
D.前三步中能量变化最大的是第二步,该步骤分两步形成稳定的微粒,反应方程式为,D错误;
故本题选D。
3.C
【详解】A.升高温度,v(正)、v(逆)均增大,A项错误;
B.使用高效催化剂可降低反应的活化能,但不能改变反应的反应热,B项错误;
C.反应达到化学平衡状态时,同一物质表示的正、逆反应速率相等,不同物质表示的正、逆反应速率之比等于化学计量数之比,则v(正)(NO)=2v(逆)(N2),C项正确;
D.反应达到平衡时各物质物质的量保持不变,但不一定相等、也不一定等于化学计量数之比,故CO和CO2的物质的量相等时,反应不一定达到化学平衡状态,D项错误;
答案选C。
4.A
【详解】A.可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物,故A错误;
B.根据S元素守恒可知,S的总的物质的量保持不变,即SO2和SO3物质的量之和一定为2mol,故B正确;
C.可通过调节反应温度等条件,可提高反应进行的程度,故C正确;
D.该反应前后气体分子数之和不相等,即压强是一变量,达到平衡时,容器内压强不再改变,故D正确;
故选:A。
5.B
【详解】A.只有温度不同,可说明升高反应温度,化学反应速率加快,A正确;
B.合成氨气的反应是放热反应,温度升高,化学平衡逆向移动,导致NH3的平衡含量降低。在工业合成氨,反应温度在400~500°C是由于在该温度下催化剂活性最大,反应速率加快,而不是提高反应物的平衡转化率,B错误;
C.该反应的正反应是气体体积减小的反应,把容积的体积缩小一半,体积减小、气体的压强增大,则正、逆反应速率都加快,C正确;
D.B试管中加入2~ 3滴FeCl3溶液,A中没有使用催化剂,二者反应速率不同,可以说明催化剂对速率的影响,D正确;
故合理选项是B。
6.B
【详解】对比A与B,B中使用催化剂,其它条件相同,该反应需在催化剂条件发生反应,故反应速率B > A;对比A与D,A中二氧化硫的浓度比D中的大,其它条件相同,故反应速率A > D;对比C与D,D中温度比C中高,其它条件相同,故反应速率D > C;故反应速率B>A>D>C,综上所述,故选B。
7.D
【详解】A.根据化学平衡常数与温度关系可知:升高温度,化学平衡常数K减小,说明升高温度,化学平衡逆向移动,逆反应为吸热反应,所以该反应的正反应为放热反应,A正确;
B.在25℃时,的化学平衡常数K=;则反应的化学平衡常数K1=,B正确;
C.80℃达到平衡时,测得n(CO)=0.3 mol,c(CO)=,由于该温度下的化学平衡常数K=2,K==2,所以Ni(CO)4的平衡浓度c[Ni(CO)4]=2×14=2 mol L 1,C正确;
D.80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol L 1,则Qc=,80℃时化学平衡常数K=2,8>2,说明此时反应逆向进行,故反应速率:v(正)<v(逆),D错误;
故合理选项是D。
8.B
【详解】A.化学反应的历程一般为:普通反应分子获得能量后成为活化分子,活化分子间发生有效碰撞,形成新的化学键释放能量,生成产物分子,故A正确;
B.据图可知CH4+CO2→CH3COOH过程中CO2分子中的C=O键也会发生断裂形成-COOH结构,故B错误;
C.据图可知①→②的焓值降低,过程为放热过程,有C-C键形成,故C正确;
D.催化剂降低反应活化能,从而增大活化分子百分数加快反应速率,故D正确;
综上所述答案为B。
9.D
【详解】A.TS2所在的基元反应活化能最大,活化分子百分数最小, A错误;
B.正反应的活化能是指正向进行的反应的活化能,图中①③⑤均为正反应活化能,其中活化能最大的为相对能量大的③,其能量为,B错误;
C.催化剂可以同等程度降低正逆反应的活化能,反应的焓变不变,C错误;
D.从图中可以看出,反应物总能量高于生成物总能量,该反应为放热反应,升高温度,平衡逆向移动,D正确;
故选D。
10.D
【详解】A.由图象可知,二氧化碳的转化率达到最高点之后,随温度升高转化率降低,说明正反应为放热反应,即H<0,又反应为气体体积减小的反应,故为S<0,所以反应低温下能自发反应,故A错误;
B.Ⅱ相对于Ⅰ,气体的物质的量增加,增大压强,平衡正向移动,转化率大于60%,故B错误;
C.时,,则根据三段式
则平衡常数K==,故C错误;
D.Ⅲ中反应的浓度商Q==0.1v(逆),故D正确;
故选D。
11.B
【详解】A.2秒时NO2的浓度为0.02mol/L,则转化的N2O4的浓度为0.01mol/L,则前2秒以N2O4的浓度变化表示的平均反应速度为:,故A错误;
B.2秒时NO2的物质的量为5L×0.02mol/L=0.1mol,由N2O42NO2可知消耗的N2O4为0.05mol,故2s时N2O4的物质的量为0.5mol-0.05mol=0.45mol,反应前后的物质的量之比等于压强之比,则在2秒时体系内的压强为开始时的(0.1mol+0.45mol)/0.5mol=1.1倍,故B正确;
C.设转化的N2O4的物质的量为x,则平衡时N2O4的物质的量为0.5mol-x,NO2的物质的量为2x,由平衡时容器内压强为开始时的1.6倍,则=1.6,解得x=0.3mol,平衡时N2O4的物质的量为0.5-0.3=0.2mol,故C错误;
D.由N2O42NO2,压缩容器体积即增大压强,平衡逆向移动,N2O4的转化率降低,故D错误;
故选:B。
12.B
【分析】由图可知,随着时间的变化,A、D的物质的量在增大,是生成物;B、C的物质的量在减小,是反应物;根据各物质的变化的物质的量之比等于化学计量数之比,得到各物质的化学计量数之比,得到化学方程式;随着时间反应进行到6s时,各物质的物质的量不再发生变化,达到化学平衡状态,由此分析。
【详解】A.由图可知,B、C的物质的量减小,A、D的物质的量增加,则B、C为反应物、A、D为生成物,B、C、A、D的Δn之比为(1-0.4)mol∶(1-0.2)mol∶(1.2-0)mol∶(0.4-0)mol=3:4:6:2,反应速率之比等于化学计量数之比,等于相同时间的物质的量变化量之比,6s时达到平衡,则反应3B+4C 6A+2D,故A不符合题意;
B.由图可知,6s前平衡正向移动,则正反应速率大于逆反应速率,故B符合题意;
C.反应进行到6s时达到化学平衡状态,改变外界条件,如温度、压强等,平衡可发生移动,故C不符合题意;
D.容器体积以及气体的质量都不变,则无论是否达到平衡状态,密度都不变,故D不符合题意;
答案选B。
13.C
【详解】A.该反应为放热反应,正反应的活化能较低,A错误;
B.反应速率应由N2断键的快慢决定,即①②③决定,B错误;
C.合成氨反应是放热反应,反应历程的最后是指形成,即合成氨气,故需要在低温下才能获得更多的氨气,即①②③是将N2吸附并断键的过程,④⑤是形成的过程,④⑤在低温区,由题中双温区这个信息可知,两个区域相差一定温度,则①②③在高温区,C正确;
D.催化剂不能改变平衡转化率,D错误;
故选D。
14. < 放热 < < OG段表示的温度或压强高于OH段,所以反应速率快,到达平衡所需的时间短 HE段相对于GF段是在低温或低压条件下到达的平衡,因为该可逆反应的正反应是放热、气体分子数增大的反应,故降温、减压时,平衡均向正反应方向移动,C的质量分数增大
【详解】(1)如题图所示,若m和n表示温度,n温度下的反应速率比m温度下的反应速率快,故m(2)若m和n表示压强,b曲线表示的反应速率快,故m(3)OG段表示的温度或压强高于OH段,所以反应速率快,到达平衡所需的时间短,所以b曲线的OG段比a曲线的OH段陡;
(4)HE段相对于GF段是在低温或低压条件下到达的平衡,因为该可逆反应的正反应是放热、气体分子数增大的反应,故降温、减压时,平衡均向正反应方向移动,C的质量分数增大,所以a曲线的HE段高于b曲线的GF段。
15.(1)反应放热,温度升高,不利于NO的吸收;随着反应进行,FeY2-浓度降低
(2) 3·OH+NO=HNO3+H2O 汽化的H2O2与催化剂的接触更充分,产生更多的·OH,·OH浓度增大,与NO混合更充分,NO的脱除效率显著提高 180℃以后,·OH分解成O2和H2O,·OH的浓度下降,NO的脱除效率下降
(3)H2在Pd表面失去电子,传递给Fe3O4,其中的Fe(III)得到电子,被还原为Fe(II),Fe(II)又失去电子,将电子传递给,被还原为N2,Fe(II)与Fe(III)之间相互转化过程中起到了传递电子的作用
【详解】(1)反应放热,温度升高,不利于NO的吸收,且随着反应进行,FeY2-浓度降低,NO的吸收率降低;
(2)①由色谱图可知:NO被·OH氧化生成N,反应为:3·OH+NO=HNO3+H2O
②汽化的H2O2与催化剂的接触更充分,产生更多的更易与NO发生反应的·OH,·OH浓度增大,与NO混合更充分,NO的脱除效率显著提高;180℃以后,·OH分解成O2和H2O,·OH的浓度下降,NO的脱除效率下降;
(3)H2在Pd表面失去电子,传递给Fe3O4,其中的Fe(Ⅲ)得到电子,被还原为Fe(Ⅱ),Fe(Ⅱ)又失去电子,将电子传递给,被还原为N2,Fe(Ⅱ)与Fe(Ⅲ)之间相互转化过程中起到了传递电子的作用。
16. 0.15mol/ (L·min) K=c(C)2/ c(A)3·c(B) > CD > 不变 不移动
【详解】(1)3A(g)+B(g) 2C(g),2min时反应达到平衡状态(温度不变),测得C的浓度为0.2mol/L,则反应的A的浓度为0.3mol/L,反应速率v= = =0.15 mol/(L min),平衡常数表达式为:K= ;
(2)AB起始量为3mol、2mol,反应比为3:1,若起始量按照3:1投料则转化率相同,按照3:2投料相当于在3:1基础上加入B物质的量1mol,A转化率增大,B转化率减小,则A、B两反应物的转化率:α(A)>α(B);
(3)3A(g)+B(g) 2C(g)
A.速率之比等于化学方程式计量数之比,BC反应之比1:2,生成C的速率与消耗B的速率相等不能说明反应达到平衡状态,故A错误;
B.反应前后气体质量和体积不变,混合气体的密度始终不变,不能说明反应达到平衡状态,故B错误;
C.反应前后气体质量不变,气体物质的量变化,当混合气体的相对平均分子质量不变,说明反应达到平衡状态,故C正确;
D.A的质量分数不再发生变化是平衡标志,故D正确;
故答案为:CD;
(4)若升高温度,再次达平衡时,平衡常数数值变大,说明平衡正向进行,正反应为吸热反应,△H>0,
故答案为:>;
(5)若保持温度不变时,继续向原平衡混合物的容器中通入少量氦气,总压增大分压不变,平衡不移动,反应速率不变,
故答案为:不变; 不移动。
17. < = 2500 O2 CH3OH+H2O-6e-=CO2+6H+
【详解】⑴分析图1,从左到右,温度升高,CO转化率减小,即逆向移动,升温向吸热反应移动即逆向为吸热反应,正向为放热反应即△H < 0,A、B两点对应的温度相同,因此两点对应的平衡常数相等,
故答案为<;=;
⑵某温度下,充分反应后,达到平衡时测得c(CO)=0.02mol/L,则此温度下的平衡常数K
,
故答案为2500;
⑶其工作原理如图所示。氢离子往右移动,根据原电池“同性相吸”原理,右边为正极,左边为负极,燃料甲醇作负极,氧化剂作正极,因此c口通入的物质为氧气;电池负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+,
故答案为O2;CH3OH+H2O-6e-=CO2+6H+。
18.(1)
(2) 0.035 增大 <
【详解】(1)①;;
②;,根据盖斯定律①-②得,-566-181=;
(2)①根据三段式
,x=;
;
平衡后,向恒容密闭容器中再充入2、1,相当于给反应加压,该反应是气体分子数减小的反应,加压平衡正向移动,重新达到平衡时,的转化率将增大;
②若为恒压密闭容器,根据方程式计量系数,反应后气体物质的量减小,则恒压相对于恒容,相当于增大压强,平衡正向移动,平衡后NO的转化率增大,故答案为:<。
19. 平衡逆向移动 平衡不移动 平衡正向移动
【分析】化学反应CO(g)+H2O(g)CO2(g)+H2(g),平衡常数,浓度商Q的表达式跟K一样,只是K中浓度是达到平衡时物质的浓度,Q中浓度是任意时刻的物质浓度。
【详解】第1组,Q==1.07>K,平衡逆向移动;
第2组,Q=+1.0=K,平衡不移动;
第3组,Q==0.9320. 1 3 73.6 0≤c<0.4
【分析】(1)化学反应前后,气体的压强之比等于物质的量之比;
(2)反应放热或吸热的多少与参与反应的物质的量的多少有关,采用归边相等的方法来分析是确定范围的一个方法。
【详解】(1)假设氮气和氢气的转化率为α,
则生成的氨气的物质的量为2xα=,所以y=3x,化学反应前后,气体的压强之比等于物质的量之比,所以=0.9,即 x+y=4,故x=1,y=3;
(2)反应后的物质的量为3.6 mol,因压强为原来的90%,故原气体的物质的量为4 mol,应加入H23 mol,气体的物质的量由4 mol减少到平衡时的3.6 mol,由差量法求得产生0.4 mol NH3,由此推知产生2 mol NH3放出热量92 kJ,反应的热化学方程式为N2(g)+3H2(g) 2NH3(g);△H=-92 kJ/mol;
此为恒容条件下反应前后化学计量数不等的平衡问题,应采用归边相等的方法来分析:因达到平衡时c为0.4 mol,若要反应向正方向进行,c应小于0.4,故0≤c<0.4,若c=2 mol,a=0,b=0,反应逆向进行达到平衡时亦剩余0.4 mol,反应掉1.6 mol,故放×92 kJ mol-1×=73.6 kJ。
21.(1)B
(2)BC
【解析】(1)
速率方程为,根据①②中数据,v:=k×(0.10)a×(0.10)b:k×(0.20)a×(0.10)b,解之得a=1;根据②③中数据,:=k×(0.20)a×(0.10)b:k×(0.20)a×(0.20)b,解之得b=1;故选B。
(2)
反应,缩小体积,增大浓度,反应速率加快;加入催化剂,反应速率增大,而降温(活化分子数百分数减小)和减压(相等于减小物质的浓度)均使反应速率减慢,故选BC。
22. acd 1.875×10-4mol·L-1·s-1 90% 2.41%
【详解】(1)只要能减少化石燃料等资源的运用都属于“开源节流”;b、大力开采煤、石油和天然气,不能减少化石燃料的运用,故b错误;a、c、d均能减少化石燃料的运用,故a、c、d正确;
(2)根据表格,2s内v(NO)==3.75×10-4mol·L-1·min-1,同一反应同一时段内各物质反应速率之比为计量数之比,所以v(N2)=v(NO)=1.875×10-4mol·L-1·min-1;
根据表格,4s后各物质浓度不在变化,所以4s时反应已经达到平衡,所以NO的转化率为=90%;
根据表格平衡时c(NO)=1.00×10-4mol·L-1,c(CO)=2.70×10-3mol·L-1=27×10-4mol·L-1,Δc(NO)=9.00×10-4mol·L-1,根据方程式2NO+2CO2CO2+N2,可知平衡时c(CO2)=9.00×10-4mol·L-1,c(N2)=4.50×10-4mol·L-1,同温同压下气体的体积分数即物质的量分数,因容积一定,可等效为浓度所占百分数,所以气相中NO所占的体积分数为=2.41%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.室温下,某溶液中初始时仅溶有等物质的量的M和N,同时发生以下两个反应:①;②。反应①的速率可表示为,反应②的速率可表示为(、为速率常数)。反应体系中M、Z的浓度随时间变化情况如图。下列说法错误的是
A.分钟内,M的平均反应速率为
B.反应过程中,体系中Y和Z的浓度之比逐渐增大
C.反应①的活化能比反应②的活化能大
D.如果反应能进行到底,反应结束时37.5%的N转化为Y
2.Shyam Kattle等结合实验与计算机模拟结果,研究了在催化剂表面上与的反应历程,前三步历程如图所示,吸附在催化剂表面上的物种用“·”标注,表示过渡态。下列有关说法错误的是
A.物质被吸附在催化剂表面形成过渡态的过程是吸热的
B.形成过渡态的活化能为
C.前三步总反应的
D.反应历程中能量变化最大的反应方程式为
3.汽车尾气处理的反应为2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-746kJ·mol-1。下列说法正确的是
A.升高温度可使v(正)增大、v(逆)减小
B.使用高效催化剂可提高该反应的反应热
C.反应达到化学平衡状态时,v(正)(NO)=2v(逆)(N2)
D.CO和CO2的物质的量相等时,反应达到化学平衡状态
4.一定温度下,将2mol和1mol充入一定容密闭容器中,在催化剂存在下进行反应:,下列说法不正确的是
A.该反应的二氧化硫可全部转化为三氧化硫
B.反应过程中和物质的量之和不变
C.通过调控反应条件,可以提高该反应进行的程度
D.达到平衡时,容器内压强不再改变
5.由下列生产或实验得出的相应结论不正确的是
事实 结论
A 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 当其他条件不变时,升高反应温度,化学反应速率加快
B 工业合成氨,在400~500°C比室温更适合合成氨的反应 升高温度提高平衡转化率
C 在容积可变的密闭容器中发生反应:2NH3(g)N2H4(l)+H2(g),把容积的体积缩小一半 正、逆反应速率均加快
D 向A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 当其他条件不变时,催化剂可以改变化学反应速率
A.A B.B C.C D.D
6.四个体积相同的密闭容器中在一定条件下发生反应:2SO2+O22 SO3.反应开始时,反应速率最大的是。
容 器 温 度 SO2(mol) O2(mol) 催化剂
A 500℃ 10 5 —
B 500℃ 10 5 V2O5
C 450℃ 8 5 —
D 500℃ 8 5 —
A.A B.B C.C D.D
7.在300mL的密闭容器中,加入镍粉并充入一定量的CO气体,一定条件下发生反应:,已知该反应的平衡常数与温度的关系如表所示。下列说法不正确的是
温度(℃) 25 80 230
平衡常数/ 2
A.上述生成的反应为放热反应
B.25℃时反应的平衡常数为
C.80℃反应达到平衡时,测得,则的平衡浓度为
D.在80℃时,测得某时刻、CO的浓度均为,则此时
8.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法不正确的是( )
A.化学反应的历程一般为:
B.CH4+CO2→CH3COOH过程中,只有C-H键发生断裂
C.①→②放出能量并形成了C-C键
D.催化剂能增大活化分子百分数从而加快了该反应的速率
9.已知化合物A与在一定条件下反应生成化合物B与,其反应历程如图所示,其中TS表示过渡态,I表示中间体。下列说法正确的是
A.TS2所在的基元反应中活化分子百分数最大
B.该历程中的最大能垒(活化能)
C.使用催化剂只降低正反应的活化能,反应的焓变不变
D.反应达到平衡状态后,升温使平衡逆向移动
10.在容积为的恒容密闭容器中充入和,在不同温度下反应合成甲醇:,反应相同时间时的转化率与温度的关系如图所示。若保持温度为,分别按Ⅱ和Ⅲ中的不同方式向容器中投入反应物,发生上述反应,相关信息如下表。
编号 起始物质的量/ 平衡转化率
Ⅰ 1 3 0 0
Ⅱ 2 6 0 0
Ⅲ 0.4 2 0.2 0.4 —
下列说法正确的是
A.反应在高温下能自发进行
B.Ⅱ中反应达到平衡时,
C.时,反应的平衡常数为
D.Ⅲ中反应达到平衡前,v(正)>v(逆)
11.在373K时,把0.5molN2O4气通入体积为5L的恒容真空密闭容器中立即出现红棕色,反应进行到2s时,NO2的浓度为0.02mol/L,在60s时体系达到平衡,此时容器内压强为开始压强的1.6倍。下列说法正确的是
A.前2svN2O4=0.01mol/L·s
B.2s时体系内压强为开始时的1.1倍
C.平衡时体系内含N2O40.25mol
D.平衡时若压缩容器体积可提高N2O4的转化率
12.一定温度下向2L体积固定的密闭容器中通入两种物质发生化学反应,反应中各物质(均为气体)的物质的量随时间变化如图所示。下列说法正确的是( )
A.该反应的化学方程式为3B+4D 6A+2C
B.6s前任意时间点,正反应速率一定大于逆反应速率
C.反应进行到6s时达到化学平衡状态,此时无论改变什么条件平衡状态都不会变化
D.当容器内气体密度保不变时,就说明反应达到平衡状态了
13.工业合成氨气需要选择合适的温度来兼顾化学反应速率及产率,科学家研制出了Ti-H-Fe双温区催化剂,其催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
A.该反应正反应的活化能高于逆反应的活化能
B.该反应的反应速率由过程④⑤决定
C.①②③在高温区发生,④⑤在低温区发生
D.增大Fe用量,不能改变反应的焓变,但可以提高N2的平衡转化率
二、填空题
14.对于反应,压强或温度对C的质量分数的影响如图所示:
(1)若m、n表示不同温度,则m (填“>”或“<”)n,正反应为 (填“放热”或“吸热”)反应。
(2)若m、n表示不同压强,则m (填“>”或“<”)n, (填“<”“>”或“=”)。
(3)b曲线的OG段比a曲线的OH段陡的原因是 。
(4)a曲线的HE段高于b曲线的GF段的原因是 。
15.烟气中含有的高浓度SO2、氮氧化物有害物质及酸性废水中的,在排放前必须进行脱硫、脱硝、脱氮处理。
(1)H2Y2-是乙二胺四乙酸根离子,与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。其吸收原理:
FeY2-(aq)+NO(g) FeY2-(NO)(aq) ΔH<0。将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如图1所示。时间越长,NO吸收率越低的原因是 。
(2)H2O2在催化剂α-FeOOH的表面上,分解产生·OH。·OH较H2O2和O2更易与烟气中的NO、SO2发生反应。反应后所得产物的离子色谱如图2所示。
①写出·OH氧化NO反应的化学方程式: 。
②当H2O2浓度一定时,NO的脱除效率与温度的关系如图3所示。升温至80℃以上,大量汽化的H2O2能使NO的脱除效率显著提高的原因是 ,温度高于180℃,NO的脱除效率降低的原因是 。
(3)用H2消除酸性废水中的是一种常用的电化学方法。其反应原理如图4所示。
请结合上述反应过程用合适的文字描述Fe(III)、Fe(II)在其中的作用: 。
16.t℃时,将3 mol A和2 mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) 2C(g),2 min时反应达到平衡状态(温度不变),测得C的浓度为0.2 mol/L,请填写下列空白:
(1)该过程用A表示的反应速率为:v(A)= ;该温度下该反应的化学平衡常数表达式为 。
(2)比较达到平衡时,A、B两反应物的转化率:α(A) α(B)(填“>”、“=”或“<”)。
(3)判断反应达到平衡状态的依据是(填字母序号) 。
A.生成C的速率与消耗B的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.A的质量分数不再发生变化
(4)若升高温度,再次达平衡时,平衡常数数值变大,则该反应的 H 0(填“>”、“=”或“<”)。
(5)若保持温度不变时,继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,则化学反应速率会 (填“加快”、“减慢”或“不变”),化学平衡将 (填“正反应方向移动”、“逆反应方向移动”或“不移动”)。
17.甲醇是一种重要的化工原料又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g)CH3OH(g),CO的平衡转化率与温度,压强的关系如图1所示。
由图可判断△H 0,A、B两点对应的平衡常数关系是KA KB(填“>、<、=”)。
(2)某温度下,充分反应后,达到平衡时测得c(CO)=0.02mol/L,则此温度下的平衡常数K= 。
(3)我国在甲醇燃料电池技术方面获得新突破,组装出自呼吸电池及主动式电池。其工作原理如图2所示。该电池工作时,c口通入的物质为 (填化学式);电池负极的电极反应式为 。
18.硝酸工业中产生的是一种大气污染物,可以通过如下反应处理:
(1)已知:;;;。则 。
(2)在一定温度下,向体积为2L的密闭容器中充入4、2。
①若为恒容密闭容器,在10min时达到平衡状态,压强为原来的,该反应的平衡常数为 (保留2位有效数字);此时NO的转化率a%;平衡后,向恒容密闭容器中再充入2、1,重新达到平衡时,的转化率将 (填“增大”、“不变”或“减小”)。
②若为恒压密闭容器,平衡后的转化率为b%,则a% b%(填“<”、“=”或“>”)。
19.已知800℃时,化学反应CO(g)+H2O(g)CO2(g)+H2(g)达到平衡,K=1.试推断在下列情况下该平衡移动的方向,填入下表:
序号 CO/mol·L 1 H2O/mol·L 1 CO2/mol·L 1 H2/mol·L 1 平衡移动的方向
1 0.3 0.5 0.4 0.4
2 1.0 0.3 0.5 0.6
3 0.8 1.6 0.7 1.7
20.在恒温恒容的密闭容器中,通入xmol N2和ymol H2发生反应N2+ 3H22NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
⑴通过计算说明起始充入N2和H2的物质的量分别为:x= ,y= 。
⑵若起始加入N2、H2和NH3的物质的量分别为amol、bmol、cmol,达平衡时各物质的含量与上述平衡完全相同。
①若c=2,在相同的条件下达平衡时,该反应吸收的热量为 kJ。
②若维持反应向正反应方向进行,则起始时c的取值范围为 。
21.CO是一种常用的还原剂。一定条件下,反应的速率方程为(k为速率常数,只与温度、催化剂有关,与浓度无关)。某温度下,该反应在不同浓度下反应速率如下表所示:
反应速率
① 0.10 0.10 v
② 0.20 0.10
③ 0.20 0.20
(1)根据表中测定结果,下列推断正确的是_______(填字母)。
A.a=1、b=2 B.a=1、b=1 C.a=2、b=2 D.a=2、b=1
(2)改变下列一个条件,反应速率增大的是_______(填字母)。
A.降温 B.缩小体积 C.加入催化剂 D.减压
22.能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是 (填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO2CO2+N2 H<0.为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s 0 1 2 3 4 5
C(NO)(×10-4mol·L-1) 10.0 4.50 2.50 1.50 1.00 1.00
C(CO)(×10-3mol·L-1) 3.60 3.05 2.85 2.75 2.70 2.70
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
前2s内的平均反应速率v(N2)= ;达到平衡时,NO的转化率为 ,气相中NO所占的体积分数为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】由图可知,M的起始浓度为0.5mol/L,反应①的速率,反应②的速率,k1、k2为速率常数,则同一反应体系中反应①、②的速率之比始终不变,所以Y、Z的浓度变化之比始终不变;①;②,则体系中始终有c(Y)+c(Z)=△c(A),由图可知,30min时△c(M)=0.5mol/L-0.300mol/L=0.2mol/L,c(Z)=0.125mol/L,则c(Y)=0.2mol/L-0.125mol/L=0.075mol/L,即反应开始后,体系中Y和Z的浓度之比为0.075mol/L:0.125mol/L=3:5;结合反应的活化能与反应速率关系比较反应①、②的活化能大小,根据和转化率公式计算反应速率和转化率,据此分析解答。
【详解】A.由图可知,30min时△c(M)=0.5mol/L-0.300mol/L=0.2mol/L,M的平均反应速率为,故A正确;
B. 反应①的速率,反应②的速率,k1、k2为速率常数,则同一反应体系中反应①、②的速率之比始终不变,所以Y、Z的浓度变化之比始终不变,故B错误;
C. 由图可知,30min时△c(M)=0.5mol/L-0.300mol/L=0.2mol/L,c(Z)=0.125mol/L,则c(Y)=△c(M )-c(Z)=0.2mol/L-0.125mol/L=0.075mol/L,则v(Y):v(Z)=0.075mol/L:0.125mol/L=3:5,即v(Y)<v(Z)、v1<v2,反应的活化能越高,反应速率越慢,所以反应①的活化能大于反应②的活化能,故C正确;
D. 由上述分析可知,体系中Y和Z的浓度之比为3:5,所以反应能进行到底时,c(Y)+c(Z)=0.5mol/L,则c(Z)=×0.5mol/L=0.3125mol/L,c(Y)= ×0.5mol/L=0.1875mol·L-1,反应结束时A转化为Z的转化率为,故D正确;
故选B。
2.D
【分析】利用反应前后能量的变化,分析反应的反应热,据此分析。
【详解】A.由图可知,被吸附在催化剂表面的物质形成过渡态的过程是吸热的,A正确;
B.从图中能量差可知,过渡态的能量为,则该步的活化能为,B正确;
C.根据图示首尾能量数据可知,该过程的总能量降低了2. 05 eV,前三步的总反应的,C正确;
D.前三步中能量变化最大的是第二步,该步骤分两步形成稳定的微粒,反应方程式为,D错误;
故本题选D。
3.C
【详解】A.升高温度,v(正)、v(逆)均增大,A项错误;
B.使用高效催化剂可降低反应的活化能,但不能改变反应的反应热,B项错误;
C.反应达到化学平衡状态时,同一物质表示的正、逆反应速率相等,不同物质表示的正、逆反应速率之比等于化学计量数之比,则v(正)(NO)=2v(逆)(N2),C项正确;
D.反应达到平衡时各物质物质的量保持不变,但不一定相等、也不一定等于化学计量数之比,故CO和CO2的物质的量相等时,反应不一定达到化学平衡状态,D项错误;
答案选C。
4.A
【详解】A.可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物,故A错误;
B.根据S元素守恒可知,S的总的物质的量保持不变,即SO2和SO3物质的量之和一定为2mol,故B正确;
C.可通过调节反应温度等条件,可提高反应进行的程度,故C正确;
D.该反应前后气体分子数之和不相等,即压强是一变量,达到平衡时,容器内压强不再改变,故D正确;
故选:A。
5.B
【详解】A.只有温度不同,可说明升高反应温度,化学反应速率加快,A正确;
B.合成氨气的反应是放热反应,温度升高,化学平衡逆向移动,导致NH3的平衡含量降低。在工业合成氨,反应温度在400~500°C是由于在该温度下催化剂活性最大,反应速率加快,而不是提高反应物的平衡转化率,B错误;
C.该反应的正反应是气体体积减小的反应,把容积的体积缩小一半,体积减小、气体的压强增大,则正、逆反应速率都加快,C正确;
D.B试管中加入2~ 3滴FeCl3溶液,A中没有使用催化剂,二者反应速率不同,可以说明催化剂对速率的影响,D正确;
故合理选项是B。
6.B
【详解】对比A与B,B中使用催化剂,其它条件相同,该反应需在催化剂条件发生反应,故反应速率B > A;对比A与D,A中二氧化硫的浓度比D中的大,其它条件相同,故反应速率A > D;对比C与D,D中温度比C中高,其它条件相同,故反应速率D > C;故反应速率B>A>D>C,综上所述,故选B。
7.D
【详解】A.根据化学平衡常数与温度关系可知:升高温度,化学平衡常数K减小,说明升高温度,化学平衡逆向移动,逆反应为吸热反应,所以该反应的正反应为放热反应,A正确;
B.在25℃时,的化学平衡常数K=;则反应的化学平衡常数K1=,B正确;
C.80℃达到平衡时,测得n(CO)=0.3 mol,c(CO)=,由于该温度下的化学平衡常数K=2,K==2,所以Ni(CO)4的平衡浓度c[Ni(CO)4]=2×14=2 mol L 1,C正确;
D.80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol L 1,则Qc=,80℃时化学平衡常数K=2,8>2,说明此时反应逆向进行,故反应速率:v(正)<v(逆),D错误;
故合理选项是D。
8.B
【详解】A.化学反应的历程一般为:普通反应分子获得能量后成为活化分子,活化分子间发生有效碰撞,形成新的化学键释放能量,生成产物分子,故A正确;
B.据图可知CH4+CO2→CH3COOH过程中CO2分子中的C=O键也会发生断裂形成-COOH结构,故B错误;
C.据图可知①→②的焓值降低,过程为放热过程,有C-C键形成,故C正确;
D.催化剂降低反应活化能,从而增大活化分子百分数加快反应速率,故D正确;
综上所述答案为B。
9.D
【详解】A.TS2所在的基元反应活化能最大,活化分子百分数最小, A错误;
B.正反应的活化能是指正向进行的反应的活化能,图中①③⑤均为正反应活化能,其中活化能最大的为相对能量大的③,其能量为,B错误;
C.催化剂可以同等程度降低正逆反应的活化能,反应的焓变不变,C错误;
D.从图中可以看出,反应物总能量高于生成物总能量,该反应为放热反应,升高温度,平衡逆向移动,D正确;
故选D。
10.D
【详解】A.由图象可知,二氧化碳的转化率达到最高点之后,随温度升高转化率降低,说明正反应为放热反应,即H<0,又反应为气体体积减小的反应,故为S<0,所以反应低温下能自发反应,故A错误;
B.Ⅱ相对于Ⅰ,气体的物质的量增加,增大压强,平衡正向移动,转化率大于60%,故B错误;
C.时,,则根据三段式
则平衡常数K==,故C错误;
D.Ⅲ中反应的浓度商Q==0.1
故选D。
11.B
【详解】A.2秒时NO2的浓度为0.02mol/L,则转化的N2O4的浓度为0.01mol/L,则前2秒以N2O4的浓度变化表示的平均反应速度为:,故A错误;
B.2秒时NO2的物质的量为5L×0.02mol/L=0.1mol,由N2O42NO2可知消耗的N2O4为0.05mol,故2s时N2O4的物质的量为0.5mol-0.05mol=0.45mol,反应前后的物质的量之比等于压强之比,则在2秒时体系内的压强为开始时的(0.1mol+0.45mol)/0.5mol=1.1倍,故B正确;
C.设转化的N2O4的物质的量为x,则平衡时N2O4的物质的量为0.5mol-x,NO2的物质的量为2x,由平衡时容器内压强为开始时的1.6倍,则=1.6,解得x=0.3mol,平衡时N2O4的物质的量为0.5-0.3=0.2mol,故C错误;
D.由N2O42NO2,压缩容器体积即增大压强,平衡逆向移动,N2O4的转化率降低,故D错误;
故选:B。
12.B
【分析】由图可知,随着时间的变化,A、D的物质的量在增大,是生成物;B、C的物质的量在减小,是反应物;根据各物质的变化的物质的量之比等于化学计量数之比,得到各物质的化学计量数之比,得到化学方程式;随着时间反应进行到6s时,各物质的物质的量不再发生变化,达到化学平衡状态,由此分析。
【详解】A.由图可知,B、C的物质的量减小,A、D的物质的量增加,则B、C为反应物、A、D为生成物,B、C、A、D的Δn之比为(1-0.4)mol∶(1-0.2)mol∶(1.2-0)mol∶(0.4-0)mol=3:4:6:2,反应速率之比等于化学计量数之比,等于相同时间的物质的量变化量之比,6s时达到平衡,则反应3B+4C 6A+2D,故A不符合题意;
B.由图可知,6s前平衡正向移动,则正反应速率大于逆反应速率,故B符合题意;
C.反应进行到6s时达到化学平衡状态,改变外界条件,如温度、压强等,平衡可发生移动,故C不符合题意;
D.容器体积以及气体的质量都不变,则无论是否达到平衡状态,密度都不变,故D不符合题意;
答案选B。
13.C
【详解】A.该反应为放热反应,正反应的活化能较低,A错误;
B.反应速率应由N2断键的快慢决定,即①②③决定,B错误;
C.合成氨反应是放热反应,反应历程的最后是指形成,即合成氨气,故需要在低温下才能获得更多的氨气,即①②③是将N2吸附并断键的过程,④⑤是形成的过程,④⑤在低温区,由题中双温区这个信息可知,两个区域相差一定温度,则①②③在高温区,C正确;
D.催化剂不能改变平衡转化率,D错误;
故选D。
14. < 放热 < < OG段表示的温度或压强高于OH段,所以反应速率快,到达平衡所需的时间短 HE段相对于GF段是在低温或低压条件下到达的平衡,因为该可逆反应的正反应是放热、气体分子数增大的反应,故降温、减压时,平衡均向正反应方向移动,C的质量分数增大
【详解】(1)如题图所示,若m和n表示温度,n温度下的反应速率比m温度下的反应速率快,故m
(4)HE段相对于GF段是在低温或低压条件下到达的平衡,因为该可逆反应的正反应是放热、气体分子数增大的反应,故降温、减压时,平衡均向正反应方向移动,C的质量分数增大,所以a曲线的HE段高于b曲线的GF段。
15.(1)反应放热,温度升高,不利于NO的吸收;随着反应进行,FeY2-浓度降低
(2) 3·OH+NO=HNO3+H2O 汽化的H2O2与催化剂的接触更充分,产生更多的·OH,·OH浓度增大,与NO混合更充分,NO的脱除效率显著提高 180℃以后,·OH分解成O2和H2O,·OH的浓度下降,NO的脱除效率下降
(3)H2在Pd表面失去电子,传递给Fe3O4,其中的Fe(III)得到电子,被还原为Fe(II),Fe(II)又失去电子,将电子传递给,被还原为N2,Fe(II)与Fe(III)之间相互转化过程中起到了传递电子的作用
【详解】(1)反应放热,温度升高,不利于NO的吸收,且随着反应进行,FeY2-浓度降低,NO的吸收率降低;
(2)①由色谱图可知:NO被·OH氧化生成N,反应为:3·OH+NO=HNO3+H2O
②汽化的H2O2与催化剂的接触更充分,产生更多的更易与NO发生反应的·OH,·OH浓度增大,与NO混合更充分,NO的脱除效率显著提高;180℃以后,·OH分解成O2和H2O,·OH的浓度下降,NO的脱除效率下降;
(3)H2在Pd表面失去电子,传递给Fe3O4,其中的Fe(Ⅲ)得到电子,被还原为Fe(Ⅱ),Fe(Ⅱ)又失去电子,将电子传递给,被还原为N2,Fe(Ⅱ)与Fe(Ⅲ)之间相互转化过程中起到了传递电子的作用。
16. 0.15mol/ (L·min) K=c(C)2/ c(A)3·c(B) > CD > 不变 不移动
【详解】(1)3A(g)+B(g) 2C(g),2min时反应达到平衡状态(温度不变),测得C的浓度为0.2mol/L,则反应的A的浓度为0.3mol/L,反应速率v= = =0.15 mol/(L min),平衡常数表达式为:K= ;
(2)AB起始量为3mol、2mol,反应比为3:1,若起始量按照3:1投料则转化率相同,按照3:2投料相当于在3:1基础上加入B物质的量1mol,A转化率增大,B转化率减小,则A、B两反应物的转化率:α(A)>α(B);
(3)3A(g)+B(g) 2C(g)
A.速率之比等于化学方程式计量数之比,BC反应之比1:2,生成C的速率与消耗B的速率相等不能说明反应达到平衡状态,故A错误;
B.反应前后气体质量和体积不变,混合气体的密度始终不变,不能说明反应达到平衡状态,故B错误;
C.反应前后气体质量不变,气体物质的量变化,当混合气体的相对平均分子质量不变,说明反应达到平衡状态,故C正确;
D.A的质量分数不再发生变化是平衡标志,故D正确;
故答案为:CD;
(4)若升高温度,再次达平衡时,平衡常数数值变大,说明平衡正向进行,正反应为吸热反应,△H>0,
故答案为:>;
(5)若保持温度不变时,继续向原平衡混合物的容器中通入少量氦气,总压增大分压不变,平衡不移动,反应速率不变,
故答案为:不变; 不移动。
17. < = 2500 O2 CH3OH+H2O-6e-=CO2+6H+
【详解】⑴分析图1,从左到右,温度升高,CO转化率减小,即逆向移动,升温向吸热反应移动即逆向为吸热反应,正向为放热反应即△H < 0,A、B两点对应的温度相同,因此两点对应的平衡常数相等,
故答案为<;=;
⑵某温度下,充分反应后,达到平衡时测得c(CO)=0.02mol/L,则此温度下的平衡常数K
,
故答案为2500;
⑶其工作原理如图所示。氢离子往右移动,根据原电池“同性相吸”原理,右边为正极,左边为负极,燃料甲醇作负极,氧化剂作正极,因此c口通入的物质为氧气;电池负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+,
故答案为O2;CH3OH+H2O-6e-=CO2+6H+。
18.(1)
(2) 0.035 增大 <
【详解】(1)①;;
②;,根据盖斯定律①-②得,-566-181=;
(2)①根据三段式
,x=;
;
平衡后,向恒容密闭容器中再充入2、1,相当于给反应加压,该反应是气体分子数减小的反应,加压平衡正向移动,重新达到平衡时,的转化率将增大;
②若为恒压密闭容器,根据方程式计量系数,反应后气体物质的量减小,则恒压相对于恒容,相当于增大压强,平衡正向移动,平衡后NO的转化率增大,故答案为:<。
19. 平衡逆向移动 平衡不移动 平衡正向移动
【分析】化学反应CO(g)+H2O(g)CO2(g)+H2(g),平衡常数,浓度商Q的表达式跟K一样,只是K中浓度是达到平衡时物质的浓度,Q中浓度是任意时刻的物质浓度。
【详解】第1组,Q==1.07>K,平衡逆向移动;
第2组,Q=+1.0=K,平衡不移动;
第3组,Q==0.93
【分析】(1)化学反应前后,气体的压强之比等于物质的量之比;
(2)反应放热或吸热的多少与参与反应的物质的量的多少有关,采用归边相等的方法来分析是确定范围的一个方法。
【详解】(1)假设氮气和氢气的转化率为α,
则生成的氨气的物质的量为2xα=,所以y=3x,化学反应前后,气体的压强之比等于物质的量之比,所以=0.9,即 x+y=4,故x=1,y=3;
(2)反应后的物质的量为3.6 mol,因压强为原来的90%,故原气体的物质的量为4 mol,应加入H23 mol,气体的物质的量由4 mol减少到平衡时的3.6 mol,由差量法求得产生0.4 mol NH3,由此推知产生2 mol NH3放出热量92 kJ,反应的热化学方程式为N2(g)+3H2(g) 2NH3(g);△H=-92 kJ/mol;
此为恒容条件下反应前后化学计量数不等的平衡问题,应采用归边相等的方法来分析:因达到平衡时c为0.4 mol,若要反应向正方向进行,c应小于0.4,故0≤c<0.4,若c=2 mol,a=0,b=0,反应逆向进行达到平衡时亦剩余0.4 mol,反应掉1.6 mol,故放×92 kJ mol-1×=73.6 kJ。
21.(1)B
(2)BC
【解析】(1)
速率方程为,根据①②中数据,v:=k×(0.10)a×(0.10)b:k×(0.20)a×(0.10)b,解之得a=1;根据②③中数据,:=k×(0.20)a×(0.10)b:k×(0.20)a×(0.20)b,解之得b=1;故选B。
(2)
反应,缩小体积,增大浓度,反应速率加快;加入催化剂,反应速率增大,而降温(活化分子数百分数减小)和减压(相等于减小物质的浓度)均使反应速率减慢,故选BC。
22. acd 1.875×10-4mol·L-1·s-1 90% 2.41%
【详解】(1)只要能减少化石燃料等资源的运用都属于“开源节流”;b、大力开采煤、石油和天然气,不能减少化石燃料的运用,故b错误;a、c、d均能减少化石燃料的运用,故a、c、d正确;
(2)根据表格,2s内v(NO)==3.75×10-4mol·L-1·min-1,同一反应同一时段内各物质反应速率之比为计量数之比,所以v(N2)=v(NO)=1.875×10-4mol·L-1·min-1;
根据表格,4s后各物质浓度不在变化,所以4s时反应已经达到平衡,所以NO的转化率为=90%;
根据表格平衡时c(NO)=1.00×10-4mol·L-1,c(CO)=2.70×10-3mol·L-1=27×10-4mol·L-1,Δc(NO)=9.00×10-4mol·L-1,根据方程式2NO+2CO2CO2+N2,可知平衡时c(CO2)=9.00×10-4mol·L-1,c(N2)=4.50×10-4mol·L-1,同温同压下气体的体积分数即物质的量分数,因容积一定,可等效为浓度所占百分数,所以气相中NO所占的体积分数为=2.41%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
