第三章物质在水溶液中的行为单元测试(含解析)2023---2024学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第三章物质在水溶液中的行为单元测试(含解析)2023---2024学年上学期高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-23 13:43:28 | ||
图片预览




文档简介
第三章 物质在水溶液中的行为 单元测试
一、单选题
1.25℃时,下列各溶液中一定能大量共存的离子组是
A.由水电离产生的c(H+)=1×10-13mol/L的溶液中:K+、NO、Cl-、HCO
B.使酚酞溶液呈红色的溶液中:Mg2+、Cu2+、SO、K+
C.澄清透明的溶液中:Cu2+、Mg2+、SO、Cl-
D.0.1mol/L的Fe(NO3)2溶液中:Na+、H+、K+、Cl-
2.下列有关化学用语表示正确的是
A.乙酸乙酯、甲醛和淀粉的实验式都为
B.甲烷二氟代物CH2F2的电子式为
C.中子数为6和8的碳原子的结构示意图都为
D.纯碱溶液呈碱性的原因:
3.下列应用与反应原理设计不一致的是
A.明矾净水:Al3++3H2OAl(OH)3+3H+
B.热的纯碱溶液清洗油污:CO+H2OHCO+OH-
C.配制氯化亚锡溶液时加入氢氧化钠:SnCl2+H2OSn(OH)Cl+HCl
D.用TiCl4制备TiO2:TiCl4+(x+2)H2O(过量)TiO2 xH2O↓+4HCl
4.已知HCl难溶于CCl4,极易溶于水,下列装置中,不适宜于作HCl气体吸收的是图中的
A. B. C. D.
5.下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
A B C D
强电解质 Fe NaCl CaCO3 HNO3
弱电解质 CH3COOH NH3 H3PO4 Fe(OH)3
非电解质 C12H22O11(蔗糖) BaSO4 C2H5OH H2O
A.A B.B C.C D.D
6.下列解释实验事实的离子方程式正确的是
A.Cu和稀HNO3反应:Cu +2NO+ 4H+= Cu2+ +2NO2↑+2H2O
B.FeCl3溶液中滴入KSCN溶液,显红色:Fe3++3SCN-=Fe(SCN)3↓
C.将等体积的SO2和Cl2通入水中:SO2+Cl2+ 2H2O=SO+2Cl-+4H+
D.用PH=4的醋酸溶液吸收NH3:NH3 +H+=NH
7.下图为室温时水溶液中M2+的存在形式与pH的关系,其中纵坐标为M2+或M(OH)物质的量浓度的对数。下列说法不正确的是
A.室温时,M(OH)2(s)的溶度积常数为1×10-17
B.沉淀法分离M2+需控制pH在8~12之间
C.pH<8时,M元素主要以M2+形式存在,pH>12时,主要以M(OH)-形式存在
D.升高温度,可以实现从b点移动到a点
8.向一定体积的碳酸钠和硫酸钠混合溶液中先后滴加等体积、等浓度的溶液和稀盐酸,d点沉淀只含有一种物质。反应过程中产生沉淀或气体的质量与加入溶液体积的关系如图所示。
下列说法正确的是
A.
B.稀盐酸的浓度为
C.原溶液中
D.c点溶液中发生反应的离子方程式为
9.短周期主族元素W、X、Y、Z的原子序数依次增大,W、Z同主族,W、Y可形成阴离子,X是四种元素中唯一的金属,X、Z可形成阴离子,下列说法错误的是
A.W、Z有相同的最高正价
B.Y的气态氢化物稳定性比W的弱
C.X、Y、Z、W的原子半径依次减小
D.X、Z形成的二元化合物的水溶液显酸性
10.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,363K时Ksp(SrSO4)最大
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
11.设为阿伏加德罗常数的值。下列说法中正确的是
A.常温下,的溶液中数目为
B.1 L 0.1 mol·L NaCN溶液中HCN与的总数目为
C.常温下,1 L 的溶液中,由水电离出的数目为
D.0.1 mol 和0.1 mol 充入密闭容器中充分反应,转移的电子数为
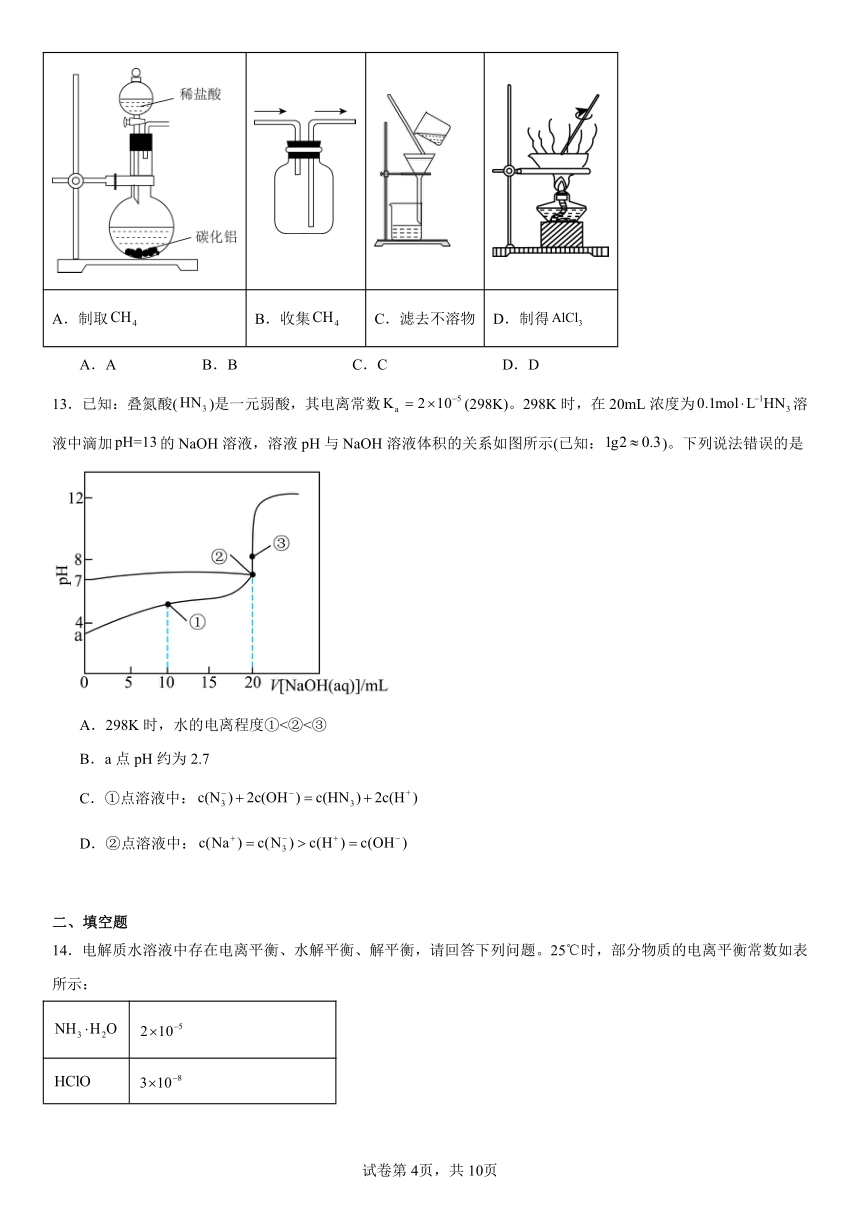
12.实验室以碳化铝(含少量C和)和盐酸为原料在室温下反应制取甲烷并获得,下列图示装置不能达到相应实验目的的是
已知:。
A.制取 B.收集 C.滤去不溶物 D.制得
A.A B.B C.C D.D
13.已知:叠氮酸()是一元弱酸,其电离常数(298K)。298K时,在20mL浓度为溶液中滴加的NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示(已知:)。下列说法错误的是
A.298K时,水的电离程度①<②<③
B.a点pH约为2.7
C.①点溶液中:
D.②点溶液中:
二、填空题
14.电解质水溶液中存在电离平衡、水解平衡、解平衡,请回答下列问题。25℃时,部分物质的电离平衡常数如表所示:
(1)的第二级电离平衡常数的表达式
(2)溶液中离子浓度由大到小的顺序是 ,水解反应的平衡常数 (保留两位有效数字)
(3)少量通入过量的溶液中,发生反应的离子方程式为
(4)相同温度下,等浓度的溶液、溶液和溶液,三种溶液的由大到小的顺序为
(5)是一种二元弱酸,25℃不同时,、、的物种分布如下图所示:
①向的溶液中逐滴滴加溶液,写出由3~5时所发生反应的离子方程式:
②时,溶液
③请结合相关平衡常数说明的酸碱性
④将和的溶液等体积混合,所得溶液中 (用只含、、三种粒子的表达式表示)
15.氯化亚铜(CuCl)是常用的催化剂。以低品位铜矿(主要成分为CuS、和铁的氧化物等)为原料制备CuCl步骤如下:
(1)“氧化浸取”。铜元素全部转化为,铁元素全部转化为。
①、和硫酸反应生成、和S,其化学方程式为 。
②为提高铜元素的浸出率,工艺上可采取的措施有 (填字母)。
A.将铜矿粉碎并搅拌 B.增加铜矿的投料量
C.适当提高硫酸浓度 D.适当缩短反应时间
(2)“除铁锰”。依次用氨水沉铁、用氨水-混合溶液沉锰。
①用氨水调节溶液的pH为3时,为 。{室温下,}
②向除铁后的溶液中滴加氨水-混合溶液,反应生成的离子方程式为 。
(3)“还原”。溶液、NaCl溶液和溶液反应生成CuCl沉淀。
已知:CuCl易被氧化,易与形成可溶的。
①反应生成CuCl的离子方程式为 。
②如图所示,和其他条件相同时,CuCl产率随增大先升高后降低的原因是 。
③如图所示,其他条件相同时,CuCl产率随反应时间延长而降低的原因是 。
16.应用化学反应原理知识解决下列问题
(1)写出醋酸(CH3COOH) 的电离方程式: 。
(2)明矾净水的原理为(用离子方程式表示) 。
(3)一定条件下,56g金属铁与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,该反应的热化学方程式为 。
(4)现有浓度为0.1mol/L 的三种电解质溶液①NaHCO3 ②Na2CO3 ③NaOH 这三种溶液的pH 由小到大的顺序是 (填编号)。
(5)常温下,下列事实能证明HA是弱电解质的是 (填编号)。
a.某NaA溶液的pH=9
b.用HA 溶液做导电实验,灯泡很暗
c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多d.0.1mol/LHA 溶液的pH≈2.8
(6)已知在100℃时,水的离子积为1×10-12,此时将 pH= 11 的 NaOH 溶液V1 L 与pH=2的H2SO4溶液V2 L均匀混合后,若所得混合溶液的pH=10,则V1: V2为 。
17.(1)某浓度的氨水中存在平衡,+、如想增大的浓度而不增大的浓度,应采取的措施是 (填字母)。
A.适当升高温度 B.加入NH4Cl固体 C.通入 D.加入少量浓盐酸,
(2)常温下,有c()相同、体积相同的醋酸和盐酸两种溶液,采取以下措施∶
①加适量醋酸钠晶体后,两溶液中的c()变化是醋酸溶液中c() (填“增大”“减小”或“不变”),盐酸中c() (填“增大”“减小”或“不变”)。
②加水稀择10倍后,醋酸溶液中的c() (填">"="或*<")盐酸溶液中的c()。
③加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积。醋酸 (填>、=或<)盐酸
④使温度都升高20℃,溶液中c():醋酸 (填“>”“=”或“<”)盐酸。
⑤分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是 (填字母)。(①表示盐酸,②表示醋酸)
(3)将0.1mol/L的加水稀释,有关稀释后醋酸溶液的说法中,正确的是 (填字母)
A.电离程度增大 B.溶液中离子总数增多 C.溶液导电性增强 D.溶液中醋酸分子增多
(4)常温下的电离常数为1.0×10-5,则0.1mol/L的溶液的pH= 。
18.A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是 ,E是 ;
(2)用水稀释0.1 mol·L-1B溶液时,溶液中随着水量的增加而减小的是 (填写序号)。
a. b. c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是 (填写序号)。
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E
d.E溶液里有镁粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中 曲线(填写序号)。
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为 。
19.按要求回答问题:
(1)将已配制好的饱和三氯化铁溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为:
(2)实验室用氨水和硫酸铝溶液制取氢氧化铝,离子方程式为
(3)过氧化钠作为供氧剂时发生的化学反应(化学方程式):
(4)请用双线桥法标注以下氧化还原反应,标明电子转移数目,3Cl2+6KOH5KCl+KClO3+3H2O ,氧化产物:还原产物= (物质的量之比)。
(5)请用单线桥法标注以下氧化还原反应,标明电子转移数目:2+5H2O2+6H+=2Mn2++5O2↑+5H2O ,还原剂是 。
20.某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①配制盐酸和溶液;
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用溶液中和过量的盐酸,记录所消耗NaOH溶液的体积;
④加入盐酸。
请回答下列问题:
(1)正确的操作顺序是 (填序号)。
(2)测定过程中发生反应的离子方程式为 ; 。
(3)如图为实验室某浓盐酸试剂瓶上的标签的有关内容,该浓盐酸中溶质的物质的量浓度为 。
用该浓盐酸配制本实验所需的盐酸,需要的仪器有容量瓶、烧杯、玻璃棒、 (从下列图中选择,写出名称)。
下列实验操作对所配制的盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
①容量瓶在使用前未干燥,里面有少量蒸馏水: ;
②未洗涤烧杯及玻璃棒: 。
(4)某同学4次测定所消耗的NaOH溶液的体积如下:
测定次数 第1次 第2次 第3次 第4次
V[NaOH(aq)]/mL 13.00 12.90 13.10 13.00
根据这个同学的实验数据,计算这种药片中碳酸钙的质量分数为 。
21.Cu可形成多种配合物,某同学在探究配合物的形成时做了以下实验,根据下列信息回答问题:
(1)向盛有硫酸铜水溶液的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色的透明溶液,请写出先后发生反应的离子方程式 , ;请画出显深蓝色的离子的结构式 (不考虑立体构型)。
(2)根据以上实验过程,判断NH3和H2O与Cu2+的配位能力:NH3 (填“>”“=”或“<”)H2O。
(3)若向盛有大量氨水的试管中逐滴加入硫酸铜溶液至过量,现象是 。
22.工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱。其中的关键反应是硫酸钠和焦炭、石灰石的反应,其反应的化学方程式为: (已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
①用化学式表示出图中的中间产物C是 ,D是 ;
②装置乙中发生反应的化学方程式为 ;
(3)联合制碱法是对氨碱法的改进,其优点是(不低于2条) 。
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行 ?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.由水电离产生的c(H+)=1×10-13mol/L的溶液可能是酸也可能是碱溶液,氢离子和氢氧根离子和HCO均不能大量共存,A不符题意;
B.使酚酞溶液呈红色的溶液呈碱性,氢氧化镁,氢氧化铜均为沉淀,不能大量共存,B不符题意;
C.Cu2+、Mg2+、SO、Cl-不反应,可以大量共存,C符合题意;
D.氢离子遇到硝酸根有强氧化性,二价铁离子会被氧化为三价,不能大量共存,D不符题意;
答案选C。
2.C
【详解】A.乙酸乙酯的化学式为C4H8O2,实验式即最简式为C2H4O,故A错误;
B.在CH2F2的电子式中F原子最外层应该有8个电子,电子式为,故B错误;
C.中子数为6和8的碳原子核电荷数都是6,核外电子数都是6,结构示意图为,故C正确;
D.纯碱溶液呈碱性主要是碳酸根的水解,其水解方程式为CO+H2OHCO+OH-,故D错误;
答案为C。
3.C
【详解】A.铝离子水解生成的氢氧化铝胶体:Al3++3H2OAl(OH)3(胶体)+3H+,氢氧化铝胶体具有净水的作用,故A不选;
B.热的纯碱溶液存在水解平衡:,水解过程是吸热的过程,升高温度,可以促进盐的水解,所以热的纯碱溶液清洗油污,属于盐的水解原理的应用,故B不选;
C.SnCl2溶液水解显示酸性,可以加盐酸来抑制其水解,配制氯化亚锡溶液时加入氢氧化钠会促使平衡正向移动,不能制得氯化亚锡溶液,不属于盐的水解原理的应用,故C选;
D.TiCl4水解可以得到TiO2 x H2O,加热失去结晶水即可得到二氧化钛,据此可以用TiCl4制备TiO2,故D不选,
故选:C。
4.B
【详解】A.倒扣的漏斗可防倒吸,A不选;
B.HCl极易溶于水,易形成倒吸,不适合做HCl吸收装置,B选;
C.HCl难溶于CCl4,气体先经过有机层再进入水中被吸收,防倒吸,C不选;
D.该装置可防倒吸,D不选;
故选:B。
5.C
【详解】A.铁是单质,既不是电解质,也不是非电解质,A错误;
B.硫酸钡是强电解质,B错误;
C.全部正确,C正确;
D.水是弱电解质,D错误;
故选C。
6.C
【详解】A.Cu和稀HNO3反应生成硝酸铜、一氧化氮和水:3Cu +2NO+ 8H+= 3Cu2+ +2NO↑+4H2O,故A错误;
B.FeCl3溶液中滴入KSCN溶液,生成红色络合物,离子方程式为:Fe3++3SCN-=Fe(SCN)3,故B错误;
C.将等体积的SO2和Cl2通入水中反应生成硫酸和HCl,离子反应方程式为:SO2+Cl2+ 2H2O=SO+2Cl-+4H+,故C正确;
D.用pH=4的醋酸溶液吸收NH3,醋酸为弱电解质,离子反应中不能拆,正确的离子反应为:NH3 +CH3COOH=NH+CH3COO-,故D错误;
答案选C。
7.D
【详解】
A.选择b点读数计算:c(M2+)=10-3mol/L,c(OH-)=10-7mol/L, Ksp= c(M2+)×c2(OH-)=1×10-17,A项正确;
B.pH在8~12之间,c(M2+)、c[M(OH)-]的浓度在10-5 mol/L以下,可以看作M2+沉淀完全,B项正确;
C.由图可知,pH<8时,M元素主要以M2+形式存在,pH>12时,主要以M(OH)-形式存在,C项正确;
D.一般情况下,升高温度,溶解平衡正向移动,c(M2+)和pH都增大,不可能从b点移动到a点,D项错误;
故选D。
8.C
【详解】由题意可知加入的,,故0-40ml为溶液,40-80ml为盐酸溶液;0-a段发生反应:,,当加入ml后沉淀达到最大,即,-40ml,说明过量,在a点时,恰好完全反应,然后b点开始加入盐酸,故沉淀减少生成气体,即发生反应:,在d点时,沉淀只有一种物质,即点时和HCl恰好完全反应,此时沉淀只有,生成气体:0.88g,,故,,;在c点时,由于,,故,结合0-a段,,,故;0-a段消耗;
A.根据分析得 =30ml,A项错误;
B.根据分析得稀盐酸的浓度为,B项错误;
C.根据分析得,C项正确;
D.c点溶液中发生反应的离子方程式为,D项错误;
答案选C。
9.A
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,X是四种元素中唯一的金属,X、Z可形成阴离子,则X为Al元素、Z为Cl元素;W、Z同主族,W、Y可形成阴离子,则W为F元素、Y为P元素。
【详解】A.氟元素的非金属性强,没有正化合价,故A错误;
B.元素的非金属性越强,气态氢化物稳定性越弱,磷元素的非金属性弱于氟元素,则磷化氢的稳定性弱于氟化氢,故B正确;
C.同周期元素,从左到右原子半径依次减小,同主族元素,从上到下原子半径依次增大,则铝、磷、氯、氟始终原子的原子半径依次减小,故C正确;
D.氯化铝是强酸弱碱盐,铝离子在溶液中水解使溶液呈酸性,故D正确;
故选A。
10.B
【详解】A.Ksp只与温度有关与浓度无关,错误;
B.由图象可知:在相同条件下,温度越低,c(SO42 ) c(Sr2+)越大,Ksp(SrSO4)越大,物质的溶解度也越大,正确;
C.a点在283K的下方,属于不饱和溶液,错误;
D.283K下的SrSO4饱和溶液升温到363K后会有晶体析出,还是属于饱和溶液,错误。
11.B
【详解】A.溶液体积未知,无法确定离子的物质的量,故A错误;
B.根据物料守恒可知:c(HCN)+c()=0.1 mol·L,溶液体积为1L,则HCN与的总数目为,故B正确;
C.的溶液中,氢氧根离子来自水的电离,c(OH-)水=,水电离出的氢离子浓度等于水电离的氢氧根离子浓度,c(H+)水=,溶液体积为1L,则由水电离出的数目为,故C错误;
D.该反应为可逆反应,反应物不能完全反应,因此转移电子数小于,故D错误;
故选:B。
12.D
【详解】A.碳化铝和盐酸为原料在室温下反应制取甲烷,装置符合要求,选项A能达到实验目的;
B.甲烷的密度小于空气,不与空气中的成分反应且不造成污染,可以用向下排空气法收集,选项B能达到实验目的;
C.滤去不溶物时可通过过滤完成,实验操作正确,选项C能达到实验目的;
D.含的滤液在蒸发结晶过程中不断水解并挥发出HCl,最终得到碱式氯化铝、或其分解产物,应在HCl气流中加热,选项D不能达到实验目的。
答案选D。
13.B
【详解】A.298K时,在20mL浓度为0.1mol L-1HN3溶液中滴加pH=13的NaOH溶液,①加入10mLNaOH溶液,为等浓度的HN3和NaN3,酸抑制水的电离,②为加入15mlNaOH溶液,为HN3和NaN3,NaN3为主,溶液pH=7,③为加入20mLNaOH溶液,恰好完全中和,为NaN3溶液,NaN3水解促进水的电离,298K时,水的电离程度①<②<③,故A正确;
B.叠氮酸(HN3)是一元弱酸,c(HN3)=0.1mol/L,c(H+)≈c(HN3)其电离常数Ka==2×10-5,c(H+)≈mol/L≈×10-3mol/L,pH=-lgc(H+)=-lg×10-3=3-lg2≈2.85,故B错误;
C.①点溶液中存在电荷守恒:c(H+)+c(Na+)=c(OH-)+c(),物料守恒为:2c(Na+)=c()+c(HN3),整理得到:c()+2c(OH-)=c(HN3)+2c(H+),故C正确;
D.②点溶液pH=7,溶液显中性,液中存在电荷守恒:c(H+)+c(Na+)=c(OH-)+c(),得到c(Na+)=c()>c(H+)=c(OH-),故D正确;
故选:B。
14. 的电离平衡常数为,水解平衡常数为,所以的电离程度大于其水解程度,溶液呈酸性
【详解】(1)的电离方程式为:、,则第二级电离平衡常数的表达式。
(2)全部电离,生成和,的电离平衡常数为,的电离平衡常数为,根据越弱越水解的规律可知水解程度更大,根据可知溶液呈碱性,又因为盐类水解是微弱的,所以离子浓度由大到小的顺序是,水解反应的平衡常数。
(3)根据表格内的电离平衡常数可知酸性大小为:>>>,所以少量通入过量的溶液中,生成物为碳酸氢钠和亚硫酸钠,则离子方程式为:。
(4)等浓度的溶液、溶液和溶液,水解均呈碱性。根据表格数据可知酸性强弱为:>>,根据越弱越水解的规律可知水解程度为溶液最大,其次是溶液,最后是溶液,所以三种溶液的由大到小的顺序为:。
(5)①随着的增大,含量一直减小,先增大后减小,一直增大,向的溶液中逐滴滴加溶液,结合图象可知由3~5时,大幅减小,大幅增大,所以反应的离子方程式为:。
②结合图象和①中分析可知时,溶液,此时=10-1.2,同理在的时候可以求出=10-4.2。时,=10-2.2,代入即可求出溶液。
③的水解平衡常数为=10-12.8<,说明NaHA电离大于水解,电离呈酸性,所以该溶液呈酸性。
④将和的溶液等体积混合,根据物料守恒可知含Na微粒总量是含A微粒总量的1.5倍,所以可以得出
15.(1) +2+4H2SO4=2+2+S; AC
(2) 3×10-6 2NH3·H2O+Mn2++2HCO=MnCO3↓+2NH+CO+2H2O
(3) 2Cu2++2Cl-+SO+H2O=2CuCl↓+SO+2H+ 增大,溶液中Cl-浓度增大,使得更容易生成CuCl,随着反应的进行,CuCl易与过多的形成可溶的,使得CuCl沉淀逐渐消失,产率下降 反应时间越长,CuCl被空气中的氧气氧化,产率下降
【详解】(1)①根据氧化还原反应特点分析元素化合价升降并配平。、和硫酸反应生成、和S,其化学方程式为+2+4H2SO4=2+2+S;
②A.将铜矿粉碎并搅拌,可提高反应物接触面积使反应更充分,可提高铜元素的浸出率,A项符合题意;
B.增加铜矿的投料量,并不能增加浓度,不能提高铜元素的浸出率,B项不符合题意;
C.适当提高硫酸浓度,使铜矿更毅反应,反应速率大,能提高铜元素的浸出率,C项符合题意;
D.适当缩短反应时间不能提高浸出率,D项不符合题意;
故答案选AC。
(2)①溶液总存在沉淀溶解平衡,根据溶度积常数计算,,用氨水调节溶液的pH为3时,为3×10-6,故答案是3×10-6;
②反应元素化合价未变,根据离子方程式特点配平。除铁后的溶液中滴加氨水-混合溶液,反应生成的离子方程式为2NH3·H2O+Mn2++2HCO=MnCO3↓+2NH+CO+2H2O;故答案是2NH3·H2O+Mn2++2HCO=MnCO3↓+2NH+CO+2H2O;
(3)①由题意分析,铜元素化合价降低,是常见还原剂,根据氧化还原反应特点,溶液、NaCl溶液和溶液反应生成CuCl沉淀的离子方程式是2Cu2++2Cl-+SO+H2O=2CuCl↓+SO+2H+;故答案是2Cu2++2Cl-+SO+H2O=2CuCl↓+SO+2H+;
②增大,溶液中Cl-浓度增大,使得更容易生成CuCl,随着反应的进行,CuCl易与过多的形成可溶的,使得CuCl沉淀逐渐消失,产率下降,故答案是增大,溶液中Cl-浓度增大,使得更容易生成CuCl,随着反应的进行,CuCl易与过多的形成可溶的,使得CuCl沉淀逐渐消失,产率下降;
③反应时间越长,CuCl与空气接触越久,越容易被氧化,使得CuCl产率下降;故答案是反应时间越长,CuCl被空气中的氧气氧化,产率下降。
16.(1)
(2)
(3)
(4)①②③
(5)ad
(6)2∶9
【详解】(1)醋酸是弱酸,电离是可逆过程,电离方程式为,故答案为;
(2)明矾水解生成氢氧化铝胶体,具有吸附性,反应的离子方程式为:,故答案为:
(3)56g金属铁的物质的量为1mol,与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,反应的热化学方程式为:
(4)碳酸氢钠是酸式盐,碳酸钠是正盐,所以碳酸钠的pH值大于碳酸氢钠的pH,氢氧化钠是强碱,完全电离,碱性最强,pH最大,三种溶液的pH 由小到大的顺序为①②③,故答案为①②③;
(5)a.某溶液的pH=9,说明溶液中存在NaA的水解过程,能够说明HA是弱电解质,正确;b.用HA 溶液做导电实验,灯泡很暗,可能是HA的浓度很小的结果,不能说明HA是弱电解质,错误;c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多是因为硫酸是二元酸,HA为一元酸,与酸的强弱无关,错误;d.0.1mol/LHA 溶液的pH≈2.8,说明HA未完全电离,能够说明HA是弱电解质,正确;故选ad;
(6)在100℃时,水的离子积为,此温度下将pH=11的溶液中的溶液,若所得混合溶液的,则反应后的溶液的,则,解得:,故答案为2:9。
17. BD 减小 减小 > > > c AB 11
【详解】(1)A.弱电解质的电离是吸热过程,升高温度,电离平衡正向移动,和浓度都增大,不符合题意;
B.加入NH4Cl固体,NH4Cl电离出,的浓度增大,平衡逆向移动,OH-浓度减小,符合题意;
C.通入适量NH3,NH3·H2O浓度增大,平衡正向移动,和OH-浓度都增大,不符合题意;
D.加入少量浓盐酸,浓盐酸电离出的H+与OH-结合成H2O,OH-浓度减小,电离平衡正向移动,浓度增大,符合题意;故答案为:BD;
(2)①醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,加入的醋酸钠电离出CH3COO-,CH3COO-浓度增大,电离平衡逆向移动,溶液中c(H+)减小;在盐酸中加入醋酸钠,醋酸钠电离出的CH3COO-与H+结合成弱酸CH3COOH,溶液中c(H+)减小;故答案为:减小;减小;
②加水稀释10倍,溶液体积变为原来的10倍,稀释后盐酸中c(H+)变为原来的1/10;加水稀释促进醋酸的电离,稀释后醋酸溶液中c(H+)大于原来的1/10;加水稀释10倍后醋酸溶液中的c(H+)>盐酸溶液中的c(H+),故答案为:>;
③醋酸为弱酸,盐酸为强酸,pH相同的盐酸和醋酸溶液,物质的量浓度:醋酸大于盐酸,等体积的溶液中加入等浓度的NaOH溶液至恰好中和,消耗的NaOH溶液的体积:醋酸>盐酸,故答案为:>;
④弱电解质的电离是吸热过程,升高温度促进醋酸的电离,醋酸溶液中c(H+)增大;升高温度,盐酸溶液中c(H+)不变,则温度都升高20℃后溶液中c(H+):醋酸>盐酸,故答案为:>;
⑤醋酸溶液中H+被消耗会促进醋酸的电离,反应过程中醋酸溶液中c(H+)大于盐酸中,醋酸与Zn反应的速率比盐酸与Zn反应的速率快;等pH、等体积的醋酸溶液和盐酸中,醋酸提供的H+总物质的量大于盐酸,醋酸与足量Zn反应放出的H2大于盐酸与足量Zn反应放出的H2;答案选c。
(3)醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,加水稀释促进CH3COOH的电离,
A.电离程度增大,正确;
B.由于电离平衡正向移动,H+、CH3COO-物质的量增大,溶液中离子总数增多,正确;
C.由于溶液体积的增大超过离子物质的量的增大,c(H+)、c(CH3COO-)物质的量浓度减小,溶液导电性减弱,错误;
D.由于电离程度增大,溶液中醋酸分子减少,错误;答案选AB。
(4)=1.0×10-5,则c(OH-)==1.0×10-3mol/L,c(H+)==1.0×10-11,则pH=11。
18.(1) NaOH CH3COOH
(2)a
(3)c
(4)④
(5)c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)
【详解】(1)根据步骤①可知,A应为HCl、B为NH3·H2O、D为NaOH,由②可知C应为NH4HSO4,剩余的CH3COOH应为E。
(2)稀释氨水,减小,增大,c(H+)·c(OH-)不变,n(OH-)增大。
(3)pH相同,体积相同的盐酸和CH3COOH溶液比较,CH3COOH的物质的量多,Mg应在盐酸中剩余,因为c(H+)相同,速率开始相等。
(4)NH3·H2O、NH4HSO4等量混合生成(NH4)2SO4,升温NH水解程度增大,所以pH下降。
(5)NaOH和NH4HSO4混合呈中性时,NaOH应稍过量,所以c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)。
19.(1)Fe3++3H2OFe(OH)3(胶体)+3H+
(2)Al3++3NH3 H2O=Al(OH)3↓+3
(3)或2Na2O2+2H2O=4NaOH+O2↑
(4) 1:5
(5) H2O2
【解析】(1)
饱和三氯化铁溶液滴入沸水中并煮沸一段时间,可制备氢氧化铁胶铁,反应的离子方程式为Fe3++3H2O Fe(OH)3(胶体)+3H+;
(2)
氨水和硫酸铝溶液反应生成氢氧化铝和硫酸铵,离子方程式为Al3++3NH3 H2O=Al(OH)3↓+3NH ;
(3)
过氧化钠作为供氧剂时,主要与二氧化碳或者水发生化学反应生成氧气,化学方程式为2Na2O2+2CO2=2Na2CO3+O2或2Na2O2+2H2O=4NaOH+O2↑;
(4)
氯气中氯元素的化合价由0价变成-1价或者+5价,根据守恒规律,故为;氧化产物是KClO3,还原产物KCl,物质的量之比为1:5;
(5)
锰元素的化合价由+7价变成+2价,且系数是2,故为;还原剂在反应中化合价升高,故为H2O2。
20.(1)①②④③或②①④③
(2)
(3) 11.9 量筒、胶头滴管 无影响 偏小
(4)60.0%
【详解】(1)测定过程的正确顺序为①配制盐酸和溶液;②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;④加入盐酸;③用溶液中和过量的盐酸,记录所消耗NaOH溶液的体积。或②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;①配制盐酸和溶液;④加入盐酸;③用溶液中和过量的盐酸,记录所消耗NaOH溶液的体积。
(2)测定过程中发生碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,过量的盐酸和氢氧化钠反应,反应的离子方程式为、。
(3)该盐酸的物质的量浓度为。配制溶液需要的仪器有容量瓶、烧杯、玻璃棒、量筒和胶头滴管。①容量瓶在使用前未干燥,里面有少量蒸馏水,对溶液浓度无影响;②未洗涤烧杯及玻璃棒,溶质的量减少,故溶液的浓度偏小。
(4)平均消耗NaOH溶液体积为=13.00mL,盐酸与氢氧化钠溶液浓度相等,可知剩余盐酸体积为13.00mL,故与碳酸钙反应盐酸体积为25.00mL-13.00mL=12.00mL,每片中碳酸钙物质的量为=6×10-4mol,则每片药剂中CaCO3的质量分数为×100%=60.0%,故答案为:60.0%。
21.(1) Cu2++2=Cu(OH)2↓+2 Cu(OH)2+4NH3. H2O= [Cu(NH3)4]2+ +2OH- +4H2O
(2)>
(3)降蓝色的透明溶液
【详解】(1)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到降蓝色的透明溶液,涉及的离子方程式:Cu2++2=Cu(OH)2↓+2、Cu(OH)2+4NH3. H2O= [Cu(NH3)4]2+ +2OH- +4H2O。降蓝色的离子为[Cu(NH3)4]2+,其结构式为:,故答案:Cu2++2NH3 H2O=Cu(OH)2↓+2NH4、Cu(OH)2+4NH3. H2O= [Cu(NH3)4]2+ +2OH- +4H2O;。
(2)硫酸铜溶液中加入过量氨水后生成了[Cu(NH3)4]2+离子,说明氨气与Cu2+的配位能力大于水与铜离子的配位能力。故答案:>。
(3)因为氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,难溶物溶解得到降蓝色的透明溶液,所以若向盛有大量氨水的试管中逐滴加入硫酸铜溶液至过量,现象是产生深蓝色的透明溶液,故答案:产生降蓝色的透明溶液,故答案:降蓝色的透明溶液。
22.(1)Na2SO4 + CaCO3 +4CCaS + Na2CO3 +4CO↑
(2) Ca( OH)2 NH3 NH3 + CO2 + NaCl + H2O =NaHCO3 + NH4Cl
(3)保留了氨碱法的优点,使食盐的利用率提高到96% ;NH4Cl可做氮肥;可与合成氨厂联合,原料气氨气和一氧化碳都由氨厂提供,减少CaCO3制CO2这一工序,降低了能耗与污染
(4)不可行,因为碳酸氢钾溶解度较大,且在常温下与氯化钾的溶解度差别小,在氨盐水碳酸化时无法大量析出
【解析】略
答案第1页,共2页
答案第1页,共2页
一、单选题
1.25℃时,下列各溶液中一定能大量共存的离子组是
A.由水电离产生的c(H+)=1×10-13mol/L的溶液中:K+、NO、Cl-、HCO
B.使酚酞溶液呈红色的溶液中:Mg2+、Cu2+、SO、K+
C.澄清透明的溶液中:Cu2+、Mg2+、SO、Cl-
D.0.1mol/L的Fe(NO3)2溶液中:Na+、H+、K+、Cl-
2.下列有关化学用语表示正确的是
A.乙酸乙酯、甲醛和淀粉的实验式都为
B.甲烷二氟代物CH2F2的电子式为
C.中子数为6和8的碳原子的结构示意图都为
D.纯碱溶液呈碱性的原因:
3.下列应用与反应原理设计不一致的是
A.明矾净水:Al3++3H2OAl(OH)3+3H+
B.热的纯碱溶液清洗油污:CO+H2OHCO+OH-
C.配制氯化亚锡溶液时加入氢氧化钠:SnCl2+H2OSn(OH)Cl+HCl
D.用TiCl4制备TiO2:TiCl4+(x+2)H2O(过量)TiO2 xH2O↓+4HCl
4.已知HCl难溶于CCl4,极易溶于水,下列装置中,不适宜于作HCl气体吸收的是图中的
A. B. C. D.
5.下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
A B C D
强电解质 Fe NaCl CaCO3 HNO3
弱电解质 CH3COOH NH3 H3PO4 Fe(OH)3
非电解质 C12H22O11(蔗糖) BaSO4 C2H5OH H2O
A.A B.B C.C D.D
6.下列解释实验事实的离子方程式正确的是
A.Cu和稀HNO3反应:Cu +2NO+ 4H+= Cu2+ +2NO2↑+2H2O
B.FeCl3溶液中滴入KSCN溶液,显红色:Fe3++3SCN-=Fe(SCN)3↓
C.将等体积的SO2和Cl2通入水中:SO2+Cl2+ 2H2O=SO+2Cl-+4H+
D.用PH=4的醋酸溶液吸收NH3:NH3 +H+=NH
7.下图为室温时水溶液中M2+的存在形式与pH的关系,其中纵坐标为M2+或M(OH)物质的量浓度的对数。下列说法不正确的是
A.室温时,M(OH)2(s)的溶度积常数为1×10-17
B.沉淀法分离M2+需控制pH在8~12之间
C.pH<8时,M元素主要以M2+形式存在,pH>12时,主要以M(OH)-形式存在
D.升高温度,可以实现从b点移动到a点
8.向一定体积的碳酸钠和硫酸钠混合溶液中先后滴加等体积、等浓度的溶液和稀盐酸,d点沉淀只含有一种物质。反应过程中产生沉淀或气体的质量与加入溶液体积的关系如图所示。
下列说法正确的是
A.
B.稀盐酸的浓度为
C.原溶液中
D.c点溶液中发生反应的离子方程式为
9.短周期主族元素W、X、Y、Z的原子序数依次增大,W、Z同主族,W、Y可形成阴离子,X是四种元素中唯一的金属,X、Z可形成阴离子,下列说法错误的是
A.W、Z有相同的最高正价
B.Y的气态氢化物稳定性比W的弱
C.X、Y、Z、W的原子半径依次减小
D.X、Z形成的二元化合物的水溶液显酸性
10.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,363K时Ksp(SrSO4)最大
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
11.设为阿伏加德罗常数的值。下列说法中正确的是
A.常温下,的溶液中数目为
B.1 L 0.1 mol·L NaCN溶液中HCN与的总数目为
C.常温下,1 L 的溶液中,由水电离出的数目为
D.0.1 mol 和0.1 mol 充入密闭容器中充分反应,转移的电子数为
12.实验室以碳化铝(含少量C和)和盐酸为原料在室温下反应制取甲烷并获得,下列图示装置不能达到相应实验目的的是
已知:。
A.制取 B.收集 C.滤去不溶物 D.制得
A.A B.B C.C D.D
13.已知:叠氮酸()是一元弱酸,其电离常数(298K)。298K时,在20mL浓度为溶液中滴加的NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示(已知:)。下列说法错误的是
A.298K时,水的电离程度①<②<③
B.a点pH约为2.7
C.①点溶液中:
D.②点溶液中:
二、填空题
14.电解质水溶液中存在电离平衡、水解平衡、解平衡,请回答下列问题。25℃时,部分物质的电离平衡常数如表所示:
(1)的第二级电离平衡常数的表达式
(2)溶液中离子浓度由大到小的顺序是 ,水解反应的平衡常数 (保留两位有效数字)
(3)少量通入过量的溶液中,发生反应的离子方程式为
(4)相同温度下,等浓度的溶液、溶液和溶液,三种溶液的由大到小的顺序为
(5)是一种二元弱酸,25℃不同时,、、的物种分布如下图所示:
①向的溶液中逐滴滴加溶液,写出由3~5时所发生反应的离子方程式:
②时,溶液
③请结合相关平衡常数说明的酸碱性
④将和的溶液等体积混合,所得溶液中 (用只含、、三种粒子的表达式表示)
15.氯化亚铜(CuCl)是常用的催化剂。以低品位铜矿(主要成分为CuS、和铁的氧化物等)为原料制备CuCl步骤如下:
(1)“氧化浸取”。铜元素全部转化为,铁元素全部转化为。
①、和硫酸反应生成、和S,其化学方程式为 。
②为提高铜元素的浸出率,工艺上可采取的措施有 (填字母)。
A.将铜矿粉碎并搅拌 B.增加铜矿的投料量
C.适当提高硫酸浓度 D.适当缩短反应时间
(2)“除铁锰”。依次用氨水沉铁、用氨水-混合溶液沉锰。
①用氨水调节溶液的pH为3时,为 。{室温下,}
②向除铁后的溶液中滴加氨水-混合溶液,反应生成的离子方程式为 。
(3)“还原”。溶液、NaCl溶液和溶液反应生成CuCl沉淀。
已知:CuCl易被氧化,易与形成可溶的。
①反应生成CuCl的离子方程式为 。
②如图所示,和其他条件相同时,CuCl产率随增大先升高后降低的原因是 。
③如图所示,其他条件相同时,CuCl产率随反应时间延长而降低的原因是 。
16.应用化学反应原理知识解决下列问题
(1)写出醋酸(CH3COOH) 的电离方程式: 。
(2)明矾净水的原理为(用离子方程式表示) 。
(3)一定条件下,56g金属铁与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,该反应的热化学方程式为 。
(4)现有浓度为0.1mol/L 的三种电解质溶液①NaHCO3 ②Na2CO3 ③NaOH 这三种溶液的pH 由小到大的顺序是 (填编号)。
(5)常温下,下列事实能证明HA是弱电解质的是 (填编号)。
a.某NaA溶液的pH=9
b.用HA 溶液做导电实验,灯泡很暗
c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多d.0.1mol/LHA 溶液的pH≈2.8
(6)已知在100℃时,水的离子积为1×10-12,此时将 pH= 11 的 NaOH 溶液V1 L 与pH=2的H2SO4溶液V2 L均匀混合后,若所得混合溶液的pH=10,则V1: V2为 。
17.(1)某浓度的氨水中存在平衡,+、如想增大的浓度而不增大的浓度,应采取的措施是 (填字母)。
A.适当升高温度 B.加入NH4Cl固体 C.通入 D.加入少量浓盐酸,
(2)常温下,有c()相同、体积相同的醋酸和盐酸两种溶液,采取以下措施∶
①加适量醋酸钠晶体后,两溶液中的c()变化是醋酸溶液中c() (填“增大”“减小”或“不变”),盐酸中c() (填“增大”“减小”或“不变”)。
②加水稀择10倍后,醋酸溶液中的c() (填">"="或*<")盐酸溶液中的c()。
③加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积。醋酸 (填>、=或<)盐酸
④使温度都升高20℃,溶液中c():醋酸 (填“>”“=”或“<”)盐酸。
⑤分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是 (填字母)。(①表示盐酸,②表示醋酸)
(3)将0.1mol/L的加水稀释,有关稀释后醋酸溶液的说法中,正确的是 (填字母)
A.电离程度增大 B.溶液中离子总数增多 C.溶液导电性增强 D.溶液中醋酸分子增多
(4)常温下的电离常数为1.0×10-5,则0.1mol/L的溶液的pH= 。
18.A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是 ,E是 ;
(2)用水稀释0.1 mol·L-1B溶液时,溶液中随着水量的增加而减小的是 (填写序号)。
a. b. c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是 (填写序号)。
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E
d.E溶液里有镁粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中 曲线(填写序号)。
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为 。
19.按要求回答问题:
(1)将已配制好的饱和三氯化铁溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为:
(2)实验室用氨水和硫酸铝溶液制取氢氧化铝,离子方程式为
(3)过氧化钠作为供氧剂时发生的化学反应(化学方程式):
(4)请用双线桥法标注以下氧化还原反应,标明电子转移数目,3Cl2+6KOH5KCl+KClO3+3H2O ,氧化产物:还原产物= (物质的量之比)。
(5)请用单线桥法标注以下氧化还原反应,标明电子转移数目:2+5H2O2+6H+=2Mn2++5O2↑+5H2O ,还原剂是 。
20.某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①配制盐酸和溶液;
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用溶液中和过量的盐酸,记录所消耗NaOH溶液的体积;
④加入盐酸。
请回答下列问题:
(1)正确的操作顺序是 (填序号)。
(2)测定过程中发生反应的离子方程式为 ; 。
(3)如图为实验室某浓盐酸试剂瓶上的标签的有关内容,该浓盐酸中溶质的物质的量浓度为 。
用该浓盐酸配制本实验所需的盐酸,需要的仪器有容量瓶、烧杯、玻璃棒、 (从下列图中选择,写出名称)。
下列实验操作对所配制的盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
①容量瓶在使用前未干燥,里面有少量蒸馏水: ;
②未洗涤烧杯及玻璃棒: 。
(4)某同学4次测定所消耗的NaOH溶液的体积如下:
测定次数 第1次 第2次 第3次 第4次
V[NaOH(aq)]/mL 13.00 12.90 13.10 13.00
根据这个同学的实验数据,计算这种药片中碳酸钙的质量分数为 。
21.Cu可形成多种配合物,某同学在探究配合物的形成时做了以下实验,根据下列信息回答问题:
(1)向盛有硫酸铜水溶液的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色的透明溶液,请写出先后发生反应的离子方程式 , ;请画出显深蓝色的离子的结构式 (不考虑立体构型)。
(2)根据以上实验过程,判断NH3和H2O与Cu2+的配位能力:NH3 (填“>”“=”或“<”)H2O。
(3)若向盛有大量氨水的试管中逐滴加入硫酸铜溶液至过量,现象是 。
22.工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱。其中的关键反应是硫酸钠和焦炭、石灰石的反应,其反应的化学方程式为: (已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
①用化学式表示出图中的中间产物C是 ,D是 ;
②装置乙中发生反应的化学方程式为 ;
(3)联合制碱法是对氨碱法的改进,其优点是(不低于2条) 。
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行 ?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.由水电离产生的c(H+)=1×10-13mol/L的溶液可能是酸也可能是碱溶液,氢离子和氢氧根离子和HCO均不能大量共存,A不符题意;
B.使酚酞溶液呈红色的溶液呈碱性,氢氧化镁,氢氧化铜均为沉淀,不能大量共存,B不符题意;
C.Cu2+、Mg2+、SO、Cl-不反应,可以大量共存,C符合题意;
D.氢离子遇到硝酸根有强氧化性,二价铁离子会被氧化为三价,不能大量共存,D不符题意;
答案选C。
2.C
【详解】A.乙酸乙酯的化学式为C4H8O2,实验式即最简式为C2H4O,故A错误;
B.在CH2F2的电子式中F原子最外层应该有8个电子,电子式为,故B错误;
C.中子数为6和8的碳原子核电荷数都是6,核外电子数都是6,结构示意图为,故C正确;
D.纯碱溶液呈碱性主要是碳酸根的水解,其水解方程式为CO+H2OHCO+OH-,故D错误;
答案为C。
3.C
【详解】A.铝离子水解生成的氢氧化铝胶体:Al3++3H2OAl(OH)3(胶体)+3H+,氢氧化铝胶体具有净水的作用,故A不选;
B.热的纯碱溶液存在水解平衡:,水解过程是吸热的过程,升高温度,可以促进盐的水解,所以热的纯碱溶液清洗油污,属于盐的水解原理的应用,故B不选;
C.SnCl2溶液水解显示酸性,可以加盐酸来抑制其水解,配制氯化亚锡溶液时加入氢氧化钠会促使平衡正向移动,不能制得氯化亚锡溶液,不属于盐的水解原理的应用,故C选;
D.TiCl4水解可以得到TiO2 x H2O,加热失去结晶水即可得到二氧化钛,据此可以用TiCl4制备TiO2,故D不选,
故选:C。
4.B
【详解】A.倒扣的漏斗可防倒吸,A不选;
B.HCl极易溶于水,易形成倒吸,不适合做HCl吸收装置,B选;
C.HCl难溶于CCl4,气体先经过有机层再进入水中被吸收,防倒吸,C不选;
D.该装置可防倒吸,D不选;
故选:B。
5.C
【详解】A.铁是单质,既不是电解质,也不是非电解质,A错误;
B.硫酸钡是强电解质,B错误;
C.全部正确,C正确;
D.水是弱电解质,D错误;
故选C。
6.C
【详解】A.Cu和稀HNO3反应生成硝酸铜、一氧化氮和水:3Cu +2NO+ 8H+= 3Cu2+ +2NO↑+4H2O,故A错误;
B.FeCl3溶液中滴入KSCN溶液,生成红色络合物,离子方程式为:Fe3++3SCN-=Fe(SCN)3,故B错误;
C.将等体积的SO2和Cl2通入水中反应生成硫酸和HCl,离子反应方程式为:SO2+Cl2+ 2H2O=SO+2Cl-+4H+,故C正确;
D.用pH=4的醋酸溶液吸收NH3,醋酸为弱电解质,离子反应中不能拆,正确的离子反应为:NH3 +CH3COOH=NH+CH3COO-,故D错误;
答案选C。
7.D
【详解】
A.选择b点读数计算:c(M2+)=10-3mol/L,c(OH-)=10-7mol/L, Ksp= c(M2+)×c2(OH-)=1×10-17,A项正确;
B.pH在8~12之间,c(M2+)、c[M(OH)-]的浓度在10-5 mol/L以下,可以看作M2+沉淀完全,B项正确;
C.由图可知,pH<8时,M元素主要以M2+形式存在,pH>12时,主要以M(OH)-形式存在,C项正确;
D.一般情况下,升高温度,溶解平衡正向移动,c(M2+)和pH都增大,不可能从b点移动到a点,D项错误;
故选D。
8.C
【详解】由题意可知加入的,,故0-40ml为溶液,40-80ml为盐酸溶液;0-a段发生反应:,,当加入ml后沉淀达到最大,即,-40ml,说明过量,在a点时,恰好完全反应,然后b点开始加入盐酸,故沉淀减少生成气体,即发生反应:,在d点时,沉淀只有一种物质,即点时和HCl恰好完全反应,此时沉淀只有,生成气体:0.88g,,故,,;在c点时,由于,,故,结合0-a段,,,故;0-a段消耗;
A.根据分析得 =30ml,A项错误;
B.根据分析得稀盐酸的浓度为,B项错误;
C.根据分析得,C项正确;
D.c点溶液中发生反应的离子方程式为,D项错误;
答案选C。
9.A
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,X是四种元素中唯一的金属,X、Z可形成阴离子,则X为Al元素、Z为Cl元素;W、Z同主族,W、Y可形成阴离子,则W为F元素、Y为P元素。
【详解】A.氟元素的非金属性强,没有正化合价,故A错误;
B.元素的非金属性越强,气态氢化物稳定性越弱,磷元素的非金属性弱于氟元素,则磷化氢的稳定性弱于氟化氢,故B正确;
C.同周期元素,从左到右原子半径依次减小,同主族元素,从上到下原子半径依次增大,则铝、磷、氯、氟始终原子的原子半径依次减小,故C正确;
D.氯化铝是强酸弱碱盐,铝离子在溶液中水解使溶液呈酸性,故D正确;
故选A。
10.B
【详解】A.Ksp只与温度有关与浓度无关,错误;
B.由图象可知:在相同条件下,温度越低,c(SO42 ) c(Sr2+)越大,Ksp(SrSO4)越大,物质的溶解度也越大,正确;
C.a点在283K的下方,属于不饱和溶液,错误;
D.283K下的SrSO4饱和溶液升温到363K后会有晶体析出,还是属于饱和溶液,错误。
11.B
【详解】A.溶液体积未知,无法确定离子的物质的量,故A错误;
B.根据物料守恒可知:c(HCN)+c()=0.1 mol·L,溶液体积为1L,则HCN与的总数目为,故B正确;
C.的溶液中,氢氧根离子来自水的电离,c(OH-)水=,水电离出的氢离子浓度等于水电离的氢氧根离子浓度,c(H+)水=,溶液体积为1L,则由水电离出的数目为,故C错误;
D.该反应为可逆反应,反应物不能完全反应,因此转移电子数小于,故D错误;
故选:B。
12.D
【详解】A.碳化铝和盐酸为原料在室温下反应制取甲烷,装置符合要求,选项A能达到实验目的;
B.甲烷的密度小于空气,不与空气中的成分反应且不造成污染,可以用向下排空气法收集,选项B能达到实验目的;
C.滤去不溶物时可通过过滤完成,实验操作正确,选项C能达到实验目的;
D.含的滤液在蒸发结晶过程中不断水解并挥发出HCl,最终得到碱式氯化铝、或其分解产物,应在HCl气流中加热,选项D不能达到实验目的。
答案选D。
13.B
【详解】A.298K时,在20mL浓度为0.1mol L-1HN3溶液中滴加pH=13的NaOH溶液,①加入10mLNaOH溶液,为等浓度的HN3和NaN3,酸抑制水的电离,②为加入15mlNaOH溶液,为HN3和NaN3,NaN3为主,溶液pH=7,③为加入20mLNaOH溶液,恰好完全中和,为NaN3溶液,NaN3水解促进水的电离,298K时,水的电离程度①<②<③,故A正确;
B.叠氮酸(HN3)是一元弱酸,c(HN3)=0.1mol/L,c(H+)≈c(HN3)其电离常数Ka==2×10-5,c(H+)≈mol/L≈×10-3mol/L,pH=-lgc(H+)=-lg×10-3=3-lg2≈2.85,故B错误;
C.①点溶液中存在电荷守恒:c(H+)+c(Na+)=c(OH-)+c(),物料守恒为:2c(Na+)=c()+c(HN3),整理得到:c()+2c(OH-)=c(HN3)+2c(H+),故C正确;
D.②点溶液pH=7,溶液显中性,液中存在电荷守恒:c(H+)+c(Na+)=c(OH-)+c(),得到c(Na+)=c()>c(H+)=c(OH-),故D正确;
故选:B。
14. 的电离平衡常数为,水解平衡常数为,所以的电离程度大于其水解程度,溶液呈酸性
【详解】(1)的电离方程式为:、,则第二级电离平衡常数的表达式。
(2)全部电离,生成和,的电离平衡常数为,的电离平衡常数为,根据越弱越水解的规律可知水解程度更大,根据可知溶液呈碱性,又因为盐类水解是微弱的,所以离子浓度由大到小的顺序是,水解反应的平衡常数。
(3)根据表格内的电离平衡常数可知酸性大小为:>>>,所以少量通入过量的溶液中,生成物为碳酸氢钠和亚硫酸钠,则离子方程式为:。
(4)等浓度的溶液、溶液和溶液,水解均呈碱性。根据表格数据可知酸性强弱为:>>,根据越弱越水解的规律可知水解程度为溶液最大,其次是溶液,最后是溶液,所以三种溶液的由大到小的顺序为:。
(5)①随着的增大,含量一直减小,先增大后减小,一直增大,向的溶液中逐滴滴加溶液,结合图象可知由3~5时,大幅减小,大幅增大,所以反应的离子方程式为:。
②结合图象和①中分析可知时,溶液,此时=10-1.2,同理在的时候可以求出=10-4.2。时,=10-2.2,代入即可求出溶液。
③的水解平衡常数为=10-12.8<,说明NaHA电离大于水解,电离呈酸性,所以该溶液呈酸性。
④将和的溶液等体积混合,根据物料守恒可知含Na微粒总量是含A微粒总量的1.5倍,所以可以得出
15.(1) +2+4H2SO4=2+2+S; AC
(2) 3×10-6 2NH3·H2O+Mn2++2HCO=MnCO3↓+2NH+CO+2H2O
(3) 2Cu2++2Cl-+SO+H2O=2CuCl↓+SO+2H+ 增大,溶液中Cl-浓度增大,使得更容易生成CuCl,随着反应的进行,CuCl易与过多的形成可溶的,使得CuCl沉淀逐渐消失,产率下降 反应时间越长,CuCl被空气中的氧气氧化,产率下降
【详解】(1)①根据氧化还原反应特点分析元素化合价升降并配平。、和硫酸反应生成、和S,其化学方程式为+2+4H2SO4=2+2+S;
②A.将铜矿粉碎并搅拌,可提高反应物接触面积使反应更充分,可提高铜元素的浸出率,A项符合题意;
B.增加铜矿的投料量,并不能增加浓度,不能提高铜元素的浸出率,B项不符合题意;
C.适当提高硫酸浓度,使铜矿更毅反应,反应速率大,能提高铜元素的浸出率,C项符合题意;
D.适当缩短反应时间不能提高浸出率,D项不符合题意;
故答案选AC。
(2)①溶液总存在沉淀溶解平衡,根据溶度积常数计算,,用氨水调节溶液的pH为3时,为3×10-6,故答案是3×10-6;
②反应元素化合价未变,根据离子方程式特点配平。除铁后的溶液中滴加氨水-混合溶液,反应生成的离子方程式为2NH3·H2O+Mn2++2HCO=MnCO3↓+2NH+CO+2H2O;故答案是2NH3·H2O+Mn2++2HCO=MnCO3↓+2NH+CO+2H2O;
(3)①由题意分析,铜元素化合价降低,是常见还原剂,根据氧化还原反应特点,溶液、NaCl溶液和溶液反应生成CuCl沉淀的离子方程式是2Cu2++2Cl-+SO+H2O=2CuCl↓+SO+2H+;故答案是2Cu2++2Cl-+SO+H2O=2CuCl↓+SO+2H+;
②增大,溶液中Cl-浓度增大,使得更容易生成CuCl,随着反应的进行,CuCl易与过多的形成可溶的,使得CuCl沉淀逐渐消失,产率下降,故答案是增大,溶液中Cl-浓度增大,使得更容易生成CuCl,随着反应的进行,CuCl易与过多的形成可溶的,使得CuCl沉淀逐渐消失,产率下降;
③反应时间越长,CuCl与空气接触越久,越容易被氧化,使得CuCl产率下降;故答案是反应时间越长,CuCl被空气中的氧气氧化,产率下降。
16.(1)
(2)
(3)
(4)①②③
(5)ad
(6)2∶9
【详解】(1)醋酸是弱酸,电离是可逆过程,电离方程式为,故答案为;
(2)明矾水解生成氢氧化铝胶体,具有吸附性,反应的离子方程式为:,故答案为:
(3)56g金属铁的物质的量为1mol,与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,反应的热化学方程式为:
(4)碳酸氢钠是酸式盐,碳酸钠是正盐,所以碳酸钠的pH值大于碳酸氢钠的pH,氢氧化钠是强碱,完全电离,碱性最强,pH最大,三种溶液的pH 由小到大的顺序为①②③,故答案为①②③;
(5)a.某溶液的pH=9,说明溶液中存在NaA的水解过程,能够说明HA是弱电解质,正确;b.用HA 溶液做导电实验,灯泡很暗,可能是HA的浓度很小的结果,不能说明HA是弱电解质,错误;c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多是因为硫酸是二元酸,HA为一元酸,与酸的强弱无关,错误;d.0.1mol/LHA 溶液的pH≈2.8,说明HA未完全电离,能够说明HA是弱电解质,正确;故选ad;
(6)在100℃时,水的离子积为,此温度下将pH=11的溶液中的溶液,若所得混合溶液的,则反应后的溶液的,则,解得:,故答案为2:9。
17. BD 减小 减小 > > > c AB 11
【详解】(1)A.弱电解质的电离是吸热过程,升高温度,电离平衡正向移动,和浓度都增大,不符合题意;
B.加入NH4Cl固体,NH4Cl电离出,的浓度增大,平衡逆向移动,OH-浓度减小,符合题意;
C.通入适量NH3,NH3·H2O浓度增大,平衡正向移动,和OH-浓度都增大,不符合题意;
D.加入少量浓盐酸,浓盐酸电离出的H+与OH-结合成H2O,OH-浓度减小,电离平衡正向移动,浓度增大,符合题意;故答案为:BD;
(2)①醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,加入的醋酸钠电离出CH3COO-,CH3COO-浓度增大,电离平衡逆向移动,溶液中c(H+)减小;在盐酸中加入醋酸钠,醋酸钠电离出的CH3COO-与H+结合成弱酸CH3COOH,溶液中c(H+)减小;故答案为:减小;减小;
②加水稀释10倍,溶液体积变为原来的10倍,稀释后盐酸中c(H+)变为原来的1/10;加水稀释促进醋酸的电离,稀释后醋酸溶液中c(H+)大于原来的1/10;加水稀释10倍后醋酸溶液中的c(H+)>盐酸溶液中的c(H+),故答案为:>;
③醋酸为弱酸,盐酸为强酸,pH相同的盐酸和醋酸溶液,物质的量浓度:醋酸大于盐酸,等体积的溶液中加入等浓度的NaOH溶液至恰好中和,消耗的NaOH溶液的体积:醋酸>盐酸,故答案为:>;
④弱电解质的电离是吸热过程,升高温度促进醋酸的电离,醋酸溶液中c(H+)增大;升高温度,盐酸溶液中c(H+)不变,则温度都升高20℃后溶液中c(H+):醋酸>盐酸,故答案为:>;
⑤醋酸溶液中H+被消耗会促进醋酸的电离,反应过程中醋酸溶液中c(H+)大于盐酸中,醋酸与Zn反应的速率比盐酸与Zn反应的速率快;等pH、等体积的醋酸溶液和盐酸中,醋酸提供的H+总物质的量大于盐酸,醋酸与足量Zn反应放出的H2大于盐酸与足量Zn反应放出的H2;答案选c。
(3)醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,加水稀释促进CH3COOH的电离,
A.电离程度增大,正确;
B.由于电离平衡正向移动,H+、CH3COO-物质的量增大,溶液中离子总数增多,正确;
C.由于溶液体积的增大超过离子物质的量的增大,c(H+)、c(CH3COO-)物质的量浓度减小,溶液导电性减弱,错误;
D.由于电离程度增大,溶液中醋酸分子减少,错误;答案选AB。
(4)=1.0×10-5,则c(OH-)==1.0×10-3mol/L,c(H+)==1.0×10-11,则pH=11。
18.(1) NaOH CH3COOH
(2)a
(3)c
(4)④
(5)c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)
【详解】(1)根据步骤①可知,A应为HCl、B为NH3·H2O、D为NaOH,由②可知C应为NH4HSO4,剩余的CH3COOH应为E。
(2)稀释氨水,减小,增大,c(H+)·c(OH-)不变,n(OH-)增大。
(3)pH相同,体积相同的盐酸和CH3COOH溶液比较,CH3COOH的物质的量多,Mg应在盐酸中剩余,因为c(H+)相同,速率开始相等。
(4)NH3·H2O、NH4HSO4等量混合生成(NH4)2SO4,升温NH水解程度增大,所以pH下降。
(5)NaOH和NH4HSO4混合呈中性时,NaOH应稍过量,所以c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)。
19.(1)Fe3++3H2OFe(OH)3(胶体)+3H+
(2)Al3++3NH3 H2O=Al(OH)3↓+3
(3)或2Na2O2+2H2O=4NaOH+O2↑
(4) 1:5
(5) H2O2
【解析】(1)
饱和三氯化铁溶液滴入沸水中并煮沸一段时间,可制备氢氧化铁胶铁,反应的离子方程式为Fe3++3H2O Fe(OH)3(胶体)+3H+;
(2)
氨水和硫酸铝溶液反应生成氢氧化铝和硫酸铵,离子方程式为Al3++3NH3 H2O=Al(OH)3↓+3NH ;
(3)
过氧化钠作为供氧剂时,主要与二氧化碳或者水发生化学反应生成氧气,化学方程式为2Na2O2+2CO2=2Na2CO3+O2或2Na2O2+2H2O=4NaOH+O2↑;
(4)
氯气中氯元素的化合价由0价变成-1价或者+5价,根据守恒规律,故为;氧化产物是KClO3,还原产物KCl,物质的量之比为1:5;
(5)
锰元素的化合价由+7价变成+2价,且系数是2,故为;还原剂在反应中化合价升高,故为H2O2。
20.(1)①②④③或②①④③
(2)
(3) 11.9 量筒、胶头滴管 无影响 偏小
(4)60.0%
【详解】(1)测定过程的正确顺序为①配制盐酸和溶液;②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;④加入盐酸;③用溶液中和过量的盐酸,记录所消耗NaOH溶液的体积。或②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;①配制盐酸和溶液;④加入盐酸;③用溶液中和过量的盐酸,记录所消耗NaOH溶液的体积。
(2)测定过程中发生碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,过量的盐酸和氢氧化钠反应,反应的离子方程式为、。
(3)该盐酸的物质的量浓度为。配制溶液需要的仪器有容量瓶、烧杯、玻璃棒、量筒和胶头滴管。①容量瓶在使用前未干燥,里面有少量蒸馏水,对溶液浓度无影响;②未洗涤烧杯及玻璃棒,溶质的量减少,故溶液的浓度偏小。
(4)平均消耗NaOH溶液体积为=13.00mL,盐酸与氢氧化钠溶液浓度相等,可知剩余盐酸体积为13.00mL,故与碳酸钙反应盐酸体积为25.00mL-13.00mL=12.00mL,每片中碳酸钙物质的量为=6×10-4mol,则每片药剂中CaCO3的质量分数为×100%=60.0%,故答案为:60.0%。
21.(1) Cu2++2=Cu(OH)2↓+2 Cu(OH)2+4NH3. H2O= [Cu(NH3)4]2+ +2OH- +4H2O
(2)>
(3)降蓝色的透明溶液
【详解】(1)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到降蓝色的透明溶液,涉及的离子方程式:Cu2++2=Cu(OH)2↓+2、Cu(OH)2+4NH3. H2O= [Cu(NH3)4]2+ +2OH- +4H2O。降蓝色的离子为[Cu(NH3)4]2+,其结构式为:,故答案:Cu2++2NH3 H2O=Cu(OH)2↓+2NH4、Cu(OH)2+4NH3. H2O= [Cu(NH3)4]2+ +2OH- +4H2O;。
(2)硫酸铜溶液中加入过量氨水后生成了[Cu(NH3)4]2+离子,说明氨气与Cu2+的配位能力大于水与铜离子的配位能力。故答案:>。
(3)因为氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,难溶物溶解得到降蓝色的透明溶液,所以若向盛有大量氨水的试管中逐滴加入硫酸铜溶液至过量,现象是产生深蓝色的透明溶液,故答案:产生降蓝色的透明溶液,故答案:降蓝色的透明溶液。
22.(1)Na2SO4 + CaCO3 +4CCaS + Na2CO3 +4CO↑
(2) Ca( OH)2 NH3 NH3 + CO2 + NaCl + H2O =NaHCO3 + NH4Cl
(3)保留了氨碱法的优点,使食盐的利用率提高到96% ;NH4Cl可做氮肥;可与合成氨厂联合,原料气氨气和一氧化碳都由氨厂提供,减少CaCO3制CO2这一工序,降低了能耗与污染
(4)不可行,因为碳酸氢钾溶解度较大,且在常温下与氯化钾的溶解度差别小,在氨盐水碳酸化时无法大量析出
【解析】略
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
