化学人教版(2019)必修第一册1.2.1电解质的电离(共35张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.1电解质的电离(共35张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 148.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-24 09:25:35 | ||
图片预览








文档简介
(共35张PPT)
演讲者:
第一章物质及其变化
第二节 离子反应
第一课时 电解质的电离
什么物质能导电?
01
物质为什么能导电?
02
物质电离怎样表示?
03
课时1 电解质的电离
——电解质
——电离
——电离方程式
01
电解质与非电解质
思考:
海洋是一个巨大的资源宝库,含有80多种元素,如果将海水中的盐全部提取出来,铺在陆地上,可以使陆地平均升高150m。可是,面对大海,我们为何看不见这些物质?
溶解于海水中的化学元素绝大多数是以离子的形式存在的!
湿手不拔插头,雨天不碰高压线。这是为什么呢?
[实验1-2]在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图1-9所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
取上述烧杯中的NaCl固体、KNO3,固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图1-9所示,将石墨电极依次放入NaCl溶液、KNO3溶液中,分别接通电源,观察并记录现象。
实验对象 灯泡发光情况 结 论
蒸馏水
NaCl 固体
KNO3 固体 NaCl 溶液
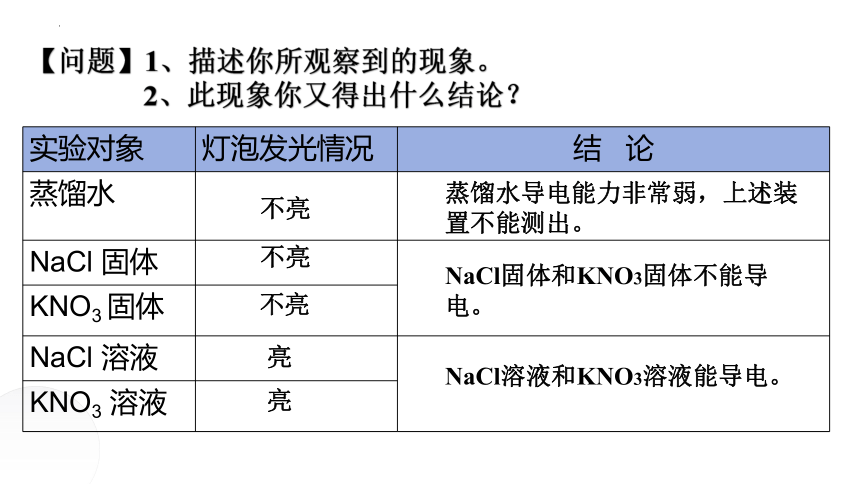
KNO3 溶液 【问题】1、描述你所观察到的现象。
2、此现象你又得出什么结论?
NaCl固体和KNO3固体不能导电。
NaCl溶液和KNO3溶液能导电。
蒸馏水导电能力非常弱,上述装置不能测出。
不亮
不亮
不亮
亮
亮
NaCl固体
纯水
发生了什么?
NaCl溶液
不导电
导电
在NaCl固体溶于水的过程中究竟发生了什么?
微观角度
深入思考:NaCl固体为什么不能导电,而NaCl溶液可以导电?
电流是如何产生的呢?
导电的前提
带电粒子
自由移动
施加电场
产生电流
总结:
NaCl固体不能导电的原因:
NaCl溶液可以导电的原因:
阴、阳离子不能自由移动
有可自由移动的阴、阳离子,只要外接电源,阴、阳离子在电场作用下定向移动,故而导电。
蔗糖与酒精本身以分子形式存在,不像NaCl含有阴阳离子,溶于水时也没有电离出自由移动的阴、阳离子,所以蔗糖、酒精溶液均不能导电。
类比迁移:为什么酒精溶液和蔗糖溶液不能导电呢?
无阴、阳离子
能否给NaCl固体以很高的能量使Na+、Cl-克服离子间的相互作用力,解离出来呢?此状态下的NaCl满足导电的前提么?可以导电么?
【实验表明】熔融NaCl能导电。
回答问题:
能否给NaCl固体以很高的能量使Na+、Cl-克服离子间的相互作用力,解离出来呢?此状态下的NaCl满足导电的前提么?可以导电么?
阴、阳离子的间的相互作用使得NaCl晶体中Na+、Cl-排列紧密,无法自由移动,水分子的作用使得Na+、Cl-可以克服这种微粒间的相互作用,从而NaCl溶液可以导电。同样在受热熔化的条件下,Na+、Cl-也可以克服这种微粒间的相互作用,形成可自由移动的阴、阳离子,因此,熔融NaCl也可以导电。
非电解质:在水溶液里和熔融状态下都不能导电的化合物
一、电解质与非电解质
重点!
电解质:在水溶液里或熔融状态下能够导电的化合物
能否导电的条件
物质类别
1、概念区分
化合物
电解质
非电解质
物质
混合物
纯净物
单质
(1)树状分类法
化合物
(2)venn图
非电解质
水溶液中导电
熔融状态导电
电解质
1、铜片、石墨能导电,它们是电解质吗?
2、NaCl 溶液能导电,因此我们说NaCl 溶液是电解质,对此你有什么看法?
不是
【解析】电解质和非电解质都是化合物,单质和混合物既不是电解质也不是非电解质。
【思考与交流】
3、CO2的水溶液能导电,CO2是电解质吗?
4、Na2O溶于水所得溶液能导电,有人因此说Na2O是电解质,对此观点你是否认可?
不是
【解析】 co2 + h2o = h2co3, 该溶液能导电是因为生成的h2co3,而不是co2本身电离出自由移动的离子而导电。
不是
不是
分类 电解质 非电解质
相同点 不同点
本质区别
存在形式
均为化合物
在水溶液中或熔融状态下能够导电
在水溶液中和熔融状态下均不能导电
在水溶液中或熔融状态下能自身电离
在水溶液中和熔融状态下不能自身电离
离子(或离子和分子)
分子
分类 电解质 非电解质
所含物质类别 酸:H2SO4 、HCl 碱:KOH、NH3·H2O 盐:NaCl、KNO3 金属氧化物:Na2O、Al2O3(熔融状态下导电) 水:H2O 少数有机物:醋酸等 非金属氧化物:CO2等
非酸性气态氢化物:NH3
大多数有机物:蔗糖、酒精、甲烷等
2、电解质与非电解质的分类
补充:强电解质与弱电解质
电解质分类 强电解质 弱电解质
电离程度 完全电离 部分电离
存在形式 离子 分子和离子
物质类别 强酸、强碱、大多数盐、活泼金属氧化物 H2O、弱酸、弱碱、少部分盐
举例 H2SO4、CaSO4、CuSO4 CH3COOH、NH3·H2O、(CH3COO)2Pb、HgCl2
类别 示例 导电情况 规律
碱和盐 NaOH、NaCl 固体不导电 水溶液、熔融状态都导电 水熔均能导
酸 H2SO4、 CH3COOH 水溶液导电、熔融状态不导电 水导熔不导
金属氧化物 Al2O3、Na2O 熔融状态能导电,不存在水溶液 熔导水不导
多数有机化合物 蔗糖、乙醇 水溶液、熔融状态都不导电 水熔均不导
3、物质导电情况
下列物质中哪些是电解质?哪些是非电解质?
①铜 ②固态NaCl ③CO2 ④H2SO4 ⑤硫酸钡
⑥酒精 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨蔗糖溶液
电解质:②固态NaCl ④H2SO4 ⑤硫酸钡 ⑧熔融状态的KNO3
非电解质: ③CO2 ⑥酒精
【注意】
(1)电解质首先必须是化合物,单质和混合物既不是电解质也不是非电解质;
(2)某些非电解质溶于水时与水反应生成电解质从而使溶液导电,但是该化合物依然是非电解质(例如:CO2)
下列说法中,正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.蔗糖、酒精在水溶液里或熔融状态时均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
C
人的手上常会沾有NaCl(汗液的成分之一),有时也会沾有其他电解质,当遇到水时,形成电解质溶液。电解质溶液能够导电,因此,湿手直接接触电源时容易发生触电事故。
湿手不拔插头,雨天不碰高压线。这是为什么呢?
【解决问题】
BaSO4、CaCO3、AgCl等难溶于水的盐是否属电解质
【解析】 BaSO4、CaCO3、AgCl 在熔融状态下可以导电,故属于电解质。
【判断正误】
液态HCl不导电,则液态HCl为非电解质;
×
【解析】水溶液或熔融状态是外界条件,只需要满足条件之一即可。
02
电离与电离方程式
1、什么样的物质在什么条件下可以导电?
思考
电解质溶于水或受热熔化时可以导电。
2、什么是电离?
3、怎样才能形象地把电离的过程描述出来?
电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做电离。
电离方程式(为简便起见,一般仍用离子符号表示水合离子)。
如:H2CO3、H2SO3、HClO、
CH3COOH、H3PO4
NaCl=Na++Cl-
KNO3=K++NO3-
电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程
电离方程式
HCl =H++Cl-
HNO3=H++NO3-
H2SO4=2H++SO42-
电离时生成的阳离子全部是H+的化合物是酸
NaOH Na++ OH—
Ca(OH)2 Ca2+ + 2OH—
Ba(OH)2 Ba2+ + 2OH—
如:KOH、Mg(OH)2 、NH3·H2O、Cu(OH)2、
思考与讨论
(1)请写出NaOH、Ca(OH)2、Ba(OH)2的电离方程式。
(2)请结合以上电离方程式,并参考酸的本质,尝试从电离的角度概括出碱的性质。
电离时生成的阴离子全部是OH-的化合物叫做碱
NaCl、KNO3 、MgCl2 、NH4NO3、 K2SO4
练习1、请写出下列物质的电离方程式,从电离角度体会盐的本质。
盐:由金属阳离子(或者NH4+)和酸根、阴离子组成的化合物。
如:BaCl2、Na2SO4、Na2CO3 、 CuSO4、AgNO3、NH4NO3
NaCl = Na+ + Cl—
KNO3 = K+ + NO3—
MgCl2 = Mg2+ + 2 Cl—
NH4NO3 = NH4+ + NO3—
铵盐
an
v
下列电离方程式中,正确的是 ( )
A.Ca(OH)2 === Ca2++ 2(OH—)
B.FeCl2 === Fe2+ + 3Cl—
C.H2SO4 === H2++ SO42—
D.Al2(SO4)3 === 2Al3++ 3SO42—
D
【解析】A项2(OH—)为错误的表示方法,正确的为:2OH—;B项是2Cl—;C项H2+为错误的表示方法,正确的为:2H+。
练习2、
练习3.下列物质属于电解质的是 ( )
A.SO2 B.NaHCO3 C.H2SO4溶液 D.Fe
练习4.下列状态下的物质,既能导电又属于电解质的是( )
A.MgCl2晶体 B.NaCl溶液 C.铜丝 D.熔融的KOH
B
D
【解析】能导电的物质为NaCl溶液、铜丝、熔融的KOH,但满足电解质定义的物质只有熔融的KOH。
书写以下物质的电离方程式,并归纳电离方程式书写的注意事项。
NaHCO3 NaHSO4
NaHSO4 = Na+ +H+ + SO42—
NaHCO3 = Na+ +HCO3—
水溶液中,强酸的酸式根能完全解离,而弱酸的酸式根不能完全解离。
1、阴阳离子拆开写,但原子团不能拆,
如:NO3—、SO42—、OH—、NH4+、CO32—等
2、原子个数守恒,电荷守恒
3、水溶液中,强酸的酸式根(HSO4—)要拆开写,
而弱酸的酸式根(HCO3—)不能拆。
书写电离方程式时的注意事项:
溶液的导电性与什么有关?
①离子浓度
②粒子所带电荷数
③温度(与金属相反)
电解质导电的原因:
电解质 自由移动的阴阳离子 定向移动 导电
电离产生
电场作用
物质导电能力的影响因素:
请大家尝试用树状分类法对本节内容进行分类,找出本节所学内容在物质的分类中的位置,并标明分类标准。
【课堂小结】
1、电解质:在水溶液里或熔融状态下能导电的化合物。
2、电离:电解质在溶于水或受热熔化时,形成自由移动的离子的过程。
3、电离方程式:离子的拆分要正确,遵循质量守恒定律、电荷守恒定律。
4、酸碱盐的拆分:酸拆为氢离子和酸根离子;碱拆为阳离子和氢氧根离子;盐拆为金属阳离子(或铵根离子)和酸根离子。
演讲者:
第一章物质及其变化
第二节 离子反应
第一课时 电解质的电离
什么物质能导电?
01
物质为什么能导电?
02
物质电离怎样表示?
03
课时1 电解质的电离
——电解质
——电离
——电离方程式
01
电解质与非电解质
思考:
海洋是一个巨大的资源宝库,含有80多种元素,如果将海水中的盐全部提取出来,铺在陆地上,可以使陆地平均升高150m。可是,面对大海,我们为何看不见这些物质?
溶解于海水中的化学元素绝大多数是以离子的形式存在的!
湿手不拔插头,雨天不碰高压线。这是为什么呢?
[实验1-2]在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图1-9所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
取上述烧杯中的NaCl固体、KNO3,固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图1-9所示,将石墨电极依次放入NaCl溶液、KNO3溶液中,分别接通电源,观察并记录现象。
实验对象 灯泡发光情况 结 论
蒸馏水
NaCl 固体
KNO3 固体 NaCl 溶液
KNO3 溶液 【问题】1、描述你所观察到的现象。
2、此现象你又得出什么结论?
NaCl固体和KNO3固体不能导电。
NaCl溶液和KNO3溶液能导电。
蒸馏水导电能力非常弱,上述装置不能测出。
不亮
不亮
不亮
亮
亮
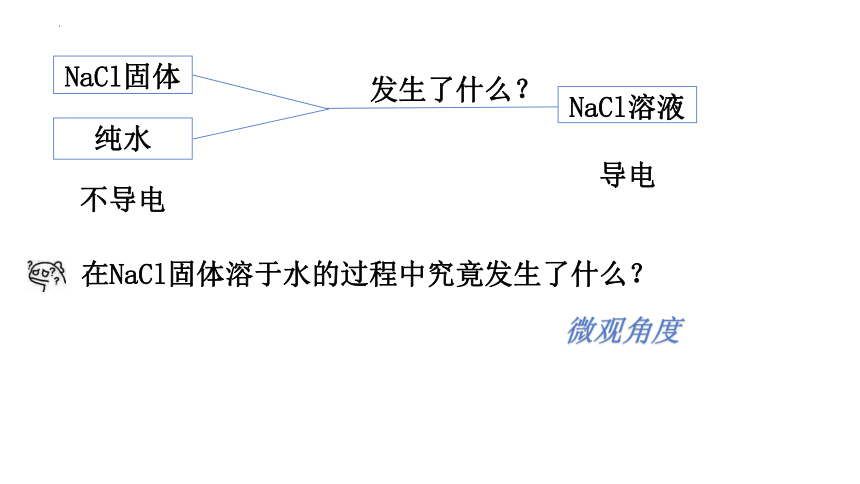
NaCl固体
纯水
发生了什么?
NaCl溶液
不导电
导电
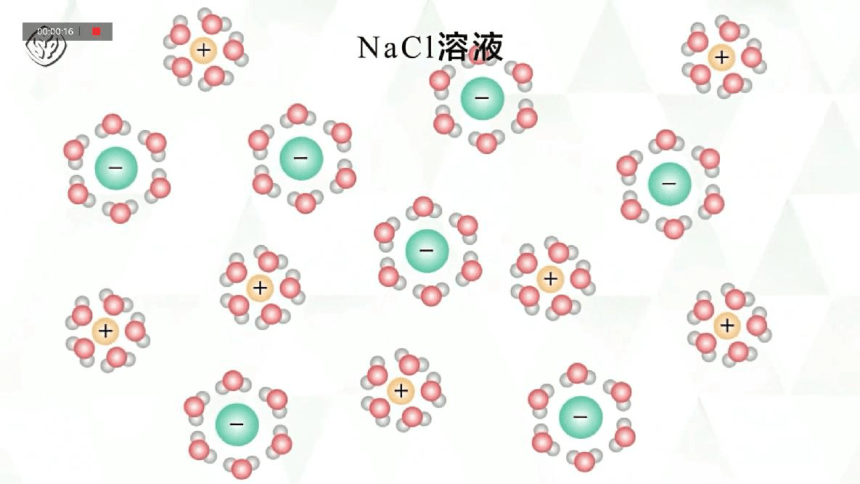
在NaCl固体溶于水的过程中究竟发生了什么?
微观角度
深入思考:NaCl固体为什么不能导电,而NaCl溶液可以导电?
电流是如何产生的呢?
导电的前提
带电粒子
自由移动
施加电场
产生电流
总结:
NaCl固体不能导电的原因:
NaCl溶液可以导电的原因:
阴、阳离子不能自由移动
有可自由移动的阴、阳离子,只要外接电源,阴、阳离子在电场作用下定向移动,故而导电。
蔗糖与酒精本身以分子形式存在,不像NaCl含有阴阳离子,溶于水时也没有电离出自由移动的阴、阳离子,所以蔗糖、酒精溶液均不能导电。
类比迁移:为什么酒精溶液和蔗糖溶液不能导电呢?
无阴、阳离子
能否给NaCl固体以很高的能量使Na+、Cl-克服离子间的相互作用力,解离出来呢?此状态下的NaCl满足导电的前提么?可以导电么?
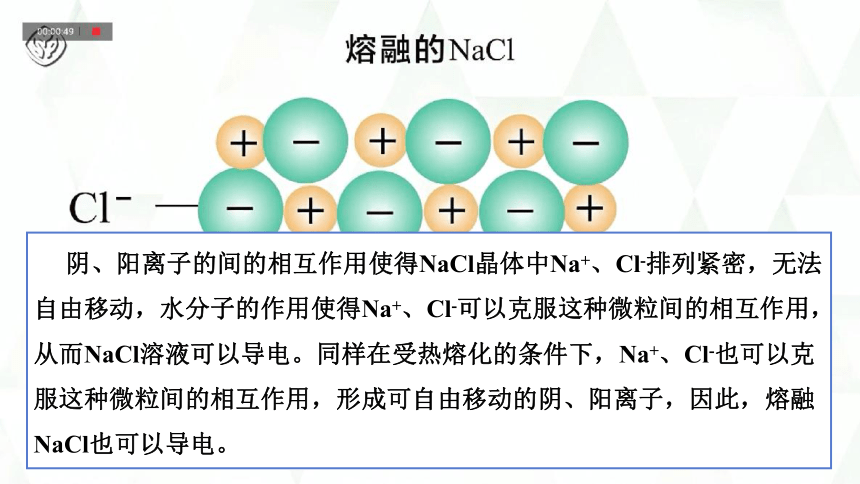
【实验表明】熔融NaCl能导电。
回答问题:
能否给NaCl固体以很高的能量使Na+、Cl-克服离子间的相互作用力,解离出来呢?此状态下的NaCl满足导电的前提么?可以导电么?
阴、阳离子的间的相互作用使得NaCl晶体中Na+、Cl-排列紧密,无法自由移动,水分子的作用使得Na+、Cl-可以克服这种微粒间的相互作用,从而NaCl溶液可以导电。同样在受热熔化的条件下,Na+、Cl-也可以克服这种微粒间的相互作用,形成可自由移动的阴、阳离子,因此,熔融NaCl也可以导电。
非电解质:在水溶液里和熔融状态下都不能导电的化合物
一、电解质与非电解质
重点!
电解质:在水溶液里或熔融状态下能够导电的化合物
能否导电的条件
物质类别
1、概念区分
化合物
电解质
非电解质
物质
混合物
纯净物
单质
(1)树状分类法
化合物
(2)venn图
非电解质
水溶液中导电
熔融状态导电
电解质
1、铜片、石墨能导电,它们是电解质吗?
2、NaCl 溶液能导电,因此我们说NaCl 溶液是电解质,对此你有什么看法?
不是
【解析】电解质和非电解质都是化合物,单质和混合物既不是电解质也不是非电解质。
【思考与交流】
3、CO2的水溶液能导电,CO2是电解质吗?
4、Na2O溶于水所得溶液能导电,有人因此说Na2O是电解质,对此观点你是否认可?
不是
【解析】 co2 + h2o = h2co3, 该溶液能导电是因为生成的h2co3,而不是co2本身电离出自由移动的离子而导电。
不是
不是
分类 电解质 非电解质
相同点 不同点
本质区别
存在形式
均为化合物
在水溶液中或熔融状态下能够导电
在水溶液中和熔融状态下均不能导电
在水溶液中或熔融状态下能自身电离
在水溶液中和熔融状态下不能自身电离
离子(或离子和分子)
分子
分类 电解质 非电解质
所含物质类别 酸:H2SO4 、HCl 碱:KOH、NH3·H2O 盐:NaCl、KNO3 金属氧化物:Na2O、Al2O3(熔融状态下导电) 水:H2O 少数有机物:醋酸等 非金属氧化物:CO2等
非酸性气态氢化物:NH3
大多数有机物:蔗糖、酒精、甲烷等
2、电解质与非电解质的分类
补充:强电解质与弱电解质
电解质分类 强电解质 弱电解质
电离程度 完全电离 部分电离
存在形式 离子 分子和离子
物质类别 强酸、强碱、大多数盐、活泼金属氧化物 H2O、弱酸、弱碱、少部分盐
举例 H2SO4、CaSO4、CuSO4 CH3COOH、NH3·H2O、(CH3COO)2Pb、HgCl2
类别 示例 导电情况 规律
碱和盐 NaOH、NaCl 固体不导电 水溶液、熔融状态都导电 水熔均能导
酸 H2SO4、 CH3COOH 水溶液导电、熔融状态不导电 水导熔不导
金属氧化物 Al2O3、Na2O 熔融状态能导电,不存在水溶液 熔导水不导
多数有机化合物 蔗糖、乙醇 水溶液、熔融状态都不导电 水熔均不导
3、物质导电情况
下列物质中哪些是电解质?哪些是非电解质?
①铜 ②固态NaCl ③CO2 ④H2SO4 ⑤硫酸钡
⑥酒精 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨蔗糖溶液
电解质:②固态NaCl ④H2SO4 ⑤硫酸钡 ⑧熔融状态的KNO3
非电解质: ③CO2 ⑥酒精
【注意】
(1)电解质首先必须是化合物,单质和混合物既不是电解质也不是非电解质;
(2)某些非电解质溶于水时与水反应生成电解质从而使溶液导电,但是该化合物依然是非电解质(例如:CO2)
下列说法中,正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.蔗糖、酒精在水溶液里或熔融状态时均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
C
人的手上常会沾有NaCl(汗液的成分之一),有时也会沾有其他电解质,当遇到水时,形成电解质溶液。电解质溶液能够导电,因此,湿手直接接触电源时容易发生触电事故。
湿手不拔插头,雨天不碰高压线。这是为什么呢?
【解决问题】
BaSO4、CaCO3、AgCl等难溶于水的盐是否属电解质
【解析】 BaSO4、CaCO3、AgCl 在熔融状态下可以导电,故属于电解质。
【判断正误】
液态HCl不导电,则液态HCl为非电解质;
×
【解析】水溶液或熔融状态是外界条件,只需要满足条件之一即可。
02
电离与电离方程式
1、什么样的物质在什么条件下可以导电?
思考
电解质溶于水或受热熔化时可以导电。
2、什么是电离?
3、怎样才能形象地把电离的过程描述出来?
电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做电离。
电离方程式(为简便起见,一般仍用离子符号表示水合离子)。
如:H2CO3、H2SO3、HClO、
CH3COOH、H3PO4
NaCl=Na++Cl-
KNO3=K++NO3-
电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程
电离方程式
HCl =H++Cl-
HNO3=H++NO3-
H2SO4=2H++SO42-
电离时生成的阳离子全部是H+的化合物是酸
NaOH Na++ OH—
Ca(OH)2 Ca2+ + 2OH—
Ba(OH)2 Ba2+ + 2OH—
如:KOH、Mg(OH)2 、NH3·H2O、Cu(OH)2、
思考与讨论
(1)请写出NaOH、Ca(OH)2、Ba(OH)2的电离方程式。
(2)请结合以上电离方程式,并参考酸的本质,尝试从电离的角度概括出碱的性质。
电离时生成的阴离子全部是OH-的化合物叫做碱
NaCl、KNO3 、MgCl2 、NH4NO3、 K2SO4
练习1、请写出下列物质的电离方程式,从电离角度体会盐的本质。
盐:由金属阳离子(或者NH4+)和酸根、阴离子组成的化合物。
如:BaCl2、Na2SO4、Na2CO3 、 CuSO4、AgNO3、NH4NO3
NaCl = Na+ + Cl—
KNO3 = K+ + NO3—
MgCl2 = Mg2+ + 2 Cl—
NH4NO3 = NH4+ + NO3—
铵盐
an
v
下列电离方程式中,正确的是 ( )
A.Ca(OH)2 === Ca2++ 2(OH—)
B.FeCl2 === Fe2+ + 3Cl—
C.H2SO4 === H2++ SO42—
D.Al2(SO4)3 === 2Al3++ 3SO42—
D
【解析】A项2(OH—)为错误的表示方法,正确的为:2OH—;B项是2Cl—;C项H2+为错误的表示方法,正确的为:2H+。
练习2、
练习3.下列物质属于电解质的是 ( )
A.SO2 B.NaHCO3 C.H2SO4溶液 D.Fe
练习4.下列状态下的物质,既能导电又属于电解质的是( )
A.MgCl2晶体 B.NaCl溶液 C.铜丝 D.熔融的KOH
B
D
【解析】能导电的物质为NaCl溶液、铜丝、熔融的KOH,但满足电解质定义的物质只有熔融的KOH。
书写以下物质的电离方程式,并归纳电离方程式书写的注意事项。
NaHCO3 NaHSO4
NaHSO4 = Na+ +H+ + SO42—
NaHCO3 = Na+ +HCO3—
水溶液中,强酸的酸式根能完全解离,而弱酸的酸式根不能完全解离。
1、阴阳离子拆开写,但原子团不能拆,
如:NO3—、SO42—、OH—、NH4+、CO32—等
2、原子个数守恒,电荷守恒
3、水溶液中,强酸的酸式根(HSO4—)要拆开写,
而弱酸的酸式根(HCO3—)不能拆。
书写电离方程式时的注意事项:
溶液的导电性与什么有关?
①离子浓度
②粒子所带电荷数
③温度(与金属相反)
电解质导电的原因:
电解质 自由移动的阴阳离子 定向移动 导电
电离产生
电场作用
物质导电能力的影响因素:
请大家尝试用树状分类法对本节内容进行分类,找出本节所学内容在物质的分类中的位置,并标明分类标准。
【课堂小结】
1、电解质:在水溶液里或熔融状态下能导电的化合物。
2、电离:电解质在溶于水或受热熔化时,形成自由移动的离子的过程。
3、电离方程式:离子的拆分要正确,遵循质量守恒定律、电荷守恒定律。
4、酸碱盐的拆分:酸拆为氢离子和酸根离子;碱拆为阳离子和氢氧根离子;盐拆为金属阳离子(或铵根离子)和酸根离子。
