微主题热练14 反应过程曲线分析(含解析)-2024年高考化学二轮复习
文档属性
| 名称 | 微主题热练14 反应过程曲线分析(含解析)-2024年高考化学二轮复习 |  | |
| 格式 | doc | ||
| 文件大小 | 333.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-23 19:28:32 | ||
图片预览


文档简介
微主题热练14 反应过程曲线分析
1. (2023·常州期末)某水样中含一定浓度的CO、HCO和其他不与酸碱反应的离子。取10.00 mL水样,用0.010 mol/L的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图所示(混合后溶液体积变化忽略不计)。下列说法不正确的是( )
A. 该水样中:c(CO )∶c(HCO)=2∶1
B. a点对应溶液中存在:c(H2CO3)+c(H+)=c(OH-)+c(CO)
C. 当V(HCl)≤20.00 mL时,溶液中c(HCO)随V(HCl)的增多基本保持不变
D. 根据实验结果可以推知:Ka1(H2CO3)·Ka2(H2CO3)>Kw
2. (2023·扬州期初)合成环氧氯丙烷时产生了盐酸和醋酸(HAc)混合液,为研究混合溶液的定量分析方法,进行以下实验。
实验1:向20 mL 0.1 mol/L HCl溶液中滴加0.1 mol/L NaOH溶液;
实验2:向20 mL 0.1 mol/L HAc溶液中滴加0.1 mol/L NaOH溶液;
实验3:向20 mL某浓度HCl与HAc混合溶液中滴加0.1 mol/L NaOH溶液。
测得实验1、2中溶液pH的变化如图所示。下列说法正确的是( )
A. 实验1所测得的pH变化为曲线b
B. 实验2中加入10 mL NaOH溶液时,溶液中存在:c(H+)+c(HAc)=c(Ac-)+c(OH-)
C. 实验3溶液中Ac-的物质的量分数存在:=
D. 实验3中根据pH约为4.30时所消耗的V(NaOH),可计算混合溶液中n(HCl)
3. (2022·泰州中学)常温下,用200 mL 0.1 mol/L NaOH溶液吸收SO2与N2混合气体,所得溶液pH与吸收气体体积的关系如图所示,已知Ka1(H2SO3)=1.2×10-2,Ka2(H2SO3)=5.6×10-8。下列说法正确的是( )
A. 吸收3 L气体时溶液中主要溶质为NaHSO3
B. 溶液pH=7时存在:2c(SO)>c(HSO)
C. X点呈酸性的原因是HSO水解程度大于其电离程度
D. 曲线上任意点均存在:c(H+)+c(Na+)=c(OH-)+c(HSO)+c(SO)
4. (2023·徐州期中)在两个相同容器中分别加入20 mL 0.4 mol/L Na2CO3溶液和40 mL 0.2 mol/L NaHCO3溶液,再分别用0.4 mol/L 盐酸滴定,利用压强传感器检测反应生成CO2引起的压强变化,得到如图所示曲线。下列说法正确的是( )
A. 图中曲线甲表示向Na2CO3溶液中滴加盐酸时的压强变化
B. a点对应两溶液中均满足:c(H2CO3)-c(CO)=c(OH-)-c(H+)
C. b、d两点对应溶液中均有:c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO)
D. c点对应溶液中c(Na+)=2[c(H2CO3)+c(HCO)+c(CO)]
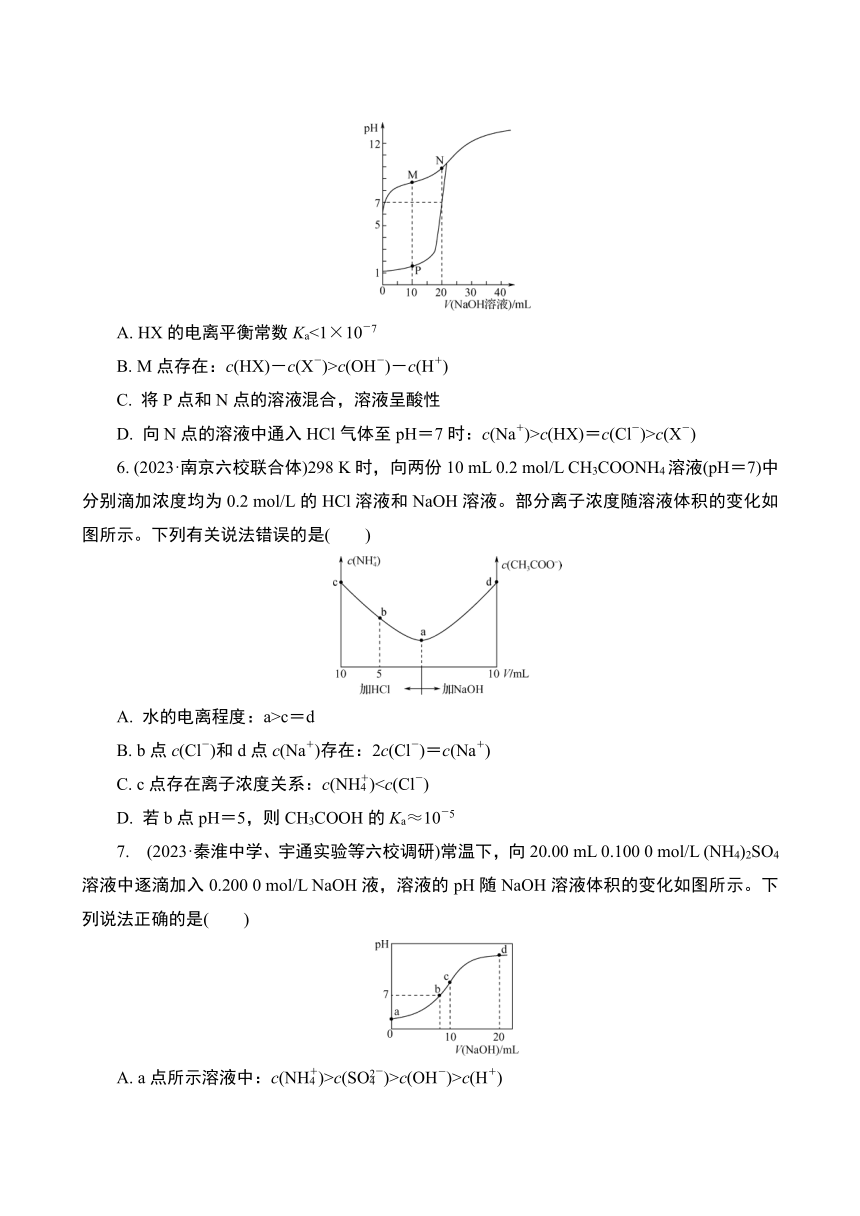
5. (2023·南京外国语)室温下,用0.1 mol/LNaOH溶液分别滴定体积均为20 mL、浓度均为0.1 mol/L的HCl和HX溶液,溶液pH随加入NaOH溶液体积的变化如图所示。下列说法不正确的是( )
A. HX的电离平衡常数Ka<1×10-7
B. M点存在:c(HX)-c(X-)>c(OH-)-c(H+)
C. 将P点和N点的溶液混合,溶液呈酸性
D. 向N点的溶液中通入HCl气体至pH=7时:c(Na+)>c(HX)=c(Cl-)>c(X-)
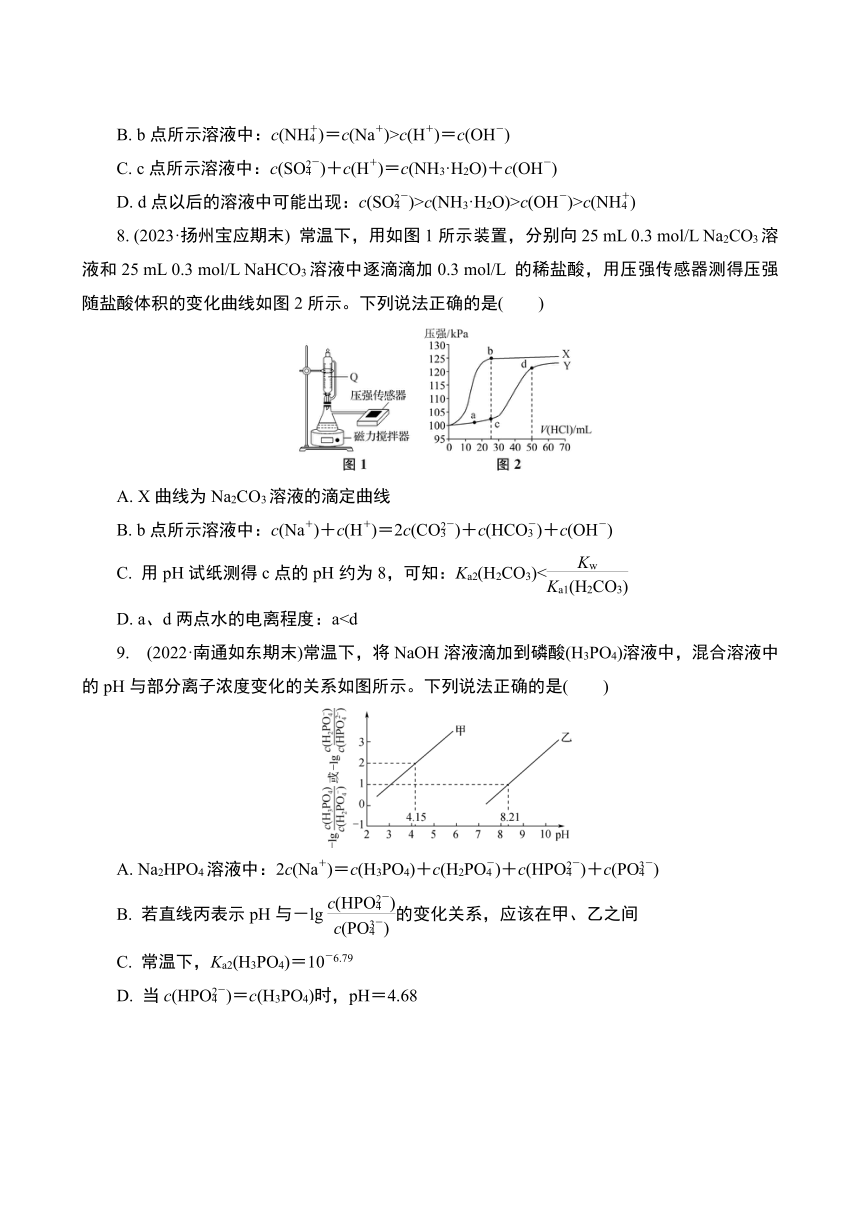
6. (2023·南京六校联合体)298 K时,向两份10 mL 0.2 mol/L CH3COONH4溶液(pH=7)中分别滴加浓度均为0.2 mol/L的HCl溶液和NaOH溶液。部分离子浓度随溶液体积的变化如图所示。下列有关说法错误的是( )
A. 水的电离程度:a>c=d
B. b点c(Cl-)和d点c(Na+)存在:2c(Cl-)=c(Na+)
C. c点存在离子浓度关系:c(NH)D. 若b点pH=5,则CH3COOH的Ka≈10-5
7. (2023·秦淮中学、宇通实验等六校调研)常温下,向20.00 mL 0.100 0 mol/L (NH4)2SO4溶液中逐滴加入0.200 0 mol/L NaOH液,溶液的pH随NaOH溶液体积的变化如图所示。下列说法正确的是( )
A. a点所示溶液中:c(NH)>c(SO)>c(OH-)>c(H+)
B. b点所示溶液中:c(NH)=c(Na+)>c(H+)=c(OH-)
C. c点所示溶液中:c(SO)+c(H+)=c(NH3·H2O)+c(OH-)
D. d点以后的溶液中可能出现:c(SO)>c(NH3·H2O)>c(OH-)>c(NH)
8. (2023·扬州宝应期末) 常温下,用如图1所示装置,分别向25 mL 0.3 mol/L Na2CO3溶液和25 mL 0.3 mol/L NaHCO3溶液中逐滴滴加0.3 mol/L 的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示。下列说法正确的是( )
A. X曲线为Na2CO3溶液的滴定曲线
B. b点所示溶液中:c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-)
C. 用pH试纸测得c点的pH约为8,可知:Ka2(H2CO3)<
D. a、d两点水的电离程度:a9. (2022·南通如东期末)常温下,将NaOH溶液滴加到磷酸(H3PO4)溶液中,混合溶液中的pH与部分离子浓度变化的关系如图所示。下列说法正确的是( )
A. Na2HPO4溶液中:2c(Na+)=c(H3PO4)+c(H2PO)+c(HPO)+c(PO)
B. 若直线丙表示pH与-lg的变化关系,应该在甲、乙之间
C. 常温下,Ka2(H3PO4)=10-6.79
D. 当c(HPO)=c(H3PO4)时,pH=4.68
微主题热练14 反应过程曲线分析
1. D 【解析】 由图可知,在滴定过程中有两次突跃,第一次突跃发生在a点,发生的反应为CO+H+===HCO,第二次突跃发生在b点,发生的反应为HCO+H+===H2O+CO2↑,两次滴定消耗HCl的物质的量之比为2∶3,说明水样中c(CO)∶c(HCO)=2∶1,A正确;a点溶液中的溶质为NaHCO3,溶液中的质子守恒式为c(H+)+c(H2CO3)=c(OH-)+c(CO),B正确;由图中数据推知,原溶液中c(CO)==0.020 mol/L,c(HCO)=c(CO)=0.010 mol/L,当V(HCl)≤20.00 mL时,随V(HCl)的增多,溶液体积变化忽略不计,c(HCO)==0.010 mol/L,基本保持不变,C正确;a点时,溶液pH>8.00,呈碱性,说明NaHCO3溶液中以HCO的水解为主,即Ka2(H2CO3)2. C 【解析】 盐酸是强酸,醋酸是弱酸,通过起点的pH可知,实验1所测得的pH变化为曲线a,A错误;实验2中加入10 mL NaOH溶液时,得到等浓度的HAc和NaAc混合溶液,电荷守恒式为c(H+)+c(Na+)=c(Ac-)+c(OH-),元素质量守恒式为2c(Na+)=c(Ac-)+c(HAc),联立两式,可得2c(H+)+c(HAc)=c(Ac-)+2c(OH-),B错误;实验3溶液中Ac-的物质的量分数存在:==,C正确;已知pH约为4.3时所消耗的NaOH溶液的体积,再结合NaOH溶液的浓度,只能求得反应消耗的n(H+)和溶液中的n(H+),溶液中的n(HAc)无法计算,故不能求得任何一种酸的物质的量,D错误。
3. B 【解析】 根据Ka1可知,HSO的水解平衡常数Kh=≈10-12<Ka2=5.6×10-8,故NaHSO3溶液显酸性,由图可知,通入混合气体3 L时,溶液pH>7,说明溶液中主要溶质并不是 NaHSO3,A错误;pH=7时,Ka2=5.6×10-8=,故c(SO)=0.56c(HSO),即2c(SO)=1.12c(HSO),即2c(SO)>c(HSO),B正确;X点溶液呈酸性,说明HSO水解程度小于其电离程度,C错误;任何电解质水溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HSO)+2c(SO),D错误。
4. D 【解析】 向溶液中逐滴滴加盐酸,先放出气体的是NaHCO3溶液,图中曲线甲表示向NaHCO3溶液中滴加盐酸时的压强变化,A错误;a点对应的两溶液分别是NaHCO3溶液和Na2CO3溶液,NaHCO3溶液中的质子守恒为c(OH-)+c(CO)=c(H2CO3)+c(H+),Na2CO3溶液中的质子守恒为c(OH-)=c(HCO)+2c(H2CO3)+c(H+),B错误;b、d两点溶液中一定都有Cl-,故电荷守恒式中缺少Cl-,C错误;曲线乙表示向Na2CO3溶液中滴加盐酸时的压强变化,滴加盐酸至c点时仍无气体放出,故该滴定过程中始终满足:N(Na)=2N(C),即c(Na+)=2[c(H2CO3)+c(HCO)+c(CO)],D正确。
5. C 【解析】 由初始pH可知,M所在的曲线对应的酸是HX,Ka=≈≈=10-11<10-7,A正确;M点对应溶液中的溶质是等物质的量的HX、NaX,电荷守恒式为c(Na+)+c(H+)=c(X-)+c(OH-),元素质量守恒式为2c(Na+)=c(HX)+c(X-),两式联立,消去c(Na+),可得c(HX)+2c(H+)=c(X-)+2c(OH-),M点对应溶液显碱性,则c(OH-)-c(H+)>0,移项得c(HX)-c(X-)=2[c(OH-)-c(H+)]>c(OH-)-c(H+),B正确;将P点和N点的溶液混合,所得溶液中n(NaCl)∶n(NaX)∶n(HX)=2∶1∶1,Ka=10-11c(HX)=c(Cl-),===10-4<1,则c(HX)=c(Cl-)>c(X-),D正确。
6. B 【解析】 a点溶液中的溶质为CH3COONH4,水的电离程度最大,c点溶液中的溶质为0.002 mol CH3COOH、0.002 mol NH4Cl,d点溶液中的溶质为0.002 mol CH3COONa、0.002 mol NH3·H2O,常温下,CH3COONH4溶液pH=7,说明Ka(CH3COOH)=Kb(NH3·H2O),c、d点水的电离程度相等,A正确;b点加入了5 mL 0.2 mol/L HCl溶液,d点加入了10 mL 0.2 mol/L NaOH溶液,则2n(Cl-)=n(Na+),由于b、d溶液总体积不同,故2c(Cl-)≠c(Na+),B错误;c点溶液中的溶质为等量的CH3COOH和NH4Cl,由于NH发生水解,部分损耗,故c(NH)7. C 【解析】 a点所示溶液中的溶质为(NH4)2SO4,溶液显酸性,则c(H+)>c(OH-),A错误;b点所示溶液中的溶质为(NH4)2SO4、Na2SO4、NH3·H2O,溶液pH=7,由电荷守恒推知,c(NH)+c(Na+)=c(SO),若c(NH)=c(Na+),则c(Na+)=c(SO),需要滴加10 mL NaOH溶液,NaOH溶液的体积与图像不符,B错误;c点所示溶液中n[(NH4)2SO4]∶n(Na2SO4)∶n(NH3·H2O)=1∶1∶2,由电荷守恒知,c(H+)+c(NH)+c(Na+)=2c(SO)+c(OH-),由元素质量守恒知,c(NH)+c(NH3·H2O)=2c(SO)=2c(Na+),联立两式,消去c(NH)、c(Na+),可得c(SO)+c(H+)=c(NH3·H2O)+c(OH-),C正确;d点所示溶液中n(Na2SO4)∶n(NH3·H2O)=1∶2,NH3·H2O微弱电离,d点以后的溶液中一定存在:c(NH3·H2O)>c(SO),D错误。
8. C 【解析】 逐滴滴加盐酸,先放出气体的是NaHCO3溶液,X曲线为NaHCO3溶液的滴定曲线,A错误;b点溶液中的主要溶质是NaCl和少量H2CO3,故b点溶液中一定有Cl-,电荷守恒式中缺少Cl-,B错误;c点所示溶液中的溶质为NaHCO3,pH约为8,则HCO的水解程度大于其电离程度,Ka2(H2CO3)<,C正确;a点所示溶液中的溶质为Na2CO3、NaHCO3,d点溶液中的主要溶质是NaCl和少量H2CO3,由盐类的水解可以促进水的电离知,a、d两点水的电离程度:a>d,D错误。
9. D 【解析】 Na2HPO4溶液中,根据元素质量守恒有:c(Na+)=2c(H3PO4)+2c(H2PO)+2c(HPO)+2c(PO),A错误;-lg>-lg,若直线丙表示pH与-lg的变化关系,则应位于乙的右边,B错误;pH=8.21时,-lg=1,=,Ka2(H3PO4)= =10-8.21×10=10-7.21,C错误;由图可知,pH=4.15时,-lg=2,=,得出Ka1(H3PO4)==10-4.15×100=10-2.15,当==1时,解得c(H+)=10-4.68 mol/L,pH=4.68,D正确。
1. (2023·常州期末)某水样中含一定浓度的CO、HCO和其他不与酸碱反应的离子。取10.00 mL水样,用0.010 mol/L的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图所示(混合后溶液体积变化忽略不计)。下列说法不正确的是( )
A. 该水样中:c(CO )∶c(HCO)=2∶1
B. a点对应溶液中存在:c(H2CO3)+c(H+)=c(OH-)+c(CO)
C. 当V(HCl)≤20.00 mL时,溶液中c(HCO)随V(HCl)的增多基本保持不变
D. 根据实验结果可以推知:Ka1(H2CO3)·Ka2(H2CO3)>Kw
2. (2023·扬州期初)合成环氧氯丙烷时产生了盐酸和醋酸(HAc)混合液,为研究混合溶液的定量分析方法,进行以下实验。
实验1:向20 mL 0.1 mol/L HCl溶液中滴加0.1 mol/L NaOH溶液;
实验2:向20 mL 0.1 mol/L HAc溶液中滴加0.1 mol/L NaOH溶液;
实验3:向20 mL某浓度HCl与HAc混合溶液中滴加0.1 mol/L NaOH溶液。
测得实验1、2中溶液pH的变化如图所示。下列说法正确的是( )
A. 实验1所测得的pH变化为曲线b
B. 实验2中加入10 mL NaOH溶液时,溶液中存在:c(H+)+c(HAc)=c(Ac-)+c(OH-)
C. 实验3溶液中Ac-的物质的量分数存在:=
D. 实验3中根据pH约为4.30时所消耗的V(NaOH),可计算混合溶液中n(HCl)
3. (2022·泰州中学)常温下,用200 mL 0.1 mol/L NaOH溶液吸收SO2与N2混合气体,所得溶液pH与吸收气体体积的关系如图所示,已知Ka1(H2SO3)=1.2×10-2,Ka2(H2SO3)=5.6×10-8。下列说法正确的是( )
A. 吸收3 L气体时溶液中主要溶质为NaHSO3
B. 溶液pH=7时存在:2c(SO)>c(HSO)
C. X点呈酸性的原因是HSO水解程度大于其电离程度
D. 曲线上任意点均存在:c(H+)+c(Na+)=c(OH-)+c(HSO)+c(SO)
4. (2023·徐州期中)在两个相同容器中分别加入20 mL 0.4 mol/L Na2CO3溶液和40 mL 0.2 mol/L NaHCO3溶液,再分别用0.4 mol/L 盐酸滴定,利用压强传感器检测反应生成CO2引起的压强变化,得到如图所示曲线。下列说法正确的是( )
A. 图中曲线甲表示向Na2CO3溶液中滴加盐酸时的压强变化
B. a点对应两溶液中均满足:c(H2CO3)-c(CO)=c(OH-)-c(H+)
C. b、d两点对应溶液中均有:c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO)
D. c点对应溶液中c(Na+)=2[c(H2CO3)+c(HCO)+c(CO)]
5. (2023·南京外国语)室温下,用0.1 mol/LNaOH溶液分别滴定体积均为20 mL、浓度均为0.1 mol/L的HCl和HX溶液,溶液pH随加入NaOH溶液体积的变化如图所示。下列说法不正确的是( )
A. HX的电离平衡常数Ka<1×10-7
B. M点存在:c(HX)-c(X-)>c(OH-)-c(H+)
C. 将P点和N点的溶液混合,溶液呈酸性
D. 向N点的溶液中通入HCl气体至pH=7时:c(Na+)>c(HX)=c(Cl-)>c(X-)
6. (2023·南京六校联合体)298 K时,向两份10 mL 0.2 mol/L CH3COONH4溶液(pH=7)中分别滴加浓度均为0.2 mol/L的HCl溶液和NaOH溶液。部分离子浓度随溶液体积的变化如图所示。下列有关说法错误的是( )
A. 水的电离程度:a>c=d
B. b点c(Cl-)和d点c(Na+)存在:2c(Cl-)=c(Na+)
C. c点存在离子浓度关系:c(NH)
7. (2023·秦淮中学、宇通实验等六校调研)常温下,向20.00 mL 0.100 0 mol/L (NH4)2SO4溶液中逐滴加入0.200 0 mol/L NaOH液,溶液的pH随NaOH溶液体积的变化如图所示。下列说法正确的是( )
A. a点所示溶液中:c(NH)>c(SO)>c(OH-)>c(H+)
B. b点所示溶液中:c(NH)=c(Na+)>c(H+)=c(OH-)
C. c点所示溶液中:c(SO)+c(H+)=c(NH3·H2O)+c(OH-)
D. d点以后的溶液中可能出现:c(SO)>c(NH3·H2O)>c(OH-)>c(NH)
8. (2023·扬州宝应期末) 常温下,用如图1所示装置,分别向25 mL 0.3 mol/L Na2CO3溶液和25 mL 0.3 mol/L NaHCO3溶液中逐滴滴加0.3 mol/L 的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示。下列说法正确的是( )
A. X曲线为Na2CO3溶液的滴定曲线
B. b点所示溶液中:c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-)
C. 用pH试纸测得c点的pH约为8,可知:Ka2(H2CO3)<
D. a、d两点水的电离程度:a
A. Na2HPO4溶液中:2c(Na+)=c(H3PO4)+c(H2PO)+c(HPO)+c(PO)
B. 若直线丙表示pH与-lg的变化关系,应该在甲、乙之间
C. 常温下,Ka2(H3PO4)=10-6.79
D. 当c(HPO)=c(H3PO4)时,pH=4.68
微主题热练14 反应过程曲线分析
1. D 【解析】 由图可知,在滴定过程中有两次突跃,第一次突跃发生在a点,发生的反应为CO+H+===HCO,第二次突跃发生在b点,发生的反应为HCO+H+===H2O+CO2↑,两次滴定消耗HCl的物质的量之比为2∶3,说明水样中c(CO)∶c(HCO)=2∶1,A正确;a点溶液中的溶质为NaHCO3,溶液中的质子守恒式为c(H+)+c(H2CO3)=c(OH-)+c(CO),B正确;由图中数据推知,原溶液中c(CO)==0.020 mol/L,c(HCO)=c(CO)=0.010 mol/L,当V(HCl)≤20.00 mL时,随V(HCl)的增多,溶液体积变化忽略不计,c(HCO)==0.010 mol/L,基本保持不变,C正确;a点时,溶液pH>8.00,呈碱性,说明NaHCO3溶液中以HCO的水解为主,即Ka2(H2CO3)
3. B 【解析】 根据Ka1可知,HSO的水解平衡常数Kh=≈10-12<Ka2=5.6×10-8,故NaHSO3溶液显酸性,由图可知,通入混合气体3 L时,溶液pH>7,说明溶液中主要溶质并不是 NaHSO3,A错误;pH=7时,Ka2=5.6×10-8=,故c(SO)=0.56c(HSO),即2c(SO)=1.12c(HSO),即2c(SO)>c(HSO),B正确;X点溶液呈酸性,说明HSO水解程度小于其电离程度,C错误;任何电解质水溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HSO)+2c(SO),D错误。
4. D 【解析】 向溶液中逐滴滴加盐酸,先放出气体的是NaHCO3溶液,图中曲线甲表示向NaHCO3溶液中滴加盐酸时的压强变化,A错误;a点对应的两溶液分别是NaHCO3溶液和Na2CO3溶液,NaHCO3溶液中的质子守恒为c(OH-)+c(CO)=c(H2CO3)+c(H+),Na2CO3溶液中的质子守恒为c(OH-)=c(HCO)+2c(H2CO3)+c(H+),B错误;b、d两点溶液中一定都有Cl-,故电荷守恒式中缺少Cl-,C错误;曲线乙表示向Na2CO3溶液中滴加盐酸时的压强变化,滴加盐酸至c点时仍无气体放出,故该滴定过程中始终满足:N(Na)=2N(C),即c(Na+)=2[c(H2CO3)+c(HCO)+c(CO)],D正确。
5. C 【解析】 由初始pH可知,M所在的曲线对应的酸是HX,Ka=≈≈=10-11<10-7,A正确;M点对应溶液中的溶质是等物质的量的HX、NaX,电荷守恒式为c(Na+)+c(H+)=c(X-)+c(OH-),元素质量守恒式为2c(Na+)=c(HX)+c(X-),两式联立,消去c(Na+),可得c(HX)+2c(H+)=c(X-)+2c(OH-),M点对应溶液显碱性,则c(OH-)-c(H+)>0,移项得c(HX)-c(X-)=2[c(OH-)-c(H+)]>c(OH-)-c(H+),B正确;将P点和N点的溶液混合,所得溶液中n(NaCl)∶n(NaX)∶n(HX)=2∶1∶1,Ka=10-11
6. B 【解析】 a点溶液中的溶质为CH3COONH4,水的电离程度最大,c点溶液中的溶质为0.002 mol CH3COOH、0.002 mol NH4Cl,d点溶液中的溶质为0.002 mol CH3COONa、0.002 mol NH3·H2O,常温下,CH3COONH4溶液pH=7,说明Ka(CH3COOH)=Kb(NH3·H2O),c、d点水的电离程度相等,A正确;b点加入了5 mL 0.2 mol/L HCl溶液,d点加入了10 mL 0.2 mol/L NaOH溶液,则2n(Cl-)=n(Na+),由于b、d溶液总体积不同,故2c(Cl-)≠c(Na+),B错误;c点溶液中的溶质为等量的CH3COOH和NH4Cl,由于NH发生水解,部分损耗,故c(NH)
8. C 【解析】 逐滴滴加盐酸,先放出气体的是NaHCO3溶液,X曲线为NaHCO3溶液的滴定曲线,A错误;b点溶液中的主要溶质是NaCl和少量H2CO3,故b点溶液中一定有Cl-,电荷守恒式中缺少Cl-,B错误;c点所示溶液中的溶质为NaHCO3,pH约为8,则HCO的水解程度大于其电离程度,Ka2(H2CO3)<,C正确;a点所示溶液中的溶质为Na2CO3、NaHCO3,d点溶液中的主要溶质是NaCl和少量H2CO3,由盐类的水解可以促进水的电离知,a、d两点水的电离程度:a>d,D错误。
9. D 【解析】 Na2HPO4溶液中,根据元素质量守恒有:c(Na+)=2c(H3PO4)+2c(H2PO)+2c(HPO)+2c(PO),A错误;-lg>-lg,若直线丙表示pH与-lg的变化关系,则应位于乙的右边,B错误;pH=8.21时,-lg=1,=,Ka2(H3PO4)= =10-8.21×10=10-7.21,C错误;由图可知,pH=4.15时,-lg=2,=,得出Ka1(H3PO4)==10-4.15×100=10-2.15,当==1时,解得c(H+)=10-4.68 mol/L,pH=4.68,D正确。
同课章节目录
