广东省东莞市2023-2024学年高一上学期1月期末教学质量检查化学试题(含答案)
文档属性
| 名称 | 广东省东莞市2023-2024学年高一上学期1月期末教学质量检查化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1018.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-24 09:38:30 | ||
图片预览


文档简介
东莞市2023-2024学年度第一学期教学质量检查
高一化学
注意事项:
1.本试卷分选择题和非选择题两部分.
2.试卷满分100分,考试时间75分钟.
可能用到的相对原子质量 H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32
一、选择题:本题包括16小题,共44分.第1~10小题,每小题2分;第11~16小题,每小题4分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.消毒剂能有效灭杀流感病毒,保护人类健康.下列消毒剂的有效成分属于盐的是( )
A.碘酊(碘的乙醇溶液) B.2.7%的双氧水
C.0.2%的高锰酸钾溶液 D.次氯酸消毒液
2.可利用反应来捕捉工业废气中的,实现固碳.下列有关说法正确的是( )
A.属于碱性氧化物 B.不属于电解质
C.的电子式为: D.与的中子数相同
3.劳动创造未来.下列劳动项目与所涉及的化学知识没有关联的是( )
选项 劳动项目 化学知识
A 水厂工人用消毒自来水 具有强氧化性
B 面点师傅用小苏打作膨松剂烘焙点心 受热分解产生
C 技术人员开发高端耐腐蚀镀铝钢板 铝能形成致密氧化膜
D 修理师傅用布擦干潮湿的自行车 铁与水蒸气反应生成
4.碳元素的价类二维关系如图1所示.下列说法不正确的是( )
图1
A.m是共价化合物 B.p→r可通过离子反应实现
C.m分解生成n的反应,n被氧化 D.p能发生还原反应生成o
5.分类法常用于研究事物的变化、性质及规律.下列说法正确的是( )
A.属于电解质,含有离子键 B.属于亚铁盐,可用作补铁剂
C.属于碱,可用于治疗胃酸过多 D.属于酸性氧化物,可用溶液吸收
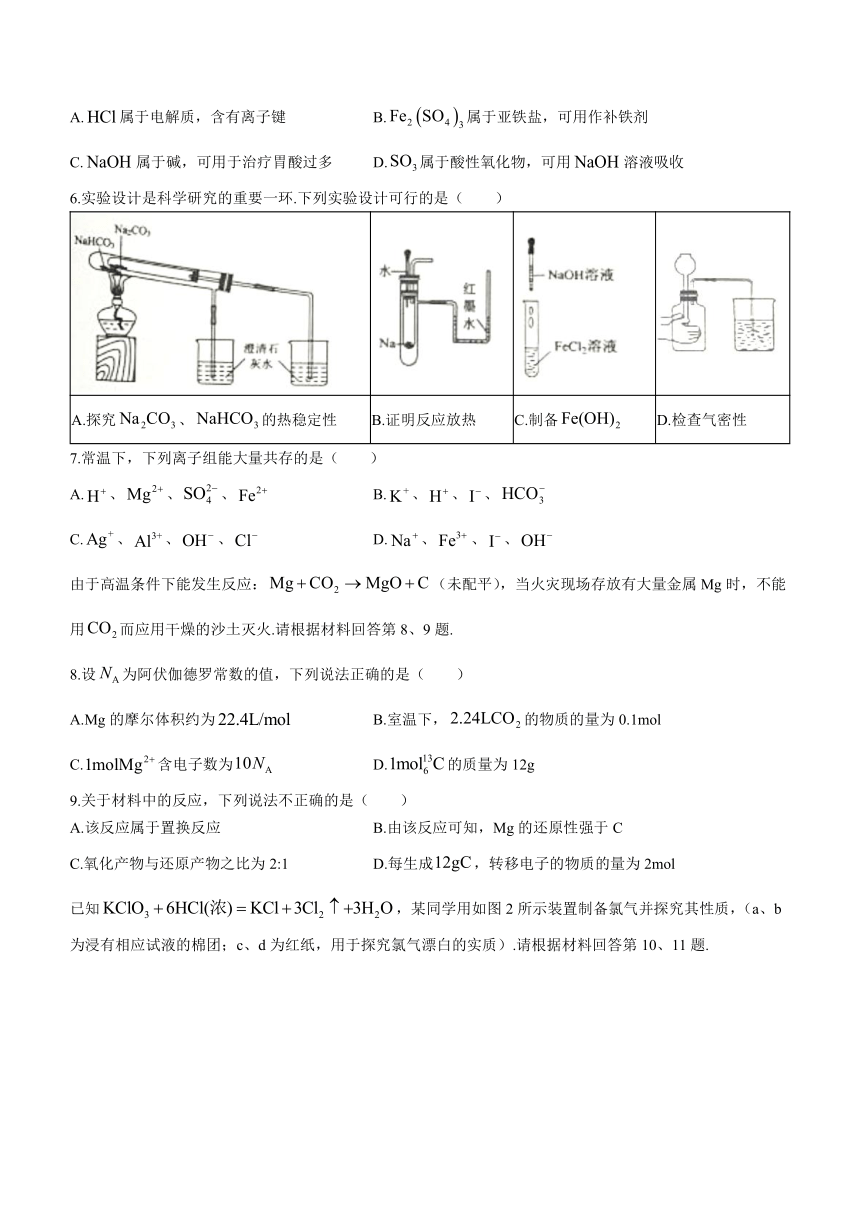
6.实验设计是科学研究的重要一环.下列实验设计可行的是( )
A.探究、的热稳定性 B.证明反应放热 C.制备 D.检查气密性
7.常温下,下列离子组能大量共存的是( )
A.、、、 В.、、、
C.、、、 D.、、、
由于高温条件下能发生反应:(未配平),当火灾现场存放有大量金属Mg时,不能用而应用干燥的沙土灭火.请根据材料回答第8、9题.
8.设为阿伏伽德罗常数的值,下列说法正确的是( )
A.Mg的摩尔体积约为 B.室温下,的物质的量为0.1mol
C.含电子数为 D.的质量为12g
9.关于材料中的反应,下列说法不正确的是( )
A.该反应属于置换反应 B.由该反应可知,Mg的还原性强于C
C.氧化产物与还原产物之比为2:1 D.每生成,转移电子的物质的量为2mol
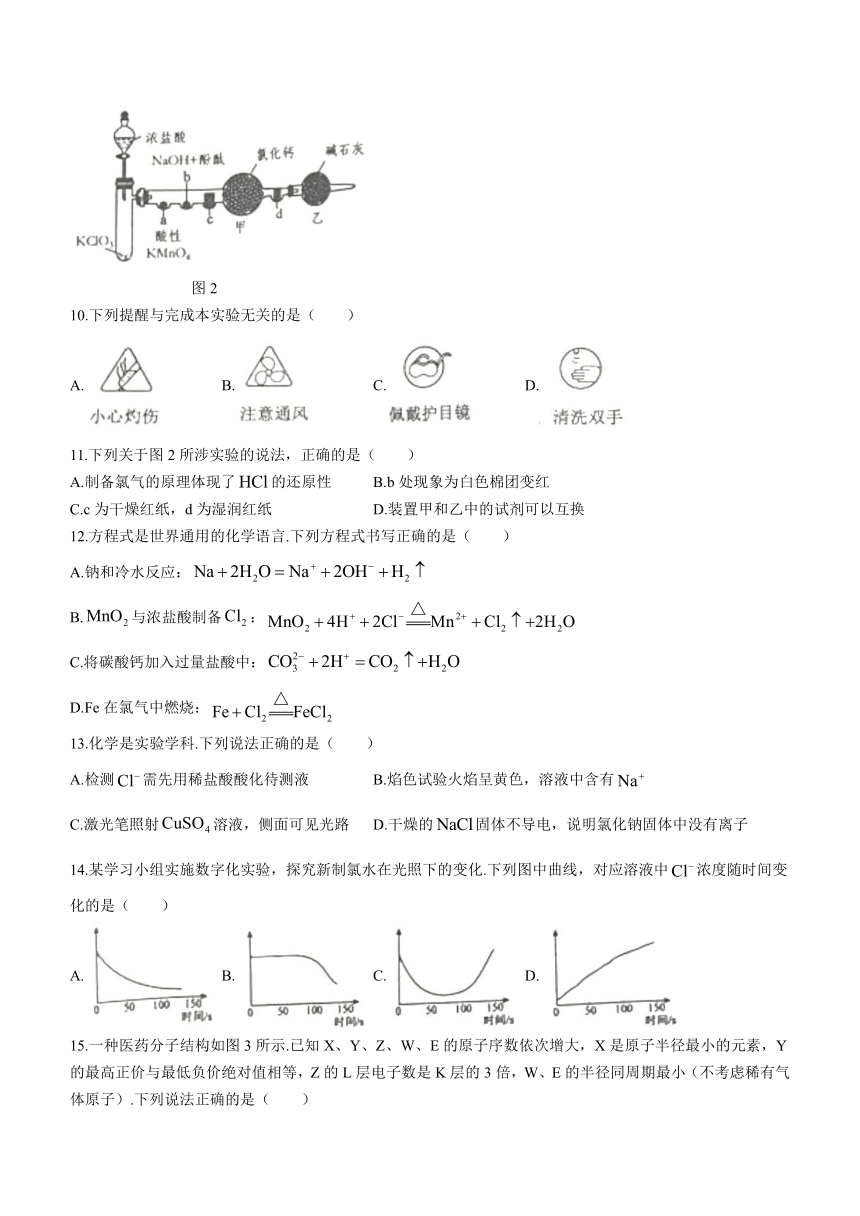
已知,某同学用如图2所示装置制备氯气并探究其性质,(a、b为浸有相应试液的棉团;c、d为红纸,用于探究氯气漂白的实质).请根据材料回答第10、11题.
图2
10.下列提醒与完成本实验无关的是( )
A. B. C. D.
11.下列关于图2所涉实验的说法,正确的是( )
A.制备氯气的原理体现了的还原性 B.b处现象为白色棉团变红
C.c为干燥红纸,d为湿润红纸 D.装置甲和乙中的试剂可以互换
12.方程式是世界通用的化学语言.下列方程式书写正确的是( )
A.钠和冷水反应:
B.与浓盐酸制备:
C.将碳酸钙加入过量盐酸中:
D.Fe在氯气中燃烧:
13.化学是实验学科.下列说法正确的是( )
A.检测需先用稀盐酸酸化待测液 B.焰色试验火焰呈黄色,溶液中含有
C.激光笔照射溶液,侧面可见光路 D.干燥的固体不导电,说明氯化钠固体中没有离子
14.某学习小组实施数字化实验,探究新制氯水在光照下的变化.下列图中曲线,对应溶液中浓度随时间变化的是( )
A. B. C. D.
15.一种医药分子结构如图3所示.已知X、Y、Z、W、E的原子序数依次增大,X是原子半径最小的元素,Y的最高正价与最低负价绝对值相等,Z的L层电子数是K层的3倍,W、E的半径同周期最小(不考虑稀有气体原子).下列说法正确的是( )
图3
A.原子半径:Y<Z B.含有非极性键
C.非金属性:W>Z D.该分子中所有原子的最外层都满足8电子结构
16.碳量子点()是一种新型碳纳米材料(颗粒直径为2~20nm).我国化学家研制出一种碳量子点()/氮化碳()复合光催化剂,可实现利用太阳光高效分解水,原理如图4所示.下列说法不正确的是( )
图4
A.与水形成的分散系具有丁达尔效应
B.是过程Ⅰ、Ⅱ的催化剂
C.总反应方程式为
D.、都属于氧化物
二、非选择题:本题共4小题,共56分.
17.(14分)
元素周期律和元素周期表,反映了元素性质与原子结构的关系,在自然科学、生产实践等各方面都有重要意义.下图为部分短周期元素化合价与原子序数的关系图.
(1)b在元素周期表中的位置为___________.
(2)f在半导体领域中有着重要应用,其原子结构示意图为___________.
(3)h、g的气态氢化物稳定性由强到弱的顺序为___________(填化学式).
(4)c、d、e简单离子的半径从大到小为___________(用化学式表示).
(5)c与d形成的淡黄色化合物的电子式为___________.
(6)X射线衍射法可以测定某些分子的结构,下列分子的结构模型正确是___________(填字母).
选项 A B C D
分子
结构 模型 直线形 直线形 直线形 平面正方形
(7)a、h的最高价氧化物的水化物酸性由强到弱的顺序为___________(填化学式).
(8)写出一条仅含a、b、c元素的氧化还原反应方程式___________.
18.(14分)
1774年,瑞典化学家舍勒将软锰矿和浓盐酸混合加热得到氯气.今天,氯气已成为重要的化工原料,大量用于制造盐酸、有机溶剂、农药、染料和药品等.
(1)液氯中含有微粒___________(填化学式).
Ⅰ.某同学用下图所示装置制取纯净的氯气并研究氯气与Na常温下的反应.
(2)试管B中试剂的名称为__________,D装置收集氯气的方法名称是__________.
(3)取下硬质试管D,用轻质塑料片盖住试管口,向试管中加入一小片金属钠,几秒后观察到钠与氯气剧烈反应.下列选项正确的是__________(填编号).
A.Na在氯气中燃烧,说明燃烧不一定需要氧气参加
B.用单线桥表示电子转移:
C.火焰为黄色,发出黄光属于化学变化
D.E的作用为防止F中水蒸气进入D中
Ⅱ.探究氯气和水反应中可逆符号的含义.
某同学查资料得知,用可逆符号表示的反应有以下两个特征:
特征a.无论反应物的比例如何,充分反应后,反应物都会有剩余.
特征b.一定条件下,增大某一反应物浓度,生成物会增多;增大某一生成物浓度,反应物会增多.
设计实验进行验证.
(4)该同学观察了多种浓度的新制氯水,证明特征a正确,他的依据是___________.
(5)为验证特征b,该同学向氯水中滴入几滴浓硫酸,测得减小,同时_________(填“增大”“减小”或“不变”),证明特征b正确.据此预测,若向此氯水中加入少许漂白粉(主要成分、),将__________(填“增大”“减小”或“不变”),此时会发生反应___________(写出反应方程式).
19.(14分)
印刷电路板是电子产品的主要基础零部件,享有“电子产品之母”的美誉.常用的覆铜板蚀刻液有蚀刻液、酸性蚀刻液等.请回答以下问题:
Ⅰ.从蚀刻废液中再生蚀刻液的工艺如下所示:
(1)请用化学方程式表示溶液蚀刻覆铜板的原理___________.
(2)某兴趣小组想要证明蚀刻废液中含有,请简述实验操作与现象___________.
(3)滤渣1的主要成分为___________(写化学式).
(4)向滤液1中加入的“氧化剂”可为___________(任写一种),该步反应的离子方程式为___________.
Ⅱ.另一种酸性溶液蚀刻覆铜板及再生的原理如下:
(5)蚀刻:酸性溶液蚀刻覆铜板涉及的反应包括:
中Cu元素的化合价为________:每蚀刻转移电子__________-.
(6)再生:向失效的酸性蚀刻液中加入,可实现蚀刻液的再生,请补充完整该过程的离子方程式:;相比于蚀刻液,酸性蚀刻液的优点是_____________.
20.(14分)
铝镁合金粉是烟花中的常见成分,其中Al的含量与烟花的安全有极大关系.某兴趣小组对某品牌烟花中所用铝镁合金粉中Al的含量进行测定(假设样品中的金属只含有Mg、Al).
Ⅰ.配制溶液
(1)需用托盘天平称量固体__________g,写出一条称量时需注意的事项__________.
(2)配制溶液的操作如下,正确顺序为:称量→溶解→转移并洗涤→__________→__________→__________→__________→装瓶贴标签.(填编号)
(3)配制溶液的过程中,玻璃棒的作用有___________.
Ⅱ.测定铝镁合金粉中Al的含量
(4)仪器甲的名称是___________.
(5)锥形瓶中反应的化学方程式为___________.
(6)根据国家标准,铝镁合金粉中A;的含量应介于47%~53%.若实验样品质量为0.52g,测得生成气体体积为0.336L(标准状况),则样品中铝的质量分数为_________(保留两位有效数字):该样品___________标准(填“符合”、“不符合”).
东莞市2023-2024学年度第一学期教学质量检查
高一化学参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 C A D C D B A C D A
题号 11 12 13 14 15 16
答案 A B B D C B
17.(14分,除标注外,每空2分)
(1)第二周期第VA族(2)
(3)(4)
(5)(1分)(6)AC(2分,漏选扣1分,选错不得分)
(7)(8)(1分,条件不扣分)
18.(14分,除标注外,每空2分)
(1)(回答也给分,答错扣分)(2)饱和食盐水向上排空法
(3)AD(漏选扣1分,选错不得分)
(4)均呈黄绿色(5)增大(1分)增大(1分)
(离子方程式也给分)
19.(14分)
(1)(2分)
(2)取少量蚀刻废液于试管中,滴入几滴KSCN溶液,溶液变成血红色.(2分,试剂1分,现象1分)(3)Fe、Cu(2分,各1分)
(4)(1分)(1分)
或(1分)(1分)
或(1分)(1分)
(共2分,试剂1分,写名称化学式均可,离子方程式1分,答案合理且对应即可)
(5)+1(2分)或(1分)
(6)(2分,配平1分,生成物1分)
再生成本低(1分,再生步骤简单等合理答案均可给分)
20.(14分,除标注外,每空2分)
(1)4.0g(1分)固体氢氧化钠应在表面皿上或在小烧杯中称量,不能在称量纸上称量(合理答案均可)(2)a d c b (3)搅拌、引流 (4)分液漏斗
(5)
(6)52% 符合(1分)
高一化学
注意事项:
1.本试卷分选择题和非选择题两部分.
2.试卷满分100分,考试时间75分钟.
可能用到的相对原子质量 H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32
一、选择题:本题包括16小题,共44分.第1~10小题,每小题2分;第11~16小题,每小题4分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.消毒剂能有效灭杀流感病毒,保护人类健康.下列消毒剂的有效成分属于盐的是( )
A.碘酊(碘的乙醇溶液) B.2.7%的双氧水
C.0.2%的高锰酸钾溶液 D.次氯酸消毒液
2.可利用反应来捕捉工业废气中的,实现固碳.下列有关说法正确的是( )
A.属于碱性氧化物 B.不属于电解质
C.的电子式为: D.与的中子数相同
3.劳动创造未来.下列劳动项目与所涉及的化学知识没有关联的是( )
选项 劳动项目 化学知识
A 水厂工人用消毒自来水 具有强氧化性
B 面点师傅用小苏打作膨松剂烘焙点心 受热分解产生
C 技术人员开发高端耐腐蚀镀铝钢板 铝能形成致密氧化膜
D 修理师傅用布擦干潮湿的自行车 铁与水蒸气反应生成
4.碳元素的价类二维关系如图1所示.下列说法不正确的是( )
图1
A.m是共价化合物 B.p→r可通过离子反应实现
C.m分解生成n的反应,n被氧化 D.p能发生还原反应生成o
5.分类法常用于研究事物的变化、性质及规律.下列说法正确的是( )
A.属于电解质,含有离子键 B.属于亚铁盐,可用作补铁剂
C.属于碱,可用于治疗胃酸过多 D.属于酸性氧化物,可用溶液吸收
6.实验设计是科学研究的重要一环.下列实验设计可行的是( )
A.探究、的热稳定性 B.证明反应放热 C.制备 D.检查气密性
7.常温下,下列离子组能大量共存的是( )
A.、、、 В.、、、
C.、、、 D.、、、
由于高温条件下能发生反应:(未配平),当火灾现场存放有大量金属Mg时,不能用而应用干燥的沙土灭火.请根据材料回答第8、9题.
8.设为阿伏伽德罗常数的值,下列说法正确的是( )
A.Mg的摩尔体积约为 B.室温下,的物质的量为0.1mol
C.含电子数为 D.的质量为12g
9.关于材料中的反应,下列说法不正确的是( )
A.该反应属于置换反应 B.由该反应可知,Mg的还原性强于C
C.氧化产物与还原产物之比为2:1 D.每生成,转移电子的物质的量为2mol
已知,某同学用如图2所示装置制备氯气并探究其性质,(a、b为浸有相应试液的棉团;c、d为红纸,用于探究氯气漂白的实质).请根据材料回答第10、11题.
图2
10.下列提醒与完成本实验无关的是( )
A. B. C. D.
11.下列关于图2所涉实验的说法,正确的是( )
A.制备氯气的原理体现了的还原性 B.b处现象为白色棉团变红
C.c为干燥红纸,d为湿润红纸 D.装置甲和乙中的试剂可以互换
12.方程式是世界通用的化学语言.下列方程式书写正确的是( )
A.钠和冷水反应:
B.与浓盐酸制备:
C.将碳酸钙加入过量盐酸中:
D.Fe在氯气中燃烧:
13.化学是实验学科.下列说法正确的是( )
A.检测需先用稀盐酸酸化待测液 B.焰色试验火焰呈黄色,溶液中含有
C.激光笔照射溶液,侧面可见光路 D.干燥的固体不导电,说明氯化钠固体中没有离子
14.某学习小组实施数字化实验,探究新制氯水在光照下的变化.下列图中曲线,对应溶液中浓度随时间变化的是( )
A. B. C. D.
15.一种医药分子结构如图3所示.已知X、Y、Z、W、E的原子序数依次增大,X是原子半径最小的元素,Y的最高正价与最低负价绝对值相等,Z的L层电子数是K层的3倍,W、E的半径同周期最小(不考虑稀有气体原子).下列说法正确的是( )
图3
A.原子半径:Y<Z B.含有非极性键
C.非金属性:W>Z D.该分子中所有原子的最外层都满足8电子结构
16.碳量子点()是一种新型碳纳米材料(颗粒直径为2~20nm).我国化学家研制出一种碳量子点()/氮化碳()复合光催化剂,可实现利用太阳光高效分解水,原理如图4所示.下列说法不正确的是( )
图4
A.与水形成的分散系具有丁达尔效应
B.是过程Ⅰ、Ⅱ的催化剂
C.总反应方程式为
D.、都属于氧化物
二、非选择题:本题共4小题,共56分.
17.(14分)
元素周期律和元素周期表,反映了元素性质与原子结构的关系,在自然科学、生产实践等各方面都有重要意义.下图为部分短周期元素化合价与原子序数的关系图.
(1)b在元素周期表中的位置为___________.
(2)f在半导体领域中有着重要应用,其原子结构示意图为___________.
(3)h、g的气态氢化物稳定性由强到弱的顺序为___________(填化学式).
(4)c、d、e简单离子的半径从大到小为___________(用化学式表示).
(5)c与d形成的淡黄色化合物的电子式为___________.
(6)X射线衍射法可以测定某些分子的结构,下列分子的结构模型正确是___________(填字母).
选项 A B C D
分子
结构 模型 直线形 直线形 直线形 平面正方形
(7)a、h的最高价氧化物的水化物酸性由强到弱的顺序为___________(填化学式).
(8)写出一条仅含a、b、c元素的氧化还原反应方程式___________.
18.(14分)
1774年,瑞典化学家舍勒将软锰矿和浓盐酸混合加热得到氯气.今天,氯气已成为重要的化工原料,大量用于制造盐酸、有机溶剂、农药、染料和药品等.
(1)液氯中含有微粒___________(填化学式).
Ⅰ.某同学用下图所示装置制取纯净的氯气并研究氯气与Na常温下的反应.
(2)试管B中试剂的名称为__________,D装置收集氯气的方法名称是__________.
(3)取下硬质试管D,用轻质塑料片盖住试管口,向试管中加入一小片金属钠,几秒后观察到钠与氯气剧烈反应.下列选项正确的是__________(填编号).
A.Na在氯气中燃烧,说明燃烧不一定需要氧气参加
B.用单线桥表示电子转移:
C.火焰为黄色,发出黄光属于化学变化
D.E的作用为防止F中水蒸气进入D中
Ⅱ.探究氯气和水反应中可逆符号的含义.
某同学查资料得知,用可逆符号表示的反应有以下两个特征:
特征a.无论反应物的比例如何,充分反应后,反应物都会有剩余.
特征b.一定条件下,增大某一反应物浓度,生成物会增多;增大某一生成物浓度,反应物会增多.
设计实验进行验证.
(4)该同学观察了多种浓度的新制氯水,证明特征a正确,他的依据是___________.
(5)为验证特征b,该同学向氯水中滴入几滴浓硫酸,测得减小,同时_________(填“增大”“减小”或“不变”),证明特征b正确.据此预测,若向此氯水中加入少许漂白粉(主要成分、),将__________(填“增大”“减小”或“不变”),此时会发生反应___________(写出反应方程式).
19.(14分)
印刷电路板是电子产品的主要基础零部件,享有“电子产品之母”的美誉.常用的覆铜板蚀刻液有蚀刻液、酸性蚀刻液等.请回答以下问题:
Ⅰ.从蚀刻废液中再生蚀刻液的工艺如下所示:
(1)请用化学方程式表示溶液蚀刻覆铜板的原理___________.
(2)某兴趣小组想要证明蚀刻废液中含有,请简述实验操作与现象___________.
(3)滤渣1的主要成分为___________(写化学式).
(4)向滤液1中加入的“氧化剂”可为___________(任写一种),该步反应的离子方程式为___________.
Ⅱ.另一种酸性溶液蚀刻覆铜板及再生的原理如下:
(5)蚀刻:酸性溶液蚀刻覆铜板涉及的反应包括:
中Cu元素的化合价为________:每蚀刻转移电子__________-.
(6)再生:向失效的酸性蚀刻液中加入,可实现蚀刻液的再生,请补充完整该过程的离子方程式:;相比于蚀刻液,酸性蚀刻液的优点是_____________.
20.(14分)
铝镁合金粉是烟花中的常见成分,其中Al的含量与烟花的安全有极大关系.某兴趣小组对某品牌烟花中所用铝镁合金粉中Al的含量进行测定(假设样品中的金属只含有Mg、Al).
Ⅰ.配制溶液
(1)需用托盘天平称量固体__________g,写出一条称量时需注意的事项__________.
(2)配制溶液的操作如下,正确顺序为:称量→溶解→转移并洗涤→__________→__________→__________→__________→装瓶贴标签.(填编号)
(3)配制溶液的过程中,玻璃棒的作用有___________.
Ⅱ.测定铝镁合金粉中Al的含量
(4)仪器甲的名称是___________.
(5)锥形瓶中反应的化学方程式为___________.
(6)根据国家标准,铝镁合金粉中A;的含量应介于47%~53%.若实验样品质量为0.52g,测得生成气体体积为0.336L(标准状况),则样品中铝的质量分数为_________(保留两位有效数字):该样品___________标准(填“符合”、“不符合”).
东莞市2023-2024学年度第一学期教学质量检查
高一化学参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 C A D C D B A C D A
题号 11 12 13 14 15 16
答案 A B B D C B
17.(14分,除标注外,每空2分)
(1)第二周期第VA族(2)
(3)(4)
(5)(1分)(6)AC(2分,漏选扣1分,选错不得分)
(7)(8)(1分,条件不扣分)
18.(14分,除标注外,每空2分)
(1)(回答也给分,答错扣分)(2)饱和食盐水向上排空法
(3)AD(漏选扣1分,选错不得分)
(4)均呈黄绿色(5)增大(1分)增大(1分)
(离子方程式也给分)
19.(14分)
(1)(2分)
(2)取少量蚀刻废液于试管中,滴入几滴KSCN溶液,溶液变成血红色.(2分,试剂1分,现象1分)(3)Fe、Cu(2分,各1分)
(4)(1分)(1分)
或(1分)(1分)
或(1分)(1分)
(共2分,试剂1分,写名称化学式均可,离子方程式1分,答案合理且对应即可)
(5)+1(2分)或(1分)
(6)(2分,配平1分,生成物1分)
再生成本低(1分,再生步骤简单等合理答案均可给分)
20.(14分,除标注外,每空2分)
(1)4.0g(1分)固体氢氧化钠应在表面皿上或在小烧杯中称量,不能在称量纸上称量(合理答案均可)(2)a d c b (3)搅拌、引流 (4)分液漏斗
(5)
(6)52% 符合(1分)
同课章节目录
