1.1 原子结构 第4课时 课件(共35页) -2023-2024学年高二上学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1 原子结构 第4课时 课件(共35页) -2023-2024学年高二上学期化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 18.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-24 09:52:12 | ||
图片预览






文档简介
(共35张PPT)
第一章
第二节 原子结构与元素的性质
0
第4课时:泡利原理、洪特规则
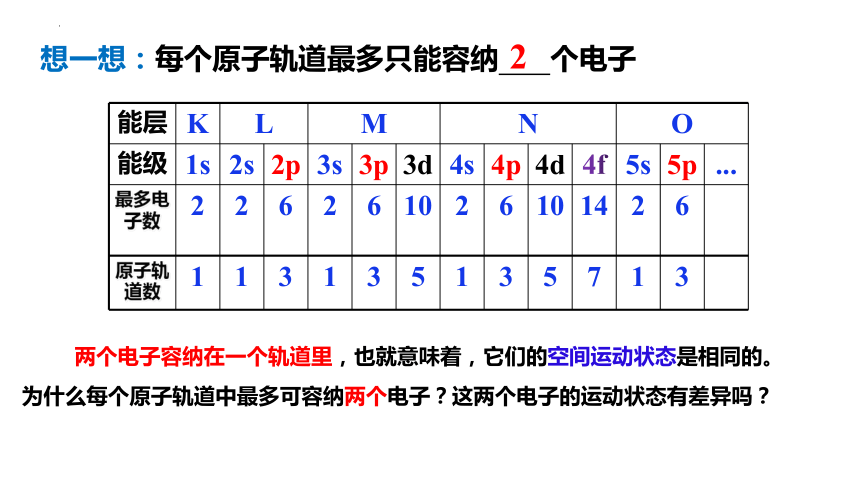
能层 K L M N O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p ...
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6
原子轨道数 1 1 3 1 3 5 1 3 5 7 1 3
想一想:每个原子轨道最多只能容纳 个电子
2
两个电子容纳在一个轨道里,也就意味着,它们的空间运动状态是相同的。为什么每个原子轨道中最多可容纳两个电子?这两个电子的运动状态有差异吗?
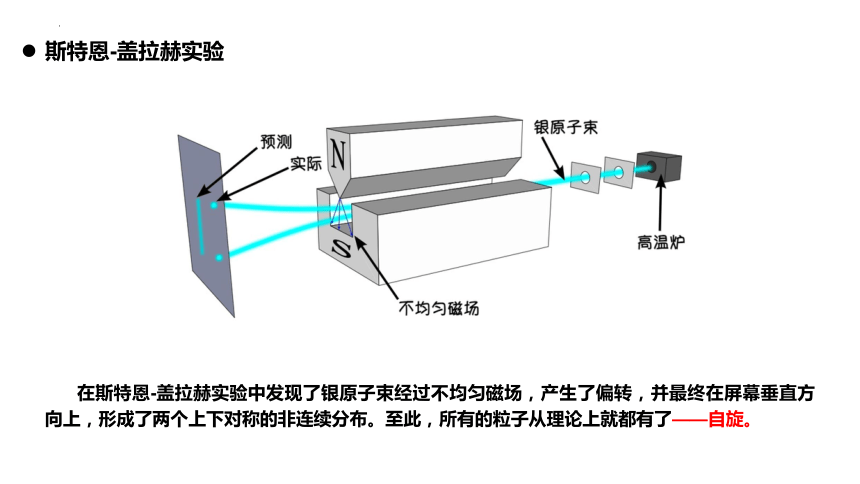
斯特恩-盖拉赫实验
在斯特恩-盖拉赫实验中发现了银原子束经过不均匀磁场,产生了偏转,并最终在屏幕垂直方向上,形成了两个上下对称的非连续分布。至此,所有的粒子从理论上就都有了——自旋。
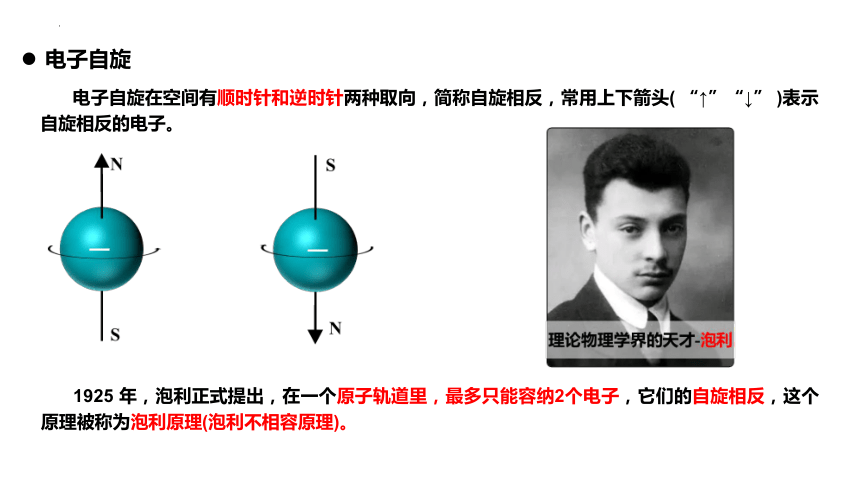
电子自旋在空间有顺时针和逆时针两种取向,简称自旋相反,常用上下箭头( “↑”“↓” )表示自旋相反的电子。
电子自旋
1925 年,泡利正式提出,在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反,这个原理被称为泡利原理(泡利不相容原理)。
物理史上最嚣张的论文——1页
1925年,两个物理研究生,竟然搞出了电子自旋的概念,认为契合了天才泡利的预测,于是就整出了1页的论文。没想到的是,这个理论竟然违背了爱因斯坦相对论,其速度居然达到了光速10倍,偏偏还是对的!他们分别叫,乌仑贝克和高斯密特。
(左乌伦贝克,右古德斯米特,拍摄时间约为 1928 年)
1927年10月,第五届索尔维会议,泡利是年龄最小的顶级科学家
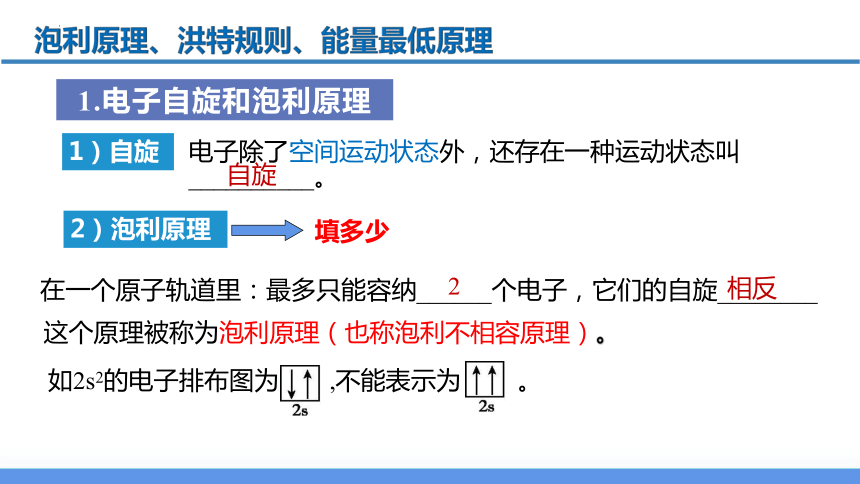
电子除了空间运动状态外,还存在一种运动状态叫__________。
自旋
1. 电子自旋和泡利原理
1)自旋
电子自旋在空间有________________两种取向,简称___________。
自旋相反
常用上下箭头( “↑”“↓” )表示
顺时针和逆时针
泡利原理、洪特规则、能量最低原理
②电子能量与能层、能级有关,电子的空间运动状态与原子轨道有关,能层、能级、原子轨道和自旋状态四个方面共同决定电子的运动状态。
③一个原子中不可能存在运动状态完全相同的2个电子
①自旋是微观粒子普遍存在的一种如同电荷、质量一样的内在属性。
注意:
电子除了空间运动状态外,还存在一种运动状态叫__________。
自旋
1.电子自旋和泡利原理
1)自旋
在一个原子轨道里:最多只能容纳______个电子,它们的自旋________
2
相反
泡利原理、洪特规则、能量最低原理
填多少
2)泡利原理
这个原理被称为泡利原理(也称泡利不相容原理)。
如2s2的电子排布图为 ,不能表示为 。
H 1s1
O 1s22s22p4
H
原子轨道
简并轨道:能量相同的原子轨道
电子对
单电子(未成对电子)
自旋平行
能级符号
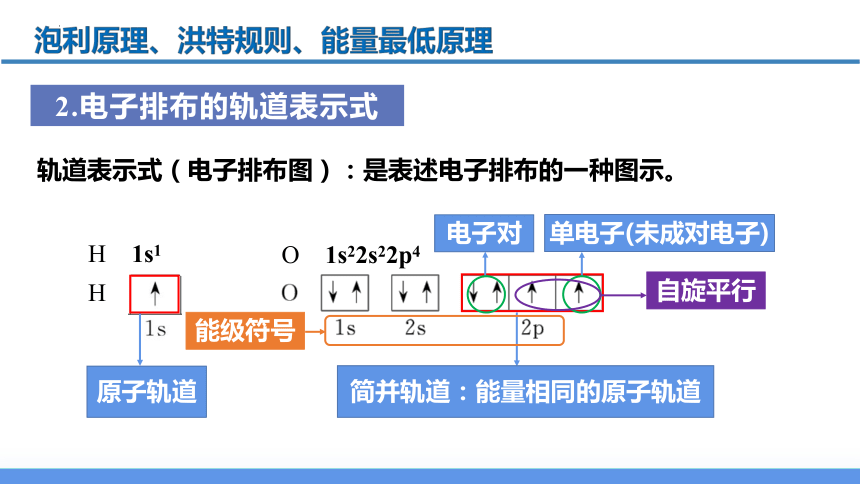
轨道表示式(电子排布图):是表述电子排布的一种图示。
2.电子排布的轨道表示式
泡利原理、洪特规则、能量最低原理
(1)用□或〇代表一个原子轨道,能量相同的原子轨道(简并轨道)的方框相连。不同能级中的□要相互分开。
(2)整个电子排布图中各能级的排列顺序要与相应的电子排布式一致。
(4)通常在方框下方或上方标记能级符号。
(3)箭头表示一种自旋状态的电子,一个箭头表示一个电子,↓↑”称电子对 ,“↑”或“↓”表示单电子(或称未成对电子),箭头同向的单电子称自旋平行。
H
H 1s1
O 1s22s22p4
(5)有时画出的能级上下错落,以表达能量高低不同。
2.电子排布的轨道表示式
泡利原理、洪特规则、能量最低原理
Li
1s
↑↓
↑
2s
Be
1s
↑↓
↑↓
2s
B
1s
↑
↑↓
↑↓
2s
2p
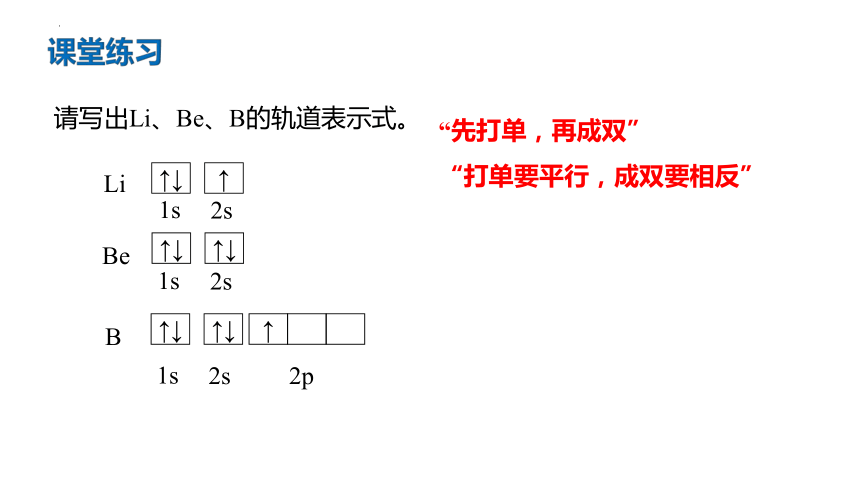
请写出Li、Be、B的轨道表示式。
课堂练习
“先打单,再成双”
“打单要平行,成双要相反”
同一个原子轨道
只有一个电子
2
1
B
1s
↑
↑↓
↑↓
2s
2p
电子对
自旋方向相反的一对电子
单电子
B 原子中: 有 对电子对,有 个单电子。
2.电子排布的轨道表示式
泡利原理、洪特规则、能量最低原理
自旋平行
箭头同向的单电子称为自旋平行
简并轨道
能量相同的原子轨道
有 种空间运动状态,有 种运动状态不同的电子。
3
5
B
1s
↑
↑↓
↑↓
2s
2p
轨道数
电子数
2.电子排布的轨道表示式
泡利原理、洪特规则、能量最低原理
练一练:1.请画出铝原子的轨道表示式
铝原子外层有 个电子对,
有 个单电子。
电子有 种空间运动状态,有 种运动状态不同的电子。
13
1
7
6
2.下列基态碳原子的轨道表示式哪个是正确的?
① C
1s
↑↓
↑↓
↑↓
2s
2p
② C
1s
↑↑
↑↓
↑↓
2s
2p
2p
③ C
↑
1s
↑
↑↓
↑↓
2s
2p
④ C
↓
1s
↑
↑↓
↑↓
2s
√
3.(2009-上海)以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A. He B. C.1s2 D.
怎么填
基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。
(能量相同的原子轨道)
(自旋方向相同)
2p3的电子排布图
√
泡利原理、洪特规则、能量最低原理
3.洪特规则
C :1s2 2s22p2
√
洪特规则是针对电子填入简并轨道而言的, 并不适用于电子填入能量不同的轨道。
↑↓
Li
Be
B
C
↑↓
1s
2s
↑↓
↑
↑↓
↑↓
1s
2s
↑
2p
↑↓
↑↓
1s
2s
↑
↑
2p
1s
2s
N
O
↑↓
↑↓
1s
2s
↑
↑
↑
2p
↑↓
↑↓
1s
2s
↑
↑
↑
↓
2p
F
Ne
↑
↑
↑
↓
↓
↑↓
1s
2s
2p
↑↓
↑↓
1s
2s
2p
↑
↑
↑
↓
↓
↓
↑↓
第二周期元素原子的电子排布图(即轨道表示式)
洪特规则特例*
光谱实验发现
能量相同的简并轨道在______、_____和_______条件时,体系能量较低,原子较稳定。
全满
半满
全空
3d 4s
↑
Cr
↑
↑
↑
↑
↑
半充满状态
怎么填
泡利原理、洪特规则、能量最低原理
3.洪特规则
3d 4s
↑↓
↑↓
↑
↑↓
↑↓
↑↓
全充满状态
Cu
在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低。
整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定。
自然界的普适规律
泡利原理、洪特规则、能量最低原理
4.能量最低原理
能量最低原理的补充:
当相邻能级能量差别不大时,有1~2个电子填入能量稍高的能级可能反而降低电子排斥能,进而使原子整体能量最低。例如:所有副族元素的基态原子。
内容:
因素:
铁原子的电子排布图
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
洪特规则
泡利原理
能量最低原理
1s
2s
2p
3p
3d
3s
4s
结论:基态原子的核外电子排布遵循泡利原理、洪特规则和能量最低原理。
违背任意一个,能量就不是最低,就不是基态。
【思考与讨论】 课本P16
(1)为什么基态氦原子的电子排布是1s2而不是1s12s1
(3)为什么基态Sc的价层电子排布是3d14s2,而不是4s3?
不满足能量最低原理
不满足洪特规则
不满足泡利原理
(2)为什么基态氮原子的轨道表示式是 ,而不是
?
【练一练】写出15P、25Mn的轨道表示式,并按要求填空。
15P:
,
有 对电子对,有 个单电子。
25Mn:
________________________________________________________________,
有 种空间运动状态,有 个单电子,属于半充满。
6
3
15
5
表示方法
原子结构示意图
电子式
电子排布式
简化电子排布式
价电子排布式
电子排布图 (轨道表示式)
价电子排布图
以硫(S)为举例
S:1s22s22p63s23p4
[Ne]3s23p4
S:3s23p4
归纳一:基态原子核外电子排布的表示方法
S:
——七图式
(1)有1个未成对电子:
(2)有2个未成对电子:
(3)有3个未成对电子:
(4)有4个未成对电子:
(5)有5个未成对电子:
(6)有6个未成对电子:
归纳二:1-36号元素中,原子核外未成对电子数与价电子排布之间的关系
ns1、ns2np1、ns2np5、3d14s2、3d104s1
ns2np2、ns2np4、3d24s2、3d84s2
ⅠA族(ns1:H、Li、Na、K); ⅢA族(ns2np1:B、Al、Ga);
ⅦA族(ns2np5:F、Cl、Br); Sc、Cu。
ⅣA族(ns2np2:C、Si、Ge); ⅥA族(ns2np4:O、S、Se)。Ti、Ni
ⅤA族(ns2np3:N、P、As),V、Co。
Fe
Mn
Cr
ns2np3、3d34s2、3d74s2
3d64s2
3d54s2
3d54s1
练一练:在前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有几种?( )
A. 6种 B. 5种 C. 4种 D. 3种
B
H C O P Fe
核外电子运动的基本特征
能层
能级
轨道
自旋
公转
自转
大范围
小范围
归纳三:基态原子核外电子运动状态的描述
电子能量与能层、能级有关
电子运动的空间范围与原子轨道有关
第一节
原子的结构与性质
第4课时
电子排布的轨道表示式(电子排布图)
核外电子在原子轨道中的排布规律
电子排布式与轨道表示式的比较
排布规律一:泡利原理
排布规律二:洪特规则
排布规律三:能量最低原理
简并轨道
电子对
单电子
自旋平行
用方框表示原子轨道,在方框的下方用能级符号表示轨道所属能级
课堂小结
1.下列原子的轨道表示式中,符合洪特规则的是( )
A. B.
C. D.
C
2.下列有关化学用语中不能体现氮原子核外电子能量有差异的是( )
A. B.
C. D.1s22s22p3
A
课堂练习
3.24Cr原子处于基态时,价电子排布可用轨道表示式表示成
,而不是 。
下列说法中正确的是( )
A.这两种排布方式都符合能量最低原理
B.这两种排布方式都符合泡利原理
C.这两种排布方式都符合洪特规则
D.这个实例说明洪特规则有时候和能量最低原理是矛盾的
B
课堂练习
4.下列关于硅原子的核外电子排布表示方法中,错误的是( )
A.1s22s22p63s23p2
B.[Ne]3s23p2
C.
D.
C
5.在短周期元素中,元素的基态原子核外未成对电子数等于能层数的元素有a种,元素的基态原子最外层电子数是未成对电子数2倍的元素有b种,则a∶b的值为( )
A.1 B.2 C.3 D.4
B
课堂练习
6.下列各组原子中,彼此化学性质一定相似的是( )
A.原子核外L能层的未成对电子数与M能层的未成对电子数相等的原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子
的Y原子
C.2p能级只有1个空轨道的X原子和3p能级只有1个空轨道的Y原子
D.最外层都只有一个电子的X、Y原子
C
课堂练习
7.(1)氧元素基态原子核外未成对电子数为____个,第三周期中有两个成单电子的元素符号________(填一种即可),M层上有2对成对电子的原子最外层共有___种不同运动状态的电子。
2
Si(或S)
6
(2)1~36号元素原子中未成对电子数为2的元素符号及价电子排布式:____________________________________________________________________________________________________________________________________
C:2s22p2,Si:3s23p2,Ge:4s24p2,O:2s22p4,S:3s23p4,Se:4s24p4,
Ti:3d24s2,Ni:3d84s2
(3)某元素的原子序数为33,该元素原子的价电子排布式为______,该元素原子核外有___个能层,___个能级,___个原子轨道,有___个单电子。
4s24p3
4
8
18
3
课堂练习
8.下列原子或离子的电子排布式或轨道表示式正确的是________(填序号,下同),违反能量最低原理的是____,违反洪特规则的是____,违反泡利原理的是____。
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
③P:
④Fe:1s22s22p63s23p63d64s2
⑤Mg2+:1s22s22p6
⑥C:
①④⑤
⑥
②
③
课堂练习
THANKS
谢谢聆听
第一章
第二节 原子结构与元素的性质
0
第4课时:泡利原理、洪特规则
能层 K L M N O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p ...
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6
原子轨道数 1 1 3 1 3 5 1 3 5 7 1 3
想一想:每个原子轨道最多只能容纳 个电子
2
两个电子容纳在一个轨道里,也就意味着,它们的空间运动状态是相同的。为什么每个原子轨道中最多可容纳两个电子?这两个电子的运动状态有差异吗?
斯特恩-盖拉赫实验
在斯特恩-盖拉赫实验中发现了银原子束经过不均匀磁场,产生了偏转,并最终在屏幕垂直方向上,形成了两个上下对称的非连续分布。至此,所有的粒子从理论上就都有了——自旋。
电子自旋在空间有顺时针和逆时针两种取向,简称自旋相反,常用上下箭头( “↑”“↓” )表示自旋相反的电子。
电子自旋
1925 年,泡利正式提出,在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反,这个原理被称为泡利原理(泡利不相容原理)。
物理史上最嚣张的论文——1页
1925年,两个物理研究生,竟然搞出了电子自旋的概念,认为契合了天才泡利的预测,于是就整出了1页的论文。没想到的是,这个理论竟然违背了爱因斯坦相对论,其速度居然达到了光速10倍,偏偏还是对的!他们分别叫,乌仑贝克和高斯密特。
(左乌伦贝克,右古德斯米特,拍摄时间约为 1928 年)
1927年10月,第五届索尔维会议,泡利是年龄最小的顶级科学家
电子除了空间运动状态外,还存在一种运动状态叫__________。
自旋
1. 电子自旋和泡利原理
1)自旋
电子自旋在空间有________________两种取向,简称___________。
自旋相反
常用上下箭头( “↑”“↓” )表示
顺时针和逆时针
泡利原理、洪特规则、能量最低原理
②电子能量与能层、能级有关,电子的空间运动状态与原子轨道有关,能层、能级、原子轨道和自旋状态四个方面共同决定电子的运动状态。
③一个原子中不可能存在运动状态完全相同的2个电子
①自旋是微观粒子普遍存在的一种如同电荷、质量一样的内在属性。
注意:
电子除了空间运动状态外,还存在一种运动状态叫__________。
自旋
1.电子自旋和泡利原理
1)自旋
在一个原子轨道里:最多只能容纳______个电子,它们的自旋________
2
相反
泡利原理、洪特规则、能量最低原理
填多少
2)泡利原理
这个原理被称为泡利原理(也称泡利不相容原理)。
如2s2的电子排布图为 ,不能表示为 。
H 1s1
O 1s22s22p4
H
原子轨道
简并轨道:能量相同的原子轨道
电子对
单电子(未成对电子)
自旋平行
能级符号
轨道表示式(电子排布图):是表述电子排布的一种图示。
2.电子排布的轨道表示式
泡利原理、洪特规则、能量最低原理
(1)用□或〇代表一个原子轨道,能量相同的原子轨道(简并轨道)的方框相连。不同能级中的□要相互分开。
(2)整个电子排布图中各能级的排列顺序要与相应的电子排布式一致。
(4)通常在方框下方或上方标记能级符号。
(3)箭头表示一种自旋状态的电子,一个箭头表示一个电子,↓↑”称电子对 ,“↑”或“↓”表示单电子(或称未成对电子),箭头同向的单电子称自旋平行。
H
H 1s1
O 1s22s22p4
(5)有时画出的能级上下错落,以表达能量高低不同。
2.电子排布的轨道表示式
泡利原理、洪特规则、能量最低原理
Li
1s
↑↓
↑
2s
Be
1s
↑↓
↑↓
2s
B
1s
↑
↑↓
↑↓
2s
2p
请写出Li、Be、B的轨道表示式。
课堂练习
“先打单,再成双”
“打单要平行,成双要相反”
同一个原子轨道
只有一个电子
2
1
B
1s
↑
↑↓
↑↓
2s
2p
电子对
自旋方向相反的一对电子
单电子
B 原子中: 有 对电子对,有 个单电子。
2.电子排布的轨道表示式
泡利原理、洪特规则、能量最低原理
自旋平行
箭头同向的单电子称为自旋平行
简并轨道
能量相同的原子轨道
有 种空间运动状态,有 种运动状态不同的电子。
3
5
B
1s
↑
↑↓
↑↓
2s
2p
轨道数
电子数
2.电子排布的轨道表示式
泡利原理、洪特规则、能量最低原理
练一练:1.请画出铝原子的轨道表示式
铝原子外层有 个电子对,
有 个单电子。
电子有 种空间运动状态,有 种运动状态不同的电子。
13
1
7
6
2.下列基态碳原子的轨道表示式哪个是正确的?
① C
1s
↑↓
↑↓
↑↓
2s
2p
② C
1s
↑↑
↑↓
↑↓
2s
2p
2p
③ C
↑
1s
↑
↑↓
↑↓
2s
2p
④ C
↓
1s
↑
↑↓
↑↓
2s
√
3.(2009-上海)以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A. He B. C.1s2 D.
怎么填
基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。
(能量相同的原子轨道)
(自旋方向相同)
2p3的电子排布图
√
泡利原理、洪特规则、能量最低原理
3.洪特规则
C :1s2 2s22p2
√
洪特规则是针对电子填入简并轨道而言的, 并不适用于电子填入能量不同的轨道。
↑↓
Li
Be
B
C
↑↓
1s
2s
↑↓
↑
↑↓
↑↓
1s
2s
↑
2p
↑↓
↑↓
1s
2s
↑
↑
2p
1s
2s
N
O
↑↓
↑↓
1s
2s
↑
↑
↑
2p
↑↓
↑↓
1s
2s
↑
↑
↑
↓
2p
F
Ne
↑
↑
↑
↓
↓
↑↓
1s
2s
2p
↑↓
↑↓
1s
2s
2p
↑
↑
↑
↓
↓
↓
↑↓
第二周期元素原子的电子排布图(即轨道表示式)
洪特规则特例*
光谱实验发现
能量相同的简并轨道在______、_____和_______条件时,体系能量较低,原子较稳定。
全满
半满
全空
3d 4s
↑
Cr
↑
↑
↑
↑
↑
半充满状态
怎么填
泡利原理、洪特规则、能量最低原理
3.洪特规则
3d 4s
↑↓
↑↓
↑
↑↓
↑↓
↑↓
全充满状态
Cu
在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低。
整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定。
自然界的普适规律
泡利原理、洪特规则、能量最低原理
4.能量最低原理
能量最低原理的补充:
当相邻能级能量差别不大时,有1~2个电子填入能量稍高的能级可能反而降低电子排斥能,进而使原子整体能量最低。例如:所有副族元素的基态原子。
内容:
因素:
铁原子的电子排布图
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
洪特规则
泡利原理
能量最低原理
1s
2s
2p
3p
3d
3s
4s
结论:基态原子的核外电子排布遵循泡利原理、洪特规则和能量最低原理。
违背任意一个,能量就不是最低,就不是基态。
【思考与讨论】 课本P16
(1)为什么基态氦原子的电子排布是1s2而不是1s12s1
(3)为什么基态Sc的价层电子排布是3d14s2,而不是4s3?
不满足能量最低原理
不满足洪特规则
不满足泡利原理
(2)为什么基态氮原子的轨道表示式是 ,而不是
?
【练一练】写出15P、25Mn的轨道表示式,并按要求填空。
15P:
,
有 对电子对,有 个单电子。
25Mn:
________________________________________________________________,
有 种空间运动状态,有 个单电子,属于半充满。
6
3
15
5
表示方法
原子结构示意图
电子式
电子排布式
简化电子排布式
价电子排布式
电子排布图 (轨道表示式)
价电子排布图
以硫(S)为举例
S:1s22s22p63s23p4
[Ne]3s23p4
S:3s23p4
归纳一:基态原子核外电子排布的表示方法
S:
——七图式
(1)有1个未成对电子:
(2)有2个未成对电子:
(3)有3个未成对电子:
(4)有4个未成对电子:
(5)有5个未成对电子:
(6)有6个未成对电子:
归纳二:1-36号元素中,原子核外未成对电子数与价电子排布之间的关系
ns1、ns2np1、ns2np5、3d14s2、3d104s1
ns2np2、ns2np4、3d24s2、3d84s2
ⅠA族(ns1:H、Li、Na、K); ⅢA族(ns2np1:B、Al、Ga);
ⅦA族(ns2np5:F、Cl、Br); Sc、Cu。
ⅣA族(ns2np2:C、Si、Ge); ⅥA族(ns2np4:O、S、Se)。Ti、Ni
ⅤA族(ns2np3:N、P、As),V、Co。
Fe
Mn
Cr
ns2np3、3d34s2、3d74s2
3d64s2
3d54s2
3d54s1
练一练:在前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有几种?( )
A. 6种 B. 5种 C. 4种 D. 3种
B
H C O P Fe
核外电子运动的基本特征
能层
能级
轨道
自旋
公转
自转
大范围
小范围
归纳三:基态原子核外电子运动状态的描述
电子能量与能层、能级有关
电子运动的空间范围与原子轨道有关
第一节
原子的结构与性质
第4课时
电子排布的轨道表示式(电子排布图)
核外电子在原子轨道中的排布规律
电子排布式与轨道表示式的比较
排布规律一:泡利原理
排布规律二:洪特规则
排布规律三:能量最低原理
简并轨道
电子对
单电子
自旋平行
用方框表示原子轨道,在方框的下方用能级符号表示轨道所属能级
课堂小结
1.下列原子的轨道表示式中,符合洪特规则的是( )
A. B.
C. D.
C
2.下列有关化学用语中不能体现氮原子核外电子能量有差异的是( )
A. B.
C. D.1s22s22p3
A
课堂练习
3.24Cr原子处于基态时,价电子排布可用轨道表示式表示成
,而不是 。
下列说法中正确的是( )
A.这两种排布方式都符合能量最低原理
B.这两种排布方式都符合泡利原理
C.这两种排布方式都符合洪特规则
D.这个实例说明洪特规则有时候和能量最低原理是矛盾的
B
课堂练习
4.下列关于硅原子的核外电子排布表示方法中,错误的是( )
A.1s22s22p63s23p2
B.[Ne]3s23p2
C.
D.
C
5.在短周期元素中,元素的基态原子核外未成对电子数等于能层数的元素有a种,元素的基态原子最外层电子数是未成对电子数2倍的元素有b种,则a∶b的值为( )
A.1 B.2 C.3 D.4
B
课堂练习
6.下列各组原子中,彼此化学性质一定相似的是( )
A.原子核外L能层的未成对电子数与M能层的未成对电子数相等的原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子
的Y原子
C.2p能级只有1个空轨道的X原子和3p能级只有1个空轨道的Y原子
D.最外层都只有一个电子的X、Y原子
C
课堂练习
7.(1)氧元素基态原子核外未成对电子数为____个,第三周期中有两个成单电子的元素符号________(填一种即可),M层上有2对成对电子的原子最外层共有___种不同运动状态的电子。
2
Si(或S)
6
(2)1~36号元素原子中未成对电子数为2的元素符号及价电子排布式:____________________________________________________________________________________________________________________________________
C:2s22p2,Si:3s23p2,Ge:4s24p2,O:2s22p4,S:3s23p4,Se:4s24p4,
Ti:3d24s2,Ni:3d84s2
(3)某元素的原子序数为33,该元素原子的价电子排布式为______,该元素原子核外有___个能层,___个能级,___个原子轨道,有___个单电子。
4s24p3
4
8
18
3
课堂练习
8.下列原子或离子的电子排布式或轨道表示式正确的是________(填序号,下同),违反能量最低原理的是____,违反洪特规则的是____,违反泡利原理的是____。
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
③P:
④Fe:1s22s22p63s23p63d64s2
⑤Mg2+:1s22s22p6
⑥C:
①④⑤
⑥
②
③
课堂练习
THANKS
谢谢聆听
