1.1 原子结构 第3课时 课件 (共22张ppt)-2023-2024学年高二上学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1 原子结构 第3课时 课件 (共22张ppt)-2023-2024学年高二上学期化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 19.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-24 09:44:45 | ||
图片预览








文档简介
(共22张PPT)
第一章
第一节 原子结构
0
第3课时:电子云与原子轨道
19世纪末,经典力学和经典电动力学在描述微观系统时的不足越来越明显。量子力学是在20世纪初由马克斯·普朗克、尼尔斯·玻尔、沃纳·海森堡、埃尔温·薛定谔、沃尔夫冈·泡利、路易·德布罗意、马克斯·玻恩、恩里科·费米、保罗·狄拉克、阿尔伯特·爱因斯坦、康普顿等一大批物理学家共同创立的。
第一排:欧文·朗缪尔、马克斯·普朗克、玛丽·居里、亨得里克·洛仑兹、阿尔伯特·爱因斯坦、保罗·朗之万、Ch.
E. Guye、C.T.R.威尔逊、O.W.里查森
第二排:彼得·德拜、马丁·努森、威廉·劳伦斯·布拉格、Hendrik Anthony
Kramers、保罗·狄拉克、亚瑟·康普顿、路易·德布罗意、马克斯·波恩、尼尔斯·玻尔
第三排:奥古斯特·皮卡尔德、E. Henriot、保罗·埃伦费斯特、Ed. Herzen、Théophile de
Donder、欧文·薛定谔、E. Verschaffelt、沃尔夫冈·泡利、沃纳·海森堡、R.H.福勒、里昂·布里渊
1927年 第五届索尔维会议
量子力学的发展
量子&量子化
一个物理量如果存在最小的不可分割的基本单位,则这个物理量是量子化的,并把最小单位称为量子。在物理学中常用到量子的概念,指一个不可分割的基本个体。例如:“光的量子”(光子)是一定频率的光的基本能量单位。而延伸出的量子力学、量子光学等成为不同的专业研究领域。其基本概念为所有的有形性质是“可量子化的”。“量子化”指其物理量的数值是离散的,而不是连续地任意取值。例如:在原子中,电子的能量是可量子化的,这决定了原子的稳定性和发射光谱等一般问题。
马克斯·卡尔·恩斯特·路德维希·普朗克
量子力学的发展
对于原子科学家最感兴趣的是——
原子核外的电子是如何运动的?
原子核外的电子是如何排布的?
1913年
电子分层排布模型
丹麦科学家
玻尔
研究了氢原子的光谱后,根据量子力学的观点,大胆突破传统思想的束缚,提出了新的原子结构模型
(1)原子核外电子在一系列稳定的轨道上运动,这些轨道称为原子轨道。核外电子在
原子轨道上运动时,既不放出能量,也不吸收能量。
(2)不同的原子轨道具有不同的能量,原子轨道的能量变化是不连续的。
(3)原子核外电子可以在能量不同的轨道上发生跃迁。
获得了1922年的诺贝尔物理学奖
资料在线
宏观物体的运动轨迹
电子的运动轨迹是什么样子?
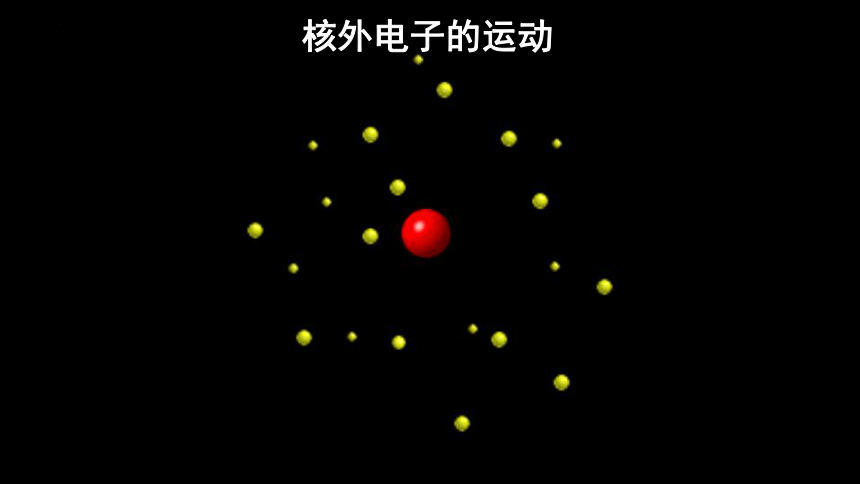
核外电子的运动
宏观物体 电子
质量 很大
速度 较慢
空间 大
轨迹 可描述 (画图或函数描述)
核外电子运动有何特点
问题探究
很小
很快(接近光速)
极小
不可确定
德国物理学家、量子力学的创立者海森堡
1920年发表著名的海森堡测不准原理
1932年获诺贝尔物理学奖
无法同时精确测量某个电子在某一时刻的位置和速率
1926年奥地利物理学家薛定谔提出:可以用一个数学方程描述核外电子的运动状态,为近代量子力学奠定了理论基础。
核外电子的运动特点
量子力学指出:一定空间运动状态的电子并不在玻尔假设的线性轨道上运动,而是在核外空间各处都可以出现,只是出现的概率不同。
薛定谔方程
1926~1935年
现代电子云模型
1926年,玻尔建立的线性轨道模型被量子力学推翻。
资料在线
2.氢原子的1s电子在原子核外出现的概率密度分布图
小点不是电子本身,小点是1s电子在原子核外出现的概率密度的形象描述。
小黑点越密,表明概率密度越大。
1.概率密度
含义:用P表示电子在某处出现的概率,V表示该处的体积,则
称为概率密度,用ρ表示
一、电子云
由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称作电子云
电子云图难绘制
电子云轮廓图
一、电子云
3.电子云
电子云是处于一定空间运动状态的电子在原子核外空间的概率密度
分布的形象化描述。不代表电子的运动轨迹。
电子云图很难绘制,使用不便,我们常使用电子云轮廓图。
(1)含义:
(2)电子云轮廓图
①绘制电子云轮廓图的目的:表示电子云轮廓的形状,对核外电子的空间运动状态有一个形象化的简便描述。
②绘制电子云轮廓图:把电子在原子核外空间出现概率P=90%的空间圈出来。
一、电子云
4. 电子云轮廓图的特点和规律
(1)所有原子的任一能层的s电子的电子云轮廓图都是一个球形,只是球的半径不同。
(2)同一原子的能层越高,s电子云半径越大。由于电子能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。
(3)s电子云只有一种空间伸展方向。
(4)除s电子云外,其他电子云轮廓图都不是球形的。
同一原子的s电子的电子云轮廓图
①p电子云轮廓图是哑铃状或纺锤形。能层序数越大,p电子云半径越大。
②无论2p、3p还是4p…..都有3个相互垂直的电子云(3种空间伸展方向),分别称为Px、Py、Pz,右下标x、y、z分别是p电子云在直角坐标系里的取向。
③同一能层中px、py、pz的能量相同。
y
x
z
y
x
z
y
x
z
Pz、Py、Px的电子云
④d电子云轮廓图是花瓣形或双哑铃形,有5种空间伸展方向
ns原子轨道只有1个
nd原子轨道有5个
np原子轨道有3个
nf 原子轨道有7个
二、原子轨道
能层序数越大,原子轨道的半径越大。
1s
2s
3s
4s
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道
常用电子云轮廓图的形状和取向来表示原子轨道的形状和取向。
各能级的一个伸展方向的电子云轮廓图即表示一个原子轨道。
能层 能级 原子轨道数 原子轨道名称 原子轨道的形状和取向 K 1s 1 1s 球形 ——
L 2s 1 2s 球形 ——
2p 3 2px、2py、2pz 哑铃形 互相垂直
M 3s 1 3s 球形 ——
3p 3 3px、3py、3pz 哑铃形 互相垂直
3d 5 …… …… ……
N 4s 1 4s 球形 ——
4p 3 4px、4py、4pz 哑铃形 互相垂直
4d 5 …… …… …...
4f 7 …… …… ……
二、原子轨道
不同能层的能级、原子轨道数、原子轨道名称以及形状和取向(P14)
原子轨道数与能层序数(n)的关系:原子轨道数目=n2
1.s能级和p能级的原子轨道存在哪些方面的差异?
提示 轨道图形、形状、数目、最多容纳电子数等不同。
2.不同能层中的s轨道和p轨道电子云轮廓分别相同吗?能量分别相同吗?
提示 电子云轮廓相同(s轨道均为球形,p轨道均为哑铃形);能量不同(能层序数越大,能量越高)。
【思考与讨论】
3.基态原子的核外电子填充在6个轨道的元素有几种?填充在7个轨道中的元素有几种?
提示 s、p能级分别有1、3个原子轨道,按照构造原理,核外电子填充在6个轨道的元素为1s22s22p63s1(Na)和1s22s22p63s2(Mg),共2种;填充在7个轨道中的元素只有1s22s22p63s23p1(Al)一种元素。
小结:原子轨道的特点
1.s原子轨道是球形的,p原子轨道是纺锤形的
2.能层序数n越大,原子轨道的半径越大;
3.不同能层的同种能级的原子轨道形状相似,只是半径不同;相同能层的同种能级的原子轨道形状相似,半径相同,能量相同,方向不同
4. s能级只有1个原子轨道;p能级有3个原子轨道,互相垂直,可分别以px、py、pz表示,能量相等。如2px、2py、2pz轨道的能量相等。
5.原子轨道数与能层序数(n)的关系:原子轨道数目=n2
第一节
原子的结构与性质
第3课时
电子云
原子轨道
概率密度分布图
电子云图
概念
形状
各能级所含有原子轨道数目
表达公式
相同原子的s电子的电子云轮廓图
px、py、pz的电子云轮廓图
概念
含义
形状:s电子云——球形,p电子云——哑铃形
原子轨道与能层序数的关系
能层、能级和原子轨道之间的关系
课堂小结
1.图1和图2分别是1s电子的概率密度分布图和原子轨道图。下列有关说法正确的是( )
A.图1中的每个小黑点表示1个电子
B.图2表示1s电子只能在球体内出现
C.图2表明1s轨道呈球形,有无数对称轴
D.图1中的小黑点表示电子在核外所处的位置
C
课堂练习
2.下列说法正确的是( )
A.不同的原子轨道形状一定不相同
B.p轨道呈哑铃形,因此p轨道上的电子运动轨迹呈哑铃形
C.2p能级有3个p轨道
D.氢原子的电子运动轨迹呈球形
C
3.下列说法中正确的是( )
A.1s电子云呈球形,表示电子绕原子核做圆周运动
B.ns能级的原子轨道图可表示为
C.3d3表示3d能级有3个轨道
D.电子云图中的小黑点密度大,说明该原子核外空间电子数目多
B
课堂练习
4.(1)可正确表示原子轨道的是_____(填字母)。
A.2s B.2d C.3p D.3f
AC
(2)如图是s能级、p能级的原子轨道图,试回答问题:
①s能级的原子轨道呈____形,每个s能级有___个原子轨道;p能级的原子轨道分别相对于x、y、z轴_____,每个p能级有___个原子轨道。
②s能级原子轨道、p能级原子轨道的半径与_________有关,________越大,原子轨道半径越大。
球
1
对称
3
能层序数
能层序数
课堂练习
5.元素X的原子最外层电子排布式为nsnnpn+1。试回答下列各题:
(1)电子排布式中的n=____;原子中能量最高的是_________________电子,其电子云在空间有__________________方向,原子轨道呈现_____形。
(2)元素X的名称是____。
2
2p
三种互相垂直的伸展
哑铃
氮
课堂小结
第一章
第一节 原子结构
0
第3课时:电子云与原子轨道
19世纪末,经典力学和经典电动力学在描述微观系统时的不足越来越明显。量子力学是在20世纪初由马克斯·普朗克、尼尔斯·玻尔、沃纳·海森堡、埃尔温·薛定谔、沃尔夫冈·泡利、路易·德布罗意、马克斯·玻恩、恩里科·费米、保罗·狄拉克、阿尔伯特·爱因斯坦、康普顿等一大批物理学家共同创立的。
第一排:欧文·朗缪尔、马克斯·普朗克、玛丽·居里、亨得里克·洛仑兹、阿尔伯特·爱因斯坦、保罗·朗之万、Ch.
E. Guye、C.T.R.威尔逊、O.W.里查森
第二排:彼得·德拜、马丁·努森、威廉·劳伦斯·布拉格、Hendrik Anthony
Kramers、保罗·狄拉克、亚瑟·康普顿、路易·德布罗意、马克斯·波恩、尼尔斯·玻尔
第三排:奥古斯特·皮卡尔德、E. Henriot、保罗·埃伦费斯特、Ed. Herzen、Théophile de
Donder、欧文·薛定谔、E. Verschaffelt、沃尔夫冈·泡利、沃纳·海森堡、R.H.福勒、里昂·布里渊
1927年 第五届索尔维会议
量子力学的发展
量子&量子化
一个物理量如果存在最小的不可分割的基本单位,则这个物理量是量子化的,并把最小单位称为量子。在物理学中常用到量子的概念,指一个不可分割的基本个体。例如:“光的量子”(光子)是一定频率的光的基本能量单位。而延伸出的量子力学、量子光学等成为不同的专业研究领域。其基本概念为所有的有形性质是“可量子化的”。“量子化”指其物理量的数值是离散的,而不是连续地任意取值。例如:在原子中,电子的能量是可量子化的,这决定了原子的稳定性和发射光谱等一般问题。
马克斯·卡尔·恩斯特·路德维希·普朗克
量子力学的发展
对于原子科学家最感兴趣的是——
原子核外的电子是如何运动的?
原子核外的电子是如何排布的?
1913年
电子分层排布模型
丹麦科学家
玻尔
研究了氢原子的光谱后,根据量子力学的观点,大胆突破传统思想的束缚,提出了新的原子结构模型
(1)原子核外电子在一系列稳定的轨道上运动,这些轨道称为原子轨道。核外电子在
原子轨道上运动时,既不放出能量,也不吸收能量。
(2)不同的原子轨道具有不同的能量,原子轨道的能量变化是不连续的。
(3)原子核外电子可以在能量不同的轨道上发生跃迁。
获得了1922年的诺贝尔物理学奖
资料在线
宏观物体的运动轨迹
电子的运动轨迹是什么样子?
核外电子的运动
宏观物体 电子
质量 很大
速度 较慢
空间 大
轨迹 可描述 (画图或函数描述)
核外电子运动有何特点
问题探究
很小
很快(接近光速)
极小
不可确定
德国物理学家、量子力学的创立者海森堡
1920年发表著名的海森堡测不准原理
1932年获诺贝尔物理学奖
无法同时精确测量某个电子在某一时刻的位置和速率
1926年奥地利物理学家薛定谔提出:可以用一个数学方程描述核外电子的运动状态,为近代量子力学奠定了理论基础。
核外电子的运动特点
量子力学指出:一定空间运动状态的电子并不在玻尔假设的线性轨道上运动,而是在核外空间各处都可以出现,只是出现的概率不同。
薛定谔方程
1926~1935年
现代电子云模型
1926年,玻尔建立的线性轨道模型被量子力学推翻。
资料在线
2.氢原子的1s电子在原子核外出现的概率密度分布图
小点不是电子本身,小点是1s电子在原子核外出现的概率密度的形象描述。
小黑点越密,表明概率密度越大。
1.概率密度
含义:用P表示电子在某处出现的概率,V表示该处的体积,则
称为概率密度,用ρ表示
一、电子云
由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称作电子云
电子云图难绘制
电子云轮廓图
一、电子云
3.电子云
电子云是处于一定空间运动状态的电子在原子核外空间的概率密度
分布的形象化描述。不代表电子的运动轨迹。
电子云图很难绘制,使用不便,我们常使用电子云轮廓图。
(1)含义:
(2)电子云轮廓图
①绘制电子云轮廓图的目的:表示电子云轮廓的形状,对核外电子的空间运动状态有一个形象化的简便描述。
②绘制电子云轮廓图:把电子在原子核外空间出现概率P=90%的空间圈出来。
一、电子云
4. 电子云轮廓图的特点和规律
(1)所有原子的任一能层的s电子的电子云轮廓图都是一个球形,只是球的半径不同。
(2)同一原子的能层越高,s电子云半径越大。由于电子能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。
(3)s电子云只有一种空间伸展方向。
(4)除s电子云外,其他电子云轮廓图都不是球形的。
同一原子的s电子的电子云轮廓图
①p电子云轮廓图是哑铃状或纺锤形。能层序数越大,p电子云半径越大。
②无论2p、3p还是4p…..都有3个相互垂直的电子云(3种空间伸展方向),分别称为Px、Py、Pz,右下标x、y、z分别是p电子云在直角坐标系里的取向。
③同一能层中px、py、pz的能量相同。
y
x
z
y
x
z
y
x
z
Pz、Py、Px的电子云
④d电子云轮廓图是花瓣形或双哑铃形,有5种空间伸展方向
ns原子轨道只有1个
nd原子轨道有5个
np原子轨道有3个
nf 原子轨道有7个
二、原子轨道
能层序数越大,原子轨道的半径越大。
1s
2s
3s
4s
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道
常用电子云轮廓图的形状和取向来表示原子轨道的形状和取向。
各能级的一个伸展方向的电子云轮廓图即表示一个原子轨道。
能层 能级 原子轨道数 原子轨道名称 原子轨道的形状和取向 K 1s 1 1s 球形 ——
L 2s 1 2s 球形 ——
2p 3 2px、2py、2pz 哑铃形 互相垂直
M 3s 1 3s 球形 ——
3p 3 3px、3py、3pz 哑铃形 互相垂直
3d 5 …… …… ……
N 4s 1 4s 球形 ——
4p 3 4px、4py、4pz 哑铃形 互相垂直
4d 5 …… …… …...
4f 7 …… …… ……
二、原子轨道
不同能层的能级、原子轨道数、原子轨道名称以及形状和取向(P14)
原子轨道数与能层序数(n)的关系:原子轨道数目=n2
1.s能级和p能级的原子轨道存在哪些方面的差异?
提示 轨道图形、形状、数目、最多容纳电子数等不同。
2.不同能层中的s轨道和p轨道电子云轮廓分别相同吗?能量分别相同吗?
提示 电子云轮廓相同(s轨道均为球形,p轨道均为哑铃形);能量不同(能层序数越大,能量越高)。
【思考与讨论】
3.基态原子的核外电子填充在6个轨道的元素有几种?填充在7个轨道中的元素有几种?
提示 s、p能级分别有1、3个原子轨道,按照构造原理,核外电子填充在6个轨道的元素为1s22s22p63s1(Na)和1s22s22p63s2(Mg),共2种;填充在7个轨道中的元素只有1s22s22p63s23p1(Al)一种元素。
小结:原子轨道的特点
1.s原子轨道是球形的,p原子轨道是纺锤形的
2.能层序数n越大,原子轨道的半径越大;
3.不同能层的同种能级的原子轨道形状相似,只是半径不同;相同能层的同种能级的原子轨道形状相似,半径相同,能量相同,方向不同
4. s能级只有1个原子轨道;p能级有3个原子轨道,互相垂直,可分别以px、py、pz表示,能量相等。如2px、2py、2pz轨道的能量相等。
5.原子轨道数与能层序数(n)的关系:原子轨道数目=n2
第一节
原子的结构与性质
第3课时
电子云
原子轨道
概率密度分布图
电子云图
概念
形状
各能级所含有原子轨道数目
表达公式
相同原子的s电子的电子云轮廓图
px、py、pz的电子云轮廓图
概念
含义
形状:s电子云——球形,p电子云——哑铃形
原子轨道与能层序数的关系
能层、能级和原子轨道之间的关系
课堂小结
1.图1和图2分别是1s电子的概率密度分布图和原子轨道图。下列有关说法正确的是( )
A.图1中的每个小黑点表示1个电子
B.图2表示1s电子只能在球体内出现
C.图2表明1s轨道呈球形,有无数对称轴
D.图1中的小黑点表示电子在核外所处的位置
C
课堂练习
2.下列说法正确的是( )
A.不同的原子轨道形状一定不相同
B.p轨道呈哑铃形,因此p轨道上的电子运动轨迹呈哑铃形
C.2p能级有3个p轨道
D.氢原子的电子运动轨迹呈球形
C
3.下列说法中正确的是( )
A.1s电子云呈球形,表示电子绕原子核做圆周运动
B.ns能级的原子轨道图可表示为
C.3d3表示3d能级有3个轨道
D.电子云图中的小黑点密度大,说明该原子核外空间电子数目多
B
课堂练习
4.(1)可正确表示原子轨道的是_____(填字母)。
A.2s B.2d C.3p D.3f
AC
(2)如图是s能级、p能级的原子轨道图,试回答问题:
①s能级的原子轨道呈____形,每个s能级有___个原子轨道;p能级的原子轨道分别相对于x、y、z轴_____,每个p能级有___个原子轨道。
②s能级原子轨道、p能级原子轨道的半径与_________有关,________越大,原子轨道半径越大。
球
1
对称
3
能层序数
能层序数
课堂练习
5.元素X的原子最外层电子排布式为nsnnpn+1。试回答下列各题:
(1)电子排布式中的n=____;原子中能量最高的是_________________电子,其电子云在空间有__________________方向,原子轨道呈现_____形。
(2)元素X的名称是____。
2
2p
三种互相垂直的伸展
哑铃
氮
课堂小结
