专题2《化学反应速率与化学平衡》单元检测题(含解析)2023---2024学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题2《化学反应速率与化学平衡》单元检测题(含解析)2023---2024学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 674.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-24 13:38:22 | ||
图片预览



文档简介
专题2《化学反应速率与化学平衡》
一、单选题
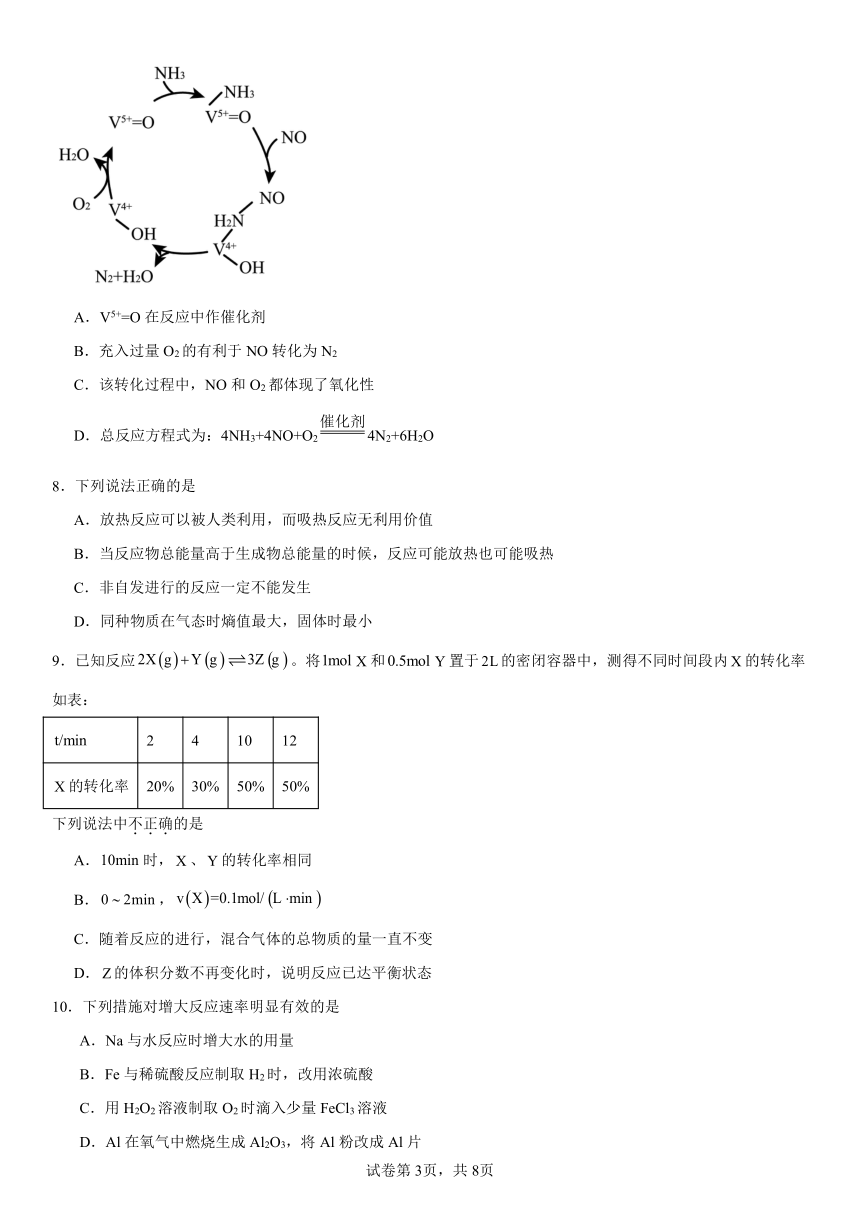
1.下列图示与对应的叙述相符的是
A.图一表示反应:mA(s)+nB(g)pC(g) △H>0,在一定温度下,平衡时B的百分含量(B%)随压强变化的关系如图所示,X点的正反应速率小于逆反应速率
B.图二是可逆反应:A(g)+B(s)C(s)+D(g) △H>0的速率时间图象,在t1时刻改变条件一定是加入催化剂
C.图三表示对于化学反应mA(g)+nB(g)pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的△H<0
D.图四所示图中的阴影部分面积的含义是(v正-v逆)
2.向体积为10L的恒容密闭容器中通入1.5mol和1.5mol制备,反应原理为。在不同温度(、)下测得容器中随时间的变化曲线如下图所示。
下列说法不正确的是
A.该反应的正方向
B.时,的平衡转化率
C.时,若改为恒温恒压容器,平衡时
D.达平衡后再充入,不能提高的转化率
3.温度为了时,将H2(g)和I2(g)各1.6mol充入10L恒容密闭容器中,发生反应H2(g)+I2(g)2HI(g),一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是
t/min 2 4 7 9
n(H2)/mol 1.2 1.1 1.0 1.0
A.0~4min的平均反应速率(HI)=0.25mol L-1 min-1
B.时,反应的平衡常数=1.2
C.其他条件不变,若降温到T0,达到平衡时,平衡常数K0=4,则此反应的ΔH<0
D.其他条件不变,9min后,向容器中再充入6molH2,平衡向正反应方向移动,再次达到平衡时,H2的浓度减小,I2的转化率增大
4.黄铁矿(主要成分FeS2),在空气中会被缓慢氧化,过程如图所示。下列说法不正确的是
A.发生反应a时,0.05molFeS2被氧化时消耗标准状况下氧气的体积大约3.92L
B.为了验证b过程反应后溶液中含Fe2+,可选用KSCN溶液和氯水
C.c发生反应的离子方程式为:
D.将d反应体系升高温度,该可逆反应的正、逆反应速率增大,平衡正向移动
5.2007年诺贝尔化学奖得主——德国科学家格哈德·埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究催生了汽车尾气净化装置。净化装置中的催化转化器可将CO、NO、NO2等转化为无害的物质。下列有关说法不正确的是( )
A.催化转化器中的铂催化剂可加快CO的氧化
B.铂表面做成蜂窝状更有利于提高催化效果
C.在铂催化下,NO、NO2可被CO还原成N2
D.使用铂催化剂,可以提高碳氢化合物被氧化的转化率
6.一定条件下,将3molA气体和1molB固体置于容积为2L的密闭容器中,发生反应: 3A(g)+B(s) C(g)+2D(g)。2min末该反应达到平衡,生成D的物质的量为0.8mol。下列判断正确的是
A.反应过程中A和B的转化率之比为1: 1
B.不能通过调控反应条件提高该反应的限度
C.从2min开始,v(正) =v(逆)=0
D.当混合气体的密度不再改变时,该反应不一定达到平衡状态
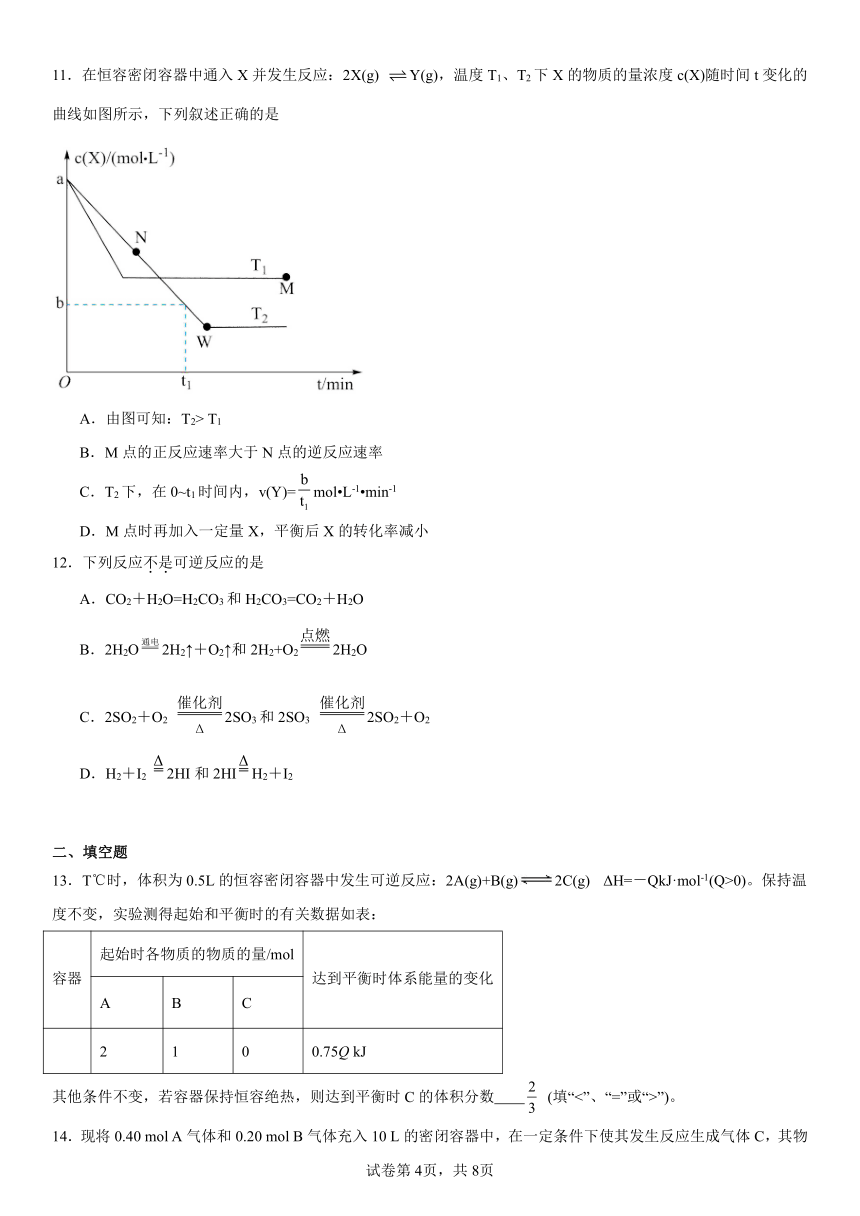
7.据文献报道,有氧条件下,NO在催化剂作用下可被NH3还原为N2,反应机理如图所示,下列说法错误的是
A.V5+=O在反应中作催化剂
B.充入过量O2的有利于NO转化为N2
C.该转化过程中,NO和O2都体现了氧化性
D.总反应方程式为:4NH3+4NO+O24N2+6H2O
8.下列说法正确的是
A.放热反应可以被人类利用,而吸热反应无利用价值
B.当反应物总能量高于生成物总能量的时候,反应可能放热也可能吸热
C.非自发进行的反应一定不能发生
D.同种物质在气态时熵值最大,固体时最小
9.已知反应。将和置于的密闭容器中,测得不同时间段内的转化率如表:
2 4 10 12
的转化率 20% 30% 50% 50%
下列说法中不正确的是
A.时,、的转化率相同
B.,
C.随着反应的进行,混合气体的总物质的量一直不变
D.的体积分数不再变化时,说明反应已达平衡状态
10.下列措施对增大反应速率明显有效的是
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C.用H2O2溶液制取O2时滴入少量FeCl3溶液
D.Al在氧气中燃烧生成Al2O3,将Al粉改成Al片
11.在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
A.由图可知:T2> T1
B.M点的正反应速率大于N点的逆反应速率
C.T2下,在0~t1时间内,v(Y)=mol L-1 min-1
D.M点时再加入一定量X,平衡后X的转化率减小
12.下列反应不是可逆反应的是
A.CO2+H2O=H2CO3和H2CO3=CO2+H2O
B.2H2O2H2↑+O2↑和2H2+O22H2O
C.2SO2+O2 2SO3和2SO3 2SO2+O2
D.H2+I2 2HI和2HIH2+I2
二、填空题
13.T℃时,体积为0.5L的恒容密闭容器中发生可逆反应:2A(g)+B(g)2C(g) ΔH=-QkJ·mol-1(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如表:
容器 起始时各物质的物质的量/mol 达到平衡时体系能量的变化
A B C
2 1 0 0.75Q kJ
其他条件不变,若容器保持恒容绝热,则达到平衡时C的体积分数 (填“<”、“=”或“>”)。
14.现将0.40 mol A气体和0.20 mol B气体充入10 L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图:
(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为 ;反应在t2时达到平衡,其化学方程式为 。
(2)该反应t2时刻反应化学平衡常数为K= 。
(3)据图中曲线变化情况分析,t1时刻改变的反应条件可能是 。
A.加入了催化剂 B.降低了反应温度
C.向容器中充入了C D.缩小了容器体积
15.在2 L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s 0 1 2 3 4
n(NO)/mol 0.020 0.01 0.008 0.007 0.007
800℃,反应达到平衡时,NO的物质的量浓度是 ;升高温度,NO的浓度增大,则该反应是 (填“放热”或“吸热”)反应。
16.在400℃,1.01X105Pa时,将SO2和14molO2 压入一个装有催化剂的VL密闭反应器中,发生2SO2+O22SO3的反应,并且在10min后达到平衡时,测得容器内有2molSO2和12molO2。
(1)SO2的起始浓度为 ,SO3(气)的平衡浓度为 ;
(2)SO2的转化率为 ,O2的平均反应速率为 ;
(3)平衡时SO3(气)占总体积的百分数为 ,此时体系压强为反应起始时体系压强的 倍;
(4)达平衡后再加入2molSO2、12molO2和4molSO3(气),此时正反应速率将 ,逆反应速率将 ,平衡 移动。
17.回答下列问题:
(1)在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是,在光照下可与反应,也可用和制备二甲醚和甲醇等新型燃料。
①在一定条件下,发生反应: △H>0。在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。若在2L密闭容器中发生反应,T℃时,通入2mol (g)和2mol (g),反应达平衡后,生成1mol CO,此时向容器中加入1mol CO和3mol 的混合气体(保持温度不变),则平衡将 移动(填“正向”、“逆向”或“不”)移动,达到新平衡后平衡常数K= 。
②(g)和(g)生成的CO和在一定条件下可发生如下反应: 。恒容条件下,下列措施中能使增大的有 (选填序号)。
a.再充入1mol b.使用催化剂 c.再充入2mol CO d.升高温度
(2)①学生甲想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和NaCl溶液,通电时,为使被完全吸收制得有较强杀菌能力的消毒液,设计了图的装置,a电极为该装置的 极,与a电极相连的电极反应为 ,该消毒液有效成分为 。
②极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的沉淀,受到学生甲制作家用环保型消毒液发生器的启发,学生乙认为,此装置也可以用于制备较为纯净的沉淀,若通电后,B极表面有无色气泡产生,且溶液中产生大量的白色沉淀,较长时间不变色。下列说法正确的是 。
A.电源a是负极 B.电解质溶液一定是NaOH溶液
C.A、B两端都必须用铁做电极 D.B极附近溶液pH增大
18.一定条件下,2CO(g)+SO2(g)2CO2(g)+S(l) △H。可实现燃煤烟气中硫的回收:
(1)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图所示。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑价格因素,选择Fe2O3的主要优点是 。
(2)工业上还可用Na2SO3溶液吸收烟气中的SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0mol/LNa2SO3溶液吸收纯净的SO2,当溶液中c(SO)降至0.2mol/L时,吸收能力显著下降,应更换吸收剂。此时溶液中c(HSO)约为 mol/L。
19.乙烯是衡量一个国家石油化工发展水平的标志性物质,以乙烯为原料,可以合成多种有机化合物。
(1)乙烯分子中的官能团名称为 ,乙烯可以与水反应,化学反应方程式为 。
(2)丙烯与HCl发生加成反应,产物之一等效氢原子只有2种,则该产物命名为 ;1mol丙烯与Cl2发生反应,最多可以消耗 molCl2.发生的反应类型是 (填选项)
A.加聚反应 B.加成反应 C.取代反应 D.氧化反应
(3)丙烯分子中,最多有 个原子共平面。
(4)“丁烯(C4H8)裂解法”是一种重要的丙烯(C3H6)生产法,在生产过程中会有生成乙烯(C2H4)的副反应发生。反应如下:主反应:3C4H8(g)4C3H6(g);副反应:C4H8(g) 2C2H4(g)。测得上述两反应的平衡体系中,各组分的质量分数(w)随温度(T)和压强(p)变化的趋势分别如图1和图2所示:
平衡体系中的C3H6(g)和C2H4(g)的质量比是工业生产C3H6(g)时选择反应条件的重要依据之一,从产物的纯度考虑,该数值越高越好,据图1和图2判断,反应条件应选择下列中的___________(填序号)。
A.300℃、0.1MPa B.700°C、0.1MPa
C.300℃、0.5MPa D.700℃、0.5MPa
20.甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+ H2O(g) CO2(g)+ 3H2(g) △H>0。
(1)在一定条件下,向体积为2L的恒容密闭容器中充入1mol CH3OH(g)和3mol H2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示的该反应的速率为 。
(2)上述可逆反应达到平衡状态的依据是(填序号) 。
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1mol CH3OH(g)和2mol H2O(g),向B容器中充入1.2mol CH3OH(g)和2.4mol H2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL。
试回答:
①反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH的转化率为 ,A、B两容器中H2O(g)的体积百分含量的大小关系为B A(填“>”“<”或“=”)。
②若打开K,一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(4)工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 平衡常数 温度 / ℃
500 800
①2H2(g)+CO(g) CH3OH(g) K1 2.5 0.15
②H2(g)+CO2(g) H2O (g)+CO(g) K2 1.0 2.50
③3H2(g)+CO2(g) CH3OH(g)+H2O (g) K3
根据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。若500℃时测得反应③在某时刻H2(g)、CO2(g) 、CH3OH(g)、H2O (g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正 v逆(填“<”“=”或“>”)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.由图可知,x点尚未平衡,此压强下B的百分含量比X点时的要大,则体系处于从正反应建立平衡的过程中,则X点的正反应速率大于逆反应速率,故A错误;
B.该反应是气体体积不变的反应,由图可知,t1时刻条件改变时,正、逆反应速率增大,但依然相等,说明平衡不移动,则改变的条件可能是催化剂,也可能是增大压强,故B错误;
C.由图可知,M点时A的百分含量最低,说明M点反应达到平衡,M点前为平衡的形成过程,M点后为平衡移动过程,由M点后,温度升高,A的百分含量增大可知,平衡向逆反应方向移动,该反应为放热反应,ΔH<0,故C正确;
D.图中的阴影部分面积表示反应物浓度和生成物浓度的改变值的差值,即是(v正-v逆)t,故D错误;
故选C。
2.C
【详解】A.由题图可知,温度下先达到平衡,温度下的速率快,所以>,温度越高越有利于平衡正向移动生成一氧化碳,该反应的正方向,A正确;
B.时,的平衡转化率,由化学方程式知反应掉的和生成的CO的量一样多,生成的CO的量为1.0mol,所以,B正确;
C.时,平衡时,若改为恒温恒压容器,由于该反应是气体体积增大的反应,相当于在原来基础上降低压强,平衡正向移动,因此平衡时,,C错误;
D.达平衡后再充入,平衡正向移动,水的转化率提高,但不能提高的转化率,D正确;
故选C。
3.C
【详解】A.(HI)=0.025mol L-1 min-1,故A错误;
B.由题可列三段式
密闭容器体积为10L,计算可得K==1.44,故B错误;
C.其他条件不变,若降温到T0,达到平衡时平衡常数增大,与时状态相比平衡正向移动,正反应为放热反应,因此ΔH<0,故C正确;
D.通入氢气后,再次达到平衡时,氢气的浓度增大,故D错误。
故答案为:C。
4.B
【详解】A.根据离子方程式:2FeS2+7O2+2H2O=2Fe2++4+4H+,找出关系式:2FeS2~7O2~7×22.4L;则0.05molFeS2消耗的氧气为:0.05mol××22.4L mol-1=3.92L,故A正确;
B.b过程是向含有Fe2+的溶液中通入O2,Fe2+遇O2会生成Fe3+,含Fe2+、Fe3+的溶液KSCN溶液直接生成红色溶液,所以含Fe2+、Fe3+的溶液不能用KSCN溶液来检验所含的Fe2+,故B错误;
C.根据箭头方向找出反应物:Fe3+、FeS2和生成物:Fe2+、;根据电子转移守恒和质量守恒写出正确的离子方程式为:14Fe3++FeS2+8H2O═15Fe2++2+16H+,故C正确;
D.d的水解反应为吸热反应,升高温度,该可逆反应的正、逆反应速率增大,平衡正向移动,故D正确;
故选:B。
5.D
【详解】试题分析:在铂催化剂的作用下,NO、NO2将CO氧化为CO2,A项正确;将铂表面做成蜂窝状,增大了反应物的接触面积,有利于提高催化效果,B项正确;NO、NO2变成N2,氮元素的化合价降低,被还原,C项正确;催化剂只能改变化学反应速率而不能改变化学反应限度(即不能使化学平衡发生移动),故D项错误,答案选D。
考点:考查催化剂对反应速率的影响
点评:该题是基础性试题的考查,主要是考查学生对催化剂影响反应速率的熟悉了解程度,意在对学生基础知识的巩固和训练,难度不大。
6.A
【详解】A.A、B起始的物质的量之比为3:1,两者转化的物质的量之比也是3:1,则反应过程中A和B的转化率之比为1:1,故A正确;
B.改变浓度、温度等均能使该反应的平衡发生移动,因此能通过调控反应条件提高该反应的限度,故B错误;
C.化学平衡是动态平衡,则v(正)=v(逆)≠0,故C错误;
D.该反应前后混合气体的质量是变量,容器体积不变,根据可知,混合气体的密度也是变量,当混合气体的密度不再改变时,该反应一定达到平衡状态,故D错误;
答案选A。
7.B
【详解】A.由图可知,反应中V5+=O即是反应物,也是生成物,在反应中作催化剂,故A正确;
B.由图可知,反应中充入过量氧气,一氧化氮会被氧化生成二氧化氮,不利于一氧化氮转化为氮气,故B错误;
C.由图可知,反应中一氧化氮的氮元素化合价降低被还原生成氮气、氧元素化合价降低被还原生成水,一氧化氮和氧气都是反应的氧化剂,都体现了氧化性,故C正确;
D.由图可知,反应中一氧化氮和氧气都是反应的氧化剂,氨气是反应的还原剂,总反应方程式为4NH3+4NO+O24N2+6H2O,故D正确;
故选B。
8.D
【分析】
【详解】A.吸热反应、放热反应均可被利用,如燃烧为放热反应,C还原金属氧化物冶炼金属为吸热反应,故A错误;
B.当反应物总能量高于生成物总能量的时候,释放能量,该反应为放热反应,故B错误;
C.某些非自发进行的反应,改变温度可以满足△H T△S<0,反应也可进行,即改变条件(温度)也可发生,故C错误;
D.气体比固体的混乱度大,则同种物质在气态时熵值最大,固体时最小,故D正确;
故选D。
9.B
【详解】A.X、Y的起始投料比与化学计量数相同,因此在任意时刻二者的转化率都相同,A正确;
B.0 2min,v(X)==0.05mol/(L min),B错误;
C.该反应为气体体积不变的反应,因此混合气体的总物质的量始终不变,C正确;
D.Z 的体积分数不再变化时,说明Z的物质的量浓度也不再变化,反应已达平衡状态,D正确;
故选B。
10.C
【详解】A.加水不能改变水的浓度,对反应速率没有影响,故A错误;
B.Fe与浓硫酸会发生钝化,不能继续反应,故B错误;
C.用H2O2溶液制取O2时滴入少量FeCl3溶液,FeCl3可以催化H2O2的分解,加快反应速率,故C正确;
D.将Al粉改成Al片,减小了反应物的接触面积,所以能使反应速率减慢,故D错误;
故选C。
11.B
【详解】A.根据“先拐先平衡”这一原理可知,T1对应的曲线先平衡,又温度越高化学反应速率越快,故T2<T1,故A错;
B.由A分析可知T2<T1,所以温度越高化学反应速率越快,则M点的正反应速率大于W点的逆反应速率,而W点的逆反应速率大于N点的逆反应速率,故B正确;
C.T2下,在0~t1时间内,,故C错;
D.由于反应前后均为一种物质,因此M点时再加入一定量X,相当于增大压强,正反应为气体体积减小的反应,所以平衡正向移动,则平衡后X的转化率增大,故D错;
答案选B。
12.B
【详解】A.二氧化碳易溶于水,溶于水的二氧化碳部分与水反应生成碳酸,同时碳酸也能够分解生成二氧化碳和水,则两个反应为可逆反应,故A不符合题意;
B.电解水制得氢气和氧气的反应条件与氢气在氧气中燃烧的反应条件不同,则两个反应不是可逆反应,故B符合题意;
C.二氧化硫在催化剂、加热条件下反应生成三氧化硫,同时三氧化硫会分解生成二氧化硫和氧气,则两个反应为可逆反应,故C不符合题意;
D.氢气与碘单质生成生成碘化氢,同时碘化氢会分解生成氢气和单质碘,则两个反应为可逆反应,故D不符合题意;
故选B。
13.<
【分析】热化学方程式的反应热表示反应物完全转化为生成物时的能量变化,根据反应放出的热量,可计算出反应的反应物及产生的C的物质的量,最后根据物质的体积分数等于该物质的物质的量占总物质的量的百分比,再与比较判断。
【详解】热化学方程式2A(g)+B(g)2C(g) ΔH=-QkJ/mol表示2molA完全反应放出QkJ的能量,根据表格数据可知物质容器中参加反应的A的物质的量△n(A)=2mol×=1.5mol,则根据物质反应关系可知B反应的物质的量是△n(B)=△n(A)=0.75mol,反应产生C的物质的量为△n(C)=△n(A)=1.5mol,所以平衡时各种物质的物质的量n(A)=2mol-1.5mol=0.5mol,n(B)=1mol-0.75mol=0.25mol,n(C)=1.5mol,所以平衡时C的体积分数为×100%=。其他条件不变,因容器保持恒容绝热,随反应进行,容器的温度升高,升高温度,化学平衡向吸热的逆反应方向移动,导致C的物质的量减少,混合气体的物质的量增多,因此最终平衡C的体积分数小于。
【点睛】本题考查了化学平衡的有关计算。先假设反应在恒温条件下进行,按照物质转化关系计算出各种物质的平衡物质的量,计算C的体积分数,再根据反应的热效应,利用反应放热,平衡移动原理,分析平衡时总物质的量及C的物质的量,从而判断出C的含量与的大小关系。
14. 1.0×10-3 mol·L-1·min-1 3A(g)+B(g)2C(g) 4×104 AD
【详解】试题分析:(1)根据 计算反应速率;根据系数比等于物质的量变化计算方程式的系数;(2)根据反应方程式计算化学平衡常数;(3)根据图象,t1时刻不一定是平衡状态,t1—t2不一定是平衡移动,但速率加快;
解析:(1)根据 ,0至t1时间内C物质的平均反应速率为1.0×10-3 mol·L-1·min-1 ;A、B、C物质的量的变化分别是0.3mol、0.1mol、0.2mol,
根据系数比等于物质的量变化,方程式是3A(g)+B(g) 2C(g);(2)化学平衡常数 ;(3)根据图象,t1时刻不一定是平衡状态,t1—t2不一定是平衡移动,但速率加快;加入了催化剂,加快反应速率,故A正确;降低了反应温度,反应速率减慢,故B错误;向容器中充入了C,C的物质的量应该突变,而图象中C的你物质的量是渐变,故C错误;缩小了容器体积,加快反应速率,故D正确;
点睛:可逆化学反应达到平衡状态时生成物与反应物的浓度(方程式系数幂次方)乘积比是化学平衡常数。
15. 0.0035mol/L 放热
【详解】3s和4s时NO物质的量都为0.007mol,说明3s时反应已经达到平衡状态,即反应达到平衡时NO物质的量为0.007mol,NO物质的量浓度为=0.0035mol/L;升高温度,NO的浓度增大,说明升高温度平衡逆向移动,则逆反应为吸热反应,正反应为放热反应;故答案为:0.0035mol/L;放热。
16. 6/Vmol·L-1 4 /Vmol·L-1 66.67% 0.2/Vmol·L-1·min-1 22.22% 0.9 增大 增大 正向
【详解】(1)由题干知O2的转化量是2mol,SO2的转化量是4mol,SO3的转化量是4mol。SO2的起始浓度为6/V mol·L-1,SO3(g)的平衡浓度为4/V mol·L-1;(2)SO2的转化率为×100%=66.67%。v(O2)= =0.2/V mol·L-1·min-1;(3)平衡时SO3占总体积的百分数为×100%=22.22%。压强之比等于物质的量之比,=0.9;(4)达平衡后再加入2molSO2、12molO2和4molSO3(g),相当于增大压强,正、逆反应速率均增大,平衡正向移动。
17.(1) 减小逆向 6.75 ② a
(2) 负 NaClO D
【详解】(1)①在一定条件下,发生反应:CH4(g)+H2O(g)CO(g)+3H2(g) △H>0。在其它条件不变的情况下降低温度,正逆反应速率均减小。若此时向容器中同时加入1molCO和3molH2的混合气体(保持温度不变),相当于增大压强,由于正反应体积减小,则平衡将逆向移动移动,温度不变,平衡常数不变,由于通入2molCH4(g)和2molH2O(g),反应达平衡后,生成1molCO,根据方程式可知生成氢气是3mol,消耗甲烷和水蒸气是1mol,剩余甲烷和水蒸气均是1mol,容器容积是2L,则达到新平衡后平衡常数K=。
②a.再充入1molH2,平衡正向移动,甲醇的物质的量增加,CO的物质的量减少,则增大,a正确;
b.使用催化剂平衡不移动,则不变,b错误;
c.再充入2molCO,平衡正向移动,甲醇的物质的量增加,但CO的物质的量增加的更多,所以减小,c错误;
d.正反应放热,升高温度平衡逆向移动,减小,d错误;
答案选a;
(2)①为使Cl2被完全吸收制得有较强杀菌能力的消毒液,氯气应该在B电极处产生,因此A电极是阴极,则a电极为该装置的负极,与a电极相连的电极反应为,阴极产生氢氧化钠,氯气和氢氧化钠反应生成次氯酸钠,则该消毒液有效成分为NaClO;
②A.若通电后,B极表面有无色气泡产生,且溶液中产生大量的白色沉淀,较长时间不变色,说明B电极是阴极,溶液中氢离子放电产生氢气,因此A电极是阳极,则电源a是正极,A错误;
B.由于阴极水电离出的氢离子放电,同时产生氢氧根离子,则电解质溶液不一定是NaOH溶液,B错误;
C.阳极铁失去电子,必须是铁作阳极,阴极不一定是铁作电极,C错误;
D.B极是阴极,氢离子放电,所以电极附近溶液pH增大,D正确;
答案选D。
18.(1)Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2的转化率,从而节约大量能源
(2)1.6
【详解】(1)由题干图象信息可知,Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2的转化率,从而节约大量能源,故答案为:Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2的转化率,从而节约大量能源;
(2)工业上还可用Na2SO3溶液吸收烟气中的SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0mol/LNa2SO3溶液吸收纯净的SO2,当溶液中c(SO)降至0.2mol/L时,c(SO)减小了1.0mol/L-0.2mol/L=0.8mol/L,根据反应方程式可知,生成的c(HSO)=1.6mol/L,故此时溶液中c(HSO)约为1.6mol/L,故答案为:1.6。
19.(1) 碳碳双键
(2) 2 氯丙烷 7 BC
(3)7
(4)C
【详解】(1)乙烯分子中的官能团名称为碳碳双键;乙烯可以与水在催化剂作用下反应生成乙醇,则化学反应方程式为;故答案为:碳碳双键;。
(2)丙烯与HCl发生加成反应,产物之一等效氢原子只有2种,则该产物为,则该产物命名为2 氯丙烷;1mol丙烯含有1mol碳碳双键,则1mol丙烯与Cl2发生加成反应,最多可以消耗1molCl2.,得到的产物有6个氢原子,因此1mol又与6mol氯气发生取代反应,因此共7mol氯气反应;故答案为:2 氯丙烷;7;BC。
(3)根据乙烯中6个原子共平面,甲烷中三个原子共平面,单键可以旋转,因此丙烯分子中,最多有7个原子共平面;故答案为:7。
(4)根据题中信息,从产物的纯度考虑,该数值越高越好,说明乙烯杂质尽量小,则根据图1得到温度在300℃时乙烯质量分数最小,图2压强在0.5MPa时乙烯的百分含量最小,则反应条件应选择300℃、0.5MPa;故答案为:C。
20. 0.01mol/(L s) ③④ 75% < 1.75a K1·K2 >
【详解】(1)
根据压强比等于物质的量比分析,有,解x=0.2mol/L,则用甲醇表示该反应的速率为:=0.01mol/(L s)。
(2)①v正(CH3OH)=v正(CO2) ,都为正反应速率,不能说明到平衡;②容器不变,全是气体,所以混合气体的总质量不变,体积不变,密度始终不变,所以混合气体的密度不变不能说明反应到平衡;③反应前后气体的总物质的量不同,所以混合气体的平均相对分子质量不变说明反应到平衡;④CH3OH、H2O、CO2、H2的浓度都不再发生变化可以说明反应到平衡。故选③④;
(3)①反应达到平衡时容器B的体积为1.5aL,
根据在恒温恒压条件下,体积比等于物质的量比分析,有
解x=0.9mol,则容器B中CH3OH的转化率为 =75%,A为恒温恒容体系,随着反应进行体系内压强变大,结合反应方程式分析,压强增大,平衡逆向移动,水的百分含量增加,所以A、B两容器中H2O(g)的体积百分含量的大小关系为B②若打开K,一段时间后重新达到平衡,反应在恒压条件下达到平衡,根据恒温恒压条件下,起始加入物质的量比相同即可等效分析,设该反应到平衡时的体积为VL,则有,v=2.75aL,则容器B的体积为1.75a。
(4)根据反应①与②分析,,反应①+②=③,,则可推导出K3= K1·K2。即500℃时K3=2.5,若500℃时测得反应③在某时刻H2(g)、CO2(g) 、CH3OH(g)、H2O (g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则=0.29小于2.5,说明反应正向进行,即此时v正 >v逆。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列图示与对应的叙述相符的是
A.图一表示反应:mA(s)+nB(g)pC(g) △H>0,在一定温度下,平衡时B的百分含量(B%)随压强变化的关系如图所示,X点的正反应速率小于逆反应速率
B.图二是可逆反应:A(g)+B(s)C(s)+D(g) △H>0的速率时间图象,在t1时刻改变条件一定是加入催化剂
C.图三表示对于化学反应mA(g)+nB(g)pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的△H<0
D.图四所示图中的阴影部分面积的含义是(v正-v逆)
2.向体积为10L的恒容密闭容器中通入1.5mol和1.5mol制备,反应原理为。在不同温度(、)下测得容器中随时间的变化曲线如下图所示。
下列说法不正确的是
A.该反应的正方向
B.时,的平衡转化率
C.时,若改为恒温恒压容器,平衡时
D.达平衡后再充入,不能提高的转化率
3.温度为了时,将H2(g)和I2(g)各1.6mol充入10L恒容密闭容器中,发生反应H2(g)+I2(g)2HI(g),一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是
t/min 2 4 7 9
n(H2)/mol 1.2 1.1 1.0 1.0
A.0~4min的平均反应速率(HI)=0.25mol L-1 min-1
B.时,反应的平衡常数=1.2
C.其他条件不变,若降温到T0,达到平衡时,平衡常数K0=4,则此反应的ΔH<0
D.其他条件不变,9min后,向容器中再充入6molH2,平衡向正反应方向移动,再次达到平衡时,H2的浓度减小,I2的转化率增大
4.黄铁矿(主要成分FeS2),在空气中会被缓慢氧化,过程如图所示。下列说法不正确的是
A.发生反应a时,0.05molFeS2被氧化时消耗标准状况下氧气的体积大约3.92L
B.为了验证b过程反应后溶液中含Fe2+,可选用KSCN溶液和氯水
C.c发生反应的离子方程式为:
D.将d反应体系升高温度,该可逆反应的正、逆反应速率增大,平衡正向移动
5.2007年诺贝尔化学奖得主——德国科学家格哈德·埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究催生了汽车尾气净化装置。净化装置中的催化转化器可将CO、NO、NO2等转化为无害的物质。下列有关说法不正确的是( )
A.催化转化器中的铂催化剂可加快CO的氧化
B.铂表面做成蜂窝状更有利于提高催化效果
C.在铂催化下,NO、NO2可被CO还原成N2
D.使用铂催化剂,可以提高碳氢化合物被氧化的转化率
6.一定条件下,将3molA气体和1molB固体置于容积为2L的密闭容器中,发生反应: 3A(g)+B(s) C(g)+2D(g)。2min末该反应达到平衡,生成D的物质的量为0.8mol。下列判断正确的是
A.反应过程中A和B的转化率之比为1: 1
B.不能通过调控反应条件提高该反应的限度
C.从2min开始,v(正) =v(逆)=0
D.当混合气体的密度不再改变时,该反应不一定达到平衡状态
7.据文献报道,有氧条件下,NO在催化剂作用下可被NH3还原为N2,反应机理如图所示,下列说法错误的是
A.V5+=O在反应中作催化剂
B.充入过量O2的有利于NO转化为N2
C.该转化过程中,NO和O2都体现了氧化性
D.总反应方程式为:4NH3+4NO+O24N2+6H2O
8.下列说法正确的是
A.放热反应可以被人类利用,而吸热反应无利用价值
B.当反应物总能量高于生成物总能量的时候,反应可能放热也可能吸热
C.非自发进行的反应一定不能发生
D.同种物质在气态时熵值最大,固体时最小
9.已知反应。将和置于的密闭容器中,测得不同时间段内的转化率如表:
2 4 10 12
的转化率 20% 30% 50% 50%
下列说法中不正确的是
A.时,、的转化率相同
B.,
C.随着反应的进行,混合气体的总物质的量一直不变
D.的体积分数不再变化时,说明反应已达平衡状态
10.下列措施对增大反应速率明显有效的是
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C.用H2O2溶液制取O2时滴入少量FeCl3溶液
D.Al在氧气中燃烧生成Al2O3,将Al粉改成Al片
11.在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
A.由图可知:T2> T1
B.M点的正反应速率大于N点的逆反应速率
C.T2下,在0~t1时间内,v(Y)=mol L-1 min-1
D.M点时再加入一定量X,平衡后X的转化率减小
12.下列反应不是可逆反应的是
A.CO2+H2O=H2CO3和H2CO3=CO2+H2O
B.2H2O2H2↑+O2↑和2H2+O22H2O
C.2SO2+O2 2SO3和2SO3 2SO2+O2
D.H2+I2 2HI和2HIH2+I2
二、填空题
13.T℃时,体积为0.5L的恒容密闭容器中发生可逆反应:2A(g)+B(g)2C(g) ΔH=-QkJ·mol-1(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如表:
容器 起始时各物质的物质的量/mol 达到平衡时体系能量的变化
A B C
2 1 0 0.75Q kJ
其他条件不变,若容器保持恒容绝热,则达到平衡时C的体积分数 (填“<”、“=”或“>”)。
14.现将0.40 mol A气体和0.20 mol B气体充入10 L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图:
(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为 ;反应在t2时达到平衡,其化学方程式为 。
(2)该反应t2时刻反应化学平衡常数为K= 。
(3)据图中曲线变化情况分析,t1时刻改变的反应条件可能是 。
A.加入了催化剂 B.降低了反应温度
C.向容器中充入了C D.缩小了容器体积
15.在2 L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s 0 1 2 3 4
n(NO)/mol 0.020 0.01 0.008 0.007 0.007
800℃,反应达到平衡时,NO的物质的量浓度是 ;升高温度,NO的浓度增大,则该反应是 (填“放热”或“吸热”)反应。
16.在400℃,1.01X105Pa时,将SO2和14molO2 压入一个装有催化剂的VL密闭反应器中,发生2SO2+O22SO3的反应,并且在10min后达到平衡时,测得容器内有2molSO2和12molO2。
(1)SO2的起始浓度为 ,SO3(气)的平衡浓度为 ;
(2)SO2的转化率为 ,O2的平均反应速率为 ;
(3)平衡时SO3(气)占总体积的百分数为 ,此时体系压强为反应起始时体系压强的 倍;
(4)达平衡后再加入2molSO2、12molO2和4molSO3(气),此时正反应速率将 ,逆反应速率将 ,平衡 移动。
17.回答下列问题:
(1)在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是,在光照下可与反应,也可用和制备二甲醚和甲醇等新型燃料。
①在一定条件下,发生反应: △H>0。在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。若在2L密闭容器中发生反应,T℃时,通入2mol (g)和2mol (g),反应达平衡后,生成1mol CO,此时向容器中加入1mol CO和3mol 的混合气体(保持温度不变),则平衡将 移动(填“正向”、“逆向”或“不”)移动,达到新平衡后平衡常数K= 。
②(g)和(g)生成的CO和在一定条件下可发生如下反应: 。恒容条件下,下列措施中能使增大的有 (选填序号)。
a.再充入1mol b.使用催化剂 c.再充入2mol CO d.升高温度
(2)①学生甲想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和NaCl溶液,通电时,为使被完全吸收制得有较强杀菌能力的消毒液,设计了图的装置,a电极为该装置的 极,与a电极相连的电极反应为 ,该消毒液有效成分为 。
②极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的沉淀,受到学生甲制作家用环保型消毒液发生器的启发,学生乙认为,此装置也可以用于制备较为纯净的沉淀,若通电后,B极表面有无色气泡产生,且溶液中产生大量的白色沉淀,较长时间不变色。下列说法正确的是 。
A.电源a是负极 B.电解质溶液一定是NaOH溶液
C.A、B两端都必须用铁做电极 D.B极附近溶液pH增大
18.一定条件下,2CO(g)+SO2(g)2CO2(g)+S(l) △H。可实现燃煤烟气中硫的回收:
(1)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图所示。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑价格因素,选择Fe2O3的主要优点是 。
(2)工业上还可用Na2SO3溶液吸收烟气中的SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0mol/LNa2SO3溶液吸收纯净的SO2,当溶液中c(SO)降至0.2mol/L时,吸收能力显著下降,应更换吸收剂。此时溶液中c(HSO)约为 mol/L。
19.乙烯是衡量一个国家石油化工发展水平的标志性物质,以乙烯为原料,可以合成多种有机化合物。
(1)乙烯分子中的官能团名称为 ,乙烯可以与水反应,化学反应方程式为 。
(2)丙烯与HCl发生加成反应,产物之一等效氢原子只有2种,则该产物命名为 ;1mol丙烯与Cl2发生反应,最多可以消耗 molCl2.发生的反应类型是 (填选项)
A.加聚反应 B.加成反应 C.取代反应 D.氧化反应
(3)丙烯分子中,最多有 个原子共平面。
(4)“丁烯(C4H8)裂解法”是一种重要的丙烯(C3H6)生产法,在生产过程中会有生成乙烯(C2H4)的副反应发生。反应如下:主反应:3C4H8(g)4C3H6(g);副反应:C4H8(g) 2C2H4(g)。测得上述两反应的平衡体系中,各组分的质量分数(w)随温度(T)和压强(p)变化的趋势分别如图1和图2所示:
平衡体系中的C3H6(g)和C2H4(g)的质量比是工业生产C3H6(g)时选择反应条件的重要依据之一,从产物的纯度考虑,该数值越高越好,据图1和图2判断,反应条件应选择下列中的___________(填序号)。
A.300℃、0.1MPa B.700°C、0.1MPa
C.300℃、0.5MPa D.700℃、0.5MPa
20.甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+ H2O(g) CO2(g)+ 3H2(g) △H>0。
(1)在一定条件下,向体积为2L的恒容密闭容器中充入1mol CH3OH(g)和3mol H2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示的该反应的速率为 。
(2)上述可逆反应达到平衡状态的依据是(填序号) 。
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1mol CH3OH(g)和2mol H2O(g),向B容器中充入1.2mol CH3OH(g)和2.4mol H2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL。
试回答:
①反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH的转化率为 ,A、B两容器中H2O(g)的体积百分含量的大小关系为B A(填“>”“<”或“=”)。
②若打开K,一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(4)工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 平衡常数 温度 / ℃
500 800
①2H2(g)+CO(g) CH3OH(g) K1 2.5 0.15
②H2(g)+CO2(g) H2O (g)+CO(g) K2 1.0 2.50
③3H2(g)+CO2(g) CH3OH(g)+H2O (g) K3
根据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。若500℃时测得反应③在某时刻H2(g)、CO2(g) 、CH3OH(g)、H2O (g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正 v逆(填“<”“=”或“>”)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.由图可知,x点尚未平衡,此压强下B的百分含量比X点时的要大,则体系处于从正反应建立平衡的过程中,则X点的正反应速率大于逆反应速率,故A错误;
B.该反应是气体体积不变的反应,由图可知,t1时刻条件改变时,正、逆反应速率增大,但依然相等,说明平衡不移动,则改变的条件可能是催化剂,也可能是增大压强,故B错误;
C.由图可知,M点时A的百分含量最低,说明M点反应达到平衡,M点前为平衡的形成过程,M点后为平衡移动过程,由M点后,温度升高,A的百分含量增大可知,平衡向逆反应方向移动,该反应为放热反应,ΔH<0,故C正确;
D.图中的阴影部分面积表示反应物浓度和生成物浓度的改变值的差值,即是(v正-v逆)t,故D错误;
故选C。
2.C
【详解】A.由题图可知,温度下先达到平衡,温度下的速率快,所以>,温度越高越有利于平衡正向移动生成一氧化碳,该反应的正方向,A正确;
B.时,的平衡转化率,由化学方程式知反应掉的和生成的CO的量一样多,生成的CO的量为1.0mol,所以,B正确;
C.时,平衡时,若改为恒温恒压容器,由于该反应是气体体积增大的反应,相当于在原来基础上降低压强,平衡正向移动,因此平衡时,,C错误;
D.达平衡后再充入,平衡正向移动,水的转化率提高,但不能提高的转化率,D正确;
故选C。
3.C
【详解】A.(HI)=0.025mol L-1 min-1,故A错误;
B.由题可列三段式
密闭容器体积为10L,计算可得K==1.44,故B错误;
C.其他条件不变,若降温到T0,达到平衡时平衡常数增大,与时状态相比平衡正向移动,正反应为放热反应,因此ΔH<0,故C正确;
D.通入氢气后,再次达到平衡时,氢气的浓度增大,故D错误。
故答案为:C。
4.B
【详解】A.根据离子方程式:2FeS2+7O2+2H2O=2Fe2++4+4H+,找出关系式:2FeS2~7O2~7×22.4L;则0.05molFeS2消耗的氧气为:0.05mol××22.4L mol-1=3.92L,故A正确;
B.b过程是向含有Fe2+的溶液中通入O2,Fe2+遇O2会生成Fe3+,含Fe2+、Fe3+的溶液KSCN溶液直接生成红色溶液,所以含Fe2+、Fe3+的溶液不能用KSCN溶液来检验所含的Fe2+,故B错误;
C.根据箭头方向找出反应物:Fe3+、FeS2和生成物:Fe2+、;根据电子转移守恒和质量守恒写出正确的离子方程式为:14Fe3++FeS2+8H2O═15Fe2++2+16H+,故C正确;
D.d的水解反应为吸热反应,升高温度,该可逆反应的正、逆反应速率增大,平衡正向移动,故D正确;
故选:B。
5.D
【详解】试题分析:在铂催化剂的作用下,NO、NO2将CO氧化为CO2,A项正确;将铂表面做成蜂窝状,增大了反应物的接触面积,有利于提高催化效果,B项正确;NO、NO2变成N2,氮元素的化合价降低,被还原,C项正确;催化剂只能改变化学反应速率而不能改变化学反应限度(即不能使化学平衡发生移动),故D项错误,答案选D。
考点:考查催化剂对反应速率的影响
点评:该题是基础性试题的考查,主要是考查学生对催化剂影响反应速率的熟悉了解程度,意在对学生基础知识的巩固和训练,难度不大。
6.A
【详解】A.A、B起始的物质的量之比为3:1,两者转化的物质的量之比也是3:1,则反应过程中A和B的转化率之比为1:1,故A正确;
B.改变浓度、温度等均能使该反应的平衡发生移动,因此能通过调控反应条件提高该反应的限度,故B错误;
C.化学平衡是动态平衡,则v(正)=v(逆)≠0,故C错误;
D.该反应前后混合气体的质量是变量,容器体积不变,根据可知,混合气体的密度也是变量,当混合气体的密度不再改变时,该反应一定达到平衡状态,故D错误;
答案选A。
7.B
【详解】A.由图可知,反应中V5+=O即是反应物,也是生成物,在反应中作催化剂,故A正确;
B.由图可知,反应中充入过量氧气,一氧化氮会被氧化生成二氧化氮,不利于一氧化氮转化为氮气,故B错误;
C.由图可知,反应中一氧化氮的氮元素化合价降低被还原生成氮气、氧元素化合价降低被还原生成水,一氧化氮和氧气都是反应的氧化剂,都体现了氧化性,故C正确;
D.由图可知,反应中一氧化氮和氧气都是反应的氧化剂,氨气是反应的还原剂,总反应方程式为4NH3+4NO+O24N2+6H2O,故D正确;
故选B。
8.D
【分析】
【详解】A.吸热反应、放热反应均可被利用,如燃烧为放热反应,C还原金属氧化物冶炼金属为吸热反应,故A错误;
B.当反应物总能量高于生成物总能量的时候,释放能量,该反应为放热反应,故B错误;
C.某些非自发进行的反应,改变温度可以满足△H T△S<0,反应也可进行,即改变条件(温度)也可发生,故C错误;
D.气体比固体的混乱度大,则同种物质在气态时熵值最大,固体时最小,故D正确;
故选D。
9.B
【详解】A.X、Y的起始投料比与化学计量数相同,因此在任意时刻二者的转化率都相同,A正确;
B.0 2min,v(X)==0.05mol/(L min),B错误;
C.该反应为气体体积不变的反应,因此混合气体的总物质的量始终不变,C正确;
D.Z 的体积分数不再变化时,说明Z的物质的量浓度也不再变化,反应已达平衡状态,D正确;
故选B。
10.C
【详解】A.加水不能改变水的浓度,对反应速率没有影响,故A错误;
B.Fe与浓硫酸会发生钝化,不能继续反应,故B错误;
C.用H2O2溶液制取O2时滴入少量FeCl3溶液,FeCl3可以催化H2O2的分解,加快反应速率,故C正确;
D.将Al粉改成Al片,减小了反应物的接触面积,所以能使反应速率减慢,故D错误;
故选C。
11.B
【详解】A.根据“先拐先平衡”这一原理可知,T1对应的曲线先平衡,又温度越高化学反应速率越快,故T2<T1,故A错;
B.由A分析可知T2<T1,所以温度越高化学反应速率越快,则M点的正反应速率大于W点的逆反应速率,而W点的逆反应速率大于N点的逆反应速率,故B正确;
C.T2下,在0~t1时间内,,故C错;
D.由于反应前后均为一种物质,因此M点时再加入一定量X,相当于增大压强,正反应为气体体积减小的反应,所以平衡正向移动,则平衡后X的转化率增大,故D错;
答案选B。
12.B
【详解】A.二氧化碳易溶于水,溶于水的二氧化碳部分与水反应生成碳酸,同时碳酸也能够分解生成二氧化碳和水,则两个反应为可逆反应,故A不符合题意;
B.电解水制得氢气和氧气的反应条件与氢气在氧气中燃烧的反应条件不同,则两个反应不是可逆反应,故B符合题意;
C.二氧化硫在催化剂、加热条件下反应生成三氧化硫,同时三氧化硫会分解生成二氧化硫和氧气,则两个反应为可逆反应,故C不符合题意;
D.氢气与碘单质生成生成碘化氢,同时碘化氢会分解生成氢气和单质碘,则两个反应为可逆反应,故D不符合题意;
故选B。
13.<
【分析】热化学方程式的反应热表示反应物完全转化为生成物时的能量变化,根据反应放出的热量,可计算出反应的反应物及产生的C的物质的量,最后根据物质的体积分数等于该物质的物质的量占总物质的量的百分比,再与比较判断。
【详解】热化学方程式2A(g)+B(g)2C(g) ΔH=-QkJ/mol表示2molA完全反应放出QkJ的能量,根据表格数据可知物质容器中参加反应的A的物质的量△n(A)=2mol×=1.5mol,则根据物质反应关系可知B反应的物质的量是△n(B)=△n(A)=0.75mol,反应产生C的物质的量为△n(C)=△n(A)=1.5mol,所以平衡时各种物质的物质的量n(A)=2mol-1.5mol=0.5mol,n(B)=1mol-0.75mol=0.25mol,n(C)=1.5mol,所以平衡时C的体积分数为×100%=。其他条件不变,因容器保持恒容绝热,随反应进行,容器的温度升高,升高温度,化学平衡向吸热的逆反应方向移动,导致C的物质的量减少,混合气体的物质的量增多,因此最终平衡C的体积分数小于。
【点睛】本题考查了化学平衡的有关计算。先假设反应在恒温条件下进行,按照物质转化关系计算出各种物质的平衡物质的量,计算C的体积分数,再根据反应的热效应,利用反应放热,平衡移动原理,分析平衡时总物质的量及C的物质的量,从而判断出C的含量与的大小关系。
14. 1.0×10-3 mol·L-1·min-1 3A(g)+B(g)2C(g) 4×104 AD
【详解】试题分析:(1)根据 计算反应速率;根据系数比等于物质的量变化计算方程式的系数;(2)根据反应方程式计算化学平衡常数;(3)根据图象,t1时刻不一定是平衡状态,t1—t2不一定是平衡移动,但速率加快;
解析:(1)根据 ,0至t1时间内C物质的平均反应速率为1.0×10-3 mol·L-1·min-1 ;A、B、C物质的量的变化分别是0.3mol、0.1mol、0.2mol,
根据系数比等于物质的量变化,方程式是3A(g)+B(g) 2C(g);(2)化学平衡常数 ;(3)根据图象,t1时刻不一定是平衡状态,t1—t2不一定是平衡移动,但速率加快;加入了催化剂,加快反应速率,故A正确;降低了反应温度,反应速率减慢,故B错误;向容器中充入了C,C的物质的量应该突变,而图象中C的你物质的量是渐变,故C错误;缩小了容器体积,加快反应速率,故D正确;
点睛:可逆化学反应达到平衡状态时生成物与反应物的浓度(方程式系数幂次方)乘积比是化学平衡常数。
15. 0.0035mol/L 放热
【详解】3s和4s时NO物质的量都为0.007mol,说明3s时反应已经达到平衡状态,即反应达到平衡时NO物质的量为0.007mol,NO物质的量浓度为=0.0035mol/L;升高温度,NO的浓度增大,说明升高温度平衡逆向移动,则逆反应为吸热反应,正反应为放热反应;故答案为:0.0035mol/L;放热。
16. 6/Vmol·L-1 4 /Vmol·L-1 66.67% 0.2/Vmol·L-1·min-1 22.22% 0.9 增大 增大 正向
【详解】(1)由题干知O2的转化量是2mol,SO2的转化量是4mol,SO3的转化量是4mol。SO2的起始浓度为6/V mol·L-1,SO3(g)的平衡浓度为4/V mol·L-1;(2)SO2的转化率为×100%=66.67%。v(O2)= =0.2/V mol·L-1·min-1;(3)平衡时SO3占总体积的百分数为×100%=22.22%。压强之比等于物质的量之比,=0.9;(4)达平衡后再加入2molSO2、12molO2和4molSO3(g),相当于增大压强,正、逆反应速率均增大,平衡正向移动。
17.(1) 减小逆向 6.75 ② a
(2) 负 NaClO D
【详解】(1)①在一定条件下,发生反应:CH4(g)+H2O(g)CO(g)+3H2(g) △H>0。在其它条件不变的情况下降低温度,正逆反应速率均减小。若此时向容器中同时加入1molCO和3molH2的混合气体(保持温度不变),相当于增大压强,由于正反应体积减小,则平衡将逆向移动移动,温度不变,平衡常数不变,由于通入2molCH4(g)和2molH2O(g),反应达平衡后,生成1molCO,根据方程式可知生成氢气是3mol,消耗甲烷和水蒸气是1mol,剩余甲烷和水蒸气均是1mol,容器容积是2L,则达到新平衡后平衡常数K=。
②a.再充入1molH2,平衡正向移动,甲醇的物质的量增加,CO的物质的量减少,则增大,a正确;
b.使用催化剂平衡不移动,则不变,b错误;
c.再充入2molCO,平衡正向移动,甲醇的物质的量增加,但CO的物质的量增加的更多,所以减小,c错误;
d.正反应放热,升高温度平衡逆向移动,减小,d错误;
答案选a;
(2)①为使Cl2被完全吸收制得有较强杀菌能力的消毒液,氯气应该在B电极处产生,因此A电极是阴极,则a电极为该装置的负极,与a电极相连的电极反应为,阴极产生氢氧化钠,氯气和氢氧化钠反应生成次氯酸钠,则该消毒液有效成分为NaClO;
②A.若通电后,B极表面有无色气泡产生,且溶液中产生大量的白色沉淀,较长时间不变色,说明B电极是阴极,溶液中氢离子放电产生氢气,因此A电极是阳极,则电源a是正极,A错误;
B.由于阴极水电离出的氢离子放电,同时产生氢氧根离子,则电解质溶液不一定是NaOH溶液,B错误;
C.阳极铁失去电子,必须是铁作阳极,阴极不一定是铁作电极,C错误;
D.B极是阴极,氢离子放电,所以电极附近溶液pH增大,D正确;
答案选D。
18.(1)Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2的转化率,从而节约大量能源
(2)1.6
【详解】(1)由题干图象信息可知,Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2的转化率,从而节约大量能源,故答案为:Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2的转化率,从而节约大量能源;
(2)工业上还可用Na2SO3溶液吸收烟气中的SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0mol/LNa2SO3溶液吸收纯净的SO2,当溶液中c(SO)降至0.2mol/L时,c(SO)减小了1.0mol/L-0.2mol/L=0.8mol/L,根据反应方程式可知,生成的c(HSO)=1.6mol/L,故此时溶液中c(HSO)约为1.6mol/L,故答案为:1.6。
19.(1) 碳碳双键
(2) 2 氯丙烷 7 BC
(3)7
(4)C
【详解】(1)乙烯分子中的官能团名称为碳碳双键;乙烯可以与水在催化剂作用下反应生成乙醇,则化学反应方程式为;故答案为:碳碳双键;。
(2)丙烯与HCl发生加成反应,产物之一等效氢原子只有2种,则该产物为,则该产物命名为2 氯丙烷;1mol丙烯含有1mol碳碳双键,则1mol丙烯与Cl2发生加成反应,最多可以消耗1molCl2.,得到的产物有6个氢原子,因此1mol又与6mol氯气发生取代反应,因此共7mol氯气反应;故答案为:2 氯丙烷;7;BC。
(3)根据乙烯中6个原子共平面,甲烷中三个原子共平面,单键可以旋转,因此丙烯分子中,最多有7个原子共平面;故答案为:7。
(4)根据题中信息,从产物的纯度考虑,该数值越高越好,说明乙烯杂质尽量小,则根据图1得到温度在300℃时乙烯质量分数最小,图2压强在0.5MPa时乙烯的百分含量最小,则反应条件应选择300℃、0.5MPa;故答案为:C。
20. 0.01mol/(L s) ③④ 75% < 1.75a K1·K2 >
【详解】(1)
根据压强比等于物质的量比分析,有,解x=0.2mol/L,则用甲醇表示该反应的速率为:=0.01mol/(L s)。
(2)①v正(CH3OH)=v正(CO2) ,都为正反应速率,不能说明到平衡;②容器不变,全是气体,所以混合气体的总质量不变,体积不变,密度始终不变,所以混合气体的密度不变不能说明反应到平衡;③反应前后气体的总物质的量不同,所以混合气体的平均相对分子质量不变说明反应到平衡;④CH3OH、H2O、CO2、H2的浓度都不再发生变化可以说明反应到平衡。故选③④;
(3)①反应达到平衡时容器B的体积为1.5aL,
根据在恒温恒压条件下,体积比等于物质的量比分析,有
解x=0.9mol,则容器B中CH3OH的转化率为 =75%,A为恒温恒容体系,随着反应进行体系内压强变大,结合反应方程式分析,压强增大,平衡逆向移动,水的百分含量增加,所以A、B两容器中H2O(g)的体积百分含量的大小关系为B
(4)根据反应①与②分析,,反应①+②=③,,则可推导出K3= K1·K2。即500℃时K3=2.5,若500℃时测得反应③在某时刻H2(g)、CO2(g) 、CH3OH(g)、H2O (g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则=0.29小于2.5,说明反应正向进行,即此时v正 >v逆。
答案第1页,共2页
答案第1页,共2页
