专题2《研究物质的基本方法》检测题2023---2024学年上学期苏教版(2019)高一化学必修第一册
文档属性
| 名称 | 专题2《研究物质的基本方法》检测题2023---2024学年上学期苏教版(2019)高一化学必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 774.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-24 13:39:10 | ||
图片预览


文档简介
专题2《研究物质的基本方法》检测题
一、单选题
1.进行化学实验时必须要有安全意识,下列做法错误的是
A.加热试管或烧杯时,应首先擦干外壁上的水
B.不慎将浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后再涂硼酸溶液
C.温度计摔坏导致水银散落到地面上,应立即用水冲洗水银
D.酒精及其它易燃有机物小面积失火,应迅速用湿抹布扑灭,烫伤(灼伤)要就医
2.某兴趣小组要配制物质的最浓度为0.1mol/L的NaCl溶液,下列装置中不需要使用的是
A. B. C. D.
3.在配制一定物质的量浓度溶液的过程中,下列有关说法正确的是
A.配制一定物质的量浓度的溶液时,必须使用的仪器有烧杯、玻璃棒、天平、容量瓶
B.配制980mL 0.2的溶液,需准确称量胆矾50.0g
C.配制一定浓度的NaOH溶液时,待NaOH固体全部溶解后,立即转移到容量瓶中
D.定容并摇匀后,发现凹液面低于刻度线,需补充滴加蒸馏水至刻度线为止
4.过氧化钙晶体(CaO2·8H2O)常用作医药消毒剂,以轻质碳酸钙为原料,按如下方法制备:
轻质CaCO3CaCl2溶液白色晶体目标产物
下列说法错误的是
A.步骤①,煮沸可以除去溶解的CO2、HCl
B.步骤②,H2O2作氧化剂、氨水用以调节溶液的pH
C.步骤①②,过滤时若用玻璃棒搅动,可能会导致滤纸破损
D.步骤③,醇洗可减少晶体损失且加速晶体干燥
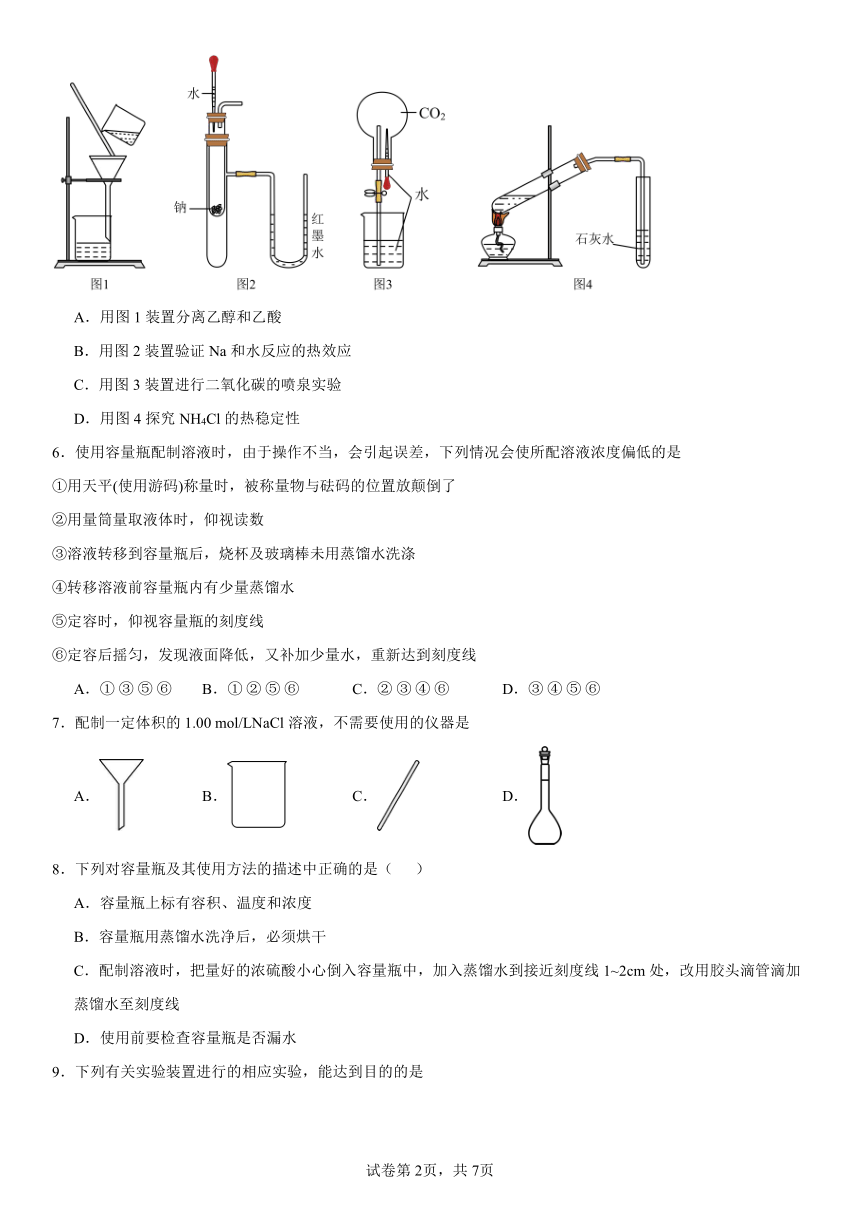
5.用下列实验装置进行相应实验,能达到实验目的的是()
A.用图1装置分离乙醇和乙酸
B.用图2装置验证Na和水反应的热效应
C.用图3装置进行二氧化碳的喷泉实验
D.用图4探究NH4Cl的热稳定性
6.使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②用量筒量取液体时,仰视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.① ③ ⑤ ⑥ B.① ② ⑤ ⑥ C.② ③ ④ ⑥ D.③ ④ ⑤ ⑥
7.配制一定体积的1.00 mol/LNaCl溶液,不需要使用的仪器是
A. B. C. D.
8.下列对容量瓶及其使用方法的描述中正确的是( )
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后,必须烘干
C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2cm处,改用胶头滴管滴加蒸馏水至刻度线
D.使用前要检查容量瓶是否漏水
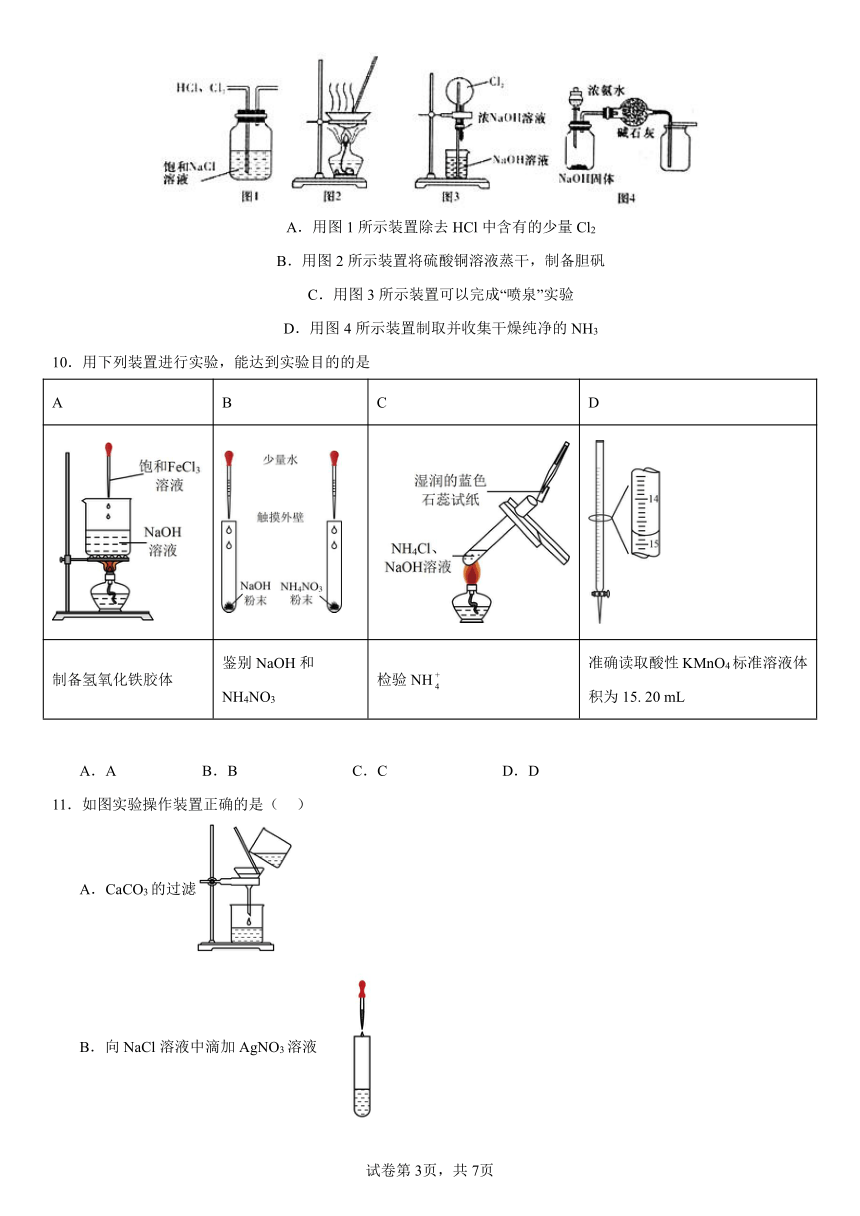
9.下列有关实验装置进行的相应实验,能达到目的的是
A.用图1所示装置除去HCl中含有的少量Cl2
B.用图2所示装置将硫酸铜溶液蒸干,制备胆矾
C.用图3所示装置可以完成“喷泉”实验
D.用图4所示装置制取并收集干燥纯净的NH3
10.用下列装置进行实验,能达到实验目的的是
A B C D
制备氢氧化铁胶体 鉴别NaOH和NH4NO3 检验NH 准确读取酸性KMnO4标准溶液体积为15. 20 mL
A.A B.B C.C D.D
11.如图实验操作装置正确的是( )
A.CaCO3的过滤
B.向NaCl溶液中滴加AgNO3溶液
C.39%的乙醇溶液中得到无水乙醇
D.蒸发的方法
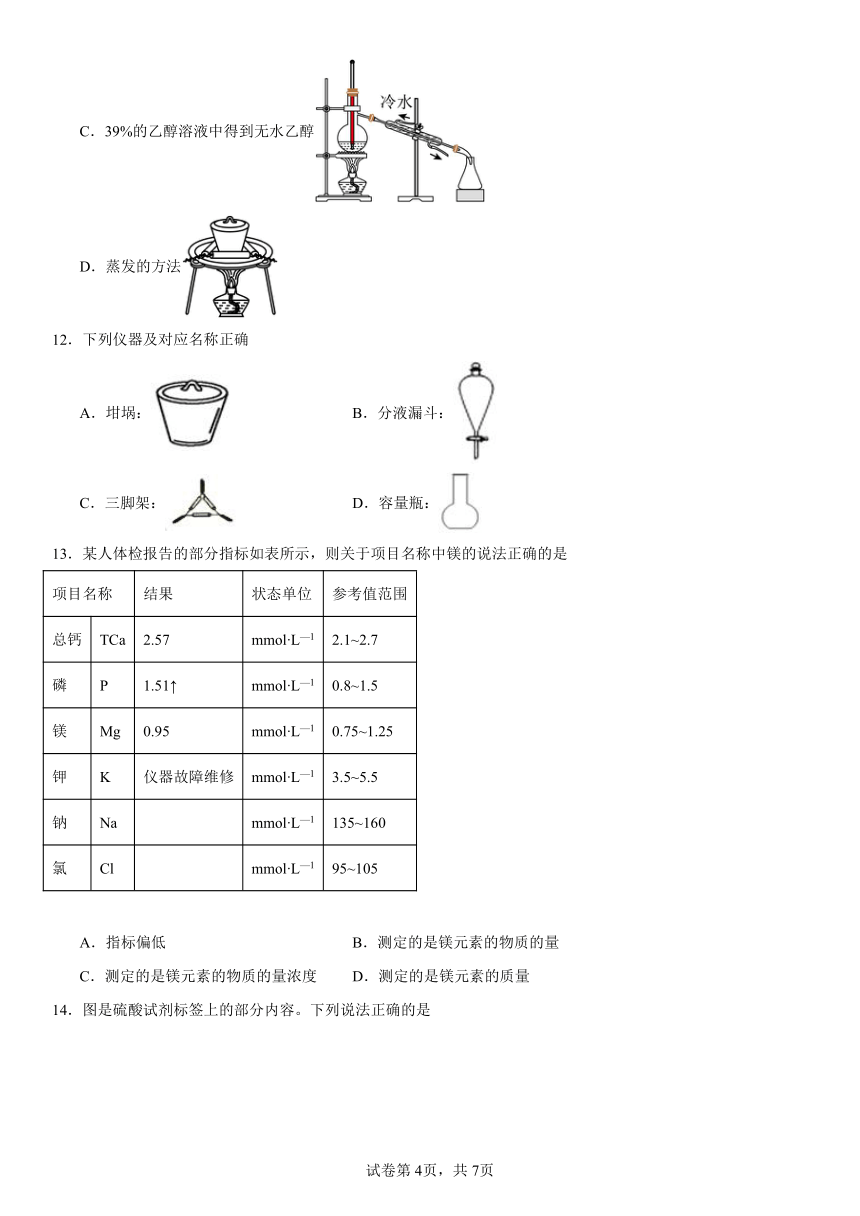
12.下列仪器及对应名称正确
A.坩埚: B.分液漏斗:
C.三脚架: D.容量瓶:
13.某人体检报告的部分指标如表所示,则关于项目名称中镁的说法正确的是
项目名称 结果 状态单位 参考值范围
总钙 TCa 2.57 mmol L—1 2.1~2.7
磷 P 1.51↑ mmol L—1 0.8~1.5
镁 Mg 0.95 mmol L—1 0.75~1.25
钾 K 仪器故障维修 mmol L—1 3.5~5.5
钠 Na mmol L—1 135~160
氯 Cl mmol L—1 95~105
A.指标偏低 B.测定的是镁元素的物质的量
C.测定的是镁元素的物质的量浓度 D.测定的是镁元素的质量
14.图是硫酸试剂标签上的部分内容。下列说法正确的是
A.该硫酸的物质的量浓度为9.2 mol/L
B.1mol锌与足量的该硫酸反应产生2g氢气
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2 mol/L
二、填空题
15.将固体溶于水配成溶液,其密度为。
(1)该溶液中的物质的量浓度为 。
(2)该溶液中的质量分数为 。
(3)从该溶液中取出,其中的物质的量浓度为 ,含的物质的量为 。
(4)将取出的溶液加水稀释,稀释后溶液中的物质的量浓度为,稀释后溶液体积为 。
16.按要求完成下列填空:
(1)现有标准状况下CO和CO2混合气体8.96L,其质量为16g,则此混合气体中,CO与CO2的体积之比是 ,氧原子的个数是 。
(2)将10.6g Na2CO3溶于水配成1L溶液,向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.4 mol/L(假设溶液体积不变),需加入NaCl的质量为 ;Cl-的物质的量浓度为 。
(3)将4g NaOH溶于 g水中,可使溶液中H2O与Na+的物质的量之比等于20∶1,若测得该溶液的密度为1.1g/cm-3,溶液中c(Na+)为 。
17.(1)在VL Al2(SO4)3溶液中,含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为
(2)有以下物质:①AgCl;②CCl4;③医用酒精;④液氧;⑤二氧化碳;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧食醋;⑨氧化钠固体;⑩氯化氢气体。其中属于电解质的是 (填序号,下同);属于非电解质的是
(3)实验室简单模拟从海水中提取溴单质的部分流程如图
实验操作②的名称 ,操作①中要用到的玻璃仪器 、
18.已知单质碘受热易升华(固体变为气体)。可用于分离或提纯物质的方法有:
A.过滤B.加热升华C.加热分解D.洗气法
下列各组混合物的分离或提纯应选用上述哪种方法最合适(填对应字母)?
(1)除去Ca(OH)2溶液中悬浮的CaCO3颗粒: 。
(2)除去O2中少量的水蒸气: 。
(3)除去固体碘中混有的少量NaI: 。
(4)除去氧化钙中的CaCO3: 。
19.某工厂从废含镍有机催化剂中回收镍的工艺流程如图所示(已知废催化剂中含有Ni 70.0%及一定量的Al、Fe、SiO2和有机物,镍及其化合物的化学性质与铁的类似,但Ni2+的性质较稳定)。回答下列问题:
已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示。
沉淀物 Al(OH)3 Fe(OH)3 Fe(OH)2 Ni(OH)2
pH 5.2 3.2 9.7 9.2
用乙醇洗涤废催化剂的目的是
20.装置A用于制备乙烯,仪器a的名称为 。
21.对于混合物的分离和提纯,常采用的方法有:①过滤、②蒸发结晶、③蒸馏、④萃取、⑤分液、⑥加热分解、⑦洗气等方法,用该方法前的序号完成下列填空:
(1)从溴水中提取溴单质,可用 的方法。
(2)除去H2中的CO2,可用 的方法除去。
(3)除去氧化钙中的碳酸钙,可用 的方法。
(4)分离沸点相差较大的液体混合物,可用 的方法。
22.工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
(1)金属M为 ,操作1为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)由CoC2O4·2H2O转化为Co2O3的化学方程式是 。
(4)知Li2CO3微溶于水,且水溶液呈碱性。其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是 ,在常温条件下,饱和Li2CO3 溶液中离子浓度由大到小的排列顺序为 。
温度/℃ 10 30 60 90
浓度/mol L-1 0.21 0.17 0.14 0.10
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A正确,防止试管炸裂;
B正确,不慎将浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后再涂硼酸溶液;
C错,温度计摔坏导致水银散落到地面上,应立即用硫粉处理;
D正确,小面积失火,应迅速用湿抹布扑灭,烫伤(灼伤)要就医;
2.D
【详解】配制0.1mol/L的氯化钠溶液需要用到的仪器有托盘天平、烧杯、玻璃棒、容量瓶和胶头滴管,用不到分液漏斗,故选D。
3.B
【详解】A.配制一定物质的量浓度的溶液时,必须使用的仪器有烧杯、玻璃棒、容量瓶、胶头滴管等,如果用固体溶质配制溶液,需要用天平称量固体的质量,若用液体溶质或浓溶液配制稀溶液,则不需要天平,需要的是量筒,故A错误;
B.实验室没有980mL的容量瓶,配制980mL0.2mol L 1 的 CuSO4 溶液时,需要用1000mL的容量瓶,称量胆矾 (CuSO4 5H2O)的质量为 1L×0.2mol L 1 ×250g/mol=50.0g,故B正确;
C.NaOH溶于水放热,配制一定浓度的 NaOH 溶液时,待 NaOH 固体全部溶解后,要等溶液冷却后才能将溶液转移到容量瓶中,否则会带来误差,故C错误;
D.摇匀时,由于溶液会残留在容量瓶刻度线上方的内壁以及瓶塞部位,所以凹液面会低于刻度线,不能再滴加蒸馏水至刻度线,这样做会使溶液体积偏大,导致溶液浓度降低,故D错误;
故选B。
4.B
【解析】由制备流程图可知,碳酸钙与盐酸反应,加热煮沸是为了除去多余的盐酸和溶解的少量二氧化碳,滤液含氯化钙,加入氨水和双氧水在冰浴条件下发生反应CaCl2+H2O2+2NH3·H2OCaO2·8H2O+2NH4Cl,过滤得到白色晶体,最后洗涤得目标产物。
【详解】A.步骤①碳酸钙与盐酸反应,生成氯化钙、二氧化碳和水,煮沸可以除去溶解的CO2、HCl,故A正确;
B.步骤②,向滤液氯化钙溶液中加入氨水和双氧水在冰浴条件下发生反应CaCl2+H2O2+2NH3·H2OCaO2·8H2O+2NH4Cl,反应中各元素化合价没有发生变化,此反应不是氧化还原反应,故B错误;
C.步骤①②,过滤时若用玻璃捧搅动,可能会导致滤纸破损,故C正确;
D.过氧化钙晶体微溶于水,不溶于乙醇,醇洗可减少晶体损失且加速晶体干燥,故D正确;
故答案为B。
5.B
【详解】A.图1装置是过滤装置,分离液体和不溶于液体的固体混合物,分离乙醇和乙酸可用蒸馏,故A错误;
B.Na和水反应,产生的热量使大试管中的空气体积发生变化,U形管两边的液面高度差发生变化,可用图2装置验证Na和水反应的热效应,故B正确;
C.二氧化碳在水中溶解度不大,不能用图3装置进行二氧化碳的喷泉实验,故C错误;
D.用图4探究NH4Cl的热稳定性,加热固体时,大试管口应向下倾斜,故D错误;
故选B。
6.A
【详解】①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了,实际称量药品的质量减小,所配溶液难度偏低,故①符合;
②用量筒量取液体时,仰视读数,量取溶液体积偏大,所配溶液浓度偏高,故②不符合;
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤,移入容量瓶中溶质的物质的量偏小,所配溶液浓度偏低,故③符合;
④配制需加水定容,转移溶液前容量瓶内有少量蒸馏水,对所配溶液无影响,故④不符合;
⑤定容时,仰视容量瓶的刻度线,所配溶液体积偏大,溶液浓度偏低,故⑤符合;
⑥摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所配溶液浓度偏小,故⑥符合;
所以①③⑤⑥符合;
故选:A。
【点睛】分析操作对溶质的物质的量或溶液的体积的影响,根据c=判断不当操作对所配溶液浓度影响。
7.A
【详解】在配制一定体积的1.00 mol/LNaCl溶液时,需要使用的仪器是烧杯、量筒、玻璃棒、胶头滴管、一定规格的容量瓶,而不需要使用漏斗,故合理选项是A。
8.D
【分析】根据容量瓶的构造、使用方法及配制一定物质的量浓度的溶液的正确方法分析。
【详解】A.容量瓶属于定量仪器,所以标有容积和刻度,由于温度影响溶液的体积,所以容量瓶上还标有使用的温度,没有浓度,故A错误;
B.容量瓶用蒸馏水洗净后,因为后面还需要加入蒸馏水定容,所以不必烘干,不影响配制结果,故B错误;
C.容量瓶中不能用于稀释浓硫酸,应该在烧杯中稀释,冷却后转移的容量瓶中,故C错误;
D.因为容量瓶有瓶塞,配制时需要摇匀,所以使用前要检查容量瓶是否漏水,故D正确;
故答案选D。
9.C
【详解】A.HCl极易溶于水,则将HCl原物质除去,不能除杂,A错误;
B.蒸干时硫酸铜晶体失去结晶水,应蒸发浓缩、冷却结晶制备胆矾,B错误;
C.挤压胶头滴管,氯气与碱反应,使烧瓶的内压小于外因,形成喷泉,则图3所示装置可以完成“喷泉”实验,C正确;
D.氨气的密度比空气的密度小,则图中为向上排空气法收集,应为向下排空气法收集,D错误;
答案选C。
【点睛】本题考查化学实验方案的评价,为高频考点,涉及气体的制备及收集、晶体制备、混合物分离提纯等,把握物质的性质、反应原理、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析。
10.B
【详解】A.制备氢氧化铁胶体是将饱和氯化铁溶液滴加到沸水中,加入到NaOH中会生成氢氧化铁沉淀,A错误;
B.氢氧化钠溶解放热,硝酸钠溶解吸热,将水分别滴加到两种物质中,一个试管温度升高,一个试管温度降低,可通过触摸外壁鉴别,B正确;
C.检验铵根离子应该用湿润的红色石蕊试纸,而不是蓝色石蕊试纸,C错误;
D.滴定管的“0”刻度线在上端,图示读数应该是14.80mL,D错误;
故答案选B。
11.B
【详解】A.过滤含有CaCO3的溶液,该过滤装置的漏斗颈应紧贴烧杯的内壁,故A错误;
B.向NaCl溶液中滴加AgNO3溶液,滴管在试管上方垂直滴入,故B正确;
C.39%的乙醇溶液中得到无水乙醇的冷凝管冷水从下口进入,上口流出,故C错误;
D.蒸发时用的是蒸发皿,故D错误;
所以本题答案:B。
12.B
【详解】A.的名称应该是坩埚,A错误;
B.的名称是分液漏斗,B正确;
C.的名称是泥三角,C错误;
D.的名称是平底烧瓶,D错误;
答案选B。
13.C
【详解】A、根据图中信息可知,镁的指标为0.95,在参考值范围0.75~1.25内,选项A错误;
B、根据单位mmol L-1可知,测定的是镁元素的物质的量浓度,选项B错误;
C、根据单位mmol L-1可知,测定的是镁元素的物质的量浓度,选项C正确;
D、根据单位mmol L-1可知,测定的是镁元素的物质的量浓度,选项D错误;
答案选C。
14.C
【详解】A.c==mol/L=18.4mol/L,故A错误;
B.该溶液为浓硫酸,与锌反应生成二氧化硫气体,没有氢气生成,故B错误;
C.设准确配制200mL4.6mol/L的稀硫酸需取该硫酸的体积为V,应需要200mL容量瓶,溶液稀释前后溶质的物质的量不变,则有:0.2L×4.6mol/L=V×18.4mol/L,V==0.05L,即50mL,故C正确;
D.硫酸的密度大于水的密度,该硫酸与等体积的水混合所得溶液的体积小于原来的2倍,则物质的量浓度大于9.2 mol/L,故D错误;
故选C。
【点睛】本题的易错点为D,要注意硫酸溶液的密度与浓度的关系的理解,硫酸的浓度越大,密度越大。
15.(1)5mol/L
(2)16.9%
(3) 5mol/L 0.05mol
(4)50mL
【详解】(1)20g氢氧化钠的物质的量为:,该溶液中NaOH的物质的量浓度为:,故答案为:5mol/L;
(2)100mL 1.185g/mL的氢氧化钠溶液的质量为:1.185g/mL×100mL=118.5g,该溶液中NaOH的质量分数为:×100%=16.9%,故答案为:16.9%;
(3)从该溶液中取出10mL,所得溶液的浓度不变,则NaOH的物质的量浓度为5mol/L;含NaOH物质的量为:n=cV=5mol/L×0.01L=0.05mol,故答案为:5mol/L;0.05mol;
(4)将取出的10mL溶液加水稀释,稀释后溶液中NaOH的物质的量浓度为1mol/L,稀释后溶液体积为:=0.05L=50mL,故答案为:50mL。
16.(1) 1∶3 4.214×1023
(2) 11.7g 0.2 mol/L
(3) 36 2.75 mol/L
【分析】根据混合气体的体积和质量列式计算;根据n=、c=计算解答;根据溶液的质量=m(水)+m(NaOH),溶液的体积=,最后根据c=计算。
(1)
标况下气体摩尔体积是22.4L/mol,混合气体n==0.4mol,设CO与CO2的物质的量分别为x、y,则x+y=0.4mol,x×28g/mol+y×44g/mol=16g,解得:x=0.1mol,y=0.3mol,则CO与CO2的体积之比等于物质的量之比=0.1mol∶0.3mol=1∶3,氧原子的物质的量=0.1mol×1+0.3mol×2=0.7mol,个数为0.7mol×6.02×1023mol-1=4.214×1023,故答案为:1∶3;4.214×1023。
(2)
10.6g Na2CO3的物质的量为=0.1 mol,溶液中Na+的物质的量为n(Na+)=2n(Na2CO3)=0.2 mol;向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.4mol L-1(假设溶液体积不变),溶液中钠离子的总物质的量为0.4mol/L×1L=0.4mol,根据钠离子守恒可知需要加入NaCl的物质的量为:0.4mol-0.2mol=0.2mol,则需加入NaCl的质量为58.5g/mol×0.2mol=11.7g;Cl-的物质的量浓度为=0.2mol/L,故答案为: 11.7 g;0.2 mol/L;
(3)
4gNaOH的物质的量==0.1mol,溶液中H2O与Na+的物质的量之比为20∶1,则水的物质的量=0.1mol×20=2mol,故水的质量为2mol×18g/mol=36g,溶液的质量=m(水)+m(NaOH)=4g+36g=40g,溶液体积==36.4cm3,溶液中c(Na+)==2.75mol/L,故答案为:36;2.75mol/L。
17. moL/L ①⑥⑨⑩ ②⑤ 蒸馏 分液漏斗 烧杯
【详解】(1)在VL Al2(SO4)3溶液中,含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为×=moL/L,故答案为:moL/L;
(2)①AgCl为电解质;②CCl4为非电解质;③医用酒精为混合物,既不是电解质也不是非电解质;④液氧为单质,既不是电解质也不是非电解质;
⑤二氧化碳本身不能电离,为非电解质;⑥碳酸氢钠固体在熔化或溶于水完全电离,为电解质;⑦氢氧化钡溶液为混合物,既不是电解质也不是非电解质;
⑧食醋为混合物,既不是电解质也不是非电解质;⑨氧化钠固体,熔化状态下可导电,为电解质;⑩氯化氢气体溶于水完全电离,为电解质;
其中属于电解质的是①⑥⑨⑩;属于非电解质的是②⑤,故答案为:①⑥⑨⑩;②⑤;
(3)实验操作②的名称为蒸馏,操作①为萃取,要用到的玻璃仪器为分液漏斗、烧杯,故答案为:蒸馏;分液漏斗;烧杯。
18.(1)A
(2)D
(3)B
(4)C
【详解】(1)除去Ca(OH)2溶液中悬浮的CaCO3颗粒,属于固液分离,用过滤法,选A;
(2)浓硫酸可以干燥氧气,O2中的水蒸气可通过装有浓H2SO4的洗气瓶,用洗气法,选D;
(3)碘易升华,加热升华可除去固体碘中混有的少量NaI,选B;
(4)碳酸钙高温分解为氧化钙和二氧化碳,加热分解可除去氧化钙中的CaCO3,选C。
19.溶解、除去有机物
【详解】乙醇是常见的有机溶剂,用乙醇洗涤废催化剂的目的是:溶解、除去有机物。
20.蒸馏烧瓶
【详解】仪器a的名称为蒸馏烧瓶。
21. ④ ⑦ ⑥ ③
【分析】根据不同分离方法的分离原理分析:①过滤用于分离固液混合物;②蒸发结晶用于分离易溶物质与水的分离;③蒸馏用于分离沸点不同的混合物;④萃取用于分离在不同溶剂中溶解度不同的物质;⑤分液用于分离互不相溶的液体混合物;⑥加热分解用于分离难分解和易分解的物质;⑦洗气用于分离性质不同的两种气体。
【详解】(1)从溴水中提取溴单质,可以向溴水中加入四氯化碳,这样溴单质溶于四氯化碳中,实现溴和水的分离,故答案为:④;
(2)氢气和二氧化碳性质不同,二氧化碳可以和碱反应,而氢气不能,可以采用洗气的方法来除杂,故答案为:⑦;
(3)碳酸钙高温易分解为氧化钙和二氧化碳气体,故可以采用加热的方法来分离,故答案为:⑥;
(4)分离沸点相差较大的液体混合物,可用蒸馏法,故答案为:③。
22. Cu 过滤 2Fe2++H2O2+2H+=2Fe3++2H2O 调节PH使Fe3+全部转化为氢氧化铁沉淀 4(CoC2O4 2H2O)+3O2 2Co2O3+8 H2O+8CO2 减少Li2CO3的溶解损失
【分析】根据题意知合金废料中加入盐酸只有Cu不与盐酸反应,加入过氧化氢把亚铁离子氧化为铁离子,再通过加入氨水调节pH使Fe3+全部转化为氢氧化铁沉淀,通过过滤操作将固液分离开,往溶液A中加入(NH4)2C2O4溶液得到CoC2O4·2H2O晶体,通过在空气中焙烧得到Co2O3,溶液B中含有Li+加入Na2CO3生成Li2CO3。
【详解】(1)合金废料中只有Cu不与盐酸反应,所以金属M是Cu;将固体与液体分离的操作是过滤,所以操作1为过滤;故填:Cu;过滤。
(2)加入过氧化氢的目的是氧化亚铁离子为铁离子,离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O;加入氨水的目的是调节溶液的pH,同时使铁离子沉淀;故填:2Fe2++H2O2+2H+=2Fe3++2H2O;调节pH使Fe3+全部转化为氢氧化铁沉淀。
(3)CoC2O4·2H2O转化为Co2O3的的过程中Co元素的化合价升高,则发生氧化还原反应,有氧气参加,同时有水和二氧化碳生成,化学方程式是4(CoC2O4 2H2O)+3O2 2Co2O3+8 H2O+8CO2;故填:4(CoC2O4 2H2O)+3O2 2Co2O3+8 H2O+8CO2。
(4)根据表中数据可知,碳酸锂的溶解度随温度升高而减小,若温度降低,则碳酸锂的溶解度增大,造成碳酸锂的损失,所以需要趁热过滤;碳酸锂的饱和溶液中,锂离子的浓度最大,水溶液呈碱性,说明碳酸根离子发生水解反应,所以溶液中的离子浓度的关系是;故填:减少Li2CO3的溶解损失;。
(5)用惰性电极电解熔融Li2CO3制取锂,阳极是阴离子碳酸根离子放电,根据元素守恒,则生成的两种气体是氧气和二氧化碳气体,电极反应式是故填:。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.进行化学实验时必须要有安全意识,下列做法错误的是
A.加热试管或烧杯时,应首先擦干外壁上的水
B.不慎将浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后再涂硼酸溶液
C.温度计摔坏导致水银散落到地面上,应立即用水冲洗水银
D.酒精及其它易燃有机物小面积失火,应迅速用湿抹布扑灭,烫伤(灼伤)要就医
2.某兴趣小组要配制物质的最浓度为0.1mol/L的NaCl溶液,下列装置中不需要使用的是
A. B. C. D.
3.在配制一定物质的量浓度溶液的过程中,下列有关说法正确的是
A.配制一定物质的量浓度的溶液时,必须使用的仪器有烧杯、玻璃棒、天平、容量瓶
B.配制980mL 0.2的溶液,需准确称量胆矾50.0g
C.配制一定浓度的NaOH溶液时,待NaOH固体全部溶解后,立即转移到容量瓶中
D.定容并摇匀后,发现凹液面低于刻度线,需补充滴加蒸馏水至刻度线为止
4.过氧化钙晶体(CaO2·8H2O)常用作医药消毒剂,以轻质碳酸钙为原料,按如下方法制备:
轻质CaCO3CaCl2溶液白色晶体目标产物
下列说法错误的是
A.步骤①,煮沸可以除去溶解的CO2、HCl
B.步骤②,H2O2作氧化剂、氨水用以调节溶液的pH
C.步骤①②,过滤时若用玻璃棒搅动,可能会导致滤纸破损
D.步骤③,醇洗可减少晶体损失且加速晶体干燥
5.用下列实验装置进行相应实验,能达到实验目的的是()
A.用图1装置分离乙醇和乙酸
B.用图2装置验证Na和水反应的热效应
C.用图3装置进行二氧化碳的喷泉实验
D.用图4探究NH4Cl的热稳定性
6.使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②用量筒量取液体时,仰视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.① ③ ⑤ ⑥ B.① ② ⑤ ⑥ C.② ③ ④ ⑥ D.③ ④ ⑤ ⑥
7.配制一定体积的1.00 mol/LNaCl溶液,不需要使用的仪器是
A. B. C. D.
8.下列对容量瓶及其使用方法的描述中正确的是( )
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后,必须烘干
C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2cm处,改用胶头滴管滴加蒸馏水至刻度线
D.使用前要检查容量瓶是否漏水
9.下列有关实验装置进行的相应实验,能达到目的的是
A.用图1所示装置除去HCl中含有的少量Cl2
B.用图2所示装置将硫酸铜溶液蒸干,制备胆矾
C.用图3所示装置可以完成“喷泉”实验
D.用图4所示装置制取并收集干燥纯净的NH3
10.用下列装置进行实验,能达到实验目的的是
A B C D
制备氢氧化铁胶体 鉴别NaOH和NH4NO3 检验NH 准确读取酸性KMnO4标准溶液体积为15. 20 mL
A.A B.B C.C D.D
11.如图实验操作装置正确的是( )
A.CaCO3的过滤
B.向NaCl溶液中滴加AgNO3溶液
C.39%的乙醇溶液中得到无水乙醇
D.蒸发的方法
12.下列仪器及对应名称正确
A.坩埚: B.分液漏斗:
C.三脚架: D.容量瓶:
13.某人体检报告的部分指标如表所示,则关于项目名称中镁的说法正确的是
项目名称 结果 状态单位 参考值范围
总钙 TCa 2.57 mmol L—1 2.1~2.7
磷 P 1.51↑ mmol L—1 0.8~1.5
镁 Mg 0.95 mmol L—1 0.75~1.25
钾 K 仪器故障维修 mmol L—1 3.5~5.5
钠 Na mmol L—1 135~160
氯 Cl mmol L—1 95~105
A.指标偏低 B.测定的是镁元素的物质的量
C.测定的是镁元素的物质的量浓度 D.测定的是镁元素的质量
14.图是硫酸试剂标签上的部分内容。下列说法正确的是
A.该硫酸的物质的量浓度为9.2 mol/L
B.1mol锌与足量的该硫酸反应产生2g氢气
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2 mol/L
二、填空题
15.将固体溶于水配成溶液,其密度为。
(1)该溶液中的物质的量浓度为 。
(2)该溶液中的质量分数为 。
(3)从该溶液中取出,其中的物质的量浓度为 ,含的物质的量为 。
(4)将取出的溶液加水稀释,稀释后溶液中的物质的量浓度为,稀释后溶液体积为 。
16.按要求完成下列填空:
(1)现有标准状况下CO和CO2混合气体8.96L,其质量为16g,则此混合气体中,CO与CO2的体积之比是 ,氧原子的个数是 。
(2)将10.6g Na2CO3溶于水配成1L溶液,向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.4 mol/L(假设溶液体积不变),需加入NaCl的质量为 ;Cl-的物质的量浓度为 。
(3)将4g NaOH溶于 g水中,可使溶液中H2O与Na+的物质的量之比等于20∶1,若测得该溶液的密度为1.1g/cm-3,溶液中c(Na+)为 。
17.(1)在VL Al2(SO4)3溶液中,含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为
(2)有以下物质:①AgCl;②CCl4;③医用酒精;④液氧;⑤二氧化碳;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧食醋;⑨氧化钠固体;⑩氯化氢气体。其中属于电解质的是 (填序号,下同);属于非电解质的是
(3)实验室简单模拟从海水中提取溴单质的部分流程如图
实验操作②的名称 ,操作①中要用到的玻璃仪器 、
18.已知单质碘受热易升华(固体变为气体)。可用于分离或提纯物质的方法有:
A.过滤B.加热升华C.加热分解D.洗气法
下列各组混合物的分离或提纯应选用上述哪种方法最合适(填对应字母)?
(1)除去Ca(OH)2溶液中悬浮的CaCO3颗粒: 。
(2)除去O2中少量的水蒸气: 。
(3)除去固体碘中混有的少量NaI: 。
(4)除去氧化钙中的CaCO3: 。
19.某工厂从废含镍有机催化剂中回收镍的工艺流程如图所示(已知废催化剂中含有Ni 70.0%及一定量的Al、Fe、SiO2和有机物,镍及其化合物的化学性质与铁的类似,但Ni2+的性质较稳定)。回答下列问题:
已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示。
沉淀物 Al(OH)3 Fe(OH)3 Fe(OH)2 Ni(OH)2
pH 5.2 3.2 9.7 9.2
用乙醇洗涤废催化剂的目的是
20.装置A用于制备乙烯,仪器a的名称为 。
21.对于混合物的分离和提纯,常采用的方法有:①过滤、②蒸发结晶、③蒸馏、④萃取、⑤分液、⑥加热分解、⑦洗气等方法,用该方法前的序号完成下列填空:
(1)从溴水中提取溴单质,可用 的方法。
(2)除去H2中的CO2,可用 的方法除去。
(3)除去氧化钙中的碳酸钙,可用 的方法。
(4)分离沸点相差较大的液体混合物,可用 的方法。
22.工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
(1)金属M为 ,操作1为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)由CoC2O4·2H2O转化为Co2O3的化学方程式是 。
(4)知Li2CO3微溶于水,且水溶液呈碱性。其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是 ,在常温条件下,饱和Li2CO3 溶液中离子浓度由大到小的排列顺序为 。
温度/℃ 10 30 60 90
浓度/mol L-1 0.21 0.17 0.14 0.10
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A正确,防止试管炸裂;
B正确,不慎将浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后再涂硼酸溶液;
C错,温度计摔坏导致水银散落到地面上,应立即用硫粉处理;
D正确,小面积失火,应迅速用湿抹布扑灭,烫伤(灼伤)要就医;
2.D
【详解】配制0.1mol/L的氯化钠溶液需要用到的仪器有托盘天平、烧杯、玻璃棒、容量瓶和胶头滴管,用不到分液漏斗,故选D。
3.B
【详解】A.配制一定物质的量浓度的溶液时,必须使用的仪器有烧杯、玻璃棒、容量瓶、胶头滴管等,如果用固体溶质配制溶液,需要用天平称量固体的质量,若用液体溶质或浓溶液配制稀溶液,则不需要天平,需要的是量筒,故A错误;
B.实验室没有980mL的容量瓶,配制980mL0.2mol L 1 的 CuSO4 溶液时,需要用1000mL的容量瓶,称量胆矾 (CuSO4 5H2O)的质量为 1L×0.2mol L 1 ×250g/mol=50.0g,故B正确;
C.NaOH溶于水放热,配制一定浓度的 NaOH 溶液时,待 NaOH 固体全部溶解后,要等溶液冷却后才能将溶液转移到容量瓶中,否则会带来误差,故C错误;
D.摇匀时,由于溶液会残留在容量瓶刻度线上方的内壁以及瓶塞部位,所以凹液面会低于刻度线,不能再滴加蒸馏水至刻度线,这样做会使溶液体积偏大,导致溶液浓度降低,故D错误;
故选B。
4.B
【解析】由制备流程图可知,碳酸钙与盐酸反应,加热煮沸是为了除去多余的盐酸和溶解的少量二氧化碳,滤液含氯化钙,加入氨水和双氧水在冰浴条件下发生反应CaCl2+H2O2+2NH3·H2OCaO2·8H2O+2NH4Cl,过滤得到白色晶体,最后洗涤得目标产物。
【详解】A.步骤①碳酸钙与盐酸反应,生成氯化钙、二氧化碳和水,煮沸可以除去溶解的CO2、HCl,故A正确;
B.步骤②,向滤液氯化钙溶液中加入氨水和双氧水在冰浴条件下发生反应CaCl2+H2O2+2NH3·H2OCaO2·8H2O+2NH4Cl,反应中各元素化合价没有发生变化,此反应不是氧化还原反应,故B错误;
C.步骤①②,过滤时若用玻璃捧搅动,可能会导致滤纸破损,故C正确;
D.过氧化钙晶体微溶于水,不溶于乙醇,醇洗可减少晶体损失且加速晶体干燥,故D正确;
故答案为B。
5.B
【详解】A.图1装置是过滤装置,分离液体和不溶于液体的固体混合物,分离乙醇和乙酸可用蒸馏,故A错误;
B.Na和水反应,产生的热量使大试管中的空气体积发生变化,U形管两边的液面高度差发生变化,可用图2装置验证Na和水反应的热效应,故B正确;
C.二氧化碳在水中溶解度不大,不能用图3装置进行二氧化碳的喷泉实验,故C错误;
D.用图4探究NH4Cl的热稳定性,加热固体时,大试管口应向下倾斜,故D错误;
故选B。
6.A
【详解】①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了,实际称量药品的质量减小,所配溶液难度偏低,故①符合;
②用量筒量取液体时,仰视读数,量取溶液体积偏大,所配溶液浓度偏高,故②不符合;
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤,移入容量瓶中溶质的物质的量偏小,所配溶液浓度偏低,故③符合;
④配制需加水定容,转移溶液前容量瓶内有少量蒸馏水,对所配溶液无影响,故④不符合;
⑤定容时,仰视容量瓶的刻度线,所配溶液体积偏大,溶液浓度偏低,故⑤符合;
⑥摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所配溶液浓度偏小,故⑥符合;
所以①③⑤⑥符合;
故选:A。
【点睛】分析操作对溶质的物质的量或溶液的体积的影响,根据c=判断不当操作对所配溶液浓度影响。
7.A
【详解】在配制一定体积的1.00 mol/LNaCl溶液时,需要使用的仪器是烧杯、量筒、玻璃棒、胶头滴管、一定规格的容量瓶,而不需要使用漏斗,故合理选项是A。
8.D
【分析】根据容量瓶的构造、使用方法及配制一定物质的量浓度的溶液的正确方法分析。
【详解】A.容量瓶属于定量仪器,所以标有容积和刻度,由于温度影响溶液的体积,所以容量瓶上还标有使用的温度,没有浓度,故A错误;
B.容量瓶用蒸馏水洗净后,因为后面还需要加入蒸馏水定容,所以不必烘干,不影响配制结果,故B错误;
C.容量瓶中不能用于稀释浓硫酸,应该在烧杯中稀释,冷却后转移的容量瓶中,故C错误;
D.因为容量瓶有瓶塞,配制时需要摇匀,所以使用前要检查容量瓶是否漏水,故D正确;
故答案选D。
9.C
【详解】A.HCl极易溶于水,则将HCl原物质除去,不能除杂,A错误;
B.蒸干时硫酸铜晶体失去结晶水,应蒸发浓缩、冷却结晶制备胆矾,B错误;
C.挤压胶头滴管,氯气与碱反应,使烧瓶的内压小于外因,形成喷泉,则图3所示装置可以完成“喷泉”实验,C正确;
D.氨气的密度比空气的密度小,则图中为向上排空气法收集,应为向下排空气法收集,D错误;
答案选C。
【点睛】本题考查化学实验方案的评价,为高频考点,涉及气体的制备及收集、晶体制备、混合物分离提纯等,把握物质的性质、反应原理、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析。
10.B
【详解】A.制备氢氧化铁胶体是将饱和氯化铁溶液滴加到沸水中,加入到NaOH中会生成氢氧化铁沉淀,A错误;
B.氢氧化钠溶解放热,硝酸钠溶解吸热,将水分别滴加到两种物质中,一个试管温度升高,一个试管温度降低,可通过触摸外壁鉴别,B正确;
C.检验铵根离子应该用湿润的红色石蕊试纸,而不是蓝色石蕊试纸,C错误;
D.滴定管的“0”刻度线在上端,图示读数应该是14.80mL,D错误;
故答案选B。
11.B
【详解】A.过滤含有CaCO3的溶液,该过滤装置的漏斗颈应紧贴烧杯的内壁,故A错误;
B.向NaCl溶液中滴加AgNO3溶液,滴管在试管上方垂直滴入,故B正确;
C.39%的乙醇溶液中得到无水乙醇的冷凝管冷水从下口进入,上口流出,故C错误;
D.蒸发时用的是蒸发皿,故D错误;
所以本题答案:B。
12.B
【详解】A.的名称应该是坩埚,A错误;
B.的名称是分液漏斗,B正确;
C.的名称是泥三角,C错误;
D.的名称是平底烧瓶,D错误;
答案选B。
13.C
【详解】A、根据图中信息可知,镁的指标为0.95,在参考值范围0.75~1.25内,选项A错误;
B、根据单位mmol L-1可知,测定的是镁元素的物质的量浓度,选项B错误;
C、根据单位mmol L-1可知,测定的是镁元素的物质的量浓度,选项C正确;
D、根据单位mmol L-1可知,测定的是镁元素的物质的量浓度,选项D错误;
答案选C。
14.C
【详解】A.c==mol/L=18.4mol/L,故A错误;
B.该溶液为浓硫酸,与锌反应生成二氧化硫气体,没有氢气生成,故B错误;
C.设准确配制200mL4.6mol/L的稀硫酸需取该硫酸的体积为V,应需要200mL容量瓶,溶液稀释前后溶质的物质的量不变,则有:0.2L×4.6mol/L=V×18.4mol/L,V==0.05L,即50mL,故C正确;
D.硫酸的密度大于水的密度,该硫酸与等体积的水混合所得溶液的体积小于原来的2倍,则物质的量浓度大于9.2 mol/L,故D错误;
故选C。
【点睛】本题的易错点为D,要注意硫酸溶液的密度与浓度的关系的理解,硫酸的浓度越大,密度越大。
15.(1)5mol/L
(2)16.9%
(3) 5mol/L 0.05mol
(4)50mL
【详解】(1)20g氢氧化钠的物质的量为:,该溶液中NaOH的物质的量浓度为:,故答案为:5mol/L;
(2)100mL 1.185g/mL的氢氧化钠溶液的质量为:1.185g/mL×100mL=118.5g,该溶液中NaOH的质量分数为:×100%=16.9%,故答案为:16.9%;
(3)从该溶液中取出10mL,所得溶液的浓度不变,则NaOH的物质的量浓度为5mol/L;含NaOH物质的量为:n=cV=5mol/L×0.01L=0.05mol,故答案为:5mol/L;0.05mol;
(4)将取出的10mL溶液加水稀释,稀释后溶液中NaOH的物质的量浓度为1mol/L,稀释后溶液体积为:=0.05L=50mL,故答案为:50mL。
16.(1) 1∶3 4.214×1023
(2) 11.7g 0.2 mol/L
(3) 36 2.75 mol/L
【分析】根据混合气体的体积和质量列式计算;根据n=、c=计算解答;根据溶液的质量=m(水)+m(NaOH),溶液的体积=,最后根据c=计算。
(1)
标况下气体摩尔体积是22.4L/mol,混合气体n==0.4mol,设CO与CO2的物质的量分别为x、y,则x+y=0.4mol,x×28g/mol+y×44g/mol=16g,解得:x=0.1mol,y=0.3mol,则CO与CO2的体积之比等于物质的量之比=0.1mol∶0.3mol=1∶3,氧原子的物质的量=0.1mol×1+0.3mol×2=0.7mol,个数为0.7mol×6.02×1023mol-1=4.214×1023,故答案为:1∶3;4.214×1023。
(2)
10.6g Na2CO3的物质的量为=0.1 mol,溶液中Na+的物质的量为n(Na+)=2n(Na2CO3)=0.2 mol;向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.4mol L-1(假设溶液体积不变),溶液中钠离子的总物质的量为0.4mol/L×1L=0.4mol,根据钠离子守恒可知需要加入NaCl的物质的量为:0.4mol-0.2mol=0.2mol,则需加入NaCl的质量为58.5g/mol×0.2mol=11.7g;Cl-的物质的量浓度为=0.2mol/L,故答案为: 11.7 g;0.2 mol/L;
(3)
4gNaOH的物质的量==0.1mol,溶液中H2O与Na+的物质的量之比为20∶1,则水的物质的量=0.1mol×20=2mol,故水的质量为2mol×18g/mol=36g,溶液的质量=m(水)+m(NaOH)=4g+36g=40g,溶液体积==36.4cm3,溶液中c(Na+)==2.75mol/L,故答案为:36;2.75mol/L。
17. moL/L ①⑥⑨⑩ ②⑤ 蒸馏 分液漏斗 烧杯
【详解】(1)在VL Al2(SO4)3溶液中,含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为×=moL/L,故答案为:moL/L;
(2)①AgCl为电解质;②CCl4为非电解质;③医用酒精为混合物,既不是电解质也不是非电解质;④液氧为单质,既不是电解质也不是非电解质;
⑤二氧化碳本身不能电离,为非电解质;⑥碳酸氢钠固体在熔化或溶于水完全电离,为电解质;⑦氢氧化钡溶液为混合物,既不是电解质也不是非电解质;
⑧食醋为混合物,既不是电解质也不是非电解质;⑨氧化钠固体,熔化状态下可导电,为电解质;⑩氯化氢气体溶于水完全电离,为电解质;
其中属于电解质的是①⑥⑨⑩;属于非电解质的是②⑤,故答案为:①⑥⑨⑩;②⑤;
(3)实验操作②的名称为蒸馏,操作①为萃取,要用到的玻璃仪器为分液漏斗、烧杯,故答案为:蒸馏;分液漏斗;烧杯。
18.(1)A
(2)D
(3)B
(4)C
【详解】(1)除去Ca(OH)2溶液中悬浮的CaCO3颗粒,属于固液分离,用过滤法,选A;
(2)浓硫酸可以干燥氧气,O2中的水蒸气可通过装有浓H2SO4的洗气瓶,用洗气法,选D;
(3)碘易升华,加热升华可除去固体碘中混有的少量NaI,选B;
(4)碳酸钙高温分解为氧化钙和二氧化碳,加热分解可除去氧化钙中的CaCO3,选C。
19.溶解、除去有机物
【详解】乙醇是常见的有机溶剂,用乙醇洗涤废催化剂的目的是:溶解、除去有机物。
20.蒸馏烧瓶
【详解】仪器a的名称为蒸馏烧瓶。
21. ④ ⑦ ⑥ ③
【分析】根据不同分离方法的分离原理分析:①过滤用于分离固液混合物;②蒸发结晶用于分离易溶物质与水的分离;③蒸馏用于分离沸点不同的混合物;④萃取用于分离在不同溶剂中溶解度不同的物质;⑤分液用于分离互不相溶的液体混合物;⑥加热分解用于分离难分解和易分解的物质;⑦洗气用于分离性质不同的两种气体。
【详解】(1)从溴水中提取溴单质,可以向溴水中加入四氯化碳,这样溴单质溶于四氯化碳中,实现溴和水的分离,故答案为:④;
(2)氢气和二氧化碳性质不同,二氧化碳可以和碱反应,而氢气不能,可以采用洗气的方法来除杂,故答案为:⑦;
(3)碳酸钙高温易分解为氧化钙和二氧化碳气体,故可以采用加热的方法来分离,故答案为:⑥;
(4)分离沸点相差较大的液体混合物,可用蒸馏法,故答案为:③。
22. Cu 过滤 2Fe2++H2O2+2H+=2Fe3++2H2O 调节PH使Fe3+全部转化为氢氧化铁沉淀 4(CoC2O4 2H2O)+3O2 2Co2O3+8 H2O+8CO2 减少Li2CO3的溶解损失
【分析】根据题意知合金废料中加入盐酸只有Cu不与盐酸反应,加入过氧化氢把亚铁离子氧化为铁离子,再通过加入氨水调节pH使Fe3+全部转化为氢氧化铁沉淀,通过过滤操作将固液分离开,往溶液A中加入(NH4)2C2O4溶液得到CoC2O4·2H2O晶体,通过在空气中焙烧得到Co2O3,溶液B中含有Li+加入Na2CO3生成Li2CO3。
【详解】(1)合金废料中只有Cu不与盐酸反应,所以金属M是Cu;将固体与液体分离的操作是过滤,所以操作1为过滤;故填:Cu;过滤。
(2)加入过氧化氢的目的是氧化亚铁离子为铁离子,离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O;加入氨水的目的是调节溶液的pH,同时使铁离子沉淀;故填:2Fe2++H2O2+2H+=2Fe3++2H2O;调节pH使Fe3+全部转化为氢氧化铁沉淀。
(3)CoC2O4·2H2O转化为Co2O3的的过程中Co元素的化合价升高,则发生氧化还原反应,有氧气参加,同时有水和二氧化碳生成,化学方程式是4(CoC2O4 2H2O)+3O2 2Co2O3+8 H2O+8CO2;故填:4(CoC2O4 2H2O)+3O2 2Co2O3+8 H2O+8CO2。
(4)根据表中数据可知,碳酸锂的溶解度随温度升高而减小,若温度降低,则碳酸锂的溶解度增大,造成碳酸锂的损失,所以需要趁热过滤;碳酸锂的饱和溶液中,锂离子的浓度最大,水溶液呈碱性,说明碳酸根离子发生水解反应,所以溶液中的离子浓度的关系是;故填:减少Li2CO3的溶解损失;。
(5)用惰性电极电解熔融Li2CO3制取锂,阳极是阴离子碳酸根离子放电,根据元素守恒,则生成的两种气体是氧气和二氧化碳气体,电极反应式是故填:。
答案第1页,共2页
答案第1页,共2页
