四川省内江市2023-2024学年高二上学期期末检测化学试题(PDF版含答案)
文档属性
| 名称 | 四川省内江市2023-2024学年高二上学期期末检测化学试题(PDF版含答案) |

|
|
| 格式 | |||
| 文件大小 | 5.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-25 00:00:00 | ||
图片预览

文档简介
内江市2023-2024学年度第一学期高二期未检测题
化学
本试卷共6页。全卷满分100分,考试时间为75分钟。
注意事项:
1.答题前,考生务必将自已的姓名、考号、班级用签宇笔填写在答题卡相应位置。
2、选择题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦
干净后,再选涂其它答案。不能答在试题卷上。
3.非选择题用签字笔将答案直接答在答题卡相应位置上。
4考试结束后,监考人员将答题卡收回。
可能用到的相对原子质量:H一1C一120一16Ni一59
一、单项选择题(本题共14小题。每小题3分,共42分。在每小题给出的四个选项中,只有一
项符合题目要求)
1.化学与社会、科学、技术、环境密切相关,下列说法错误的是
A.采用合适的催化剂可以提高合成氨工业中原料的转化率
B.生活中常用明矾净水,可加速水中悬浮物沉降
C.合理利用太阳能、风能和氢能等能源有利于实现“低碳经济”
D.钢铁在潮湿的空气中容易生锈,其主要原因是形成了原电池,
2.对于化学反应中的能量变化,表述正确的是
A.氧化还原反应均为吸热反应
B.加热才能发生的反应肯定属于吸热反应
C.化学变化时形成化学键的过程需吸收能量
D.电解池是把电能直接转化为化学能的装置
3.反应X(s)+Y(g)一2Z(g)△H<0,达到平衡时,下列说法正确的是
A,增大c(Y),Y的转化率增大
B.减小容器体积,平衡逆向移动
C。加入催化剂,X的质量增大
D.升高温度,Z的体积分数增大
4.已知热化学反应方程式:
①.C(s)+02(g)=C02(g)
△H1=-393.5kJ/mol
②c0(g)+20,(g)=C0,(g)
△H2'=-283.0kJ/mol
下列说法正确的是
:A.反应①:E(反应物)B.C0的燃烧热是283.0kJ
C.C生成C0需要吸收热量
D.盖斯定律可间接获得不方便测量的反应热
5.下列溶液显酸性,解释其原因的化学用语错误的是
A.醋酸溶液:CHCO0H一H*+CHC00
高二化学试卷第1页(共6页)
B.硫酸溶液:H2S04=2H*+S0
C.硫酸氢钠溶液:NaHSO一Na+H*+SO
D.NH4NO3溶液:NH4+H20三NH3·H20+H
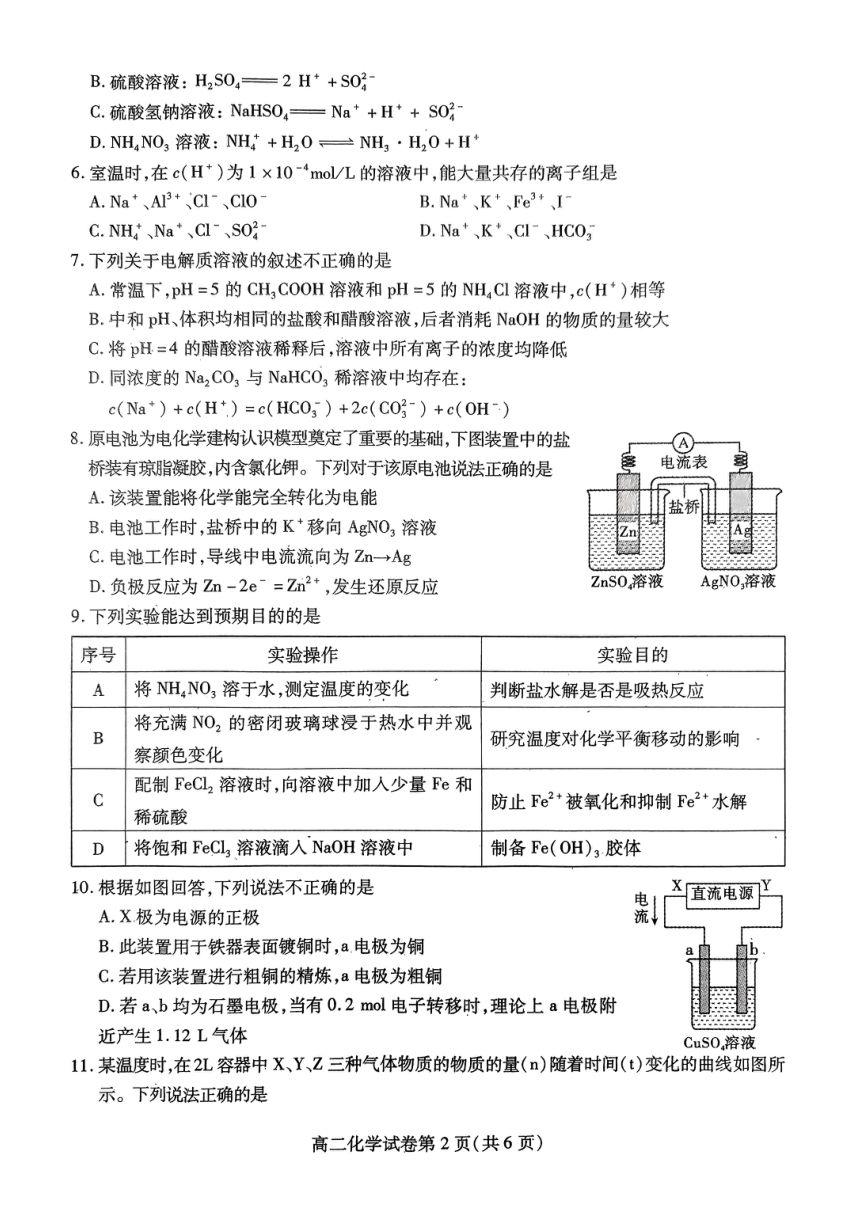
6.室温时,在c(H*)为1×10-4mo/L的溶液中,能大量共存的离子组是
A.Na+、Al3+Cl-、Cl0
B.Na+、K+、fe3+、I
C.NHt、Na+、Cl、S02
D.Na+、K+、Cl-、HC0g
7.下列关于电解质溶液的叙述不正确的是
A.常温下,pH=5的CH3COOH溶液和pH=5的NH,Cl溶液中,c(H)相等
B.中和pH、体积均相同的盐酸和醋酸浴液,后者消耗NaOH的物质的量较大
C.将pH.=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
D.同浓度的Na2CO,与NaHCO3稀溶液中均存在:
c(Na+)+c(H+)=c(HC03)+2c(C0好-)+c(OH)
8.原电池为电化学建构认识模型奠定了重要的基础,下图装置中的盐
A
桥装有琼脂凝胶,内含氯化钾。下列对于该原电池说法正确的是
电流表
A.该装置能将化学能完全转化为电能
B.电池工作时,盐桥中的K移向AgNO3溶液
C.电池工作时,导线中电流流向为Zm-→Ag
D.负极反应为Zm-2e=Zm2+,发生还原反应
ZnS0,溶液
AgNO溶液
9.下列实验能达到预期目的的是
序号
实验操作
实验目的
A
将NH,NO3溶于水,测定温度的变化
判断盐水解是否是吸热反应
将充满NO2的密闭玻璃球浸于热水中并观
B
研究温度对化学平衡移动的影响
察颜色变化
配制FeCL2溶液时,向溶液中加入少量Fe和
C
防止Fe2+被氧化和抑制Fe2+水解
稀硫酸
D
将饱和FeCL3溶液滴入NaOH溶液中
制备Fe(OH)3.胶体
10.根据如图回答,下列说法不正确的是
电
直流电源
A.X极为电源的正极
流
B.此装置用于铁器表面镀铜时,a.电极为铜
a
C.若用该装置进行粗铜的精炼,a电极为粗铜
D.若a、b均为石墨电极,当有0.2mol电子转移时,理论上a电极附
近产生1.12L气体
CuS0,溶液
11.某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所
示。下列说法正确的是
高二化学试卷第2页(共6页)
化学
本试卷共6页。全卷满分100分,考试时间为75分钟。
注意事项:
1.答题前,考生务必将自已的姓名、考号、班级用签宇笔填写在答题卡相应位置。
2、选择题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦
干净后,再选涂其它答案。不能答在试题卷上。
3.非选择题用签字笔将答案直接答在答题卡相应位置上。
4考试结束后,监考人员将答题卡收回。
可能用到的相对原子质量:H一1C一120一16Ni一59
一、单项选择题(本题共14小题。每小题3分,共42分。在每小题给出的四个选项中,只有一
项符合题目要求)
1.化学与社会、科学、技术、环境密切相关,下列说法错误的是
A.采用合适的催化剂可以提高合成氨工业中原料的转化率
B.生活中常用明矾净水,可加速水中悬浮物沉降
C.合理利用太阳能、风能和氢能等能源有利于实现“低碳经济”
D.钢铁在潮湿的空气中容易生锈,其主要原因是形成了原电池,
2.对于化学反应中的能量变化,表述正确的是
A.氧化还原反应均为吸热反应
B.加热才能发生的反应肯定属于吸热反应
C.化学变化时形成化学键的过程需吸收能量
D.电解池是把电能直接转化为化学能的装置
3.反应X(s)+Y(g)一2Z(g)△H<0,达到平衡时,下列说法正确的是
A,增大c(Y),Y的转化率增大
B.减小容器体积,平衡逆向移动
C。加入催化剂,X的质量增大
D.升高温度,Z的体积分数增大
4.已知热化学反应方程式:
①.C(s)+02(g)=C02(g)
△H1=-393.5kJ/mol
②c0(g)+20,(g)=C0,(g)
△H2'=-283.0kJ/mol
下列说法正确的是
:A.反应①:E(反应物)
C.C生成C0需要吸收热量
D.盖斯定律可间接获得不方便测量的反应热
5.下列溶液显酸性,解释其原因的化学用语错误的是
A.醋酸溶液:CHCO0H一H*+CHC00
高二化学试卷第1页(共6页)
B.硫酸溶液:H2S04=2H*+S0
C.硫酸氢钠溶液:NaHSO一Na+H*+SO
D.NH4NO3溶液:NH4+H20三NH3·H20+H
6.室温时,在c(H*)为1×10-4mo/L的溶液中,能大量共存的离子组是
A.Na+、Al3+Cl-、Cl0
B.Na+、K+、fe3+、I
C.NHt、Na+、Cl、S02
D.Na+、K+、Cl-、HC0g
7.下列关于电解质溶液的叙述不正确的是
A.常温下,pH=5的CH3COOH溶液和pH=5的NH,Cl溶液中,c(H)相等
B.中和pH、体积均相同的盐酸和醋酸浴液,后者消耗NaOH的物质的量较大
C.将pH.=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
D.同浓度的Na2CO,与NaHCO3稀溶液中均存在:
c(Na+)+c(H+)=c(HC03)+2c(C0好-)+c(OH)
8.原电池为电化学建构认识模型奠定了重要的基础,下图装置中的盐
A
桥装有琼脂凝胶,内含氯化钾。下列对于该原电池说法正确的是
电流表
A.该装置能将化学能完全转化为电能
B.电池工作时,盐桥中的K移向AgNO3溶液
C.电池工作时,导线中电流流向为Zm-→Ag
D.负极反应为Zm-2e=Zm2+,发生还原反应
ZnS0,溶液
AgNO溶液
9.下列实验能达到预期目的的是
序号
实验操作
实验目的
A
将NH,NO3溶于水,测定温度的变化
判断盐水解是否是吸热反应
将充满NO2的密闭玻璃球浸于热水中并观
B
研究温度对化学平衡移动的影响
察颜色变化
配制FeCL2溶液时,向溶液中加入少量Fe和
C
防止Fe2+被氧化和抑制Fe2+水解
稀硫酸
D
将饱和FeCL3溶液滴入NaOH溶液中
制备Fe(OH)3.胶体
10.根据如图回答,下列说法不正确的是
电
直流电源
A.X极为电源的正极
流
B.此装置用于铁器表面镀铜时,a.电极为铜
a
C.若用该装置进行粗铜的精炼,a电极为粗铜
D.若a、b均为石墨电极,当有0.2mol电子转移时,理论上a电极附
近产生1.12L气体
CuS0,溶液
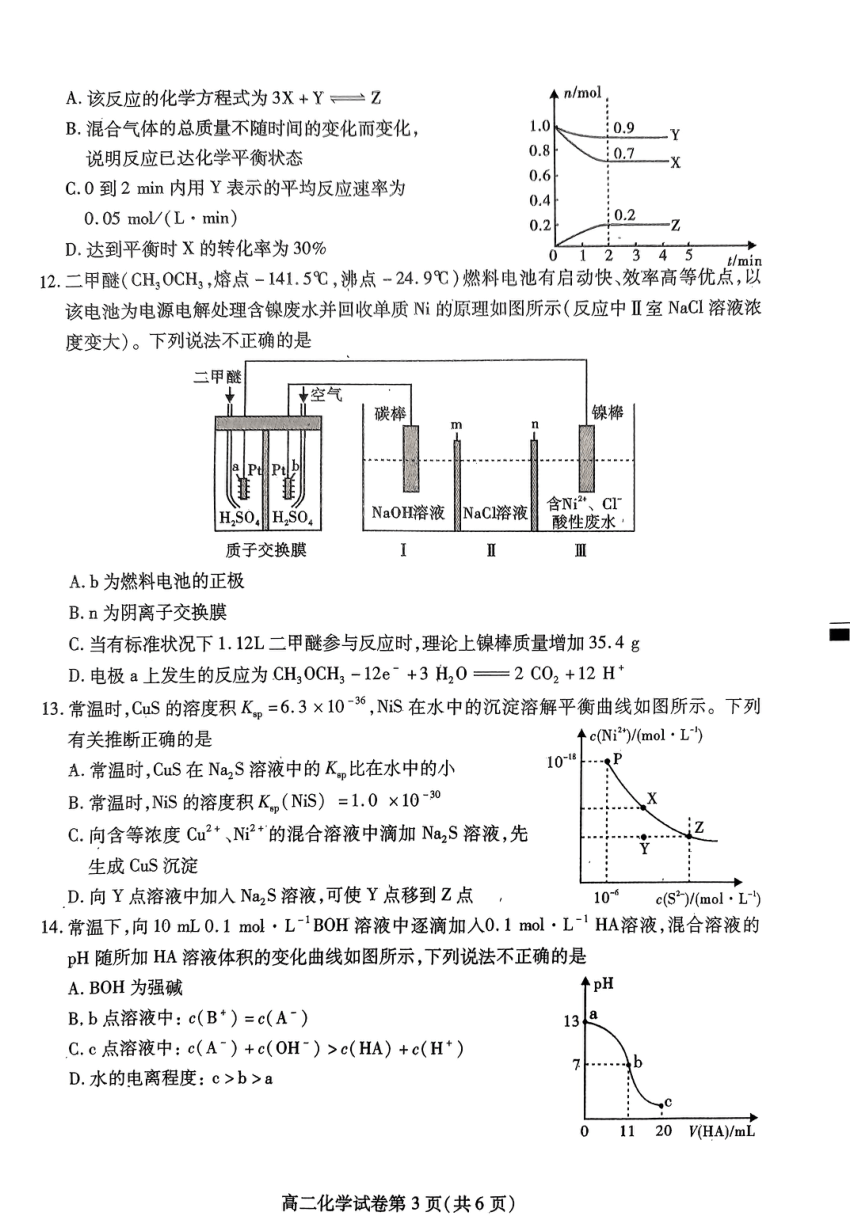
11.某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所
示。下列说法正确的是
高二化学试卷第2页(共6页)
同课章节目录
