浙江中考科学二轮复习提升讲义 11.物质互相转化和循环(含答案)
文档属性
| 名称 | 浙江中考科学二轮复习提升讲义 11.物质互相转化和循环(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 696.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-01-26 10:12:40 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
第十一讲:物质互相转化和循环
一、单选题
1.在氢气还原氧化铜的实验中,观察到的现象是( )
A.有红色的铜生成
B.试管底有水生成
C.有铜和水生成
D.黑色固体变成红色,试管口有水珠生成
2.有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种。取样溶于水,有白色沉淀产生;过滤后,向该白色沉淀中滴加过量盐酸,沉淀部分溶解并有气体产生。由此推断白色固体中( )
A.可能存在NaOH B.可能存在Na2SO4
C.肯定不存在BaCl2 D.肯定存在Na2CO3和Na2SO4、NaOH
3.只用一种试剂就能将NaOH、HCl、BaCl2三种溶液一次鉴别出来,它是( )
A.酚酞试液 B.Na2SO4溶液
C.CuSO4溶液 D.Fe(NO3)3溶液
4.下表所列各组物质中,物质之间按箭头所示方向的转化通过一步反应就能实现的是( )
选项 物质
甲 乙 丙 丁
A CO2 CaCO3 H2O O2
B NaOH NaCl CO2 Na2CO3
C H2O2 H2O O2 MgO
D CaO Ca(OH)2 H2O CaCl2
A.A B.B C.C D.D
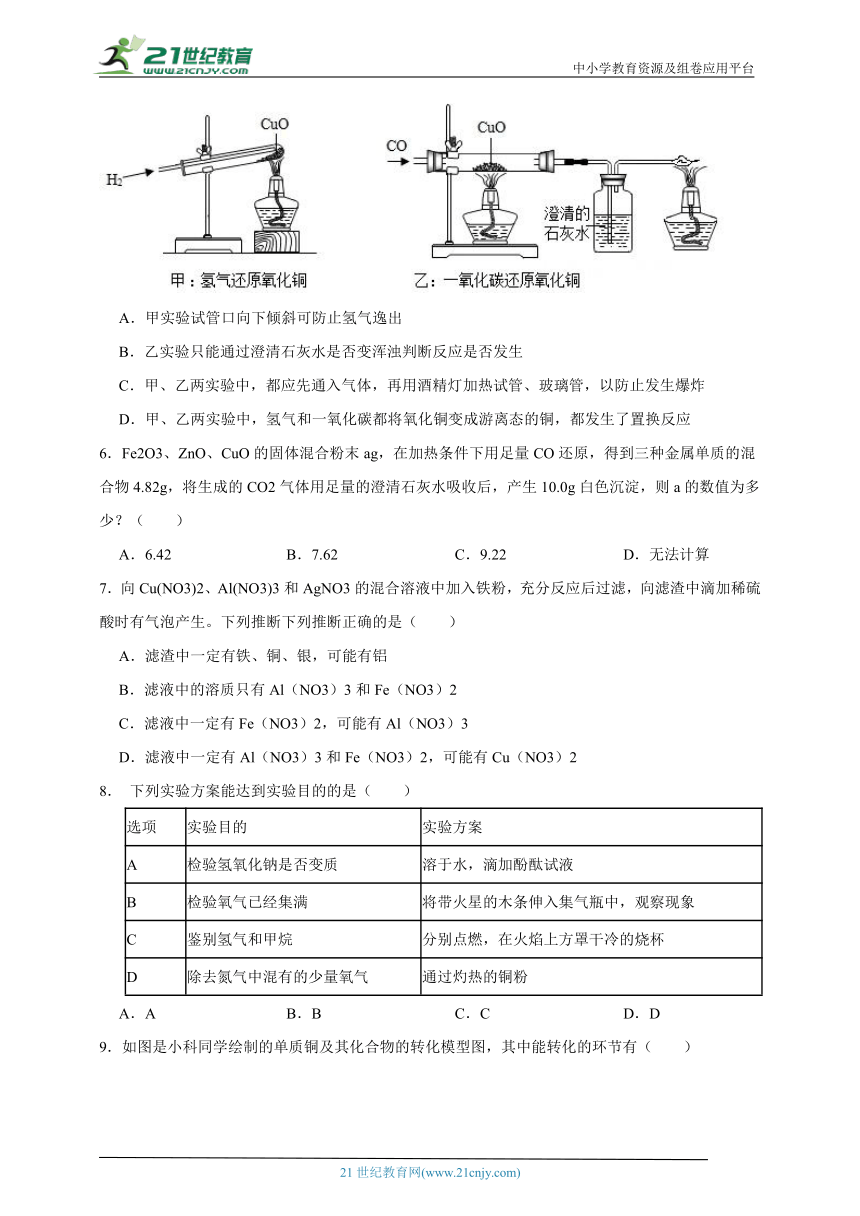
5.如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
A.甲实验试管口向下倾斜可防止氢气逸出
B.乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生
C.甲、乙两实验中,都应先通入气体,再用酒精灯加热试管、玻璃管,以防止发生爆炸
D.甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应
6.Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下用足量CO还原,得到三种金属单质的混合物4.82g,将生成的CO2气体用足量的澄清石灰水吸收后,产生10.0g白色沉淀,则a的数值为多少?( )
A.6.42 B.7.62 C.9.22 D.无法计算
7.向Cu(NO3)2、Al(NO3)3和AgNO3的混合溶液中加入铁粉,充分反应后过滤,向滤渣中滴加稀硫酸时有气泡产生。下列推断下列推断正确的是( )
A.滤渣中一定有铁、铜、银,可能有铝
B.滤液中的溶质只有Al(NO3)3和Fe(NO3)2
C.滤液中一定有Fe(NO3)2,可能有Al(NO3)3
D.滤液中一定有Al(NO3)3和Fe(NO3)2,可能有Cu(NO3)2
8. 下列实验方案能达到实验目的的是( )
选项 实验目的 实验方案
A 检验氢氧化钠是否变质 溶于水,滴加酚酞试液
B 检验氧气已经集满 将带火星的木条伸入集气瓶中,观察现象
C 鉴别氢气和甲烷 分别点燃,在火焰上方罩干冷的烧杯
D 除去氮气中混有的少量氧气 通过灼热的铜粉
A.A B.B C.C D.D
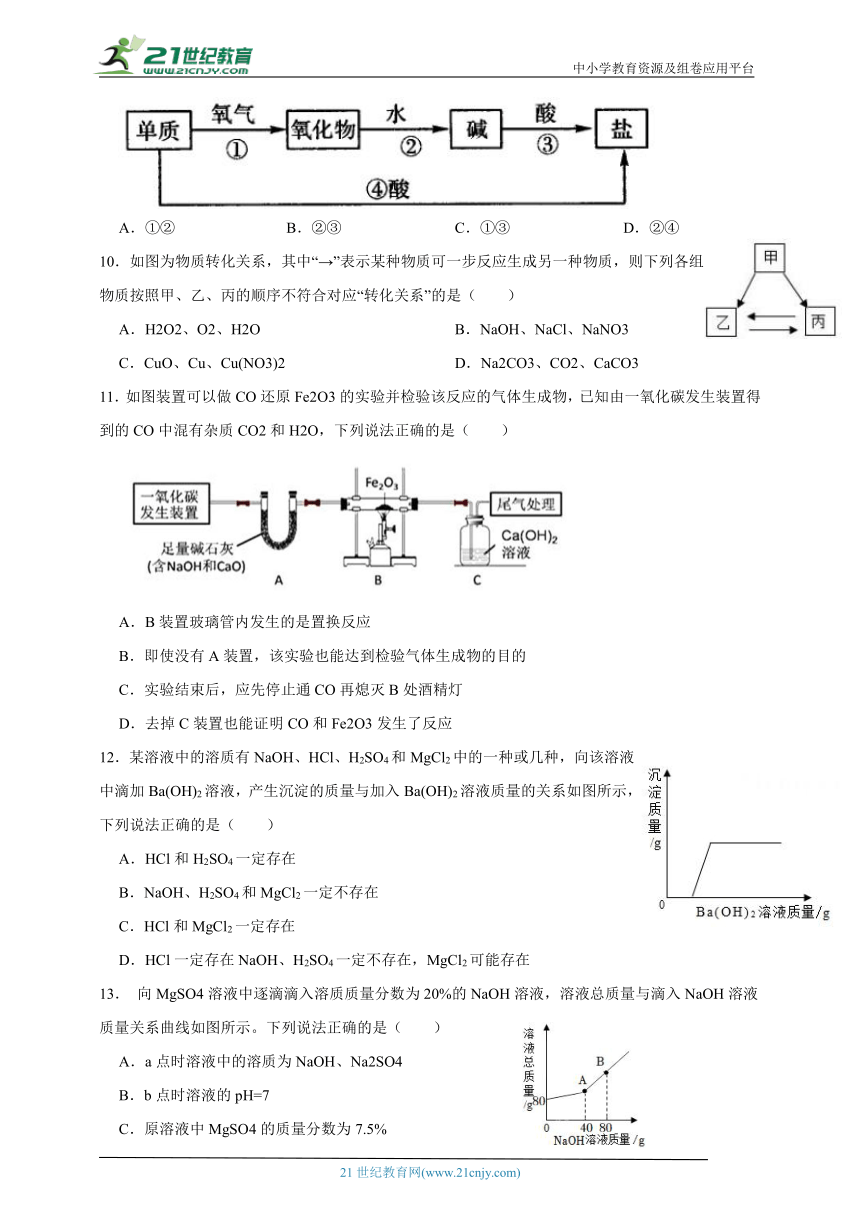
9.如图是小科同学绘制的单质铜及其化合物的转化模型图,其中能转化的环节有( )
A.①② B.②③ C.①③ D.②④
10.如图为物质转化关系,其中“→”表示某种物质可一步反应生成另一种物质,则下列各组物质按照甲、乙、丙的顺序不符合对应“转化关系”的是( )
A.H2O2、O2、H2O B.NaOH、NaCl、NaNO3
C.CuO、Cu、Cu(NO3)2 D.Na2CO3、CO2、CaCO3
11.如图装置可以做CO还原Fe2O3的实验并检验该反应的气体生成物,已知由一氧化碳发生装置得到的CO中混有杂质CO2和H2O,下列说法正确的是( )
A.B装置玻璃管内发生的是置换反应
B.即使没有A装置,该实验也能达到检验气体生成物的目的
C.实验结束后,应先停止通CO再熄灭B处酒精灯
D.去掉C装置也能证明CO和Fe2O3发生了反应
12.某溶液中的溶质有NaOH、HCl、H2SO4和MgCl2中的一种或几种,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图所示,下列说法正确的是( )
A.HCl和H2SO4一定存在
B.NaOH、H2SO4和MgCl2一定不存在
C.HCl和MgCl2一定存在
D.HCl一定存在NaOH、H2SO4一定不存在,MgCl2可能存在
13. 向MgSO4溶液中逐滴滴入溶质质量分数为20%的NaOH溶液,溶液总质量与滴入NaOH溶液质量关系曲线如图所示。下列说法正确的是( )
A.a点时溶液中的溶质为NaOH、Na2SO4
B.b点时溶液的pH=7
C.原溶液中MgSO4的质量分数为7.5%
D.a点时锥形瓶内所得溶液的溶质质量分数约为12.4%
14.甲、乙、丙、丁四位同学设计了下列有关物质鉴别的方案:
甲:只用水,就有办法鉴别NH4NO3、NaOH、CaCO3和NaCl四种固体;
乙:利用CO2气体就能区分NaOH、Ca(OH)2和稀盐酸三种溶液;
丙:有酚酞和BaCl2溶液,就能鉴别盐酸、硫酸、Na2CO3、NaOH和KNO3五种溶液;
丁:不用其它任何试剂就能将HCl、BaCl2、Na2CO3、NaCl四种溶液鉴别出来。
下列有关这些方案的评价正确的是( )
A.只有甲的可行 B.只有乙和丁的可行
C.只有乙的不可行 D.都可行
15.冰糖葫芦是用一个个表面粘有糖的金桔串联而成的传统小吃,深受同学们的喜欢。小桐想到用所学的化学物质串联成“冰糖葫芦”,如下图所示。已知箭头表示转化关系,图中五种物质的类别都不相同:其中B常温下是一种气体,是光合作用的原料;D是一种常见的碱,可用于中和酸性土壤。下列说法正确的是( )
A.物质A能使无色酚酞试液变红色
B.物质B能使无水硫酸铜呈现蓝色
C.物质C转化为B的方法中有两种反应类型
D.物质D在水中的溶解度随温度升高而增大
16.如图a、b、c、d是初中科学中常见的四种不同类别的物质,连线的两物质(或其水溶液)都能发生化学反应,分别生成甲、乙、丙、丁四种物质(部分生成物已经略去)。其中甲是一种蓝色絮状沉淀物,c为应用最广泛的金属(其粉末颜色为黑色),丙为氯化物。下列推断不合理的是( )
A.a所属的物质类别是碱
B.c与d反应的化学方程式是Fe+2HCl=FeCl2+H2↑
C.a与b反应的基本类型属于复分解反应
D.b的溶液与c反应后,溶液的质量增加
17.金属或非金属单质及其化合物之间能发生一定规律的转化。下列铜及其化合物此的转化能通过一步反应实现的是( )
A.Cu→CuO B.CuO→Cu(OH)2
C.Cu(OH)2→CuCl2 D.CuCl2→Cu
二、填空题
18.我市经济开发过程中,要坚持开发与环保并重。某化学课外活动小组在调查一化工厂时发现,该厂有甲乙两车间,各排出的废水澄清透明,经分析分别含有三种不同离子,共含有Na+、Ag+、Cu2+、CO32-、OH-、NO3-六种离子:
(1)乙车间的废水呈蓝色,其中的阴离子为 ;
(2)甲车间的废水含有的三种离子是 ;
(3)写出检验其中一车间废水中含有OH-的方法. .
19.科比学习了物质的性质后,梳理单质、氧化物、酸、碱、盐与X之间的转化关系如图所示。“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物,生成物及反应条件已略去。
(1)若X是氯化钠,酸→X的化学方程式 ,图中碱的化学式为 ;
(2)若X是水,则能实现图中物质转化的基本反应类型有____(填字母)。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
20.四年一度的世界杯足球赛于2022年11月在卡塔尔举行。足球迷小彬同学设计了以“足球小子”为轮廓的物质反应关系图,其中A~G分别为氧化铜、硫酸铜、氢氧化钙、碳酸钙、硝酸银、氯化钡和铁粉中的一种。已知:相邻的两种物质能发生反应,A、D均是黑色固体,B在水中溶解度很小,E的水溶液呈蓝色。
(1)B在生活或生产中的一种用途是 。
(2)A与稀盐酸完全反应的现象为 。
(3)E与F反应的化学方程式为 。
21.“寓学于乐”是一种有效的学习方式。如图为“领取奖杯游戏”的物质阶梯。只有阶梯上相邻的物质之间能发生反应,才可向上攀登。
(1)若攀登阶梯甲能领取奖杯,则标号为③的台阶可以是下列哪一种物质____。
A.NaCl B.Na2CO3 C.CO2 D.Fe2O3
(2)搭建阶梯乙从图中相应的台阶上物质可以从以下提供的物质O2、Fe、HCl、NaOH中选择,填在图中相应的台阶上,能领取奖杯。从高到低的顺序是 。
22.有一包白色固体可能含Na2CO3、Na2SO4、NaCl、Ba(NO3)2、NaOH中的一种或几种。联盟兴趣小组为探究其成分做了以下实验:
Ⅰ.取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如甲图所示;
Ⅱ.取少量B点时的清液于试管中,滴加酚酞溶液,酚酞溶液不变色;
Ⅲ.继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如乙图所示。请回答下列问题:
(1)BC段可观察到的现象是 ;
(2)白色固体中一定有 ;
(3)为进一步确定该白色固体的成分,该组同学接下来应 。
三、实验探究题
23.有一包固体,可能由硝酸铜、硫酸钠、氯化钠、碳酸钠、氢氧化钠中的一种或几种组成。为了探究该固体的组成,某科学小组设计并开展以下实验:已知,步骤Ⅰ中固体全部消失,溶液呈蓝色,无气泡产生;步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成。
请回答下列问题:
(1)原固体中一定含有的物质是 。
(2)步骤Ⅱ中产生白色沉淀的化学方程式是 。
(3)步骤Ⅲ所得蓝色滤液中一定含有的溶质是 。
24.为了探究复分解反应发生的实质,A、B、C三组同学根据三个特殊的复分解反应设计了实验方案并开展了探究活动,请你参与他们的活动。
【实验探究】A组:探究酸碱反应。
在烧杯中加入氢氧化钾溶液后,滴几滴酚酞试液,然后逐滴加入稀盐酸,最后溶液为无色。小金认为溶液显中性,小东认为不对。小东按以下实验方案进行实验:
实验步骤 实验现象 结论
取少量反应后的溶液于试管中,加入碳酸钠溶液 有气泡产生 稀盐酸过量
B组:探究两种显碱性的溶液是可以反应的。
在烧杯中加入澄清石灰水,加入一定量的碳酸钠溶液后过滤。滤液中溶质是什么?
小方认为溶质是NaOH。
小欢认为溶质是NaOH、Ca(OH)2。
小华认为溶质还有可能是 。
小华思考后用以下方案验证了他的猜想。
实验步骤 实验现象 结论
取少量反应后的溶液于试管中,加入稀盐酸 猜想正确
C组:探究两种盐溶液是可以反应的。
小妮在烧杯中加入碳酸钠溶液,加入一定量的硝酸钡溶液后有白色沉淀生成。小妮得出结论:两种盐溶液是可以反应的。该反应的化学方程式为 。
【延伸与拓展】最后,A、B、C三个小组的同学把三个实验的废液倒在一起,结果发现:先有大量气泡产生,后有白色沉淀产生。过滤后得到无色澄清溶液。最终所得的滤液中一定含有的离子有 。
【反思与总结】复分解反应的实质是两种离子接触后,生成了沉淀、气体或水。
25.有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 。
(2)滤渣a的成分是 。(填写化学式)
(3)写出反应(1)中生成气体的化学方程式: 。
(4)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,现象②不变。则滤渣a的成分一定有 。(填写出化学式)
26.小明取一包某食品包装袋内的“脱氧剂”,查阅资料发现其成分除铁粉外,可能含有碳粉、Na2CO3、NaCl、Fe2O3等。为确定其成分,进行了如下实验:
(1) 过滤操作中除了需带铁圈的铁架台、滤纸、玻璃棒外,还需要用到的仪器有
(2)写出用 pH试纸测定滤液pH的方法 。
(3)要确定pH=9的溶液中是否有NaCl,可以采取的方法是
(4)由实验可知,该包“脱氧剂”一定含有的物质是 。
四、解答题
27.黄铜(由铜和锌形成的合金)有较强的耐磨性能,在生活中有广泛的用途。晓军同学为 了测定黄铜屑样品组成,分四组取样品与稀硫酸反应,其实验数据记录如下表:
样 品 第 1 份 第2份 第3份 第4份
取样品质量(g) 25.0 25.0 25.0 25.0
取稀硫酸质量(g) 40.0 80.0 120.0 160.0
产生气体质量(g) 0.2 0.4 0.5 m
试计算:
(1)上表中 m 的数值是 ;
(2)通过分析上述数据可知,当黄铜样品和稀硫酸的质量比为 时,两者恰好完全 反应;
(3)求所用稀硫酸中硫酸的质量分数?
28.金属材料在人类文明的发展中起着重要作用,古代冶金技术彰显了我国劳动人民的智慧。
(1)战国《韩非子·内储说上》提到,早期采金技术均是“沙里淘金”。金在自然界中主要以 (填“单质”或“化合物”〉形式存在。
(2)北宋沈括所著的《梦溪笔谈》中记载了"湿法炼铜”的方法:“繁胆矾铁釜,久之亦化为铜”。即在“铁釜”中加入硫酸铜溶液,则可得到铜。写出"铁釜”中发生反应的化学方程式: 。
(3)明代宋应星所著的《天工开物》一书,介绍了“火法炼锌”的方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐,如图所示,泥封,“其底铺薪,发火煅红,冷定毁罐取出”。
①炉甘石(ZnCO3)加入锌罐之前,先将其粉碎的目的是 。
②反应区中,炉甘石(ZnCO3)在高温下分解生成氧化锌,煤炭中的碳与氧化锌反应生成锌和二氧化碳,该反应中体现了碳的 (填“还原性"或“氧化性”)。
③必须“冷定”后才能"“毁罐”取锌,请从化学变化的角度解释其原因: 。
29.某化肥厂以“钾泻盐”(MgSO4·KCl·nH2O)为原料制造高质量钾肥,化肥中KCl含量的高低会直接影响着化肥的品质。某兴趣小组为了测定“钾泻盐”中KCl的质量分数及n的值,设计了如下两种实验方案:
试可答下列问题:
(1)加入足量AgNO3溶液后,方案二中生成固体的成量大于方案一,原为是方案二中所得28.7克固体物质中除生成了 外,还生成了微溶的Ag2SO4;
(2)方案一中,滴加足量的Ba(NO3)2溶液,过滤后所得滤液中除可能含有Ba(NO)3外,一定含有的溶质是 ;
(3)该钾泻盐样品中KCl的质量分数为多少 (精确到1%)
(4)该钾泻盐化学式中n的值是多少 (要写出计算过程)
30.有一包不纯的碳酸钠白色粉末,可能含有硫酸钠、氧氧化钠的一种或两种,某科学兴趣小组为确定其成分做了如下实验:
Ⅰ.现取样品16g于烧杯中并加84g水搅拌,全部溶解。再向烧杯中逐渐滴加26.1%硝酸钡溶液并不断搅拌,烧杯内固体的质量随加入硝酸钡溶液的质量的变化如图甲所示;
Ⅱ.在B点开始,向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图乙所示。
(1)CD段发生反应的化学方程式为 。
(2)E点时,溶液中一定含有的溶质是 。
(3)根据上述实验判断原白色粉末中是否存在氢氧化钠,若不存在,请说明理由;若存在,试计算出它的质量?
答案解析部分
1.【答案】D
2.【答案】A
3.【答案】C
4.【答案】A
5.【答案】C
6.【答案】A
7.【答案】B
8.【答案】D
9.【答案】C
10.【答案】B
11.【答案】D
12.【答案】C
13.【答案】D
14.【答案】D
15.【答案】C
16.【答案】D
17.【答案】A,C,D
18.【答案】(1)NO3-
(2)Na+ 、CO32- 、OH-
(3)取样,先加入足量CaCl2,再加入酚酞
19.【答案】(1)HCl+NaOH=NaCl+H2O;NaOH
(2)A;B;C;D
20.【答案】(1)建筑材料
(2)黑色固体消失,溶液由无色变成蓝色
(3)CuSO4+BaCl2=BaSO4 ↓+CuCl2
21.【答案】(1)B
(2)NaOH、HCl、 Fe、 O2
22.【答案】(1)沉淀部分溶解,产生气泡
(2)Na2CO3、Na2SO4、Ba(NO3)2
(3)向溶液中加入过量稀 HNO3(或取实验Ⅲ中的溶液),再加入硝酸银溶液
23.【答案】(1)Cu(NO2)2、Na2SO4;
(2)Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3
(3)Cu(NO3)2、Ba(NO3)2、NaNO3、HNO3
24.【答案】NaOH;Na2CO3;有气泡;Na2CO3+Ba(NO3)2=K+Na+Cl-NO3-
25.【答案】(1)漏斗
(2)CaCO3和Mg(OH)2;
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑
(4)CaCO3和BaSO4
26.【答案】(1)漏斗、烧杯
(2)用洁净的玻璃棒蘸取少量的被测试液滴在pH试纸上,将试纸显示的颜色与标准比色卡进行比较
(3)在溶液中加入足量的硝酸钙或者硝酸钡,过滤,在滤液中加入硝酸银,若有白色沉淀,则存在NaCl
(4)铁粉、碳粉、Na2CO3、Fe2O3
27.【答案】(1)0.5
(2)1:4
(3)与第1、2两份样品反应时,所加硫酸均完全反应(可用这两次数据来计算)设与第1份反应掉的硫酸质量为x
Zn+ H2SO4═ZnSO4+ H2↑
98 2
c 0.2g
98∶2= x∶0.2
x =9.8gH2SO4%=(9.8g/40)×100%=24.5%
28.【答案】(1)单质
(2)Fe+CuSO4=FeSO4+Cu
(3)增大反应物的接触面积,使反应更快更充分;还原性;防止生成的锌在较高的温度下重新被氧化
29.【答案】(1)AgCl
(2)KCl和Mg(NO3)2
(3)
KCl+AgNO3= AgCl+KNO3
74.5 143.5
x 14.35g
x=7.45g
该钾泻盐样品中KCl的质量分数= ×100%≈30%
答:该钾泻盐样品中KCl的质量分数为30%。
(4)解:设样品中硫酸镁的质量为y
MgSO4+Ba(NO3)2= BaSO4+Mg(NO3)2
120 233
y 23.3g
y=12g
结晶水的质量=24.85g 12g 7.45g=5.4g
化学式中硫酸镁与水分子的个数之比 =1 :3 ,即 n=3
答:该钾泻盐化学式中n的值是3。
30.【答案】(1)BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑
(2)HNO3、Ba(NO3)2、NaNO3
(3)BC段固体质量不变,是因为稀硝酸先和氢氧化钠反应生成硝酸钠和水,说明白色粉末中 含有氢氧化钠;
设碳酸钠质量为x,硫酸钠质量为y
BaCl2+ Na2CO3= BaCO3↓+2NaCl
106 197
x 24.36g-4.66g
x= 10.6g
BaCl2+ Na2SO4= BaSO4↓+2NaCl
142 233
y 4.66g
X=2.84
氢氧化钠质量:16g-10.6g-2.84g=2.56g,
所以样品中含有氢氧化钠,质量是 2.56g
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第十一讲:物质互相转化和循环
一、单选题
1.在氢气还原氧化铜的实验中,观察到的现象是( )
A.有红色的铜生成
B.试管底有水生成
C.有铜和水生成
D.黑色固体变成红色,试管口有水珠生成
2.有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种。取样溶于水,有白色沉淀产生;过滤后,向该白色沉淀中滴加过量盐酸,沉淀部分溶解并有气体产生。由此推断白色固体中( )
A.可能存在NaOH B.可能存在Na2SO4
C.肯定不存在BaCl2 D.肯定存在Na2CO3和Na2SO4、NaOH
3.只用一种试剂就能将NaOH、HCl、BaCl2三种溶液一次鉴别出来,它是( )
A.酚酞试液 B.Na2SO4溶液
C.CuSO4溶液 D.Fe(NO3)3溶液
4.下表所列各组物质中,物质之间按箭头所示方向的转化通过一步反应就能实现的是( )
选项 物质
甲 乙 丙 丁
A CO2 CaCO3 H2O O2
B NaOH NaCl CO2 Na2CO3
C H2O2 H2O O2 MgO
D CaO Ca(OH)2 H2O CaCl2
A.A B.B C.C D.D
5.如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
A.甲实验试管口向下倾斜可防止氢气逸出
B.乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生
C.甲、乙两实验中,都应先通入气体,再用酒精灯加热试管、玻璃管,以防止发生爆炸
D.甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应
6.Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下用足量CO还原,得到三种金属单质的混合物4.82g,将生成的CO2气体用足量的澄清石灰水吸收后,产生10.0g白色沉淀,则a的数值为多少?( )
A.6.42 B.7.62 C.9.22 D.无法计算
7.向Cu(NO3)2、Al(NO3)3和AgNO3的混合溶液中加入铁粉,充分反应后过滤,向滤渣中滴加稀硫酸时有气泡产生。下列推断下列推断正确的是( )
A.滤渣中一定有铁、铜、银,可能有铝
B.滤液中的溶质只有Al(NO3)3和Fe(NO3)2
C.滤液中一定有Fe(NO3)2,可能有Al(NO3)3
D.滤液中一定有Al(NO3)3和Fe(NO3)2,可能有Cu(NO3)2
8. 下列实验方案能达到实验目的的是( )
选项 实验目的 实验方案
A 检验氢氧化钠是否变质 溶于水,滴加酚酞试液
B 检验氧气已经集满 将带火星的木条伸入集气瓶中,观察现象
C 鉴别氢气和甲烷 分别点燃,在火焰上方罩干冷的烧杯
D 除去氮气中混有的少量氧气 通过灼热的铜粉
A.A B.B C.C D.D
9.如图是小科同学绘制的单质铜及其化合物的转化模型图,其中能转化的环节有( )
A.①② B.②③ C.①③ D.②④
10.如图为物质转化关系,其中“→”表示某种物质可一步反应生成另一种物质,则下列各组物质按照甲、乙、丙的顺序不符合对应“转化关系”的是( )
A.H2O2、O2、H2O B.NaOH、NaCl、NaNO3
C.CuO、Cu、Cu(NO3)2 D.Na2CO3、CO2、CaCO3
11.如图装置可以做CO还原Fe2O3的实验并检验该反应的气体生成物,已知由一氧化碳发生装置得到的CO中混有杂质CO2和H2O,下列说法正确的是( )
A.B装置玻璃管内发生的是置换反应
B.即使没有A装置,该实验也能达到检验气体生成物的目的
C.实验结束后,应先停止通CO再熄灭B处酒精灯
D.去掉C装置也能证明CO和Fe2O3发生了反应
12.某溶液中的溶质有NaOH、HCl、H2SO4和MgCl2中的一种或几种,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图所示,下列说法正确的是( )
A.HCl和H2SO4一定存在
B.NaOH、H2SO4和MgCl2一定不存在
C.HCl和MgCl2一定存在
D.HCl一定存在NaOH、H2SO4一定不存在,MgCl2可能存在
13. 向MgSO4溶液中逐滴滴入溶质质量分数为20%的NaOH溶液,溶液总质量与滴入NaOH溶液质量关系曲线如图所示。下列说法正确的是( )
A.a点时溶液中的溶质为NaOH、Na2SO4
B.b点时溶液的pH=7
C.原溶液中MgSO4的质量分数为7.5%
D.a点时锥形瓶内所得溶液的溶质质量分数约为12.4%
14.甲、乙、丙、丁四位同学设计了下列有关物质鉴别的方案:
甲:只用水,就有办法鉴别NH4NO3、NaOH、CaCO3和NaCl四种固体;
乙:利用CO2气体就能区分NaOH、Ca(OH)2和稀盐酸三种溶液;
丙:有酚酞和BaCl2溶液,就能鉴别盐酸、硫酸、Na2CO3、NaOH和KNO3五种溶液;
丁:不用其它任何试剂就能将HCl、BaCl2、Na2CO3、NaCl四种溶液鉴别出来。
下列有关这些方案的评价正确的是( )
A.只有甲的可行 B.只有乙和丁的可行
C.只有乙的不可行 D.都可行
15.冰糖葫芦是用一个个表面粘有糖的金桔串联而成的传统小吃,深受同学们的喜欢。小桐想到用所学的化学物质串联成“冰糖葫芦”,如下图所示。已知箭头表示转化关系,图中五种物质的类别都不相同:其中B常温下是一种气体,是光合作用的原料;D是一种常见的碱,可用于中和酸性土壤。下列说法正确的是( )
A.物质A能使无色酚酞试液变红色
B.物质B能使无水硫酸铜呈现蓝色
C.物质C转化为B的方法中有两种反应类型
D.物质D在水中的溶解度随温度升高而增大
16.如图a、b、c、d是初中科学中常见的四种不同类别的物质,连线的两物质(或其水溶液)都能发生化学反应,分别生成甲、乙、丙、丁四种物质(部分生成物已经略去)。其中甲是一种蓝色絮状沉淀物,c为应用最广泛的金属(其粉末颜色为黑色),丙为氯化物。下列推断不合理的是( )
A.a所属的物质类别是碱
B.c与d反应的化学方程式是Fe+2HCl=FeCl2+H2↑
C.a与b反应的基本类型属于复分解反应
D.b的溶液与c反应后,溶液的质量增加
17.金属或非金属单质及其化合物之间能发生一定规律的转化。下列铜及其化合物此的转化能通过一步反应实现的是( )
A.Cu→CuO B.CuO→Cu(OH)2
C.Cu(OH)2→CuCl2 D.CuCl2→Cu
二、填空题
18.我市经济开发过程中,要坚持开发与环保并重。某化学课外活动小组在调查一化工厂时发现,该厂有甲乙两车间,各排出的废水澄清透明,经分析分别含有三种不同离子,共含有Na+、Ag+、Cu2+、CO32-、OH-、NO3-六种离子:
(1)乙车间的废水呈蓝色,其中的阴离子为 ;
(2)甲车间的废水含有的三种离子是 ;
(3)写出检验其中一车间废水中含有OH-的方法. .
19.科比学习了物质的性质后,梳理单质、氧化物、酸、碱、盐与X之间的转化关系如图所示。“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物,生成物及反应条件已略去。
(1)若X是氯化钠,酸→X的化学方程式 ,图中碱的化学式为 ;
(2)若X是水,则能实现图中物质转化的基本反应类型有____(填字母)。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
20.四年一度的世界杯足球赛于2022年11月在卡塔尔举行。足球迷小彬同学设计了以“足球小子”为轮廓的物质反应关系图,其中A~G分别为氧化铜、硫酸铜、氢氧化钙、碳酸钙、硝酸银、氯化钡和铁粉中的一种。已知:相邻的两种物质能发生反应,A、D均是黑色固体,B在水中溶解度很小,E的水溶液呈蓝色。
(1)B在生活或生产中的一种用途是 。
(2)A与稀盐酸完全反应的现象为 。
(3)E与F反应的化学方程式为 。
21.“寓学于乐”是一种有效的学习方式。如图为“领取奖杯游戏”的物质阶梯。只有阶梯上相邻的物质之间能发生反应,才可向上攀登。
(1)若攀登阶梯甲能领取奖杯,则标号为③的台阶可以是下列哪一种物质____。
A.NaCl B.Na2CO3 C.CO2 D.Fe2O3
(2)搭建阶梯乙从图中相应的台阶上物质可以从以下提供的物质O2、Fe、HCl、NaOH中选择,填在图中相应的台阶上,能领取奖杯。从高到低的顺序是 。
22.有一包白色固体可能含Na2CO3、Na2SO4、NaCl、Ba(NO3)2、NaOH中的一种或几种。联盟兴趣小组为探究其成分做了以下实验:
Ⅰ.取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如甲图所示;
Ⅱ.取少量B点时的清液于试管中,滴加酚酞溶液,酚酞溶液不变色;
Ⅲ.继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如乙图所示。请回答下列问题:
(1)BC段可观察到的现象是 ;
(2)白色固体中一定有 ;
(3)为进一步确定该白色固体的成分,该组同学接下来应 。
三、实验探究题
23.有一包固体,可能由硝酸铜、硫酸钠、氯化钠、碳酸钠、氢氧化钠中的一种或几种组成。为了探究该固体的组成,某科学小组设计并开展以下实验:已知,步骤Ⅰ中固体全部消失,溶液呈蓝色,无气泡产生;步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成。
请回答下列问题:
(1)原固体中一定含有的物质是 。
(2)步骤Ⅱ中产生白色沉淀的化学方程式是 。
(3)步骤Ⅲ所得蓝色滤液中一定含有的溶质是 。
24.为了探究复分解反应发生的实质,A、B、C三组同学根据三个特殊的复分解反应设计了实验方案并开展了探究活动,请你参与他们的活动。
【实验探究】A组:探究酸碱反应。
在烧杯中加入氢氧化钾溶液后,滴几滴酚酞试液,然后逐滴加入稀盐酸,最后溶液为无色。小金认为溶液显中性,小东认为不对。小东按以下实验方案进行实验:
实验步骤 实验现象 结论
取少量反应后的溶液于试管中,加入碳酸钠溶液 有气泡产生 稀盐酸过量
B组:探究两种显碱性的溶液是可以反应的。
在烧杯中加入澄清石灰水,加入一定量的碳酸钠溶液后过滤。滤液中溶质是什么?
小方认为溶质是NaOH。
小欢认为溶质是NaOH、Ca(OH)2。
小华认为溶质还有可能是 。
小华思考后用以下方案验证了他的猜想。
实验步骤 实验现象 结论
取少量反应后的溶液于试管中,加入稀盐酸 猜想正确
C组:探究两种盐溶液是可以反应的。
小妮在烧杯中加入碳酸钠溶液,加入一定量的硝酸钡溶液后有白色沉淀生成。小妮得出结论:两种盐溶液是可以反应的。该反应的化学方程式为 。
【延伸与拓展】最后,A、B、C三个小组的同学把三个实验的废液倒在一起,结果发现:先有大量气泡产生,后有白色沉淀产生。过滤后得到无色澄清溶液。最终所得的滤液中一定含有的离子有 。
【反思与总结】复分解反应的实质是两种离子接触后,生成了沉淀、气体或水。
25.有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 。
(2)滤渣a的成分是 。(填写化学式)
(3)写出反应(1)中生成气体的化学方程式: 。
(4)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,现象②不变。则滤渣a的成分一定有 。(填写出化学式)
26.小明取一包某食品包装袋内的“脱氧剂”,查阅资料发现其成分除铁粉外,可能含有碳粉、Na2CO3、NaCl、Fe2O3等。为确定其成分,进行了如下实验:
(1) 过滤操作中除了需带铁圈的铁架台、滤纸、玻璃棒外,还需要用到的仪器有
(2)写出用 pH试纸测定滤液pH的方法 。
(3)要确定pH=9的溶液中是否有NaCl,可以采取的方法是
(4)由实验可知,该包“脱氧剂”一定含有的物质是 。
四、解答题
27.黄铜(由铜和锌形成的合金)有较强的耐磨性能,在生活中有广泛的用途。晓军同学为 了测定黄铜屑样品组成,分四组取样品与稀硫酸反应,其实验数据记录如下表:
样 品 第 1 份 第2份 第3份 第4份
取样品质量(g) 25.0 25.0 25.0 25.0
取稀硫酸质量(g) 40.0 80.0 120.0 160.0
产生气体质量(g) 0.2 0.4 0.5 m
试计算:
(1)上表中 m 的数值是 ;
(2)通过分析上述数据可知,当黄铜样品和稀硫酸的质量比为 时,两者恰好完全 反应;
(3)求所用稀硫酸中硫酸的质量分数?
28.金属材料在人类文明的发展中起着重要作用,古代冶金技术彰显了我国劳动人民的智慧。
(1)战国《韩非子·内储说上》提到,早期采金技术均是“沙里淘金”。金在自然界中主要以 (填“单质”或“化合物”〉形式存在。
(2)北宋沈括所著的《梦溪笔谈》中记载了"湿法炼铜”的方法:“繁胆矾铁釜,久之亦化为铜”。即在“铁釜”中加入硫酸铜溶液,则可得到铜。写出"铁釜”中发生反应的化学方程式: 。
(3)明代宋应星所著的《天工开物》一书,介绍了“火法炼锌”的方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐,如图所示,泥封,“其底铺薪,发火煅红,冷定毁罐取出”。
①炉甘石(ZnCO3)加入锌罐之前,先将其粉碎的目的是 。
②反应区中,炉甘石(ZnCO3)在高温下分解生成氧化锌,煤炭中的碳与氧化锌反应生成锌和二氧化碳,该反应中体现了碳的 (填“还原性"或“氧化性”)。
③必须“冷定”后才能"“毁罐”取锌,请从化学变化的角度解释其原因: 。
29.某化肥厂以“钾泻盐”(MgSO4·KCl·nH2O)为原料制造高质量钾肥,化肥中KCl含量的高低会直接影响着化肥的品质。某兴趣小组为了测定“钾泻盐”中KCl的质量分数及n的值,设计了如下两种实验方案:
试可答下列问题:
(1)加入足量AgNO3溶液后,方案二中生成固体的成量大于方案一,原为是方案二中所得28.7克固体物质中除生成了 外,还生成了微溶的Ag2SO4;
(2)方案一中,滴加足量的Ba(NO3)2溶液,过滤后所得滤液中除可能含有Ba(NO)3外,一定含有的溶质是 ;
(3)该钾泻盐样品中KCl的质量分数为多少 (精确到1%)
(4)该钾泻盐化学式中n的值是多少 (要写出计算过程)
30.有一包不纯的碳酸钠白色粉末,可能含有硫酸钠、氧氧化钠的一种或两种,某科学兴趣小组为确定其成分做了如下实验:
Ⅰ.现取样品16g于烧杯中并加84g水搅拌,全部溶解。再向烧杯中逐渐滴加26.1%硝酸钡溶液并不断搅拌,烧杯内固体的质量随加入硝酸钡溶液的质量的变化如图甲所示;
Ⅱ.在B点开始,向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图乙所示。
(1)CD段发生反应的化学方程式为 。
(2)E点时,溶液中一定含有的溶质是 。
(3)根据上述实验判断原白色粉末中是否存在氢氧化钠,若不存在,请说明理由;若存在,试计算出它的质量?
答案解析部分
1.【答案】D
2.【答案】A
3.【答案】C
4.【答案】A
5.【答案】C
6.【答案】A
7.【答案】B
8.【答案】D
9.【答案】C
10.【答案】B
11.【答案】D
12.【答案】C
13.【答案】D
14.【答案】D
15.【答案】C
16.【答案】D
17.【答案】A,C,D
18.【答案】(1)NO3-
(2)Na+ 、CO32- 、OH-
(3)取样,先加入足量CaCl2,再加入酚酞
19.【答案】(1)HCl+NaOH=NaCl+H2O;NaOH
(2)A;B;C;D
20.【答案】(1)建筑材料
(2)黑色固体消失,溶液由无色变成蓝色
(3)CuSO4+BaCl2=BaSO4 ↓+CuCl2
21.【答案】(1)B
(2)NaOH、HCl、 Fe、 O2
22.【答案】(1)沉淀部分溶解,产生气泡
(2)Na2CO3、Na2SO4、Ba(NO3)2
(3)向溶液中加入过量稀 HNO3(或取实验Ⅲ中的溶液),再加入硝酸银溶液
23.【答案】(1)Cu(NO2)2、Na2SO4;
(2)Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3
(3)Cu(NO3)2、Ba(NO3)2、NaNO3、HNO3
24.【答案】NaOH;Na2CO3;有气泡;Na2CO3+Ba(NO3)2=K+Na+Cl-NO3-
25.【答案】(1)漏斗
(2)CaCO3和Mg(OH)2;
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑
(4)CaCO3和BaSO4
26.【答案】(1)漏斗、烧杯
(2)用洁净的玻璃棒蘸取少量的被测试液滴在pH试纸上,将试纸显示的颜色与标准比色卡进行比较
(3)在溶液中加入足量的硝酸钙或者硝酸钡,过滤,在滤液中加入硝酸银,若有白色沉淀,则存在NaCl
(4)铁粉、碳粉、Na2CO3、Fe2O3
27.【答案】(1)0.5
(2)1:4
(3)与第1、2两份样品反应时,所加硫酸均完全反应(可用这两次数据来计算)设与第1份反应掉的硫酸质量为x
Zn+ H2SO4═ZnSO4+ H2↑
98 2
c 0.2g
98∶2= x∶0.2
x =9.8gH2SO4%=(9.8g/40)×100%=24.5%
28.【答案】(1)单质
(2)Fe+CuSO4=FeSO4+Cu
(3)增大反应物的接触面积,使反应更快更充分;还原性;防止生成的锌在较高的温度下重新被氧化
29.【答案】(1)AgCl
(2)KCl和Mg(NO3)2
(3)
KCl+AgNO3= AgCl+KNO3
74.5 143.5
x 14.35g
x=7.45g
该钾泻盐样品中KCl的质量分数= ×100%≈30%
答:该钾泻盐样品中KCl的质量分数为30%。
(4)解:设样品中硫酸镁的质量为y
MgSO4+Ba(NO3)2= BaSO4+Mg(NO3)2
120 233
y 23.3g
y=12g
结晶水的质量=24.85g 12g 7.45g=5.4g
化学式中硫酸镁与水分子的个数之比 =1 :3 ,即 n=3
答:该钾泻盐化学式中n的值是3。
30.【答案】(1)BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑
(2)HNO3、Ba(NO3)2、NaNO3
(3)BC段固体质量不变,是因为稀硝酸先和氢氧化钠反应生成硝酸钠和水,说明白色粉末中 含有氢氧化钠;
设碳酸钠质量为x,硫酸钠质量为y
BaCl2+ Na2CO3= BaCO3↓+2NaCl
106 197
x 24.36g-4.66g
x= 10.6g
BaCl2+ Na2SO4= BaSO4↓+2NaCl
142 233
y 4.66g
X=2.84
氢氧化钠质量:16g-10.6g-2.84g=2.56g,
所以样品中含有氢氧化钠,质量是 2.56g
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
