天津市2023-2024学年度重点校联考高二化学(扫描版含答案)
文档属性
| 名称 | 天津市2023-2024学年度重点校联考高二化学(扫描版含答案) |  | |
| 格式 | |||
| 文件大小 | 9.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-26 08:09:42 | ||
图片预览


文档简介
2
8
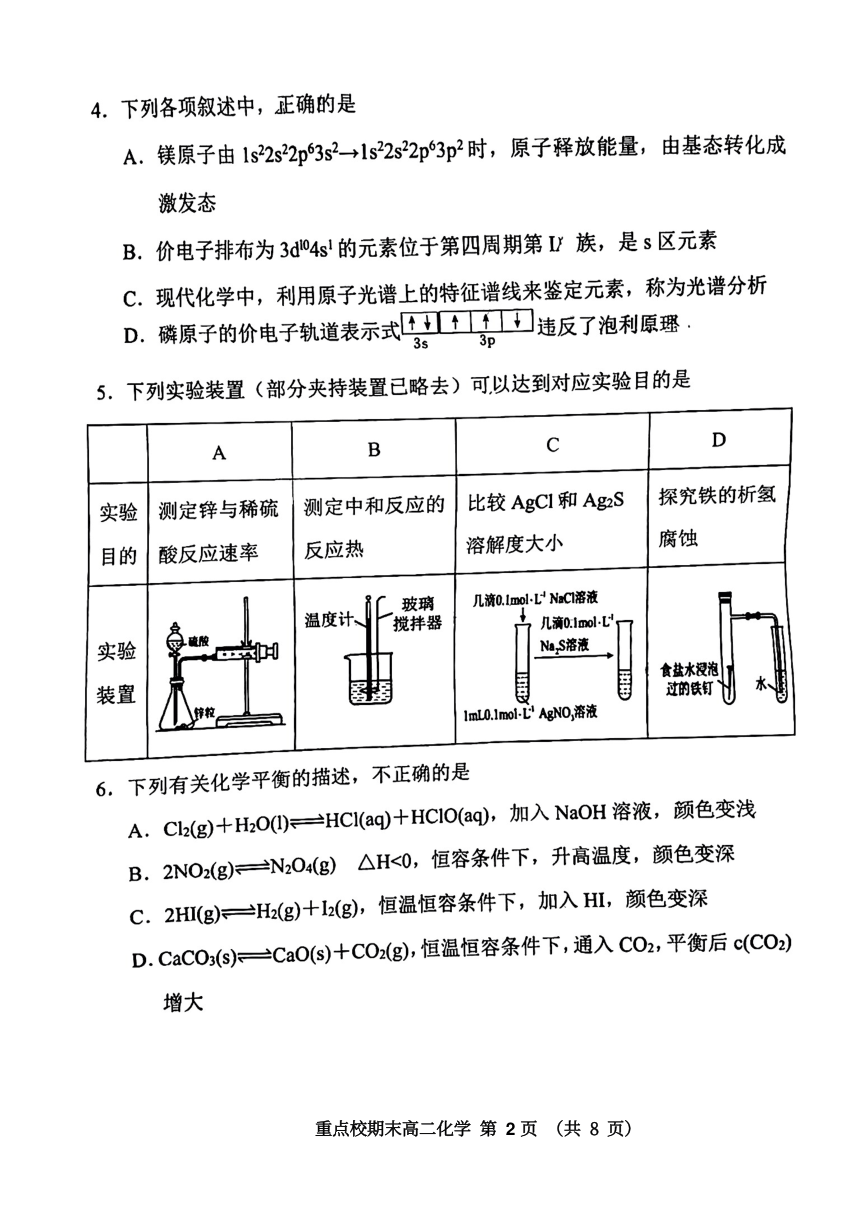
7.化学小组研究金属的电化学腐蚀,实验如下:
序号
实验I
实验Ⅱ
酚酞溶液+K,Fe(CN)s溶液
酚酞溶液+KIFe(CN)6溶液
锌片
铜片
实验
琼脂
琼脂
食盐水
铁钉
食盐水
铁钉
培养皿
培养皿
现象
铁钉周边出现
色
铁钉周边出现蓝色
锌片周边未见明显变化
铜片周边略显红色
下列说法不正确的是
A,实验I中铁钉周边出现红色
B.实验1中负极的电极反应式:Fe-2e=e2*
C.实验IⅡ中正极的电极反应式:O2+2H20+4e=40H
D.对比实验I、Ⅱ可知,生活中镀锌铁板比镀铜铁板在镀层破损后更耐腐蚀
8.某温度下,在某一恒容密闭容器中,充入一定物质的量的NO0和C,发生
反应2NO(g)+Cl2(g)三2NOCI(g)△H<0,下列说法正确的是
A.仅适当降低温度,该反应的正逆反应速率均减小
B,加入合适的催化剂,该反应达到平衡时cO)沁C)的
的值将增大
C.该反应的反应物的键能总和本于生成物的键能总和
D.保持其他条件不变,仅充入少量的稀有气体,该反应的速率将增大
9.利用如图所示装置模拟电解在工业生产的应用,下列
直流电源
说法正确的是
A.若要在铁片上镀铜,Z为NSO4溶液
B.若要在铁片上镀铜,X、Y分别为纯铜和铁片
C.若Z是饱和NaCI溶液,电解一段时间后,Y
2
电极析出少量的Na
D.若Z是饱和NaCl溶液,X电极首先发生的电极反应式是:
2H20.4e=4H++021
3
13.常温下,向20mL0.2mol/LH2X溶液中滴加0.2mol/LNa0H溶液,溶液中
各微粒的物质的量分数随pH的变化如图所示,以下说法不正确的是
100
质
H2X
HX
分
50
6
9101112134
pH
A.由图可推测,H2X为弱酸
B.滴加过程中发生的反应:H2X+OH=HX+H20,HX+OH=X2+H2O
C.水的电离程度:a点与b点大致相等
D.若常温下Ka(Y=l.l×102,HY与少量Na2X发生的反应是:
2HY+X2-H2X+2Y
14.如图所示与对应叙述相符的是
pH
ce2或c(Cu2)
PH
4
甲酸
林积分数%
②
-FeS
乙酸
①
CuS
a()
VHO)
05101520Va0H/mL
n(N)/n(H)
分
乙
丙
A.图甲:一定温度FeS、CuS沉淀溶解平衡曲线,则Ksp(FeS)Ksp(CuS)
B.图乙:等体积pH=2的甲酸与乙酸稀释的pH曲线,则酸性:甲酸<乙酸
C.图丙:某温度下向20mL0.1molL-1CH3C0OH溶液中逐滴加入0.1
molL1NaOH溶液,pH变化曲线如图丙所示(忽略温度变化).则
①点(CH3COO->cNa)>c(CH3COOH)
D.图丁:N2(g)+3H2(g)一2NH3(g)平衡时NH3体积分数随起始
n(N2)n(H2)变化曲线,则转化率:A(H2)=(H2
5
8
8
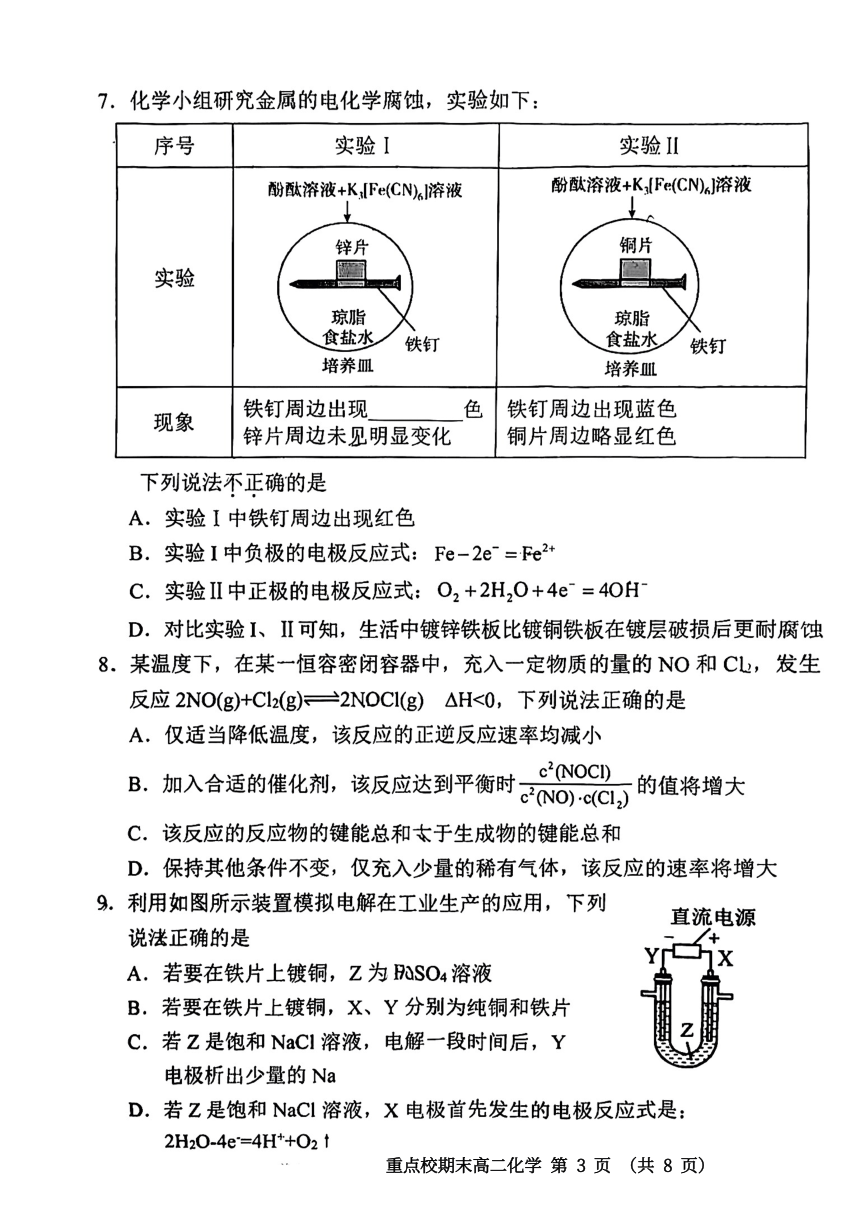
7.化学小组研究金属的电化学腐蚀,实验如下:
序号
实验I
实验Ⅱ
酚酞溶液+K,Fe(CN)s溶液
酚酞溶液+KIFe(CN)6溶液
锌片
铜片
实验
琼脂
琼脂
食盐水
铁钉
食盐水
铁钉
培养皿
培养皿
现象
铁钉周边出现
色
铁钉周边出现蓝色
锌片周边未见明显变化
铜片周边略显红色
下列说法不正确的是
A,实验I中铁钉周边出现红色
B.实验1中负极的电极反应式:Fe-2e=e2*
C.实验IⅡ中正极的电极反应式:O2+2H20+4e=40H
D.对比实验I、Ⅱ可知,生活中镀锌铁板比镀铜铁板在镀层破损后更耐腐蚀
8.某温度下,在某一恒容密闭容器中,充入一定物质的量的NO0和C,发生
反应2NO(g)+Cl2(g)三2NOCI(g)△H<0,下列说法正确的是
A.仅适当降低温度,该反应的正逆反应速率均减小
B,加入合适的催化剂,该反应达到平衡时cO)沁C)的
的值将增大
C.该反应的反应物的键能总和本于生成物的键能总和
D.保持其他条件不变,仅充入少量的稀有气体,该反应的速率将增大
9.利用如图所示装置模拟电解在工业生产的应用,下列
直流电源
说法正确的是
A.若要在铁片上镀铜,Z为NSO4溶液
B.若要在铁片上镀铜,X、Y分别为纯铜和铁片
C.若Z是饱和NaCI溶液,电解一段时间后,Y
2
电极析出少量的Na
D.若Z是饱和NaCl溶液,X电极首先发生的电极反应式是:
2H20.4e=4H++021
3
13.常温下,向20mL0.2mol/LH2X溶液中滴加0.2mol/LNa0H溶液,溶液中
各微粒的物质的量分数随pH的变化如图所示,以下说法不正确的是
100
质
H2X
HX
分
50
6
9101112134
pH
A.由图可推测,H2X为弱酸
B.滴加过程中发生的反应:H2X+OH=HX+H20,HX+OH=X2+H2O
C.水的电离程度:a点与b点大致相等
D.若常温下Ka(Y=l.l×102,HY与少量Na2X发生的反应是:
2HY+X2-H2X+2Y
14.如图所示与对应叙述相符的是
pH
ce2或c(Cu2)
PH
4
甲酸
林积分数%
②
-FeS
乙酸
①
CuS
a()
VHO)
05101520Va0H/mL
n(N)/n(H)
分
乙
丙
A.图甲:一定温度FeS、CuS沉淀溶解平衡曲线,则Ksp(FeS)Ksp(CuS)
B.图乙:等体积pH=2的甲酸与乙酸稀释的pH曲线,则酸性:甲酸<乙酸
C.图丙:某温度下向20mL0.1molL-1CH3C0OH溶液中逐滴加入0.1
molL1NaOH溶液,pH变化曲线如图丙所示(忽略温度变化).则
①点(CH3COO->cNa)>c(CH3COOH)
D.图丁:N2(g)+3H2(g)一2NH3(g)平衡时NH3体积分数随起始
n(N2)n(H2)变化曲线,则转化率:A(H2)=(H2
5
8
同课章节目录
