河南省开封市等2地2023-2024学年高二上学期1月期末调研化学试题(含答案)
文档属性
| 名称 | 河南省开封市等2地2023-2024学年高二上学期1月期末调研化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 820.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-26 09:23:26 | ||
图片预览


文档简介
开封市等2地2023-2024学年第一学期期末调研试卷
高二化学
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,本卷考试时间为90分钟,满分为100分。
2.答卷前,考生将自己的姓名、准考证号、考试科目、试卷类型用2B铅笔涂写在答题卡上。
3.第Ⅰ卷每小题选出答案后,用2B铅笔在答题卡上将对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试卷上。
4.第Ⅱ卷所有题目的答案,考生须用0.5毫米黑色签字笔答在答题卡规定的区域内,在试卷上答题不得分。
5.考试结束,监考人员将答题卡收回。
可能用到的相对原子质量:Mg-24 Cu-64
第Ⅰ卷(选择题)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。)
1.下列轨道表示式中,属于氧的基态原子的是( )
A. B.
C. D.
2.下列粒子的模型为四面体且其空间结构为三角锥形的是( )
A. B. C. D.
3.下列现象能用“相似相溶”规律解释的是( )
A.用纯碱洗涤油脂 B.溴易溶于四氯化碳
C.酸性:甲酸>乙酸>丙酸 D.碘易溶于浓碘化钾水溶液
4.下列曲线表示卤族元素或其单质性质随核电荷数的变化趋势,正确的是( )
A. B.
C. D.
5.下列物质的性质与分子间作用力无关的是( )
A.比易液化 B.沸点:
C.等质量的冰比液态水的体积大 D.稳定性:
6.元素周期表中铋元素的数据见下图,下列说法错误的是( )
A.铋原子的价层电子排布式为
B.铋原子能级有三个未成对电子
C.铋原子最外层有5个能量相同的电子
D.铋元素的相对原子质量是
7.下列说法中,正确的是( )
A.在所有分子中都存在化学键
B.所有的键的强度都比键的大
C.键长等于成键两原子的半径之和
D.键可以绕键轴旋转,键一定不能绕键轴旋转
8.下列现象与电化学腐蚀无关的是( )
A.银质物品久置表面变暗 B.船体上镶嵌锌块,船体不易被腐蚀
C.生铁中含有碳,抗腐蚀能力比纯铁弱 D.用锡焊接的铜质器件,焊接处易生锈
9.下列说法中,错误的是( )
A.和轨道形状均为哑铃形
B.元素周期表中,区全部是金属元素
C.、、轨道相互垂直,但能量相等
D.共价化合物中,电负性大的成键元素表现为负价
10.下列有关晶胞的说法中,正确的是( )
A.晶胞是晶体中最小的平行六面体 B.晶胞是晶体结构中最小的重复单元
C.晶胞中的粒子都完全属于该晶胞 D.不同晶体中晶胞的大小和形状均相同
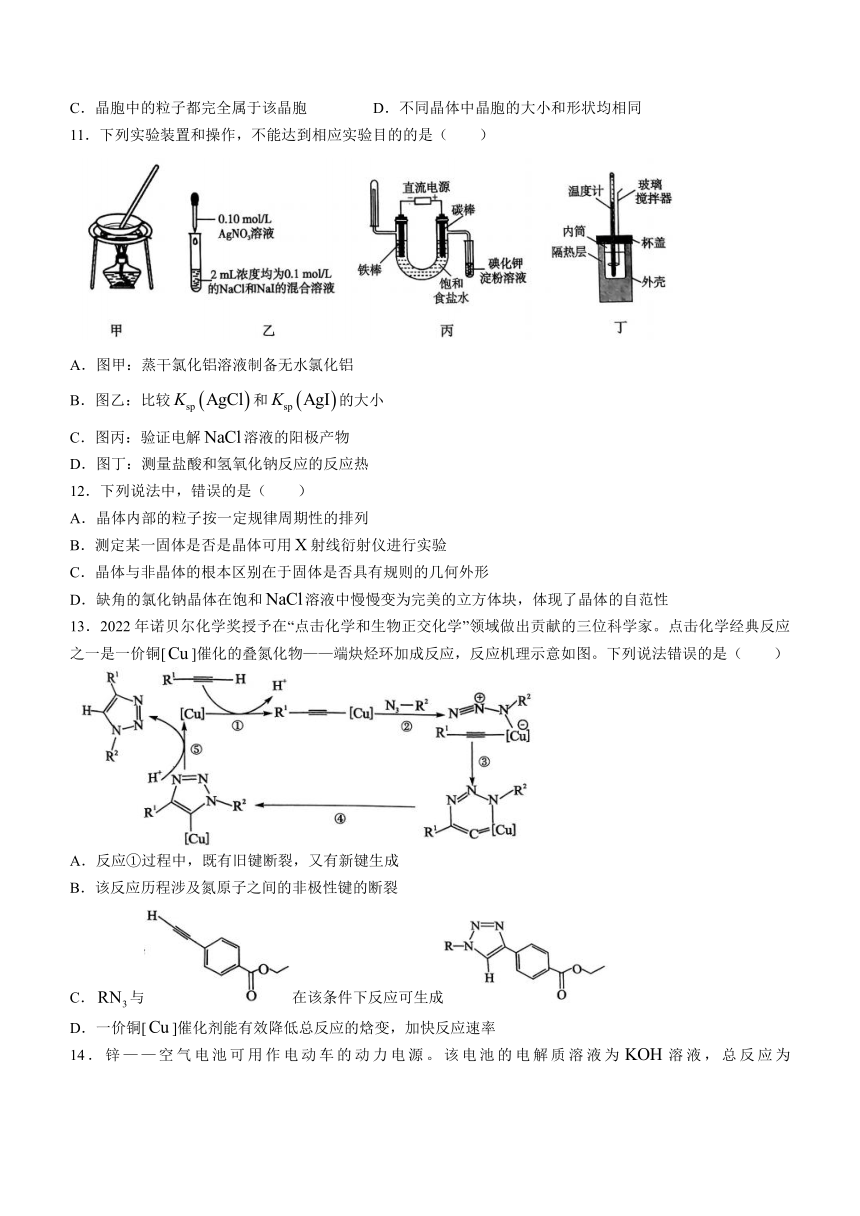
11.下列实验装置和操作,不能达到相应实验目的的是( )
A.图甲:蒸干氯化铝溶液制备无水氯化铝
B.图乙:比较和的大小
C.图丙:验证电解溶液的阳极产物
D.图丁:测量盐酸和氢氧化钠反应的反应热
12.下列说法中,错误的是( )
A.晶体内部的粒子按一定规律周期性的排列
B.测定某一固体是否是晶体可用射线衍射仪进行实验
C.晶体与非晶体的根本区别在于固体是否具有规则的几何外形
D.缺角的氯化钠晶体在饱和溶液中慢慢变为完美的立方体块,体现了晶体的自范性
13.2022年诺贝尔化学奖授予在“点击化学和生物正交化学”领域做出贡献的三位科学家。点击化学经典反应之一是一价铜[]催化的叠氮化物——端炔烃环加成反应,反应机理示意如图。下列说法错误的是( )
A.反应①过程中,既有旧键断裂,又有新键生成
B.该反应历程涉及氮原子之间的非极性键的断裂
C.与在该条件下反应可生成
D.一价铜[]催化剂能有效降低总反应的焓变,加快反应速率
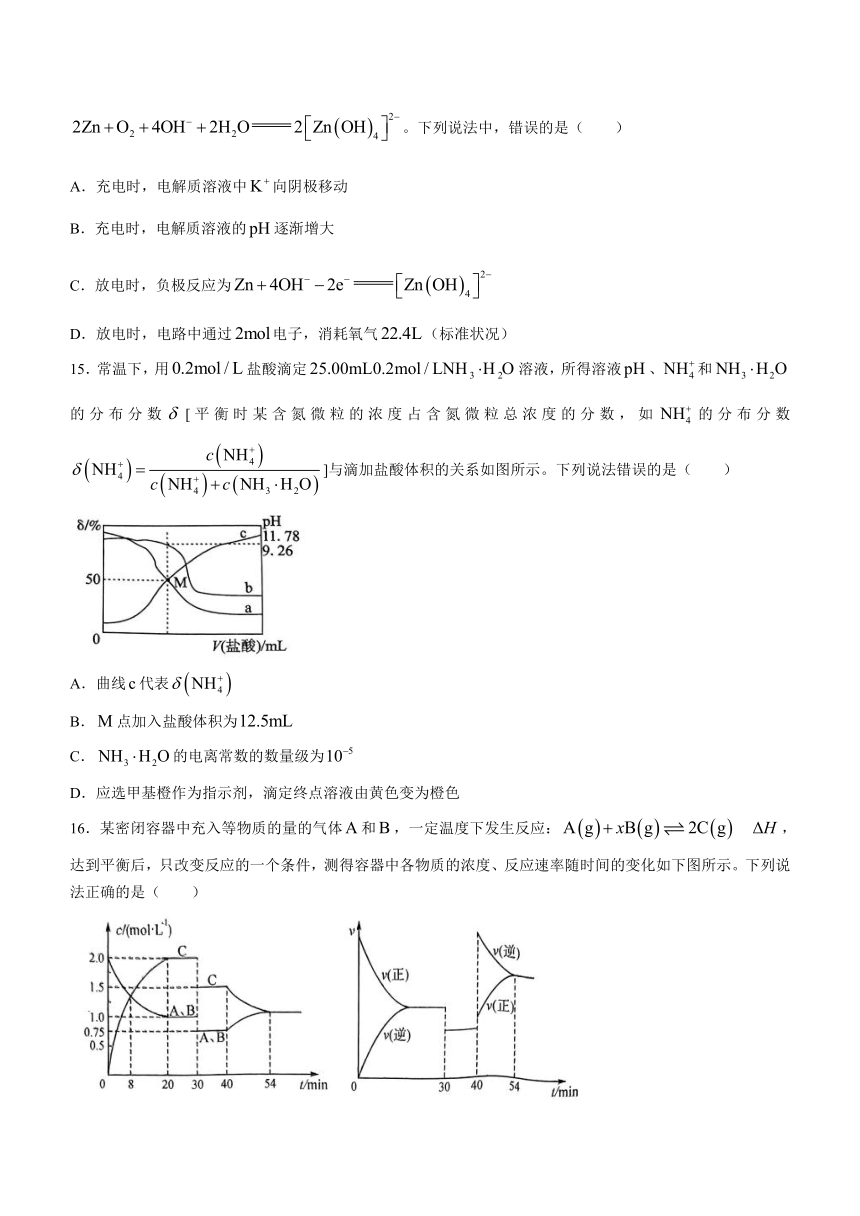
14.锌——空气电池可用作电动车的动力电源。该电池的电解质溶液为溶液,总反应为。下列说法中,错误的是( )
A.充电时,电解质溶液中向阴极移动
B.充电时,电解质溶液的逐渐增大
C.放电时,负极反应为
D.放电时,电路中通过电子,消耗氧气(标准状况)
15.常温下,用盐酸滴定溶液,所得溶液、和的分布分数[平衡时某含氮微粒的浓度占含氮微粒总浓度的分数,如的分布分数]与滴加盐酸体积的关系如图所示。下列说法错误的是( )
A.曲线代表
B.点加入盐酸体积为
C.的电离常数的数量级为
D.应选甲基橙作为指示剂,滴定终点溶液由黄色变为橙色
16.某密闭容器中充入等物质的量的气体和,一定温度下发生反应: ,达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间的变化如下图所示。下列说法正确的是( )
A.时达到化学平衡状态
B.时降低温度,时升高温度
C.反应方程式中的,正反应为放热反应
D.内用表示的平均反应速率为
第Ⅱ卷(非选择题)
二、非选择题(本题包括5小题,共52分)
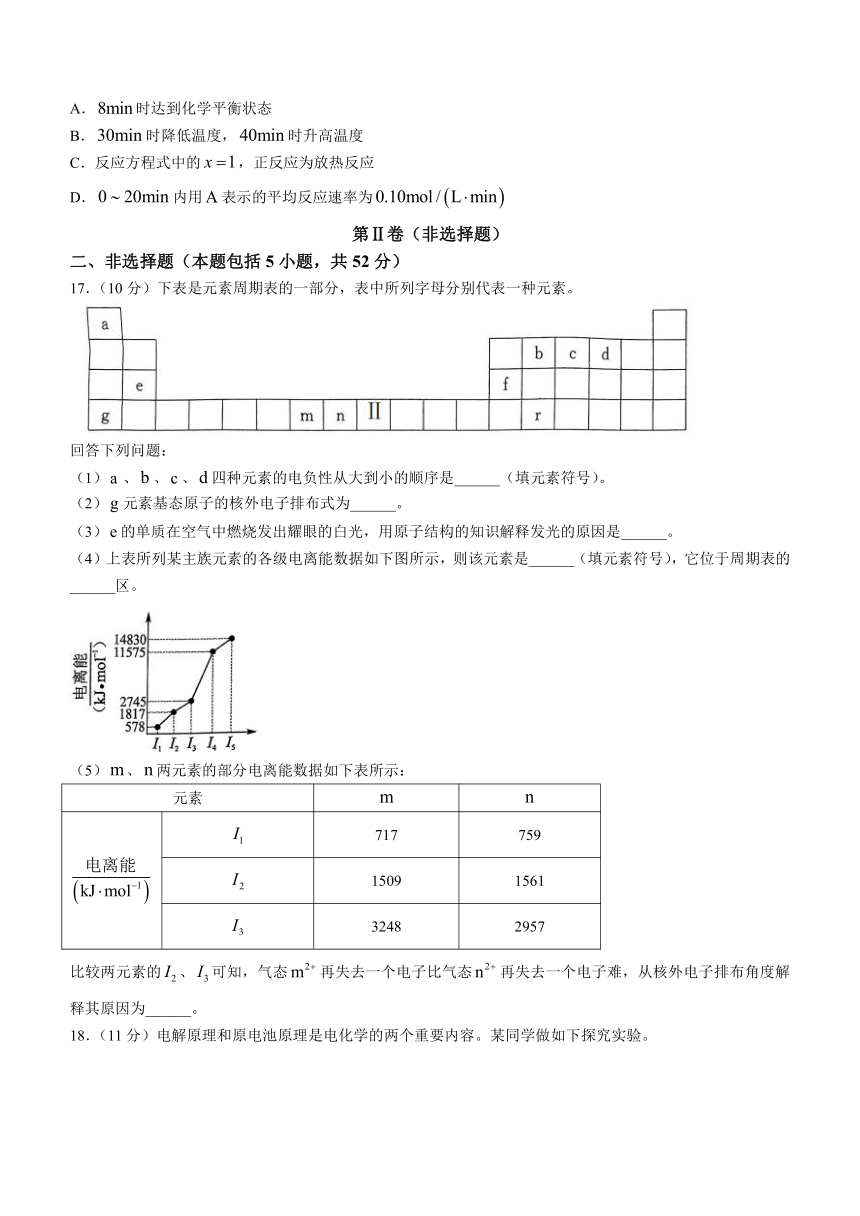
17.(10分)下表是元素周期表的一部分,表中所列字母分别代表一种元素。
回答下列问题:
(1)、、、四种元素的电负性从大到小的顺序是______(填元素符号)。
(2)元素基态原子的核外电子排布式为______。
(3)的单质在空气中燃烧发出耀眼的白光,用原子结构的知识解释发光的原因是______。
(4)上表所列某主族元素的各级电离能数据如下图所示,则该元素是______(填元素符号),它位于周期表的______区。
(5)、两元素的部分电离能数据如下表所示:
元素
717 759
1509 1561
3248 2957
比较两元素的、可知,气态再失去一个电子比气态再失去一个电子难,从核外电子排布角度解释其原因为______。
18.(11分)电解原理和原电池原理是电化学的两个重要内容。某同学做如下探究实验。
回答下列问题:
(1)如图1为某同学依据氧化还原反应设计的原电池装置,该反应的离子方程式为______。反应前,两电极质量相等,一段时间后,两电极质量相差,则导线中通过电子的物质的量为______。盐桥中装有含饱和溶液的琼脂,盐桥的作用有______(答出两点即可)。
(2)如图2,其他条件不变,将盐桥换成铜丝与石墨相连成型,则石墨为______极(填“正”、“负”、“阴”、“阳”),石墨上发生的电极反应为______,甲烧杯中总反应为______。
19.(10分)已知与可以形成和两种化合物。回答下列问题:
(1)水中粒子间作用力有①②水分子间的范德华力③氢键,从强到弱顺序为______(填序号)。可与形成,中采用______杂化。中键角比中键角大的原因为______。
(2)是常用的氧化剂,其分子结构如下图所示,两个氢原子犹如在半展开的书的两面上。的电子式为______;是______分子(填“极性”或“非极性”)。能与水混溶,却不溶于的原因是______。
20.(11分)氢能是一种极具发展潜力的清洁能源。
(1) 是目前大规模制取氢气的重要方法之一。
①时,该反应的平衡常数,在容积为的密闭容器中进行反应,测得某一时刻混合物中、、和的物质的量分别为、、和,该反应的平衡常数表达式为______;判断该时刻反应______(填“正向进行”、“逆向进行”或“达平衡”)。
②时,该反应的平衡常数。在容积为的密闭容器中,将与混合加热到,反应达平衡时的转化率为______;欲提高反应速率及的平衡转化率,理论上可以采取的措施为______(填序号)。
a.通入过量水蒸气 b.降低温度 c.增大压强 d.加入催化剂
(2)工业上利用得到的与进一步合成二甲醚:
其他条件不变时,相同时间内的转化率随温度的变化情况如图所示。
(1)合成二甲醚反应的______0(填“>”“<”或“=”)。
(2)图中,在之前,随温度升高,转化率增大的原因是______。
(3)在图中绘制出转化率随压强变化的曲线图(作出趋势即可)。
21.(10分)氯碱工业是化工产业的重要基础,其原理示意图如下。生产过程中产生的副产物氯酸盐需要处理。
已知:ⅰ.当升高时,易歧化为和。ⅱ.与不反应。
回答下列问题:
(1)电解饱和食盐水的离子方程式为______。
(2)下列关于产生的说法中,合理的是______(填序号)。
a.主要在阴极室产生
b.在电极上放电,可能产生
c.阳离子交换膜破损导致向阳极室迁移,可能产生
(3)实验室采用下列流程测定副产物含量。
①加入的目的是消耗水样中残留的和。若测定中未加入,则水样中的浓度将______(填“偏大”“偏小”或“不受影响”)。
②滴定至终点时消耗酸性溶液,水样中的浓度为______。
(4)可用盐酸处理淡盐水中的并回收。处理时,可能的作用一方面提高,增强还原性;另一方面提高,______。
高二化学参考答案
说明:1.若考生给出其他答案,只要合理,可比照给分。
2.题中没要求写出化学式、元素符号(或名称)的,考生给出名称(或化学式、元素符号)也给分。
3.化学方程式未写反应条件或未标“↑”、“↓”符号的,可不扣分;未配平的,给一半分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
答案 C A B C D C D A B B A C D D B C
17.(10分)
(1)(2分)
(2)或(2分)
(3)电子从能量较高的原子轨道跃迁到能量较低的原子轨道时,以光(子)的形式释放能量(2分)
(4) (各1分,共2分)
(5)的价电子排布为,的价电子排布为,的半充满结构更稳定,失去电子更困难。(2分)
18.(11分)
(1)(2分) (2分) 形成闭合回路;保持溶液呈电中性。(2分)
(2)阴(1分) (2分)
19.(10分)
(1)①>③>②(2分) (1分)
中原子比多一个孤电子对,对键的斥力较大,故的键角小于的键角(2分)
(2)(2分) 极性(1分)
是极性分子且能和水分子形成氢键,是非极性分子(2分)
20.(11分)
(1)①(2分) 达平衡(1分)
②(2分) (1分)
(2)①<(1分)
②之前,反应未达平衡,温度越高反应速率越快,的转化率越大(2分)
③(2分)
21.(10分)
(1)(2分)
(2)(2分)
(3)①偏大(2分) ②(2分)
(4)增强的氧化性(2分)
高二化学
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,本卷考试时间为90分钟,满分为100分。
2.答卷前,考生将自己的姓名、准考证号、考试科目、试卷类型用2B铅笔涂写在答题卡上。
3.第Ⅰ卷每小题选出答案后,用2B铅笔在答题卡上将对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试卷上。
4.第Ⅱ卷所有题目的答案,考生须用0.5毫米黑色签字笔答在答题卡规定的区域内,在试卷上答题不得分。
5.考试结束,监考人员将答题卡收回。
可能用到的相对原子质量:Mg-24 Cu-64
第Ⅰ卷(选择题)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。)
1.下列轨道表示式中,属于氧的基态原子的是( )
A. B.
C. D.
2.下列粒子的模型为四面体且其空间结构为三角锥形的是( )
A. B. C. D.
3.下列现象能用“相似相溶”规律解释的是( )
A.用纯碱洗涤油脂 B.溴易溶于四氯化碳
C.酸性:甲酸>乙酸>丙酸 D.碘易溶于浓碘化钾水溶液
4.下列曲线表示卤族元素或其单质性质随核电荷数的变化趋势,正确的是( )
A. B.
C. D.
5.下列物质的性质与分子间作用力无关的是( )
A.比易液化 B.沸点:
C.等质量的冰比液态水的体积大 D.稳定性:
6.元素周期表中铋元素的数据见下图,下列说法错误的是( )
A.铋原子的价层电子排布式为
B.铋原子能级有三个未成对电子
C.铋原子最外层有5个能量相同的电子
D.铋元素的相对原子质量是
7.下列说法中,正确的是( )
A.在所有分子中都存在化学键
B.所有的键的强度都比键的大
C.键长等于成键两原子的半径之和
D.键可以绕键轴旋转,键一定不能绕键轴旋转
8.下列现象与电化学腐蚀无关的是( )
A.银质物品久置表面变暗 B.船体上镶嵌锌块,船体不易被腐蚀
C.生铁中含有碳,抗腐蚀能力比纯铁弱 D.用锡焊接的铜质器件,焊接处易生锈
9.下列说法中,错误的是( )
A.和轨道形状均为哑铃形
B.元素周期表中,区全部是金属元素
C.、、轨道相互垂直,但能量相等
D.共价化合物中,电负性大的成键元素表现为负价
10.下列有关晶胞的说法中,正确的是( )
A.晶胞是晶体中最小的平行六面体 B.晶胞是晶体结构中最小的重复单元
C.晶胞中的粒子都完全属于该晶胞 D.不同晶体中晶胞的大小和形状均相同
11.下列实验装置和操作,不能达到相应实验目的的是( )
A.图甲:蒸干氯化铝溶液制备无水氯化铝
B.图乙:比较和的大小
C.图丙:验证电解溶液的阳极产物
D.图丁:测量盐酸和氢氧化钠反应的反应热
12.下列说法中,错误的是( )
A.晶体内部的粒子按一定规律周期性的排列
B.测定某一固体是否是晶体可用射线衍射仪进行实验
C.晶体与非晶体的根本区别在于固体是否具有规则的几何外形
D.缺角的氯化钠晶体在饱和溶液中慢慢变为完美的立方体块,体现了晶体的自范性
13.2022年诺贝尔化学奖授予在“点击化学和生物正交化学”领域做出贡献的三位科学家。点击化学经典反应之一是一价铜[]催化的叠氮化物——端炔烃环加成反应,反应机理示意如图。下列说法错误的是( )
A.反应①过程中,既有旧键断裂,又有新键生成
B.该反应历程涉及氮原子之间的非极性键的断裂
C.与在该条件下反应可生成
D.一价铜[]催化剂能有效降低总反应的焓变,加快反应速率
14.锌——空气电池可用作电动车的动力电源。该电池的电解质溶液为溶液,总反应为。下列说法中,错误的是( )
A.充电时,电解质溶液中向阴极移动
B.充电时,电解质溶液的逐渐增大
C.放电时,负极反应为
D.放电时,电路中通过电子,消耗氧气(标准状况)
15.常温下,用盐酸滴定溶液,所得溶液、和的分布分数[平衡时某含氮微粒的浓度占含氮微粒总浓度的分数,如的分布分数]与滴加盐酸体积的关系如图所示。下列说法错误的是( )
A.曲线代表
B.点加入盐酸体积为
C.的电离常数的数量级为
D.应选甲基橙作为指示剂,滴定终点溶液由黄色变为橙色
16.某密闭容器中充入等物质的量的气体和,一定温度下发生反应: ,达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间的变化如下图所示。下列说法正确的是( )
A.时达到化学平衡状态
B.时降低温度,时升高温度
C.反应方程式中的,正反应为放热反应
D.内用表示的平均反应速率为
第Ⅱ卷(非选择题)
二、非选择题(本题包括5小题,共52分)
17.(10分)下表是元素周期表的一部分,表中所列字母分别代表一种元素。
回答下列问题:
(1)、、、四种元素的电负性从大到小的顺序是______(填元素符号)。
(2)元素基态原子的核外电子排布式为______。
(3)的单质在空气中燃烧发出耀眼的白光,用原子结构的知识解释发光的原因是______。
(4)上表所列某主族元素的各级电离能数据如下图所示,则该元素是______(填元素符号),它位于周期表的______区。
(5)、两元素的部分电离能数据如下表所示:
元素
717 759
1509 1561
3248 2957
比较两元素的、可知,气态再失去一个电子比气态再失去一个电子难,从核外电子排布角度解释其原因为______。
18.(11分)电解原理和原电池原理是电化学的两个重要内容。某同学做如下探究实验。
回答下列问题:
(1)如图1为某同学依据氧化还原反应设计的原电池装置,该反应的离子方程式为______。反应前,两电极质量相等,一段时间后,两电极质量相差,则导线中通过电子的物质的量为______。盐桥中装有含饱和溶液的琼脂,盐桥的作用有______(答出两点即可)。
(2)如图2,其他条件不变,将盐桥换成铜丝与石墨相连成型,则石墨为______极(填“正”、“负”、“阴”、“阳”),石墨上发生的电极反应为______,甲烧杯中总反应为______。
19.(10分)已知与可以形成和两种化合物。回答下列问题:
(1)水中粒子间作用力有①②水分子间的范德华力③氢键,从强到弱顺序为______(填序号)。可与形成,中采用______杂化。中键角比中键角大的原因为______。
(2)是常用的氧化剂,其分子结构如下图所示,两个氢原子犹如在半展开的书的两面上。的电子式为______;是______分子(填“极性”或“非极性”)。能与水混溶,却不溶于的原因是______。
20.(11分)氢能是一种极具发展潜力的清洁能源。
(1) 是目前大规模制取氢气的重要方法之一。
①时,该反应的平衡常数,在容积为的密闭容器中进行反应,测得某一时刻混合物中、、和的物质的量分别为、、和,该反应的平衡常数表达式为______;判断该时刻反应______(填“正向进行”、“逆向进行”或“达平衡”)。
②时,该反应的平衡常数。在容积为的密闭容器中,将与混合加热到,反应达平衡时的转化率为______;欲提高反应速率及的平衡转化率,理论上可以采取的措施为______(填序号)。
a.通入过量水蒸气 b.降低温度 c.增大压强 d.加入催化剂
(2)工业上利用得到的与进一步合成二甲醚:
其他条件不变时,相同时间内的转化率随温度的变化情况如图所示。
(1)合成二甲醚反应的______0(填“>”“<”或“=”)。
(2)图中,在之前,随温度升高,转化率增大的原因是______。
(3)在图中绘制出转化率随压强变化的曲线图(作出趋势即可)。
21.(10分)氯碱工业是化工产业的重要基础,其原理示意图如下。生产过程中产生的副产物氯酸盐需要处理。
已知:ⅰ.当升高时,易歧化为和。ⅱ.与不反应。
回答下列问题:
(1)电解饱和食盐水的离子方程式为______。
(2)下列关于产生的说法中,合理的是______(填序号)。
a.主要在阴极室产生
b.在电极上放电,可能产生
c.阳离子交换膜破损导致向阳极室迁移,可能产生
(3)实验室采用下列流程测定副产物含量。
①加入的目的是消耗水样中残留的和。若测定中未加入,则水样中的浓度将______(填“偏大”“偏小”或“不受影响”)。
②滴定至终点时消耗酸性溶液,水样中的浓度为______。
(4)可用盐酸处理淡盐水中的并回收。处理时,可能的作用一方面提高,增强还原性;另一方面提高,______。
高二化学参考答案
说明:1.若考生给出其他答案,只要合理,可比照给分。
2.题中没要求写出化学式、元素符号(或名称)的,考生给出名称(或化学式、元素符号)也给分。
3.化学方程式未写反应条件或未标“↑”、“↓”符号的,可不扣分;未配平的,给一半分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
答案 C A B C D C D A B B A C D D B C
17.(10分)
(1)(2分)
(2)或(2分)
(3)电子从能量较高的原子轨道跃迁到能量较低的原子轨道时,以光(子)的形式释放能量(2分)
(4) (各1分,共2分)
(5)的价电子排布为,的价电子排布为,的半充满结构更稳定,失去电子更困难。(2分)
18.(11分)
(1)(2分) (2分) 形成闭合回路;保持溶液呈电中性。(2分)
(2)阴(1分) (2分)
19.(10分)
(1)①>③>②(2分) (1分)
中原子比多一个孤电子对,对键的斥力较大,故的键角小于的键角(2分)
(2)(2分) 极性(1分)
是极性分子且能和水分子形成氢键,是非极性分子(2分)
20.(11分)
(1)①(2分) 达平衡(1分)
②(2分) (1分)
(2)①<(1分)
②之前,反应未达平衡,温度越高反应速率越快,的转化率越大(2分)
③(2分)
21.(10分)
(1)(2分)
(2)(2分)
(3)①偏大(2分) ②(2分)
(4)增强的氧化性(2分)
同课章节目录
