江西省抚州市2023-2024学年高一上学期1月学生学业质量监测(期末考试)化学试卷(含答案)
文档属性
| 名称 | 江西省抚州市2023-2024学年高一上学期1月学生学业质量监测(期末考试)化学试卷(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 1009.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-26 00:00:00 | ||
图片预览


文档简介
抚州市2023-2024学年度上学期学生学业质量监测
高一化学试题卷
说明:1.本卷分为第Ⅰ卷和第Ⅱ卷,共18小题,全卷满分100分,考试时间为75分钟。
2.答案须写在答题卡相应的位置上,不得在本试题卷上作答,否则不给分。
3.所有考试结束3天后,考生可凭借准考证号登录智学网(www.)查询考试成绩,密码与准考证号相同。
本卷可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 K-39 Mn-55
第Ⅰ卷(选择题,共42分)
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一个选项符合题意)
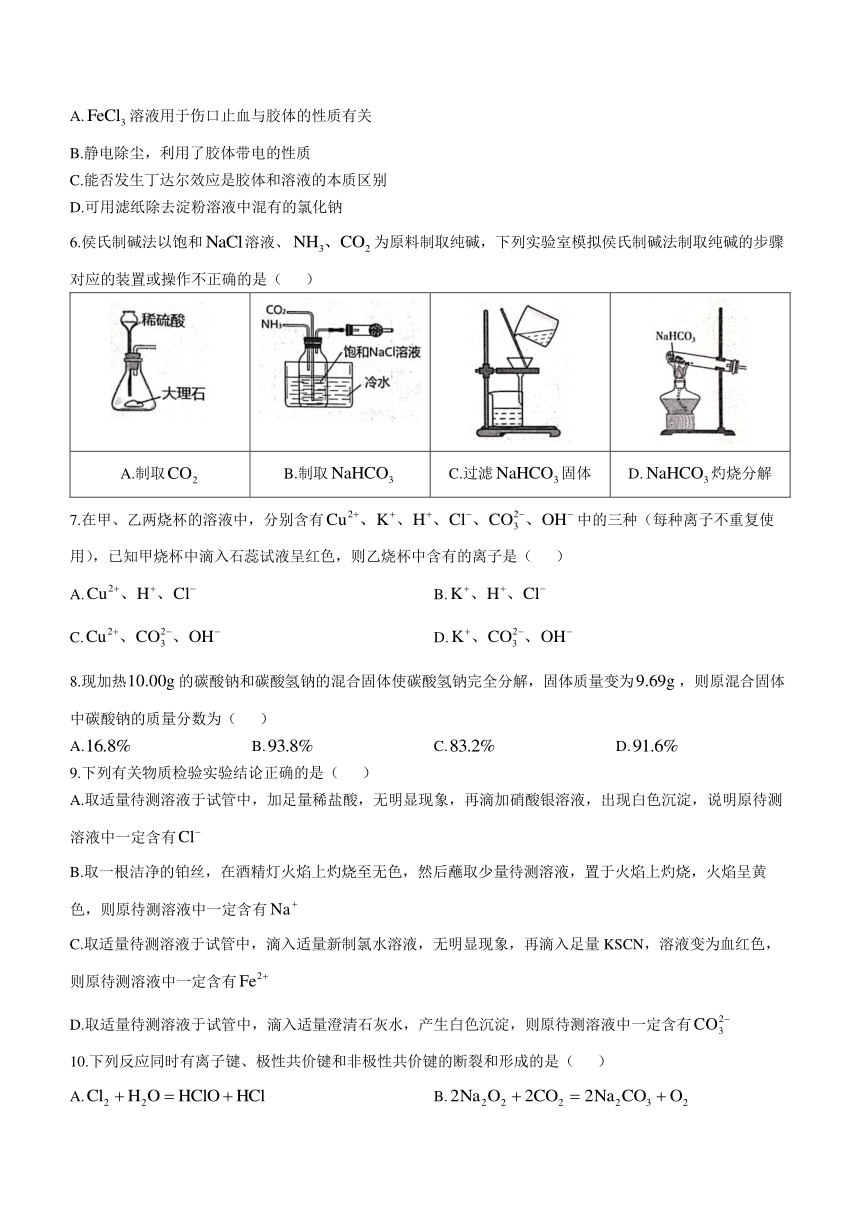
1.下列仪器名称正确的是( )
选项 A B C D
仪器
名称 长颈漏斗 蒸发皿 容量瓶 圆底烧瓶
2.化学贯穿古今,下列对诗词中所涉及化学知识的解读不正确的是( )
A.“错把陈醋当成墨,写尽半生纸上酸”,陈醋是混合物
B.“熬胆矾铁斧,久之亦化为铜”,该过程涉及氧化还原反应
C.“火树银花合,星桥铁锁开”,诗词中所涉及的焰色试验是化学变化
D.“朱门酒肉臭,路有冻死骨”,“朱门”中含有
3.下列离子方程式书写正确的是( )
A.将钠粒投入水中:
B.磺化亚铁溶液与等物质的量的氯气反应:
C.氢氧化钡溶液与稀硫酸的反应:
D.用醋酸溶解水垢中的:
4.化学用语是学习化学的重要工具,下列表述错误的是( )
A.的电子式: B.氮气分子的电子式:
C.中子数为8的氧原子: D.的结构式:
5.胶体是一种重要的分散系,下列有关叙述正确的是( )
A.溶液用于伤口止血与胶体的性质有关
B.静电除尘,利用了胶体带电的性质
C.能否发生丁达尔效应是胶体和溶液的本质区别
D.可用滤纸除去淀粉溶液中混有的氯化钠
6.侯氏制碱法以饱和溶液、为原料制取纯碱,下列实验室模拟侯氏制碱法制取纯碱的步骤对应的装置或操作不正确的是( )
A.制取 B.制取 C.过滤固体 D.灼烧分解
7.在甲、乙两烧杯的溶液中,分别含有中的三种(每种离子不重复使用),已知甲烧杯中滴入石蕊试液呈红色,则乙烧杯中含有的离子是( )
A. B.
C. D.
8.现加热的碳酸钠和碳酸氢钠的混合固体使碳酸氢钠完全分解,固体质量变为,则原混合固体中碳酸钠的质量分数为( )
A. B. C. D.
9.下列有关物质检验实验结论正确的是( )
A.取适量待测溶液于试管中,加足量稀盐酸,无明显现象,再滴加硝酸银溶液,出现白色沉淀,说明原待测溶液中一定含有
B.取一根洁净的铂丝,在酒精灯火焰上灼烧至无色,然后蘸取少量待测溶液,置于火焰上灼烧,火焰呈黄色,则原待测溶液中一定含有
C.取适量待测溶液于试管中,滴入适量新制氯水溶液,无明显现象,再滴入足量KSCN,溶液变为血红色,则原待测溶液中一定含有
D.取适量待测溶液于试管中,滴入适量澄清石灰水,产生白色沉淀,则原待测溶液中一定含有
10.下列反应同时有离子键、极性共价键和非极性共价键的断裂和形成的是( )
A. B.
C. D.
11.用表示阿伏加德罗常数的值,下列说法正确的是( )
A.的溶液中,所含的总数为
B.将含的饱和溶液滴入沸水中制得胶体,形成的胶粒数为
C.与足量溶液反应,转移电子数为
D.常温常压下,氧气和臭氧的混合气体含氧原子数是
12.下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
A.简单气态氢化物的稳定性:RB.Z与R形成的化合物常用于电解制Z
C.X与W形成的某种化合物可导致酸雨
D.X与Y可以形成阴阳离子个数比为1:1和1:2的两种离子化合物
13.2023年10月26日,“神州十七号”载人飞船发射成功,火箭推进过程中发生反应。已知中为-3价,则下列说法正确的是( )
A.氧化性: B.该反应中为还原产物
C.生成时,转移电子 D.氧化产物与还原产物的物质的量之比为2:3
14.向和的混合溶液中加入一定量的铁粉,下列说法中正确的是( )
A.若铁粉有剩余,则溶液中可能有
B.若铁粉有剩余,则溶液中的金属阳离子一定有和
C.若铁粉无剩余,则溶液中一定有
D.若铁粉无剩余,且溶液中无,则溶液中一定有,一定无
第II卷(非选择题,共58分)
二、填空题(本题共4小题,共58分)
15.(15分)(1)现有以下物质:a.溶液、b.液氨、c.固体、d.、e.氯水、f.干冰、g.熔融、h.冰醋酸、i.硬铝。
①以上物质中属于混合物的是_________(填字母序号),属于非电解质的是_________(填字母)
②写出d在水溶液中的电离方程式___________________________。
③在足量a中加入少量f,发生反应的离子方程式为___________________________。
(2)常作为漂白剂、消毒剂,也可用作潜艇供氧剂。
①写出与的化学反应方程式并用双线桥表示电子转移的方向与数目________________________
②标准状况下,每生成转移的电子物质的量为_________。
(3)若中含有b个氢原子,则阿伏伽德罗常数为_________(用含a、b的式子表示)
16.(15分)下图是元素周期表的一部分,根据①-⑨在周期表中的位置按要求回答问题:
(1)画出元素④的原子结构示意图_________。
(2)②与③形成的一种化合物甲在大气含量过高会产生温室效应,其电子式为_________。
(3)用电子式表示元素⑧和⑨形成化合物乙的形成过程___________________________。
(4)③与⑦对应的简单氢化物中,沸点较高的是_________(填化学式),原因为__________________。
(5)为了证明④和⑤两种元素的金属性强弱,下列说法能提供证据的是_________(填字母号)。
A.比较两种元素对应单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
(6)某同学设计实验用下图装置证明元素②、⑥的非金属性强弱:
①溶液B为__________________。
②溶液C中发生反应的离子方程式为___________________________。
17.(12分)在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 质量(g) 摩尔质量()
蔗糖 25.00 342
硫酸钾 0.87 174
阿司匹林 0.17 180
高锰酸钾 0.316 158
硝酸银 0.075 170
(1)配制上述“鲜花保鲜剂”一定要用到的仪器有烧杯、药匙、电子天平、胶头滴管、玻璃棒、_______。
(2)配制上述“鲜花保鲜剂”时,正确的操作顺序是(每个操作只用一次)_______(填字母序号)。
A.在烧杯中加入适量水溶解,待其恢复至室温
B.将烧杯中的溶液沿玻璃棒注入容量瓶中
C.改用胶头滴管加水,使溶液的凹面恰好与刻度线相切
D.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
E.用电子天平称量各组成成分,并把它们放入烧杯中混合
F.将容量瓶盖紧,反复上下颠倒,摇匀,装入贴有标签的试剂瓶
G.用少量水洗涤烧杯和玻璃棒2-3次,洗涤液均注入容量瓶,振荡
(3)在溶液配制过程中,下列操作使配制浓度偏低的是_______(填字母序号)。
A.定容时俯视容量瓶刻度线
B.移液后未洗涤玻璃棒和烧杯
C.容量瓶洗净后未干燥
D.定容摇匀后发现液面低于容量瓶的刻度线,又加蒸馏水至刻度线
(4)“鲜花保鲜剂”中(阿司匹林中不含)的物质的量浓度为______________。
(5)若要配制的硫酸,则:①所需质量分数为、密度为的浓硫酸的体积为_______(计算结果保留一位小数)。
②如果实验室有量筒,应选用_______量筒最好。
18.(16分)氯元素可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制各和并探究其性质。问答下列问题:
已知:
(1)上述装置中制备氯气的化学方程式为_____________________________________________。
(2)导管a的作用为_______________,d中采用冰水浴冷却的目的是_______________,d中反应的离子方程式为______________________________。
(3)e的作用是吸收多余的氯气,可选用试剂_______________(填字母序号)溶液。
A. B. C. D.
(4)将少量和溶液分别滴加到1号和2号淀粉试纸上,1号试纸变_______色,2号试纸颜色不变。可知该条件下的氧化能力_______(填“大于”或“小于”)。
(5)用制得的氯气做如图1的实验,向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器加入NaOH溶液,再利用注射器加入稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法错误的是_______(填字母序号)。
图1 图2
A.阶段①说明氯气溶于水,溶于水的氯气全部与水反应
B.阶段②发生了氧化还原反应,该反应常用于制漂白粉
C.阶段③发生反应的离子方程式为
D.若将换成,所得的压强变化趋势与图2相似
抚州市2023—2024学年度上学期学生学业质量监测
高一化学参考答案
一、选择题
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 C C A B A A D D B B D C C D
二、填空题(除特殊标注的空以外,每空2分,共58分)
15.(15分)
(1)①aei,bf ② ③
(2)①(3分,方程式2分、双线桥1分) ②6mol
(3)
16.(15分)
(1) (2)
(3)
(4)(1分);水分子中存在氢键,使熔沸点升高
(5)BC
(6)①饱和溶液(未写饱和扣1分)
②或
17.(12分)
(1)容量瓶(未写不给分)
(2)EABGDCF
(3)BD (4)0.024 (5)①16.3 ②20
18.(16分)
(1)(浓);平衡气压,便于液体顺利流下
(2)防止温度过高生成;
(3)BD (4)蓝;大于 (5)AB
高一化学试题卷
说明:1.本卷分为第Ⅰ卷和第Ⅱ卷,共18小题,全卷满分100分,考试时间为75分钟。
2.答案须写在答题卡相应的位置上,不得在本试题卷上作答,否则不给分。
3.所有考试结束3天后,考生可凭借准考证号登录智学网(www.)查询考试成绩,密码与准考证号相同。
本卷可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 K-39 Mn-55
第Ⅰ卷(选择题,共42分)
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一个选项符合题意)
1.下列仪器名称正确的是( )
选项 A B C D
仪器
名称 长颈漏斗 蒸发皿 容量瓶 圆底烧瓶
2.化学贯穿古今,下列对诗词中所涉及化学知识的解读不正确的是( )
A.“错把陈醋当成墨,写尽半生纸上酸”,陈醋是混合物
B.“熬胆矾铁斧,久之亦化为铜”,该过程涉及氧化还原反应
C.“火树银花合,星桥铁锁开”,诗词中所涉及的焰色试验是化学变化
D.“朱门酒肉臭,路有冻死骨”,“朱门”中含有
3.下列离子方程式书写正确的是( )
A.将钠粒投入水中:
B.磺化亚铁溶液与等物质的量的氯气反应:
C.氢氧化钡溶液与稀硫酸的反应:
D.用醋酸溶解水垢中的:
4.化学用语是学习化学的重要工具,下列表述错误的是( )
A.的电子式: B.氮气分子的电子式:
C.中子数为8的氧原子: D.的结构式:
5.胶体是一种重要的分散系,下列有关叙述正确的是( )
A.溶液用于伤口止血与胶体的性质有关
B.静电除尘,利用了胶体带电的性质
C.能否发生丁达尔效应是胶体和溶液的本质区别
D.可用滤纸除去淀粉溶液中混有的氯化钠
6.侯氏制碱法以饱和溶液、为原料制取纯碱,下列实验室模拟侯氏制碱法制取纯碱的步骤对应的装置或操作不正确的是( )
A.制取 B.制取 C.过滤固体 D.灼烧分解
7.在甲、乙两烧杯的溶液中,分别含有中的三种(每种离子不重复使用),已知甲烧杯中滴入石蕊试液呈红色,则乙烧杯中含有的离子是( )
A. B.
C. D.
8.现加热的碳酸钠和碳酸氢钠的混合固体使碳酸氢钠完全分解,固体质量变为,则原混合固体中碳酸钠的质量分数为( )
A. B. C. D.
9.下列有关物质检验实验结论正确的是( )
A.取适量待测溶液于试管中,加足量稀盐酸,无明显现象,再滴加硝酸银溶液,出现白色沉淀,说明原待测溶液中一定含有
B.取一根洁净的铂丝,在酒精灯火焰上灼烧至无色,然后蘸取少量待测溶液,置于火焰上灼烧,火焰呈黄色,则原待测溶液中一定含有
C.取适量待测溶液于试管中,滴入适量新制氯水溶液,无明显现象,再滴入足量KSCN,溶液变为血红色,则原待测溶液中一定含有
D.取适量待测溶液于试管中,滴入适量澄清石灰水,产生白色沉淀,则原待测溶液中一定含有
10.下列反应同时有离子键、极性共价键和非极性共价键的断裂和形成的是( )
A. B.
C. D.
11.用表示阿伏加德罗常数的值,下列说法正确的是( )
A.的溶液中,所含的总数为
B.将含的饱和溶液滴入沸水中制得胶体,形成的胶粒数为
C.与足量溶液反应,转移电子数为
D.常温常压下,氧气和臭氧的混合气体含氧原子数是
12.下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
A.简单气态氢化物的稳定性:R
C.X与W形成的某种化合物可导致酸雨
D.X与Y可以形成阴阳离子个数比为1:1和1:2的两种离子化合物
13.2023年10月26日,“神州十七号”载人飞船发射成功,火箭推进过程中发生反应。已知中为-3价,则下列说法正确的是( )
A.氧化性: B.该反应中为还原产物
C.生成时,转移电子 D.氧化产物与还原产物的物质的量之比为2:3
14.向和的混合溶液中加入一定量的铁粉,下列说法中正确的是( )
A.若铁粉有剩余,则溶液中可能有
B.若铁粉有剩余,则溶液中的金属阳离子一定有和
C.若铁粉无剩余,则溶液中一定有
D.若铁粉无剩余,且溶液中无,则溶液中一定有,一定无
第II卷(非选择题,共58分)
二、填空题(本题共4小题,共58分)
15.(15分)(1)现有以下物质:a.溶液、b.液氨、c.固体、d.、e.氯水、f.干冰、g.熔融、h.冰醋酸、i.硬铝。
①以上物质中属于混合物的是_________(填字母序号),属于非电解质的是_________(填字母)
②写出d在水溶液中的电离方程式___________________________。
③在足量a中加入少量f,发生反应的离子方程式为___________________________。
(2)常作为漂白剂、消毒剂,也可用作潜艇供氧剂。
①写出与的化学反应方程式并用双线桥表示电子转移的方向与数目________________________
②标准状况下,每生成转移的电子物质的量为_________。
(3)若中含有b个氢原子,则阿伏伽德罗常数为_________(用含a、b的式子表示)
16.(15分)下图是元素周期表的一部分,根据①-⑨在周期表中的位置按要求回答问题:
(1)画出元素④的原子结构示意图_________。
(2)②与③形成的一种化合物甲在大气含量过高会产生温室效应,其电子式为_________。
(3)用电子式表示元素⑧和⑨形成化合物乙的形成过程___________________________。
(4)③与⑦对应的简单氢化物中,沸点较高的是_________(填化学式),原因为__________________。
(5)为了证明④和⑤两种元素的金属性强弱,下列说法能提供证据的是_________(填字母号)。
A.比较两种元素对应单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
(6)某同学设计实验用下图装置证明元素②、⑥的非金属性强弱:
①溶液B为__________________。
②溶液C中发生反应的离子方程式为___________________________。
17.(12分)在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 质量(g) 摩尔质量()
蔗糖 25.00 342
硫酸钾 0.87 174
阿司匹林 0.17 180
高锰酸钾 0.316 158
硝酸银 0.075 170
(1)配制上述“鲜花保鲜剂”一定要用到的仪器有烧杯、药匙、电子天平、胶头滴管、玻璃棒、_______。
(2)配制上述“鲜花保鲜剂”时,正确的操作顺序是(每个操作只用一次)_______(填字母序号)。
A.在烧杯中加入适量水溶解,待其恢复至室温
B.将烧杯中的溶液沿玻璃棒注入容量瓶中
C.改用胶头滴管加水,使溶液的凹面恰好与刻度线相切
D.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
E.用电子天平称量各组成成分,并把它们放入烧杯中混合
F.将容量瓶盖紧,反复上下颠倒,摇匀,装入贴有标签的试剂瓶
G.用少量水洗涤烧杯和玻璃棒2-3次,洗涤液均注入容量瓶,振荡
(3)在溶液配制过程中,下列操作使配制浓度偏低的是_______(填字母序号)。
A.定容时俯视容量瓶刻度线
B.移液后未洗涤玻璃棒和烧杯
C.容量瓶洗净后未干燥
D.定容摇匀后发现液面低于容量瓶的刻度线,又加蒸馏水至刻度线
(4)“鲜花保鲜剂”中(阿司匹林中不含)的物质的量浓度为______________。
(5)若要配制的硫酸,则:①所需质量分数为、密度为的浓硫酸的体积为_______(计算结果保留一位小数)。
②如果实验室有量筒,应选用_______量筒最好。
18.(16分)氯元素可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制各和并探究其性质。问答下列问题:
已知:
(1)上述装置中制备氯气的化学方程式为_____________________________________________。
(2)导管a的作用为_______________,d中采用冰水浴冷却的目的是_______________,d中反应的离子方程式为______________________________。
(3)e的作用是吸收多余的氯气,可选用试剂_______________(填字母序号)溶液。
A. B. C. D.
(4)将少量和溶液分别滴加到1号和2号淀粉试纸上,1号试纸变_______色,2号试纸颜色不变。可知该条件下的氧化能力_______(填“大于”或“小于”)。
(5)用制得的氯气做如图1的实验,向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器加入NaOH溶液,再利用注射器加入稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法错误的是_______(填字母序号)。
图1 图2
A.阶段①说明氯气溶于水,溶于水的氯气全部与水反应
B.阶段②发生了氧化还原反应,该反应常用于制漂白粉
C.阶段③发生反应的离子方程式为
D.若将换成,所得的压强变化趋势与图2相似
抚州市2023—2024学年度上学期学生学业质量监测
高一化学参考答案
一、选择题
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 C C A B A A D D B B D C C D
二、填空题(除特殊标注的空以外,每空2分,共58分)
15.(15分)
(1)①aei,bf ② ③
(2)①(3分,方程式2分、双线桥1分) ②6mol
(3)
16.(15分)
(1) (2)
(3)
(4)(1分);水分子中存在氢键,使熔沸点升高
(5)BC
(6)①饱和溶液(未写饱和扣1分)
②或
17.(12分)
(1)容量瓶(未写不给分)
(2)EABGDCF
(3)BD (4)0.024 (5)①16.3 ②20
18.(16分)
(1)(浓);平衡气压,便于液体顺利流下
(2)防止温度过高生成;
(3)BD (4)蓝;大于 (5)AB
同课章节目录
