2.1.1共价键 课件 (共50页) 2023-2024学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.1.1共价键 课件 (共50页) 2023-2024学年高二下学期化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 16.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-26 12:09:01 | ||
图片预览











文档简介
(共50张PPT)
第二章 分子结构与性质
第一节 共价键
课时一 共价键
假如发生了大灾难,人类全部的科学知识只能概括为一句话传诸后世,那么这句话应该是“万物皆原子构成”。
——1965年诺贝尔奖得主,理查德·费曼
理查德·费曼
学习目标
1.认识原子间通过原子轨道重叠形成共价键,了解共价键具有饱和性和方向性。
2.知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型。
化学键
01
化学键
使离子相结合或原子相结合的强烈相互作用通称为化学键。
定义
只存在于相邻的原子或离子之间,分子间不存在化学键。
存在范围
化学键的类型
离子键:阴阳离子间的强烈静电作用
共价键:
相邻原子之间通过共用电子对形成的强烈作用力
金属键:
金属阳离子与自由电子之间的强烈静电作用
01
化学键
战
形成过程
原子
原子
离子
化合物
单质或化合物
得失电子
静电作用
共用电子
【思考】
HCl为何只有一对共用电子对?H2、O2、N2也是有一对吗?
电负性的差值
1.7
形成条件
非极性键
极性键
离子键
0
共价键
02
共价键
Gilbert Newton Lewis
(吉尔伯特·牛顿·路易斯)
1916年,吉尔伯特·牛顿·路易斯提出共价键的电子理论。该理论认为2个(或多个)原子可以相互“共用”一对或多对电子,以便达成惰性气体原子的电子层结构,而形成共价键,路易斯在1916年《原子和分子》和1923年《价键及原子和分子的结构》中阐述了共价键电子理论的观点,并列出无机物和有机物的电子结构式。
02
共价键
常见的NaCl和HCl的性质差异很大,思考:从微粒间相互作用的角度解释NaCl和HCl性质差异大的原因。
NaCl
HCl
02
共价键
NaCl和HCl的形成过程
离子键
NaCl
HCl
共价键
02
共价键
化学键的类型与电负性的差值的关系
离子键
H和Cl的电负性的差值
Na和Cl的电负性的差值
共价键
0
0.9
2.1
电负性的差值
成键原子之间的电负性差值
大于1.7
小于1.7
通常形成离子键,相应的化合物为离子化合物
通常形成共价键,相应的化合物为共价化合物
02
共价键
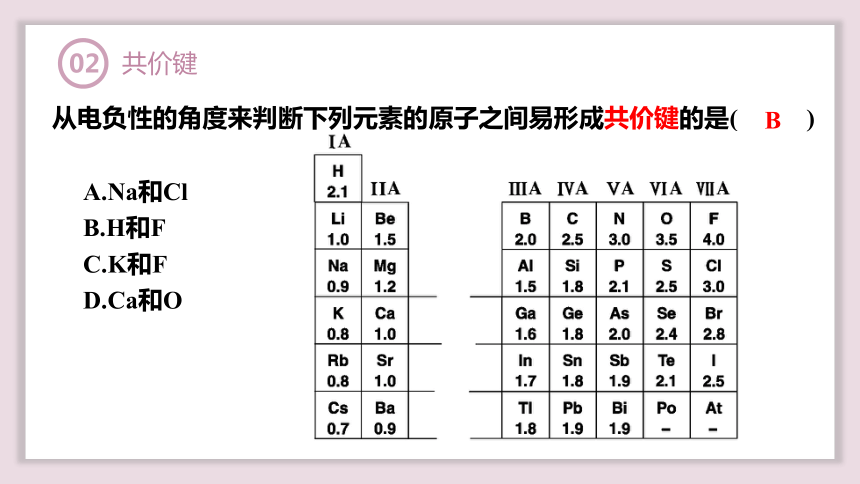
从电负性的角度来判断下列元素的原子之间易形成共价键的是( )
B
A.Na和Cl
B.H和F
C.K和F
D.Ca和O
02
共价键
原子间通过___________所形成的相互作用
共价键的形成
共价键的形成与特征
共用电子对
共价键
成键要素
一般是同种的或者不同种的非金属元素
原子
共用电子对与成键原子的静电作用
成键微粒
成键
本质
成键
元素
02
共价键
根据共价键的定义,只能有H2、HCl、Cl2等,不可能有H3 、H2 Cl和Cl3等,这是为什么呢?
02
共价键
共价键的特征
饱和性
——电子配对原理
一个原子有几个 ,便和几个 电子配对成键,形成几个共价键,这就是共价键的饱和性。
未成对电子
自旋状态相反的
示例
H2
H
↑
1s1
H
↓
1s1
Cl
3p5
↑↓
↑↓
↑
↑↓
3s2
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
Cl2
02
共价键
NH3分子中N原子为什么是1个,而H原子为3个?
N和H原子的电子式分别为 和H·,N原子最外层有3个未成对电子,H原子有1个未成对电子,形成共价键时每个N原子只需与3个H原子分别形成3对共用电子对即可达到稳定状态,共价键达到饱和,从而决定了分子中H原子个数。
02
共价键
战
类型
单键:相邻原子之间共用一对电子
双键:相邻原子之间共用两对电子
三键:相邻原子之间共用三对电子
极性键:不同原子之间
非极性键:相同原子之间
共用电子对数
电子对数偏移
【思考】
当电子形成电子对时,电子云(原子轨道)如何变化?
02
共价键
共价键的特征
H-H的形成
02
共价键
H
↑
1s1
H
↓
1s1
H2
相互靠拢
原子轨道相互重叠
形成氢分子的共价键(H-H)
“头碰头”
H-H的形成
共价键的特征
02
共价键
共价键的特征
形成氢分子的共价键(H-H)
相互靠拢
原子轨道相互重叠
σ 键
σ 键的特征
形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云的图形不变,这种特征称为轴对称
H2中的σ键是由两个s轨道重叠形成的,可称为 s-s σ键, σ键的强度较大
02
共价键
共价键的特征
——最大重叠原理
方向性
除s轨道是球形对称外,其他原子轨道在空间都具有一定的分布特点。在形成共价键时,原子轨道重叠的 ,电子在核间出现的 越大,所形成的共价键就越 ,因此共价键将尽可能沿着__________________的方向形成,所以共价键具有方向性
越多
电子出现概率最大
概率
牢固
02
共价键
现代价键理论的基本要点
两个原子各自提供1个自旋方向相反的电子彼此配对
电子配对原理
——饱和性
两个原子轨道重叠越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定
最大重叠原理
——方向性
02
共价键
共价键类型(按成键原子的原子轨道的重叠方式分类)
σ键——s-p σ键
H-Cl的形成
02
共价键
σ键——p-p σ键
Cl-Cl的形成
02
共价键
σ键——p-p σ键
Cl2中的共价键由2个氯原子各提供1个未成对电子的3p原子轨道重叠形成的
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
Cl—Cl的p-p σ键的形成
Cl
3p5
↑↓
↑↓
↑
↑↓
3s2
Cl
Cl
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成的共价单键
Cl2
02
共价键
归纳小结:σ键
σ 键
“头碰头”
原子轨道的重叠方式:
特征:电子云图形轴对称,能旋转
s-s σ键,如:H-H
s-p σ键,如:H-Cl
p-p σ键,如:Cl-Cl
种类
形成σ键的原子轨道的重叠程度较大,故σ键较稳定。
02
共价键
π键
p轨道和p轨道除能形成σ键外,还能形成π键——由两个原子的p轨道“肩并肩”重叠形成
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成的π键
02
共价键
π键的电子云具有__________性,即每个π键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为_____;π键______旋转;不如σ键____________,较易____________。
镜面对称
镜像
不能
牢固
断裂
特征
02
共价键
“肩并肩”
π 键
原子轨道的重叠方式:
特征:
p-p π键
种类:
电子云由两块组成,镜面对称,
不能旋转
不存在s-s π键,s-p π键!
π键不能单独存在!通常存在于共价双键或共价三键中。
归纳小结:π 键
02
共价键
用电子式表示N2的形成过程,并用原子轨道重叠来解释其共价键的形成过程。
+
:
:
:
:
N
:
N
N
·
·
·
:
N
·
·
·
:
↑
↑
↑
↑↓
2s
2p
N
x
y
z
N的2p轨道
02
共价键
x
y
z
x
y
z
“头碰头”
02
共价键
y
z
x
y
z
“肩并肩”
“肩并肩”
y
z
x
y
z
p-p σ键
p-p π键
p-p π键
02
共价键
两原子形成共价键时,先形成σ键,然后才能形成π键。
02
共价键
σ 键和 π 键的判断
共价单键 共价双键 共价三键
σ键
s-s
s-p
p-p
1个σ键、1个π键
1个σ键、2个π键
注意:分子中存在π键,则一定存在σ键;若存在σ键,则不一定存在π键。
02
共价键
(1)乙烷中有___个σ键,乙烯、乙炔中σ键与π键的个数之比分别为_____、_____。
(2)乙烯和乙炔的化学性质为什么比乙烷活泼?
乙烯的碳碳双键和乙炔的碳碳三键中分别含1个和2个π键,π键原子轨道重叠程度小,不稳定,容易断裂。而乙烷中没有π键,σ键稳定,不易断裂。
7
3∶2
5∶1
乙烷
乙烯
乙炔
观察下图乙烷、乙烯和乙炔分子的结构,并回答下列问题。
02
共价键
乙烯分子中σ键和π键的形成过程
02
共价键
乙炔分子中σ键和π键的形成过程
课堂总结
03
课堂总结
共价键的形成与特征
共价键类型
形成:原子间通过共用电子对所形成的相互作用
特征
σ键
π键
饱和性
方向性
原子轨道的重叠方式:“头碰头”
电子云的对称方式:轴对称
种类:s-s σ键,如:H-H/s-p σ键,如:H-Cl/p-p σ键,如:Cl-Cl
原子轨道的重叠方式:“肩并肩”
电子云的对称方式:镜面对称
种类:p-p π键
共价键
03
课堂总结
键类型 σ键 π键
常见类型
原子轨道重叠方式
键的特征
原子轨道重叠程度
成键规律判断
s-s 、s-p、p-p
p-p
“头碰头”重叠
“肩并肩”重叠
轴对称,可旋转
镜面对称,不可旋转
大
小
单键:σ键;
双键:1个σ键、1个π键;
三键:1个σ键、2个π键
σ键与π键的比较
课堂练习
04
课堂练习
1.下列分子中含π键的是( )
A.CH4 B.C2H4
C.C2H5Cl D.CH3CH2OH
B
2.下列说法不正确的是( )
A.σ键是轴对称的,π键是镜像对称的
B.在气体单质中,一定有σ键,可能有π键
C.两个原子间形成共价键时,最多有一个σ键
D.BF3分子中原子的最外层电子数不全是8
B
04
课堂练习
3.下列说法正确的是( )。
A、π键是由两个p轨道“头碰头”重叠形成的
B、σ键的电子云图形是镜面对称的,而π键的电子云图形是轴对称的
C、所有的 键的强度都比 键的大
D、共价化合物中,一定有 键,可能有 键
D
04
课堂练习
4.丁烯二酸(HOOCCH==CHCOOH)分子结构中含有σ键、π键的个数分别是( )
A.4个σ键,1个π键 B.11个σ键,3个π键
C.4个σ键,3个π键 D.9个σ键,5个π键
B
5.已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4molN—H断裂,则形成的π键的数目为______。
3NA
04
课堂练习
6.下图表示氢原子的电子云重叠示意图。以下各种说法错误的是( )
A.图中电子云重叠表示电子在核间出现的概率大
B.是两个氢原子核外的1s原子轨道发生重叠形成共价键
C.氢原子的核外电子呈云雾状,在两核间分布得密一些,将两核吸引
D.氢原子之间形成σ键,s-sσ键没有方向性
C
04
课堂练习
7.下列各组物质中,所有化学键都是共价键的是( )
A.H2S和Na2O2 B.H2O2和CaF2
C.NH3和N2 D.HNO3和NaCl
C
04
课堂练习
8.下列说法正确的是( )
A.若把H2S写成H3S,则违背了共价键的饱和性
B.H3O+的存在说明共价键不应有饱和性
C.所有共价键都有方向性
D.金属元素与非金属元素的原子间只形成离子键
A
04
课堂练习
9.下列说法不正确的是( )
A.σ键一般比π键原子轨道重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有1个σ键
C.气体单质中,一定有σ键,可能有π键
D.一个N2分子中有1个σ键,2个π键
C
04
课堂练习
10.有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2,⑨HCN(H—C≡N)。
(1)只有σ键的是______________(填序号,下同);既有σ键又有π键的是________。
①②③⑥⑦⑧
④⑤⑨
(2)含有由两个原子的s轨道重叠形成的σ键的是____。
⑦
(3)含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是______________。
(4)含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是______________。
①③⑤⑥⑧⑨
②④⑤⑥⑧⑨
感谢观看
THANK YOU
第二章 分子结构与性质
第一节 共价键
课时一 共价键
假如发生了大灾难,人类全部的科学知识只能概括为一句话传诸后世,那么这句话应该是“万物皆原子构成”。
——1965年诺贝尔奖得主,理查德·费曼
理查德·费曼
学习目标
1.认识原子间通过原子轨道重叠形成共价键,了解共价键具有饱和性和方向性。
2.知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型。
化学键
01
化学键
使离子相结合或原子相结合的强烈相互作用通称为化学键。
定义
只存在于相邻的原子或离子之间,分子间不存在化学键。
存在范围
化学键的类型
离子键:阴阳离子间的强烈静电作用
共价键:
相邻原子之间通过共用电子对形成的强烈作用力
金属键:
金属阳离子与自由电子之间的强烈静电作用
01
化学键
战
形成过程
原子
原子
离子
化合物
单质或化合物
得失电子
静电作用
共用电子
【思考】
HCl为何只有一对共用电子对?H2、O2、N2也是有一对吗?
电负性的差值
1.7
形成条件
非极性键
极性键
离子键
0
共价键
02
共价键
Gilbert Newton Lewis
(吉尔伯特·牛顿·路易斯)
1916年,吉尔伯特·牛顿·路易斯提出共价键的电子理论。该理论认为2个(或多个)原子可以相互“共用”一对或多对电子,以便达成惰性气体原子的电子层结构,而形成共价键,路易斯在1916年《原子和分子》和1923年《价键及原子和分子的结构》中阐述了共价键电子理论的观点,并列出无机物和有机物的电子结构式。
02
共价键
常见的NaCl和HCl的性质差异很大,思考:从微粒间相互作用的角度解释NaCl和HCl性质差异大的原因。
NaCl
HCl
02
共价键
NaCl和HCl的形成过程
离子键
NaCl
HCl
共价键
02
共价键
化学键的类型与电负性的差值的关系
离子键
H和Cl的电负性的差值
Na和Cl的电负性的差值
共价键
0
0.9
2.1
电负性的差值
成键原子之间的电负性差值
大于1.7
小于1.7
通常形成离子键,相应的化合物为离子化合物
通常形成共价键,相应的化合物为共价化合物
02
共价键
从电负性的角度来判断下列元素的原子之间易形成共价键的是( )
B
A.Na和Cl
B.H和F
C.K和F
D.Ca和O
02
共价键
原子间通过___________所形成的相互作用
共价键的形成
共价键的形成与特征
共用电子对
共价键
成键要素
一般是同种的或者不同种的非金属元素
原子
共用电子对与成键原子的静电作用
成键微粒
成键
本质
成键
元素
02
共价键
根据共价键的定义,只能有H2、HCl、Cl2等,不可能有H3 、H2 Cl和Cl3等,这是为什么呢?
02
共价键
共价键的特征
饱和性
——电子配对原理
一个原子有几个 ,便和几个 电子配对成键,形成几个共价键,这就是共价键的饱和性。
未成对电子
自旋状态相反的
示例
H2
H
↑
1s1
H
↓
1s1
Cl
3p5
↑↓
↑↓
↑
↑↓
3s2
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
Cl2
02
共价键
NH3分子中N原子为什么是1个,而H原子为3个?
N和H原子的电子式分别为 和H·,N原子最外层有3个未成对电子,H原子有1个未成对电子,形成共价键时每个N原子只需与3个H原子分别形成3对共用电子对即可达到稳定状态,共价键达到饱和,从而决定了分子中H原子个数。
02
共价键
战
类型
单键:相邻原子之间共用一对电子
双键:相邻原子之间共用两对电子
三键:相邻原子之间共用三对电子
极性键:不同原子之间
非极性键:相同原子之间
共用电子对数
电子对数偏移
【思考】
当电子形成电子对时,电子云(原子轨道)如何变化?
02
共价键
共价键的特征
H-H的形成
02
共价键
H
↑
1s1
H
↓
1s1
H2
相互靠拢
原子轨道相互重叠
形成氢分子的共价键(H-H)
“头碰头”
H-H的形成
共价键的特征
02
共价键
共价键的特征
形成氢分子的共价键(H-H)
相互靠拢
原子轨道相互重叠
σ 键
σ 键的特征
形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云的图形不变,这种特征称为轴对称
H2中的σ键是由两个s轨道重叠形成的,可称为 s-s σ键, σ键的强度较大
02
共价键
共价键的特征
——最大重叠原理
方向性
除s轨道是球形对称外,其他原子轨道在空间都具有一定的分布特点。在形成共价键时,原子轨道重叠的 ,电子在核间出现的 越大,所形成的共价键就越 ,因此共价键将尽可能沿着__________________的方向形成,所以共价键具有方向性
越多
电子出现概率最大
概率
牢固
02
共价键
现代价键理论的基本要点
两个原子各自提供1个自旋方向相反的电子彼此配对
电子配对原理
——饱和性
两个原子轨道重叠越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定
最大重叠原理
——方向性
02
共价键
共价键类型(按成键原子的原子轨道的重叠方式分类)
σ键——s-p σ键
H-Cl的形成
02
共价键
σ键——p-p σ键
Cl-Cl的形成
02
共价键
σ键——p-p σ键
Cl2中的共价键由2个氯原子各提供1个未成对电子的3p原子轨道重叠形成的
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
Cl—Cl的p-p σ键的形成
Cl
3p5
↑↓
↑↓
↑
↑↓
3s2
Cl
Cl
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成的共价单键
Cl2
02
共价键
归纳小结:σ键
σ 键
“头碰头”
原子轨道的重叠方式:
特征:电子云图形轴对称,能旋转
s-s σ键,如:H-H
s-p σ键,如:H-Cl
p-p σ键,如:Cl-Cl
种类
形成σ键的原子轨道的重叠程度较大,故σ键较稳定。
02
共价键
π键
p轨道和p轨道除能形成σ键外,还能形成π键——由两个原子的p轨道“肩并肩”重叠形成
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成的π键
02
共价键
π键的电子云具有__________性,即每个π键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为_____;π键______旋转;不如σ键____________,较易____________。
镜面对称
镜像
不能
牢固
断裂
特征
02
共价键
“肩并肩”
π 键
原子轨道的重叠方式:
特征:
p-p π键
种类:
电子云由两块组成,镜面对称,
不能旋转
不存在s-s π键,s-p π键!
π键不能单独存在!通常存在于共价双键或共价三键中。
归纳小结:π 键
02
共价键
用电子式表示N2的形成过程,并用原子轨道重叠来解释其共价键的形成过程。
+
:
:
:
:
N
:
N
N
·
·
·
:
N
·
·
·
:
↑
↑
↑
↑↓
2s
2p
N
x
y
z
N的2p轨道
02
共价键
x
y
z
x
y
z
“头碰头”
02
共价键
y
z
x
y
z
“肩并肩”
“肩并肩”
y
z
x
y
z
p-p σ键
p-p π键
p-p π键
02
共价键
两原子形成共价键时,先形成σ键,然后才能形成π键。
02
共价键
σ 键和 π 键的判断
共价单键 共价双键 共价三键
σ键
s-s
s-p
p-p
1个σ键、1个π键
1个σ键、2个π键
注意:分子中存在π键,则一定存在σ键;若存在σ键,则不一定存在π键。
02
共价键
(1)乙烷中有___个σ键,乙烯、乙炔中σ键与π键的个数之比分别为_____、_____。
(2)乙烯和乙炔的化学性质为什么比乙烷活泼?
乙烯的碳碳双键和乙炔的碳碳三键中分别含1个和2个π键,π键原子轨道重叠程度小,不稳定,容易断裂。而乙烷中没有π键,σ键稳定,不易断裂。
7
3∶2
5∶1
乙烷
乙烯
乙炔
观察下图乙烷、乙烯和乙炔分子的结构,并回答下列问题。
02
共价键
乙烯分子中σ键和π键的形成过程
02
共价键
乙炔分子中σ键和π键的形成过程
课堂总结
03
课堂总结
共价键的形成与特征
共价键类型
形成:原子间通过共用电子对所形成的相互作用
特征
σ键
π键
饱和性
方向性
原子轨道的重叠方式:“头碰头”
电子云的对称方式:轴对称
种类:s-s σ键,如:H-H/s-p σ键,如:H-Cl/p-p σ键,如:Cl-Cl
原子轨道的重叠方式:“肩并肩”
电子云的对称方式:镜面对称
种类:p-p π键
共价键
03
课堂总结
键类型 σ键 π键
常见类型
原子轨道重叠方式
键的特征
原子轨道重叠程度
成键规律判断
s-s 、s-p、p-p
p-p
“头碰头”重叠
“肩并肩”重叠
轴对称,可旋转
镜面对称,不可旋转
大
小
单键:σ键;
双键:1个σ键、1个π键;
三键:1个σ键、2个π键
σ键与π键的比较
课堂练习
04
课堂练习
1.下列分子中含π键的是( )
A.CH4 B.C2H4
C.C2H5Cl D.CH3CH2OH
B
2.下列说法不正确的是( )
A.σ键是轴对称的,π键是镜像对称的
B.在气体单质中,一定有σ键,可能有π键
C.两个原子间形成共价键时,最多有一个σ键
D.BF3分子中原子的最外层电子数不全是8
B
04
课堂练习
3.下列说法正确的是( )。
A、π键是由两个p轨道“头碰头”重叠形成的
B、σ键的电子云图形是镜面对称的,而π键的电子云图形是轴对称的
C、所有的 键的强度都比 键的大
D、共价化合物中,一定有 键,可能有 键
D
04
课堂练习
4.丁烯二酸(HOOCCH==CHCOOH)分子结构中含有σ键、π键的个数分别是( )
A.4个σ键,1个π键 B.11个σ键,3个π键
C.4个σ键,3个π键 D.9个σ键,5个π键
B
5.已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4molN—H断裂,则形成的π键的数目为______。
3NA
04
课堂练习
6.下图表示氢原子的电子云重叠示意图。以下各种说法错误的是( )
A.图中电子云重叠表示电子在核间出现的概率大
B.是两个氢原子核外的1s原子轨道发生重叠形成共价键
C.氢原子的核外电子呈云雾状,在两核间分布得密一些,将两核吸引
D.氢原子之间形成σ键,s-sσ键没有方向性
C
04
课堂练习
7.下列各组物质中,所有化学键都是共价键的是( )
A.H2S和Na2O2 B.H2O2和CaF2
C.NH3和N2 D.HNO3和NaCl
C
04
课堂练习
8.下列说法正确的是( )
A.若把H2S写成H3S,则违背了共价键的饱和性
B.H3O+的存在说明共价键不应有饱和性
C.所有共价键都有方向性
D.金属元素与非金属元素的原子间只形成离子键
A
04
课堂练习
9.下列说法不正确的是( )
A.σ键一般比π键原子轨道重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有1个σ键
C.气体单质中,一定有σ键,可能有π键
D.一个N2分子中有1个σ键,2个π键
C
04
课堂练习
10.有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2,⑨HCN(H—C≡N)。
(1)只有σ键的是______________(填序号,下同);既有σ键又有π键的是________。
①②③⑥⑦⑧
④⑤⑨
(2)含有由两个原子的s轨道重叠形成的σ键的是____。
⑦
(3)含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是______________。
(4)含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是______________。
①③⑤⑥⑧⑨
②④⑤⑥⑧⑨
感谢观看
THANK YOU
