化学九年级上湘教版化学变化的条件课件(21张ppt)
文档属性
| 名称 | 化学九年级上湘教版化学变化的条件课件(21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-07-16 17:05:22 | ||
图片预览







文档简介
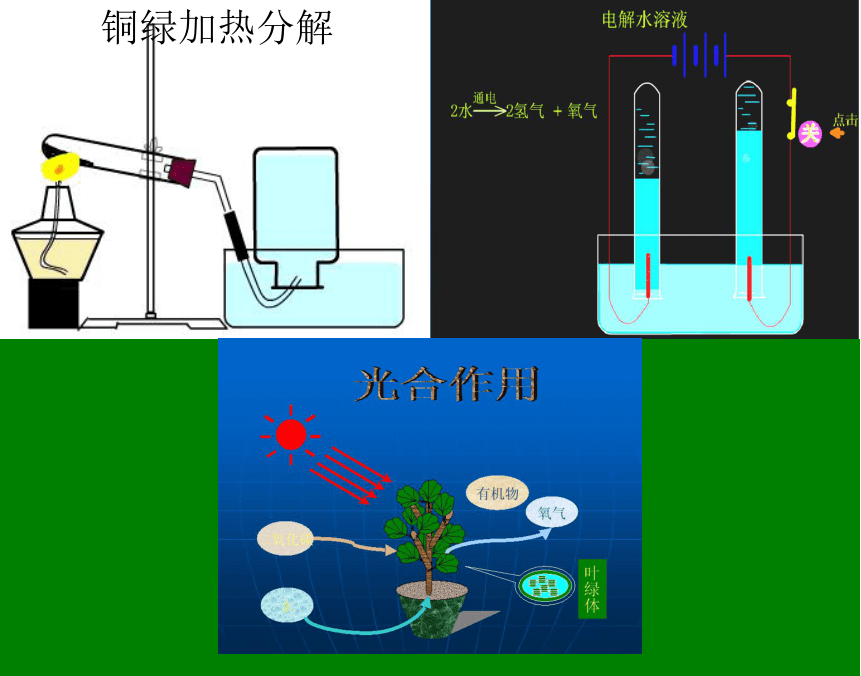
课件21张PPT。铜绿加热分解
[实验步骤]
1、向试管中加入1ml CuSO4溶液
2、再向其中滴加1.5ml NaOH溶液,振荡
3.把浊液一分为二
4、一支置于常温下,观察Cu(OH)2常温下是否分解
5、另一支用试管夹夹住,在酒精灯上加热,观察Cu(OH)2是否能分解探究氢氧化铜是否在常温下就能分解?[猜想与假设]1、Cu(OH)2常温下不分解。
2、若要使Cu(OH)2分解,必须加热到
一定的温度。
3、温度能影响化学反应的发生。 1、给过氧化氢溶液加热,温度越高产生气泡越多。
2、在夏季食品容易变质,而在冰箱中能保存较长时间。
[实验步骤]
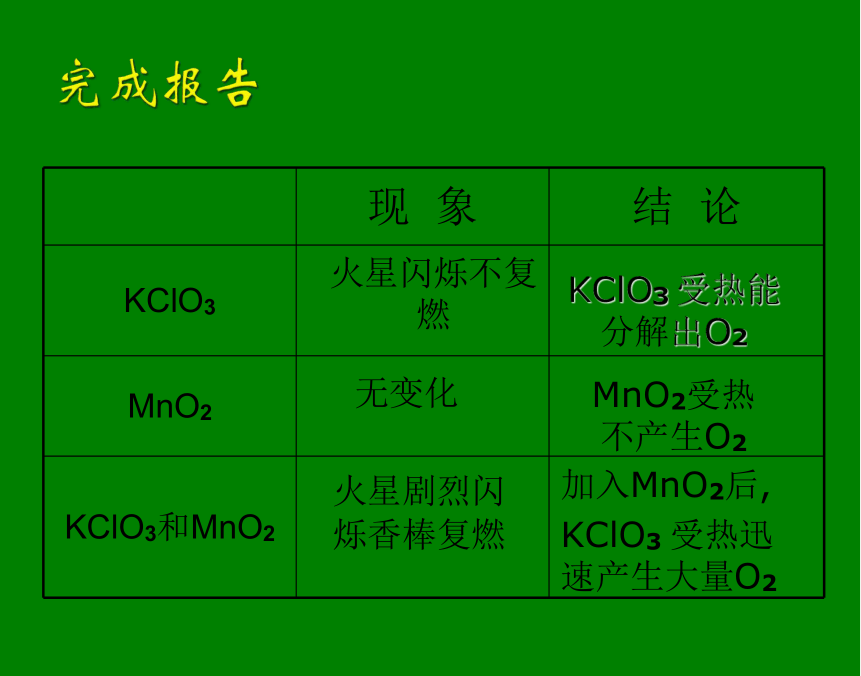
1、石棉网一端放2勺KClO3,另一端放入2/3勺MnO2
2、用带火星的香棒分别接触KClO3、MnO2,观察现象
3、将KClO3与MnO2混合均匀,用带火星的香棒接触混合物,观察现象探究MnO2在KClO3分解中的作用火星闪烁不复燃KClO3 受热能分解出O2无变化MnO2受热不产生O2火星剧烈闪烁香棒复燃 加入MnO2后,
KClO3 受热迅速产生大量O2 象MnO2那样能够改变化学反应的速率,而本身的质量和化学性质在反应前后不变的物质叫催化剂,催化剂所起的作用叫催化作用。
下面关于催化剂的叙述正确的是( )
A、在反应中使用催化剂,反应速度一定加快
B、若用双氧水制取O2,只能选用MnO2作为催化剂
C、催化剂可以改变物质的化学反应速率
D、催化剂在反应前后,一切性质都不改变C 光合作用水二氧化碳有机物氧气叶绿体 化学变化能否发生的根本决定性因素是反应物本身的性质,即内因。除此以外,化学反应的发生还与外界的一些因素有关,即外因。 外因是化学变化的条件,内因是变化的根据,外因通过内因而起作用。
-------毛泽东1、形成化学变化是有条件的观点。
2、了解化学变化中常见的条件。
3、初步了解催化剂和催化作用的概念。 1、常温下,碘与镁化合生成碘化镁时反应速度很慢,若滴几滴水,则剧烈反应生成碘化镁,还形成一股美丽的紫色烟雾。在此反应中 水 是( )
A、反应物 B、氧化剂 C、催化剂 D、生成物 C 2、化学反应往往需要在一定的条件下进行。通过控制或改变反应条件可以加快、减慢甚至阻止反应的进行。下列措施中,能加快其化学反应速率的是( )
A、铁门表面喷漆 B、冰箱保存食物
C、扇子扇煤炉火
D、木头电线杆稍稍烤焦埋入土中 C[能力检测] 3、木炭放在空气中不反应,是因为缺少____条件;在通风不畅的地方容易产生会使人中毒的 _ ,在通风良好的地方就产生 ,在氧气中燃烧比在空气中燃烧更剧烈的原因是_____。
由此你想到了什么? 实验室用氯酸钾来制取氧气,如果不用二氧化锰做催化剂,最好选用( ) A Fe2O3 B Al2O3 C CuO DMgO请调查、走访、查阅资料,我们生活中哪些地方使用了催化剂?
[实验步骤]
1、向试管中加入1ml CuSO4溶液
2、再向其中滴加1.5ml NaOH溶液,振荡
3.把浊液一分为二
4、一支置于常温下,观察Cu(OH)2常温下是否分解
5、另一支用试管夹夹住,在酒精灯上加热,观察Cu(OH)2是否能分解探究氢氧化铜是否在常温下就能分解?[猜想与假设]1、Cu(OH)2常温下不分解。
2、若要使Cu(OH)2分解,必须加热到
一定的温度。
3、温度能影响化学反应的发生。 1、给过氧化氢溶液加热,温度越高产生气泡越多。
2、在夏季食品容易变质,而在冰箱中能保存较长时间。
[实验步骤]
1、石棉网一端放2勺KClO3,另一端放入2/3勺MnO2
2、用带火星的香棒分别接触KClO3、MnO2,观察现象
3、将KClO3与MnO2混合均匀,用带火星的香棒接触混合物,观察现象探究MnO2在KClO3分解中的作用火星闪烁不复燃KClO3 受热能分解出O2无变化MnO2受热不产生O2火星剧烈闪烁香棒复燃 加入MnO2后,
KClO3 受热迅速产生大量O2 象MnO2那样能够改变化学反应的速率,而本身的质量和化学性质在反应前后不变的物质叫催化剂,催化剂所起的作用叫催化作用。
下面关于催化剂的叙述正确的是( )
A、在反应中使用催化剂,反应速度一定加快
B、若用双氧水制取O2,只能选用MnO2作为催化剂
C、催化剂可以改变物质的化学反应速率
D、催化剂在反应前后,一切性质都不改变C 光合作用水二氧化碳有机物氧气叶绿体 化学变化能否发生的根本决定性因素是反应物本身的性质,即内因。除此以外,化学反应的发生还与外界的一些因素有关,即外因。 外因是化学变化的条件,内因是变化的根据,外因通过内因而起作用。
-------毛泽东1、形成化学变化是有条件的观点。
2、了解化学变化中常见的条件。
3、初步了解催化剂和催化作用的概念。 1、常温下,碘与镁化合生成碘化镁时反应速度很慢,若滴几滴水,则剧烈反应生成碘化镁,还形成一股美丽的紫色烟雾。在此反应中 水 是( )
A、反应物 B、氧化剂 C、催化剂 D、生成物 C 2、化学反应往往需要在一定的条件下进行。通过控制或改变反应条件可以加快、减慢甚至阻止反应的进行。下列措施中,能加快其化学反应速率的是( )
A、铁门表面喷漆 B、冰箱保存食物
C、扇子扇煤炉火
D、木头电线杆稍稍烤焦埋入土中 C[能力检测] 3、木炭放在空气中不反应,是因为缺少____条件;在通风不畅的地方容易产生会使人中毒的 _ ,在通风良好的地方就产生 ,在氧气中燃烧比在空气中燃烧更剧烈的原因是_____。
由此你想到了什么? 实验室用氯酸钾来制取氧气,如果不用二氧化锰做催化剂,最好选用( ) A Fe2O3 B Al2O3 C CuO DMgO请调查、走访、查阅资料,我们生活中哪些地方使用了催化剂?
同课章节目录
- 专题一 走进化学殿堂
- 单元1 化学使生活更美好
- 单元2 如何学习化学
- 专题二 空气和水
- 单元1 多组分的空气
- 单元2 氧气
- 单元3 自然界的水
- 专题三 物质的构成
- 单元1 构成物质的微粒
- 单元2 组成物质的元素
- 单元3 纯净物组成的表示方法
- 专题四 燃料与燃烧
- 单元1 燃烧与灭火
- 单元2 碳及其化合物
- 单元3 化石燃料的利用
- 专题五 化学变化及其表示
- 单元1 化学变化是有条件的
- 单元2 质量守恒定律
- 单元3 化学方程式
- 专题六 物质的溶解
- 单元1 物质的溶解过程
- 单元2 物质的溶解性
- 单元3 物质的溶解性的改变
- 学生实验
- 实验1 实验基本操作
- 实验2 氧气的实验室制取与性质
- 实验3 燃烧的条件
- 实验4 二氧化碳的实验室制取与性质
- 实验5 一定浓度溶液的配置
