3.3 金属晶体与离子晶体 第2课时课件(共41张PPT)-2023-2024学年高二化学(人教版2019选择性必修2)
文档属性
| 名称 | 3.3 金属晶体与离子晶体 第2课时课件(共41张PPT)-2023-2024学年高二化学(人教版2019选择性必修2) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-26 18:05:09 | ||
图片预览





文档简介
(共41张PPT)
第三节 金属晶体与离子晶体
第2课时
第三章 晶体结构与性质
晶体类型的比较
2
过渡晶体与混合型晶体
1
本节重点
本节难点
我们已经讨论了分子晶体、共价晶体、金属晶体和离子晶体等四类典型晶体
思考:还有其他类型的晶体吗?
分子晶体
CO2
离子晶体
NaCl
共价晶体
SiO2
金属晶体
Cu
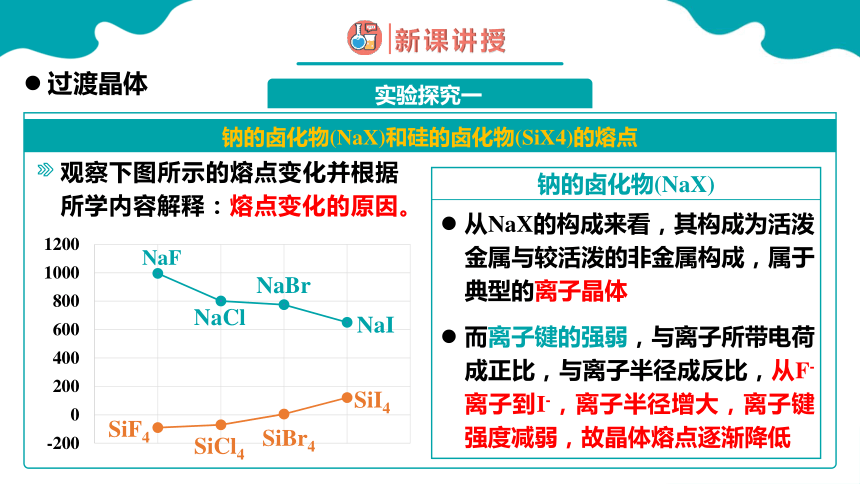
钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点
实验探究一
过渡晶体
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
观察下图所示的熔点变化并根据所学内容解释:熔点变化的原因。
从NaX的构成来看,其构成为活泼金属与较活泼的非金属构成,属于典型的离子晶体
钠的卤化物(NaX)
而离子键的强弱,与离子所带电荷成正比,与离子半径成反比,从F-离子到I-,离子半径增大,离子键强度减弱,故晶体熔点逐渐降低
钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点
实验探究一
过渡晶体
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
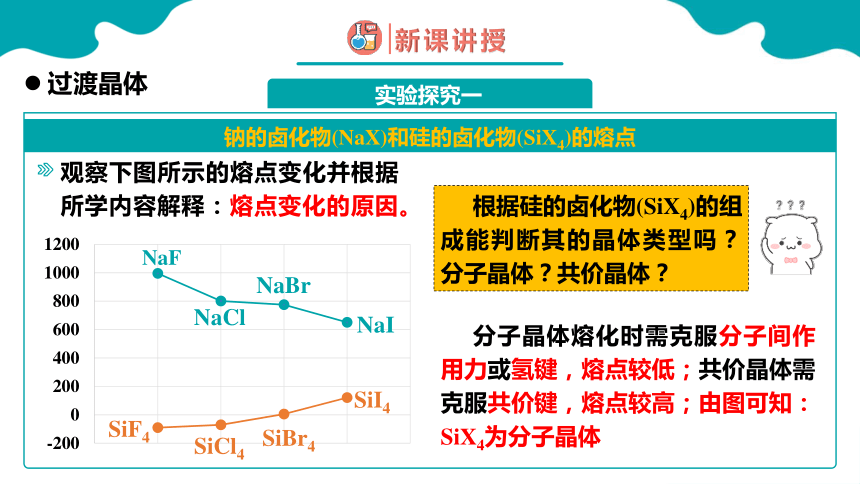
观察下图所示的熔点变化并根据所学内容解释:熔点变化的原因。
根据硅的卤化物(SiX4)的组成能判断其的晶体类型吗?分子晶体?共价晶体?
分子晶体熔化时需克服分子间作用力或氢键,熔点较低;共价晶体需克服共价键,熔点较高;由图可知:SiX4为分子晶体
钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点
实验探究一
过渡晶体
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
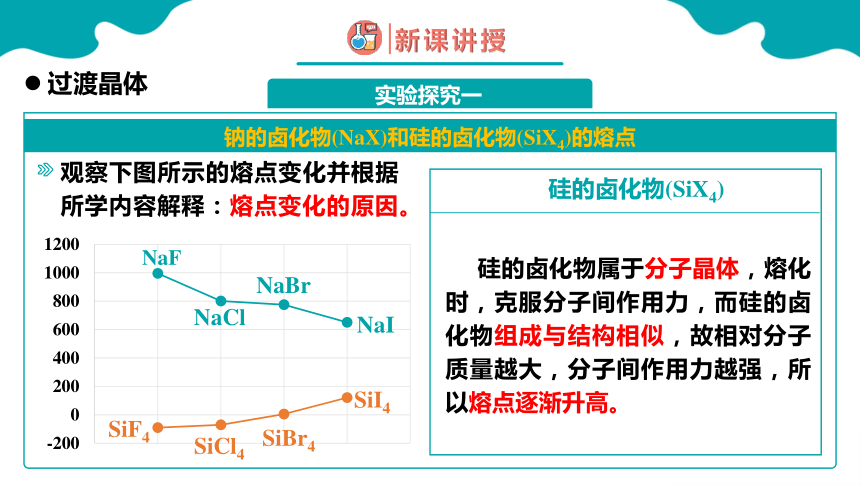
观察下图所示的熔点变化并根据所学内容解释:熔点变化的原因。
硅的卤化物属于分子晶体,熔化时,克服分子间作用力,而硅的卤化物组成与结构相似,故相对分子质量越大,分子间作用力越强,所以熔点逐渐升高。
硅的卤化物(SiX4)
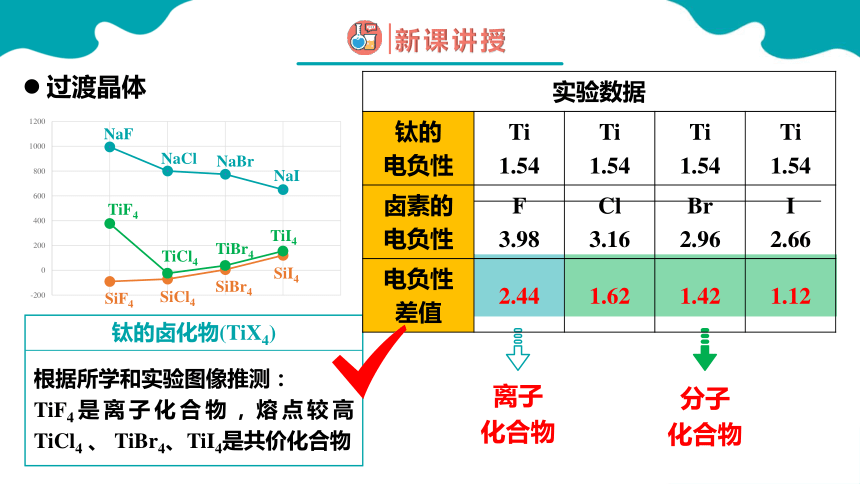
TiF4熔点高于TiCl4 、 TiBr4、TiI4 ,而TiCl4至TiI4熔点依次升高,解释原因
实验探究二
过渡晶体
观察下图所示的熔点变化并根据所学内容解释:熔点变化的原因。
根据所学和实验图像推测:
TiF4是离子化合物,熔点较高TiCl4 、 TiBr4、TiI4是共价化合物
钛的卤化物(TiX4)
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
TiF4
TiCl4
TiBr4
TiI4
推测是否正确?为什么由金属元素和非金属元素组成的化合物可能是共价化合物呢?
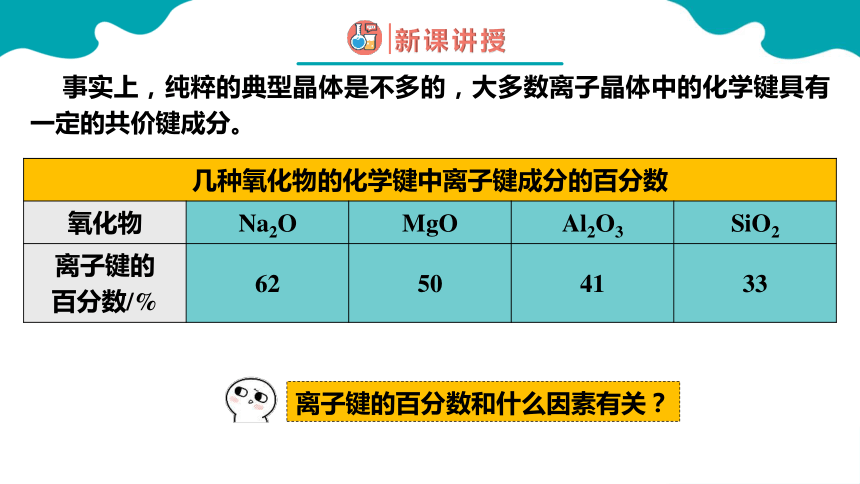
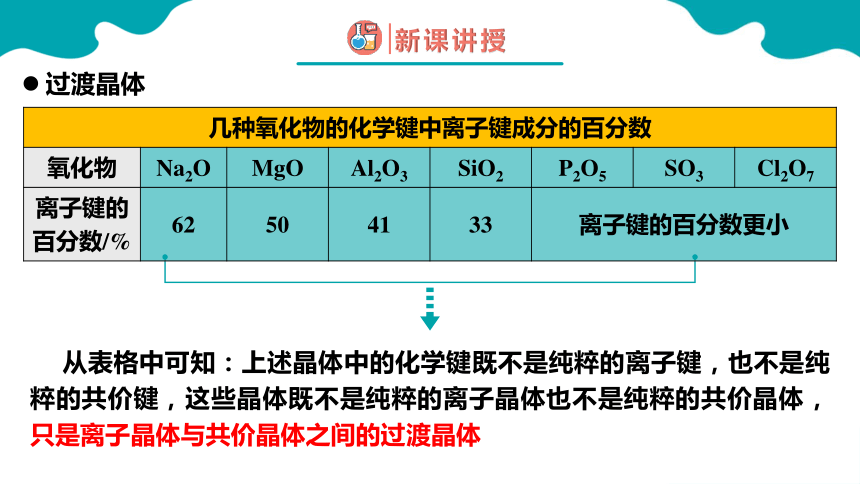
事实上,纯粹的典型晶体是不多的,大多数离子晶体中的化学键具有一定的共价键成分。
几种氧化物的化学键中离子键成分的百分数 氧化物 Na2O MgO Al2O3 SiO2
离子键的 百分数/% 62 50 41 33
离子键的百分数和什么因素有关?
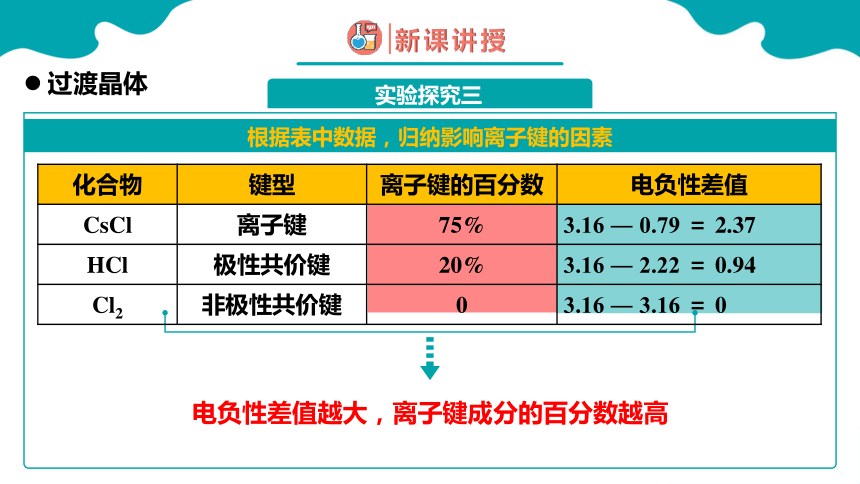
根据表中数据,归纳影响离子键的因素
实验探究三
过渡晶体
电负性差值越大,离子键成分的百分数越高
化合物 键型 离子键的百分数 电负性差值
CsCl 离子键 75% 3.16 ― 0.79 = 2.37
HCl 极性共价键 20% 3.16 ― 2.22 = 0.94
Cl2 非极性共价键 0 3.16 ― 3.16 = 0
过渡晶体
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
TiF4
TiCl4
TiBr4
TiI4
根据所学和实验图像推测:
TiF4是离子化合物,熔点较高TiCl4 、 TiBr4、TiI4是共价化合物
钛的卤化物(TiX4)
离子
化合物
分子
化合物
实验数据 钛的 电负性 Ti 1.54 Ti 1.54 Ti 1.54 Ti
1.54
卤素的 电负性 F 3.98 Cl 3.16 Br 2.96 I
2.66
电负性 差值 2.44 1.62 1.42 1.12
从表格中可知:上述晶体中的化学键既不是纯粹的离子键,也不是纯粹的共价键,这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的过渡晶体
几种氧化物的化学键中离子键成分的百分数 氧化物 Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子键的百分数/% 62 50 41 33 离子键的百分数更小 过渡晶体
离子
晶体
共价
晶体
分子
晶体
离子晶体和共价晶体的过渡标准是化学键中离子键成分的百分数。离子键成分的百分数大,作为离子晶体,离子键成分的百分数小,作为共价晶体。
过渡晶体
几种氧化物的化学键中离子键成分的百分数 氧化物 Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子键的百分数/% 62 50 41 33 离子键的百分数更小 资料1 氯化铝晶体的导电性随温度变化图
资料2 氯化铝处于熔融态时,以二聚体的Al2Cl6的形式存在
问题1:冶炼铝通常采用电解熔融Al2O3(熔点:2 054℃)的方法,为什么不电解熔融态AlCl3(熔点:192.6℃)?
实验探究四
过渡晶体
从资料1可知,当温度达到熔点时,AlCl3为液体,电导率几乎变到零,这说明体系中不存在自由移动的离子。结合资料2,AlCl3分子的结构,可知不能用电解熔融态氯化铝来冶炼铝
问题2:判断AlCl3的晶体类型
实验探究四
过渡晶体
资料1 氯化铝晶体的导电性随温度变化图
资料2 氯化铝处于熔融态时,以二聚体的Al2Cl6的形式存在
结合资料2,AlCl3分子的结构,熔融态氯化铝为共价化合物,所以其为分子晶体;
综合以上两点:AlCl3中的化学键既有一定的离子性,又有一定的共价性,即AlCl3是介于离子晶体和分子晶体之间的过渡晶体。
结合资料1:AlCl3晶体的导电性随温度变化图,在接近熔点时导电性提高,说明体系中存在一定数量的离子,这些离子可以在一定范围内运动,推测固态氯化铝晶体是离子晶体;
过渡晶体与混合型晶体
第三周期元素的氯化物及其晶体类型
MgCl2
SiCl4
SF6
离子晶体
NaCl
Mg
Al
Si
P
S
分子晶体
Cl2
AlCl3
过渡晶体
分子晶体
分子晶体
离子晶体
金属晶体
Na
从不同角度观察石墨的结构模型
实验测得:石墨晶体是层状结构的,层内的碳原子的核间距为142 pm,层间距离为335 pm。
混合型晶体
石墨晶
体中的
二维平
面结构
石墨
的层
状结构
分析石墨晶体的构成微粒及微粒间相互作用,并解释石墨具有导电性和润滑性的原因
实验探究五
混合型晶体
石墨
的层
状结构
石墨的层状结构
分析石墨晶体的构成微粒及微粒间相互作用,并解释石墨具有导电性和润滑性的原因
实验探究五
混合型晶体
因为石墨晶体的层间距离为335pm,远大于正常化学键的键长。说明层与层之间没有化学键相连,是靠范德华力维系的。
由于相邻碳原子平面之间相隔较远,电子不可能从一个平面跳跃到另一个平面,故石墨的导电性只能沿着石墨平面的方向
石墨的导电性
石墨的层状结构
因为分子间作用力较弱,层与层之间易于断开而滑动,所以石墨具有润滑性
分析石墨晶体的构成微粒及微粒间相互作用,并解释石墨具有导电性和润滑性的原因
实验探究五
混合型晶体
石墨的润滑性
混合型晶体
在石墨晶体中既有共价键又带有金属键性质,而层间结合则依靠分子间作用力。所以这是一种十分典型的混合键型单质晶体。
概念
结构特点——层状结构
①同层内,碳原子采用 杂化,以 相结合形成 结构。所有碳原子的p轨道平行且相互重叠,p轨道中的电子可在整个碳原子平面中运动。
②层与层之间以 相结合。
sp2
共价键
平面六元并环
范德华力
晶体类型
石墨晶体中,既有 ,又有 和 ,属于 。
共价键
金属键
范德华力
混合型晶体
混合型晶体
物理性质
导电性
导热性
润滑性
纯粹的典型晶体是没有的( )
离子键成分的百分数是依据电负性的差值计算出来的,差值越大,离子键成分的百分数越小( )
在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅限于晶体微观空间的一个个分子中( )
四类晶体都有过渡型( )
石墨的二维结构内,每个碳原子的配位数为3( )
石墨的导电只能沿石墨平面的方向进行( )
石墨晶体层与层之间距离较大,所以石墨的熔点不高( )
回顾所学内容,判断下列问题的对与错
问题1
问题2
问题3
问题4
问题5
问题6
问题7
四种晶体的比较
晶体 分子晶体 离子晶体 金属晶体 共价晶体
构成微粒 分子 阴、阳离子 金属离子、自由电子 原子
微粒间 作用力 范德华力 (少数有氢键) 离子键 金属键 共价键
性质 熔、沸点 较低 较高 一般较高 很高
硬度 小 略硬而脆 一般较大 很大
溶解性 相似相溶 多数溶于水 不溶,有些与水反应 不溶
机械加工性能 不良 不良 良好 不良
导电性 固态、液态均不导电,部分溶于水时导电 固态时不导电,熔融时导电,能溶于水的溶于水时导电 固态、熔融态时导电 大部分固态、熔融时都不导电
四种晶体的比较
晶体 分子晶体 离子晶体 金属晶体 共价晶体
构成微粒 分子 阴、阳离子 金属离子、自由电子 原子
微粒间 作用力 范德华力 (少数有氢键) 离子键 金属键 共价键
作用力大小规律 组成和结构相似的分子,相对分子质量大的范德华力大 离子所带电荷数多、半径小的离子键强 金属原子的价电子数多、半径小的金属离子与自由电子间的作用力强 共价键键长短(电子云重叠多)、原子半径小的共价键稳定
分子间通过_____________形成的晶体属于____________;
由_____________和_____________通过金属键形成的晶体属于_____________。
由阴、阳离子通过_____________形成的晶体属于_____________ ;
由原子通过_____________形成的晶体属于_____________ ;
晶体类型的判断方法
分子间作用力
依据组成晶体的微观粒子和粒子间的作用判断
分子晶体
共价键
离子键
金属阳离子
自由电子
金属晶体
离子晶体
共价晶体
晶体类型的判断方法
依据物质的分类判断
①活泼金属的________(如________、MgO等)、________ [如KOH、Ba(OH)2等]和绝大多数的________是离子晶体。
②大多数非金属单质(除金刚石、石墨、晶体硼、晶体硅等外)、_____________、____________(除SiO2外)、酸、绝大多数有机物(除有机盐外)是分子晶体。
③常见的共价晶体单质有金刚石、晶体硼、晶体硅等;常见的共价晶体化合物有碳化硅、SiO2等。
④________单质(除汞外)与________均属于金属晶体。
氧化物
Na2O
强碱
盐类
气态氢化物
非金属氧化物
金属
合金
晶体类型的判断方法
依据晶体的熔点判断
离子晶体的熔点较高,常在数百至几千摄氏度
共价晶体的熔点高,常在一千至几千摄氏度
分子晶体的熔点较低,常在数百摄氏度以下至很低温度
金属晶体多数熔点高,但也有熔点相当低的
晶体类型的判断方法
依据导电性判断
离子晶体在水溶液中和熔融状态下都导电
共价晶体一般为非导体,但晶体硅能导电
分子晶体为非导体,而分子晶体中的电解质(主要是酸和非金属氢化物)溶于水,使分子内的化学键断裂形成自由离子,也能导电
金属晶体是电的良导体
晶体类型的判断方法
依据硬度和机械性能判断
离子晶体硬度较大或略硬而脆
共价晶体硬度大
分子晶体硬度小且较脆
金属晶体多数硬度大,但也有硬度较小的,且具有延展性
【例1】四种物质的一些性质如下表:
晶体类型:
单质硫是_____晶体;单质硼是_____晶体;
氯化铝是_____晶体;苛性钾是_____晶体。
分子
共价
分子
离子
物质 熔点/℃ 沸点/℃ 其他性质
单质硫 120.5 271.5 —
单质硼 2 300 2 550 硬度大
氯化铝 190 182.7 177.8 ℃升华
苛性钾 300 1 320 晶体不导电,熔融态导电
钙钛矿太阳能电池
近年来,钙钛矿太阳能电池凭借制造成本低、效率高等显著优点,迅速成为全球太阳能电池领域的研究热点。钙钛矿电池理论光电转换效率可达26%,接近单晶硅太阳能电池(25.6%)的水平。最新报道的钙钛矿太阳能电池光电转换效率达到20.1%,远高于多晶硅太阳能电池的光电转换效率(18%),具有十分广阔的市场应用前景。
1.维生素B1晶体溶于水的过程中要克服的微粒间的作用力有
A.离子键、共价键
B.离子键、氢键、共价键
C.氢键、范德华力
D.离子键、氢键、范德华力
【答案】D
【详解】维生素B1分子中含有氨基和羟基,易形成氢键,故溶于水时要破坏离子键、氢键和范德华力,故D正确;
故选D。
2.下列说法错误的是
A.气态和液态物质都是由分子构成的
B.超分子的重要特征是分子识别和自组装
C.大多数晶体都是四种典型晶体之间的过渡晶体
D.石墨晶体中既有共价键和范德华力又有类似金属的导电性属于混合型晶体
【答案】A
【详解】A.常温下汞为液态,由汞原子构成,A错误;
B.超分子通常是指由两种或两种以上分子依靠分子间相互作用结合在一起,组成复杂的、有组织的聚集体,超分子的重要特征是分子识别和自组装,B正确;
C. 四类典型晶体分别是分子晶体、共价晶体、金属晶体和离子晶体 等,但纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶体,C正确;
D.石墨为层状结构,层内 C 原子间以共价键结合成六边形,层与层之间为范德华力,是一种混合型的晶体,D正确;
3.下列说法不正确的是
A.Al2O3是偏向离子晶体的过渡晶体,当作离子晶体来处理:SiO2是偏向共价晶体的过渡晶体,当作共价晶体来处理
B.Na2O 中离子键的百分数为62%,则Na2O不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体
C.Na2O通常当作离子晶体来处理,因为Na2O是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
【答案】A
【详解】A.Al2O3和SiO2都是偏向共价晶体的过渡晶体,当作共价晶体来处理,故A错误;
B.Na2O 中离子键的百分数为62%,说明Na2O中存在共价键,则Na2O不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体,故B正确;
C.离子键和共价键的本质区别是形成两元素电负性的差值,差值大为离子键,差值小为共价键,Na2O通常当作离子晶体来处理,因为Na2O是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近,故C正确;
D.根据微粒间的作用力分析,分子晶体、共价晶体、金属晶体和离子晶体都有过渡型,故D正确;
故选A。
4.下列各组物质中,化学键类型和晶体类型都相同的是
A.Ar和K
B.NaCl和NaOH
C.CH4和H2O
D.CO2和SiO2
【答案】C
【详解】A.Ar为只含分子间作用力的分子晶体,K为含有金属键的金属晶体,A选项错误;
B.NaCl为只含离子键的离子晶体,NaOH是含有共价键、离子键的离子晶体,B选项错误;
C.CH4和H2O均是含有共价键和分子间作用力的分子晶体,C选项正确;
D.CO2是含有共价键、分子间作用力的分子晶体,SiO2是只含共价键的原子晶体,D选项错误;
答案选C。
5.黑鳞的晶体结构是与石墨类似的层状结构,如图所示。下列有关说法不正确的是
A.黑磷晶体中片层间作用力为范德华力
B.黑磷与白磷均可导电
C.黑磷晶体的熔沸点比白磷高
D.1 mol黑磷晶体中含有1.5 mol P-P键
【答案】B
【详解】A.由黑鳞的晶体结构是与石墨类似的层状结构,为混合型晶体,片层间作用力为范德华力,A正确;
B.白磷为分子晶体,黑磷结构与石墨类似为混合型晶体,则黑鳞能导电、白磷不导电,B错误;
C.黑磷结构与石墨类似为混合型晶体,其熔沸点很高,故黑磷晶体的熔沸点比白磷高,C正确;
D.可利用均摊法得黑磷晶体中1个磷原子形成3/2=1.5个共价键,则1 mol黑磷晶体中含有1.5 mol P-P,D正确;
故选B。
第三节
金属晶体与离子晶体
第2课时
混合型晶体
晶体类型
过渡晶体
概念
结构特点——层状结构
物理性质
四种晶体的比较
晶体类型的判断方法
THANKS
第三节 金属晶体与离子晶体
第2课时
第三章 晶体结构与性质
晶体类型的比较
2
过渡晶体与混合型晶体
1
本节重点
本节难点
我们已经讨论了分子晶体、共价晶体、金属晶体和离子晶体等四类典型晶体
思考:还有其他类型的晶体吗?
分子晶体
CO2
离子晶体
NaCl
共价晶体
SiO2
金属晶体
Cu
钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点
实验探究一
过渡晶体
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
观察下图所示的熔点变化并根据所学内容解释:熔点变化的原因。
从NaX的构成来看,其构成为活泼金属与较活泼的非金属构成,属于典型的离子晶体
钠的卤化物(NaX)
而离子键的强弱,与离子所带电荷成正比,与离子半径成反比,从F-离子到I-,离子半径增大,离子键强度减弱,故晶体熔点逐渐降低
钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点
实验探究一
过渡晶体
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
观察下图所示的熔点变化并根据所学内容解释:熔点变化的原因。
根据硅的卤化物(SiX4)的组成能判断其的晶体类型吗?分子晶体?共价晶体?
分子晶体熔化时需克服分子间作用力或氢键,熔点较低;共价晶体需克服共价键,熔点较高;由图可知:SiX4为分子晶体
钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点
实验探究一
过渡晶体
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
观察下图所示的熔点变化并根据所学内容解释:熔点变化的原因。
硅的卤化物属于分子晶体,熔化时,克服分子间作用力,而硅的卤化物组成与结构相似,故相对分子质量越大,分子间作用力越强,所以熔点逐渐升高。
硅的卤化物(SiX4)
TiF4熔点高于TiCl4 、 TiBr4、TiI4 ,而TiCl4至TiI4熔点依次升高,解释原因
实验探究二
过渡晶体
观察下图所示的熔点变化并根据所学内容解释:熔点变化的原因。
根据所学和实验图像推测:
TiF4是离子化合物,熔点较高TiCl4 、 TiBr4、TiI4是共价化合物
钛的卤化物(TiX4)
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
TiF4
TiCl4
TiBr4
TiI4
推测是否正确?为什么由金属元素和非金属元素组成的化合物可能是共价化合物呢?
事实上,纯粹的典型晶体是不多的,大多数离子晶体中的化学键具有一定的共价键成分。
几种氧化物的化学键中离子键成分的百分数 氧化物 Na2O MgO Al2O3 SiO2
离子键的 百分数/% 62 50 41 33
离子键的百分数和什么因素有关?
根据表中数据,归纳影响离子键的因素
实验探究三
过渡晶体
电负性差值越大,离子键成分的百分数越高
化合物 键型 离子键的百分数 电负性差值
CsCl 离子键 75% 3.16 ― 0.79 = 2.37
HCl 极性共价键 20% 3.16 ― 2.22 = 0.94
Cl2 非极性共价键 0 3.16 ― 3.16 = 0
过渡晶体
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
TiF4
TiCl4
TiBr4
TiI4
根据所学和实验图像推测:
TiF4是离子化合物,熔点较高TiCl4 、 TiBr4、TiI4是共价化合物
钛的卤化物(TiX4)
离子
化合物
分子
化合物
实验数据 钛的 电负性 Ti 1.54 Ti 1.54 Ti 1.54 Ti
1.54
卤素的 电负性 F 3.98 Cl 3.16 Br 2.96 I
2.66
电负性 差值 2.44 1.62 1.42 1.12
从表格中可知:上述晶体中的化学键既不是纯粹的离子键,也不是纯粹的共价键,这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的过渡晶体
几种氧化物的化学键中离子键成分的百分数 氧化物 Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子键的百分数/% 62 50 41 33 离子键的百分数更小 过渡晶体
离子
晶体
共价
晶体
分子
晶体
离子晶体和共价晶体的过渡标准是化学键中离子键成分的百分数。离子键成分的百分数大,作为离子晶体,离子键成分的百分数小,作为共价晶体。
过渡晶体
几种氧化物的化学键中离子键成分的百分数 氧化物 Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子键的百分数/% 62 50 41 33 离子键的百分数更小 资料1 氯化铝晶体的导电性随温度变化图
资料2 氯化铝处于熔融态时,以二聚体的Al2Cl6的形式存在
问题1:冶炼铝通常采用电解熔融Al2O3(熔点:2 054℃)的方法,为什么不电解熔融态AlCl3(熔点:192.6℃)?
实验探究四
过渡晶体
从资料1可知,当温度达到熔点时,AlCl3为液体,电导率几乎变到零,这说明体系中不存在自由移动的离子。结合资料2,AlCl3分子的结构,可知不能用电解熔融态氯化铝来冶炼铝
问题2:判断AlCl3的晶体类型
实验探究四
过渡晶体
资料1 氯化铝晶体的导电性随温度变化图
资料2 氯化铝处于熔融态时,以二聚体的Al2Cl6的形式存在
结合资料2,AlCl3分子的结构,熔融态氯化铝为共价化合物,所以其为分子晶体;
综合以上两点:AlCl3中的化学键既有一定的离子性,又有一定的共价性,即AlCl3是介于离子晶体和分子晶体之间的过渡晶体。
结合资料1:AlCl3晶体的导电性随温度变化图,在接近熔点时导电性提高,说明体系中存在一定数量的离子,这些离子可以在一定范围内运动,推测固态氯化铝晶体是离子晶体;
过渡晶体与混合型晶体
第三周期元素的氯化物及其晶体类型
MgCl2
SiCl4
SF6
离子晶体
NaCl
Mg
Al
Si
P
S
分子晶体
Cl2
AlCl3
过渡晶体
分子晶体
分子晶体
离子晶体
金属晶体
Na
从不同角度观察石墨的结构模型
实验测得:石墨晶体是层状结构的,层内的碳原子的核间距为142 pm,层间距离为335 pm。
混合型晶体
石墨晶
体中的
二维平
面结构
石墨
的层
状结构
分析石墨晶体的构成微粒及微粒间相互作用,并解释石墨具有导电性和润滑性的原因
实验探究五
混合型晶体
石墨
的层
状结构
石墨的层状结构
分析石墨晶体的构成微粒及微粒间相互作用,并解释石墨具有导电性和润滑性的原因
实验探究五
混合型晶体
因为石墨晶体的层间距离为335pm,远大于正常化学键的键长。说明层与层之间没有化学键相连,是靠范德华力维系的。
由于相邻碳原子平面之间相隔较远,电子不可能从一个平面跳跃到另一个平面,故石墨的导电性只能沿着石墨平面的方向
石墨的导电性
石墨的层状结构
因为分子间作用力较弱,层与层之间易于断开而滑动,所以石墨具有润滑性
分析石墨晶体的构成微粒及微粒间相互作用,并解释石墨具有导电性和润滑性的原因
实验探究五
混合型晶体
石墨的润滑性
混合型晶体
在石墨晶体中既有共价键又带有金属键性质,而层间结合则依靠分子间作用力。所以这是一种十分典型的混合键型单质晶体。
概念
结构特点——层状结构
①同层内,碳原子采用 杂化,以 相结合形成 结构。所有碳原子的p轨道平行且相互重叠,p轨道中的电子可在整个碳原子平面中运动。
②层与层之间以 相结合。
sp2
共价键
平面六元并环
范德华力
晶体类型
石墨晶体中,既有 ,又有 和 ,属于 。
共价键
金属键
范德华力
混合型晶体
混合型晶体
物理性质
导电性
导热性
润滑性
纯粹的典型晶体是没有的( )
离子键成分的百分数是依据电负性的差值计算出来的,差值越大,离子键成分的百分数越小( )
在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅限于晶体微观空间的一个个分子中( )
四类晶体都有过渡型( )
石墨的二维结构内,每个碳原子的配位数为3( )
石墨的导电只能沿石墨平面的方向进行( )
石墨晶体层与层之间距离较大,所以石墨的熔点不高( )
回顾所学内容,判断下列问题的对与错
问题1
问题2
问题3
问题4
问题5
问题6
问题7
四种晶体的比较
晶体 分子晶体 离子晶体 金属晶体 共价晶体
构成微粒 分子 阴、阳离子 金属离子、自由电子 原子
微粒间 作用力 范德华力 (少数有氢键) 离子键 金属键 共价键
性质 熔、沸点 较低 较高 一般较高 很高
硬度 小 略硬而脆 一般较大 很大
溶解性 相似相溶 多数溶于水 不溶,有些与水反应 不溶
机械加工性能 不良 不良 良好 不良
导电性 固态、液态均不导电,部分溶于水时导电 固态时不导电,熔融时导电,能溶于水的溶于水时导电 固态、熔融态时导电 大部分固态、熔融时都不导电
四种晶体的比较
晶体 分子晶体 离子晶体 金属晶体 共价晶体
构成微粒 分子 阴、阳离子 金属离子、自由电子 原子
微粒间 作用力 范德华力 (少数有氢键) 离子键 金属键 共价键
作用力大小规律 组成和结构相似的分子,相对分子质量大的范德华力大 离子所带电荷数多、半径小的离子键强 金属原子的价电子数多、半径小的金属离子与自由电子间的作用力强 共价键键长短(电子云重叠多)、原子半径小的共价键稳定
分子间通过_____________形成的晶体属于____________;
由_____________和_____________通过金属键形成的晶体属于_____________。
由阴、阳离子通过_____________形成的晶体属于_____________ ;
由原子通过_____________形成的晶体属于_____________ ;
晶体类型的判断方法
分子间作用力
依据组成晶体的微观粒子和粒子间的作用判断
分子晶体
共价键
离子键
金属阳离子
自由电子
金属晶体
离子晶体
共价晶体
晶体类型的判断方法
依据物质的分类判断
①活泼金属的________(如________、MgO等)、________ [如KOH、Ba(OH)2等]和绝大多数的________是离子晶体。
②大多数非金属单质(除金刚石、石墨、晶体硼、晶体硅等外)、_____________、____________(除SiO2外)、酸、绝大多数有机物(除有机盐外)是分子晶体。
③常见的共价晶体单质有金刚石、晶体硼、晶体硅等;常见的共价晶体化合物有碳化硅、SiO2等。
④________单质(除汞外)与________均属于金属晶体。
氧化物
Na2O
强碱
盐类
气态氢化物
非金属氧化物
金属
合金
晶体类型的判断方法
依据晶体的熔点判断
离子晶体的熔点较高,常在数百至几千摄氏度
共价晶体的熔点高,常在一千至几千摄氏度
分子晶体的熔点较低,常在数百摄氏度以下至很低温度
金属晶体多数熔点高,但也有熔点相当低的
晶体类型的判断方法
依据导电性判断
离子晶体在水溶液中和熔融状态下都导电
共价晶体一般为非导体,但晶体硅能导电
分子晶体为非导体,而分子晶体中的电解质(主要是酸和非金属氢化物)溶于水,使分子内的化学键断裂形成自由离子,也能导电
金属晶体是电的良导体
晶体类型的判断方法
依据硬度和机械性能判断
离子晶体硬度较大或略硬而脆
共价晶体硬度大
分子晶体硬度小且较脆
金属晶体多数硬度大,但也有硬度较小的,且具有延展性
【例1】四种物质的一些性质如下表:
晶体类型:
单质硫是_____晶体;单质硼是_____晶体;
氯化铝是_____晶体;苛性钾是_____晶体。
分子
共价
分子
离子
物质 熔点/℃ 沸点/℃ 其他性质
单质硫 120.5 271.5 —
单质硼 2 300 2 550 硬度大
氯化铝 190 182.7 177.8 ℃升华
苛性钾 300 1 320 晶体不导电,熔融态导电
钙钛矿太阳能电池
近年来,钙钛矿太阳能电池凭借制造成本低、效率高等显著优点,迅速成为全球太阳能电池领域的研究热点。钙钛矿电池理论光电转换效率可达26%,接近单晶硅太阳能电池(25.6%)的水平。最新报道的钙钛矿太阳能电池光电转换效率达到20.1%,远高于多晶硅太阳能电池的光电转换效率(18%),具有十分广阔的市场应用前景。
1.维生素B1晶体溶于水的过程中要克服的微粒间的作用力有
A.离子键、共价键
B.离子键、氢键、共价键
C.氢键、范德华力
D.离子键、氢键、范德华力
【答案】D
【详解】维生素B1分子中含有氨基和羟基,易形成氢键,故溶于水时要破坏离子键、氢键和范德华力,故D正确;
故选D。
2.下列说法错误的是
A.气态和液态物质都是由分子构成的
B.超分子的重要特征是分子识别和自组装
C.大多数晶体都是四种典型晶体之间的过渡晶体
D.石墨晶体中既有共价键和范德华力又有类似金属的导电性属于混合型晶体
【答案】A
【详解】A.常温下汞为液态,由汞原子构成,A错误;
B.超分子通常是指由两种或两种以上分子依靠分子间相互作用结合在一起,组成复杂的、有组织的聚集体,超分子的重要特征是分子识别和自组装,B正确;
C. 四类典型晶体分别是分子晶体、共价晶体、金属晶体和离子晶体 等,但纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶体,C正确;
D.石墨为层状结构,层内 C 原子间以共价键结合成六边形,层与层之间为范德华力,是一种混合型的晶体,D正确;
3.下列说法不正确的是
A.Al2O3是偏向离子晶体的过渡晶体,当作离子晶体来处理:SiO2是偏向共价晶体的过渡晶体,当作共价晶体来处理
B.Na2O 中离子键的百分数为62%,则Na2O不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体
C.Na2O通常当作离子晶体来处理,因为Na2O是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
【答案】A
【详解】A.Al2O3和SiO2都是偏向共价晶体的过渡晶体,当作共价晶体来处理,故A错误;
B.Na2O 中离子键的百分数为62%,说明Na2O中存在共价键,则Na2O不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体,故B正确;
C.离子键和共价键的本质区别是形成两元素电负性的差值,差值大为离子键,差值小为共价键,Na2O通常当作离子晶体来处理,因为Na2O是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近,故C正确;
D.根据微粒间的作用力分析,分子晶体、共价晶体、金属晶体和离子晶体都有过渡型,故D正确;
故选A。
4.下列各组物质中,化学键类型和晶体类型都相同的是
A.Ar和K
B.NaCl和NaOH
C.CH4和H2O
D.CO2和SiO2
【答案】C
【详解】A.Ar为只含分子间作用力的分子晶体,K为含有金属键的金属晶体,A选项错误;
B.NaCl为只含离子键的离子晶体,NaOH是含有共价键、离子键的离子晶体,B选项错误;
C.CH4和H2O均是含有共价键和分子间作用力的分子晶体,C选项正确;
D.CO2是含有共价键、分子间作用力的分子晶体,SiO2是只含共价键的原子晶体,D选项错误;
答案选C。
5.黑鳞的晶体结构是与石墨类似的层状结构,如图所示。下列有关说法不正确的是
A.黑磷晶体中片层间作用力为范德华力
B.黑磷与白磷均可导电
C.黑磷晶体的熔沸点比白磷高
D.1 mol黑磷晶体中含有1.5 mol P-P键
【答案】B
【详解】A.由黑鳞的晶体结构是与石墨类似的层状结构,为混合型晶体,片层间作用力为范德华力,A正确;
B.白磷为分子晶体,黑磷结构与石墨类似为混合型晶体,则黑鳞能导电、白磷不导电,B错误;
C.黑磷结构与石墨类似为混合型晶体,其熔沸点很高,故黑磷晶体的熔沸点比白磷高,C正确;
D.可利用均摊法得黑磷晶体中1个磷原子形成3/2=1.5个共价键,则1 mol黑磷晶体中含有1.5 mol P-P,D正确;
故选B。
第三节
金属晶体与离子晶体
第2课时
混合型晶体
晶体类型
过渡晶体
概念
结构特点——层状结构
物理性质
四种晶体的比较
晶体类型的判断方法
THANKS
