浙江中考科学二轮复习提升讲义 12.化学方程式计算(含答案)
文档属性
| 名称 | 浙江中考科学二轮复习提升讲义 12.化学方程式计算(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 558.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-01-29 08:56:34 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第十二讲:化学方程式计算
一、解答题
1.古籍中有记载制烧碱的方法,其核心反应可表示为:2NaOH+CaCO ↓。小宁模仿古法,以实验室中的Na CO 、Ca(OH) 固体为原料,制备400g溶质质量分数为10%的NaOH溶液用于制作叶脉书签。
(1)制作叶脉书签时,用NaOH溶液去除叶肉,是利用了NaOH的 性。
(2)400g溶质质量分数为10%的NaOH溶液中,含NaOH的质量为 g、水的质量为 g。
(3)需称取Na CO 、Ca(OH) 的质量各为多少
2.小明买了一瓶钙片,但说明书某些地方模糊不清,于是拿到实验室做了探究:取2片钙片样品研磨后放在烧杯里,加入50g盐酸溶液,两者恰好完全反应(假设钙片中其他成分不与盐酸溶液反应),测得烧杯中剩余物质的总质量(m)与反应时间(t)的关系如图所示。
(1)将钙片研磨的目的是 。
(2)反应后产生气体的质量 g。
(3)试通过计算求每片钙片中碳酸钙的含量
3.小新用稀盐酸和石灰石反应制取二氧化碳(石灰石中的杂质既不溶于水也不和酸反应),为了探究反应后溶液的成分,他又进行如下实验:取反应后的溶液50g于烧杯中,逐滴滴入碳酸钠溶液,发现先有气泡产生,后生成白色沉淀。下表为产生的气体总质量、沉淀总质量与滴入碳酸钠溶液总质量的关系。
(1)表中n= 。
(2)所取的反应后50g溶液中溶质是 。
(3)所用碳酸钠溶液中溶质的质量分数是多少?
4.某兴趣小组收集到含有碳酸钠和氢氧化钠的混合废液5.11kg,他们用溶质质量分数为19.6%的稀硫酸来处理废液。在向废液中加入稀硫酸过程中,测得所得溶液的质量与加入稀硫酸质量的关系如下图所示。
(1)在处理废液过程中, (填字母)点对应的溶液pH=7。
(2)生成CO2的质量是 。
(3)求出B点的坐标(x0,y0)(写出计算过程)。
5.某化学兴趣小组做完酸碱盐实验后,得到硫酸和硫酸铜混合溶液200g,为达到排放的标准,现用120g氢氧化钠溶液分6次加入混合溶液中,得到的实验数据如下:
实验次数 1 2 3 4 5 6
加入氢氧化钠溶液的质量/g 20 20 20 20 20 20
反应后溶液的质量/g 220 a 255.1 270.2 285.3 305.3
(1)表格中“a”的值是 g。
(2)计算所加氢氧化钠溶液的溶质质量分数。
(3)计算第五次反应结束后,溶液中溶质的质量分数(精确到0.1%)。
6.近日,曾红极一时的休闲食品——槟榔的广告宣传被广电总局全面禁止。槟榔中含有的槟榔碱(C8H13NO2)就像烟碱(尼古丁)一样,会使人兴奋、上瘾,甚至致癌。槟榔碱是一种生物败,它在常温下是一种油状液体,能溶于水和乙醇。
(1)槟榔碱属于 (选填“有机物”或“混合物”)
(2)请写出槟榔碱的一条物理性质: 。
(3)31g槟榔碱中含有氧元素的质量为 g。
7.将40g稀盐酸逐滴加入到20g溶质质量分数为4%的氢氧化钠溶液中,边滴加边搅拌。随着稀盐酸的滴加,溶液的pH变化如图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。试回答:
(1)图二从A到B过程中,溶液的pH逐渐 。(填“增大”或“减小”)。
(2)图二表示C点时的溶质是 。
(3)计算稀盐酸中溶质的质量分数。
8.科学小组为测定某实验废液中硫酸铜和硫酸的质量分数,分别在三只烧杯中倒入50g废液,并在烧杯中依次加入一定量的铁粉。实验结束后,测得的数据见如表:
第一组 第二组 第三组
反应前加入铁粉质量/g 5.6 8.4 11.2
反应后剩余固体的质量/g 3.2 3.2 6.0
反应后产生氢气(H2)的质量 0.1 0.2 0.2
请回答:
(1)对比第一、二组数据,第一组实验结束后,废液中的 (填化学式)已全部参加反应。
(2)计算50g废液中所含硫酸的质量分数为多大。
(3)计算第二组反应完全后,所得溶液的溶质质量分数。
9.某科学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们称取了13.6g固体样品,用图甲所示的装置继续实验,测定的部分数据如图乙所示。试计算该固体样品中各成分的质量。
10.为测定某镁矿石中镁元素的质量分数,兴趣小组的同学取了5g该镁矿石粉末,加入过量的稀硫酸,充分反应后过滤、除杂,得到只含有MgSO4和H2SO4两种溶质的混合溶液100g,将该100g混合溶液放于烧杯中,然后取40g氢氧化钠溶液,分4次加入到盛有100g混合溶液的烧杯中,充分反应,测得的实验数据如下表所示:
实验编号 第一次 第二次 第三次 第四次
加入氢氧化钠溶液质量/g 10 10 10 10
烧杯中生成沉淀的总质量/g 0.464 1.044 1.160 1.160
请计算:
(1)100g混合液中硫酸镁的质量。
(2)该镁矿石中镁元素的质量分数。(假设5g镁矿石中的镁元素全部转化为100g混合溶液中MgSO4中的镁元素)
(3)加入的氢氧化钠溶液的溶质质量分数。
11.实验室中取50.8gH2O2溶液和2gMnO2粉末混合制取氧气。当制得所需的氧气后,停止收集,此时测得装置内剩余物质的总质量为52g,剩余H2O2溶液中溶质质量分数降为1.68%。请计算:
(1)H2O2和MnO2属于 (填物质类别)。
(2)反应中制得氧气的质量是 g。
(3)计算反应前所用H2O2溶液的溶质质量分数。
12.中医药方【金花清感颗粒】在今年新冠肺炎疫情的控制和治疗中发挥了很好的作用,它由金银花、薄荷、甘草等12味药组成。
(1)金花清感颗粒中含有的薄荷醇(C20H20O6),甘草素(C15H12O4)等有效成分属于 (填“有机物”或“无机物”)。
(2)甘草素分子中碳、氢、氧的原子个数比是 。
(3)该药方中提取某有机化合物X与8g氧气恰好完全反应,生成8.8g二氧化碳和1.8g水。则X中碳、氢的质量比为 。
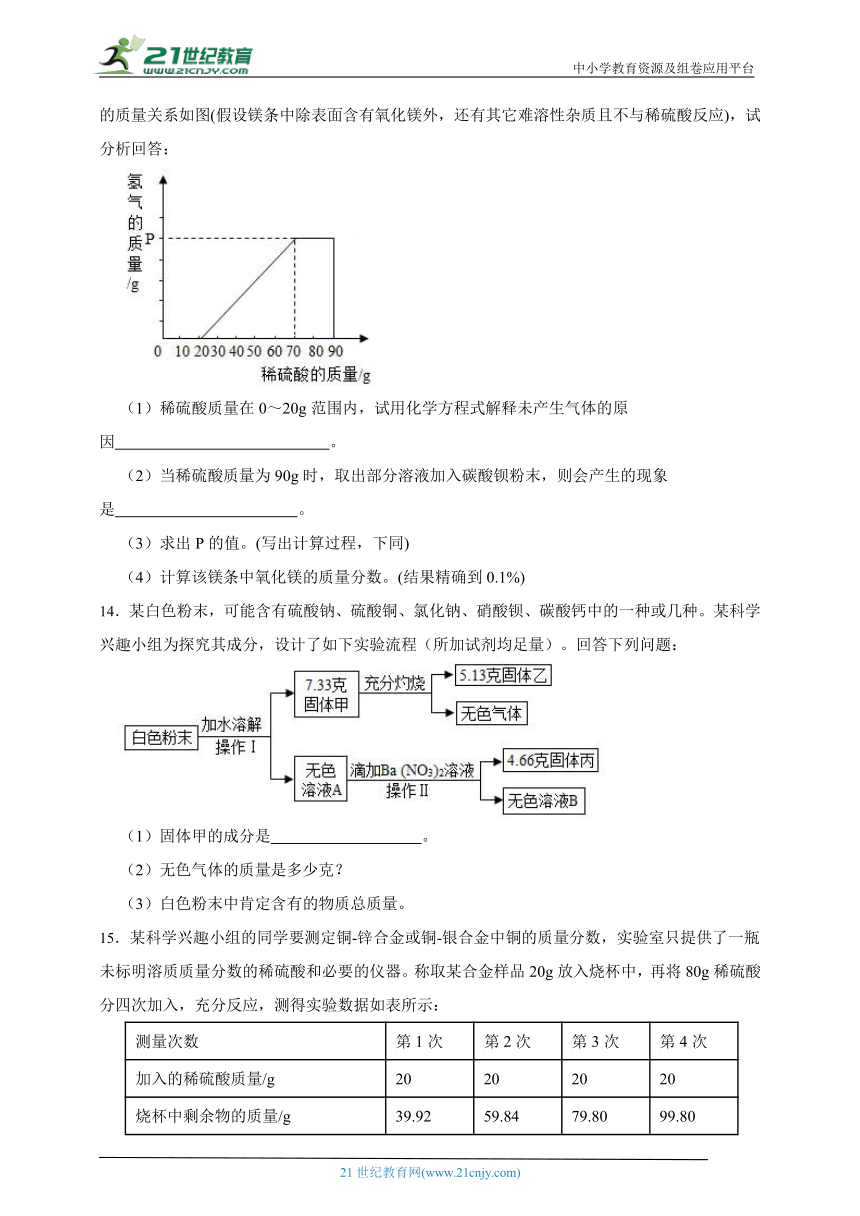
13.某兴趣小组用12g镁条与溶质质量分数为49%的稀硫酸反应,测得产生氢气的质量与稀硫酸的质量关系如图(假设镁条中除表面含有氧化镁外,还有其它难溶性杂质且不与稀硫酸反应),试分析回答:
(1)稀硫酸质量在0~20g范围内,试用化学方程式解释未产生气体的原因 。
(2)当稀硫酸质量为90g时,取出部分溶液加入碳酸钡粉末,则会产生的现象是 。
(3)求出P的值。(写出计算过程,下同)
(4)计算该镁条中氧化镁的质量分数。(结果精确到0.1%)
14.某白色粉末,可能含有硫酸钠、硫酸铜、氯化钠、硝酸钡、碳酸钙中的一种或几种。某科学兴趣小组为探究其成分,设计了如下实验流程(所加试剂均足量)。回答下列问题:
(1)固体甲的成分是 。
(2)无色气体的质量是多少克?
(3)白色粉末中肯定含有的物质总质量。
15.某科学兴趣小组的同学要测定铜-锌合金或铜-银合金中铜的质量分数,实验室只提供了一瓶未标明溶质质量分数的稀硫酸和必要的仪器。称取某合金样品20g放入烧杯中,再将80g稀硫酸分四次加入,充分反应,测得实验数据如表所示:
测量次数 第1次 第2次 第3次 第4次
加入的稀硫酸质量/g 20 20 20 20
烧杯中剩余物的质量/g 39.92 59.84 79.80 99.80
(1)你认为能测出其中铜的质量分数的是 合金。(选填:铜-锌 或 铜-银)
(2)第三次实验中,溶液中所含溶质是
(3)求能测定的合金中铜的质量分数是多少
(4)求所用稀硫酸的溶质质量分数?
16.建造“南昌舰”的特种钢材需要用富铁矿石(含铁量高于50%)来冶炼。研学实践小组为测出某地赤铁矿石(主要成分是Fe2O3)中的含铁量,进行实验;取20g赤铁矿石样品,逐渐加入稀盐酸,充分反应。实验相关数据如图所示(假设杂质不溶于水,也不与酸反应)。
(1)20g赤铁矿石样品中氧化铁的质量为 g;
(2)该样品中铁元素的质量分数为 ,由此判断出该赤铁矿石 (填“属于”或“不属于”)富铁矿石。
(3)若赤铁矿中氧化铁的质量分数为80%(其他成分不含铁),600t这样的赤铁矿可以炼出含杂质为4%的生铁多少吨?
17.现有FeCl3和CuCl2的混合溶液195.2g,向其中加入铁粉,反应的先后顺序为:2FeCl3+Fe=3FeCl2;CuCl2+Fe=FeCl2+Cu。加入铁粉的质量与反应后的溶液中剩余固体的质量的关系如图所示。回答下列问题:
(1)剩余固体的质量>6.4g时,剩余固体的成分是: (填化学式)。
(2)求原FeCl3和CuCl2的混合溶液中FeCl3的质量为多少克?
(3)求当加入11.2g铁粉时,反应后所得溶液中FeCl2的质量分数。
18.图甲中 A 是一种常见的酸,它能与黑色固体 B 反应,B 质量为 8 克。将 NaOH溶液缓缓加入到 C 中,生成的蓝色沉淀 E 与加入 NaOH 溶液的质量关系如图乙所示。在D 中加入 Ba(NO3)2 溶液能生成一种不溶于稀硝酸的白色沉淀。请回答:
(1)A 溶液中溶质的化学式为 ;
(2)NaOH 溶液的溶质质量分数是多少?(列式计算)
(3)C 溶液中加入 NaOH 溶液至恰好完全反应时,所得溶液溶质质量是多少?(列式计算)
19.兴趣小组设计了以下实验装置来测定某氧化铜样品的纯度(杂质不与氢气反应),他们准确称取15g干燥样品进行实验,并准确称取完全反应前后装置丙和丁的质量如表:
装置丙 装置丁
反应前 48.8g 161.2g
反应后 46.7g 163.9g
(1)该实验中,装置乙的作用是
(2)小明认为装置丙减少的质量就是氧元素质量,他由此求得氧化铜的质量为 g,氧化铜样品的纯度为 ;
(3)小丽根据装置丁的质量变化也计算出了氧化铜样品的纯度,请写出她的计算过程。
(4)比较小明和小丽的计算结果,请分析导致这一结果的原因可能是 。
A.装置的气密性不好
B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足
D.空气中的二氧化碳被丁处浓硫酸吸收
20.学习稀硫酸的化学性质时,老师在课堂上做了稀硫酸与氧化铜粉末反应的演示实验,小东对实验后的废液进行了溶质成分的鉴定,如图甲,将NaOH溶液渐渐加入到废液A中,生成蓝色沉淀C的质量与加入的NaOH溶液的质量关系如图乙所示,在B中加入Ba(NO3)2溶液能生成一种不溶于稀硝酸的白色沉淀E.
(1)在过滤操作中,需要用到的玻璃仪器有 (选填序号).
A.酒精灯、漏斗、玻璃棒
B.漏斗、玻璃棒、烧杯
C.酒精灯、试管、玻璃棒
(2)废液A呈 (填“酸性”“碱性”或“中性”),其中含有的溶质是 (写化学式).
(3)在B中加入Ba(NO3)2溶液至恰好完全反应时,经过滤得到69.9克白色沉淀E,通过计算说明,图乙中的H点表示的溶液的质量是多少克?
答案解析部分
1.【答案】(1)腐蚀
(2)40;360
(3)解:设需称取 Na CO 、Ca(OH) 的质量各为x、y。
106 74 80
x y 40g
2.【答案】(1)增大碳酸钙与盐酸的接触面积,利于充分反应,使计算结果更准确
(2)1.1
(3)解:设2片钙片中含碳酸钙x
CaCO3+2HCl=CaCl2+H2O+ CO2↑
100 44
x 1.1g
x =2.5 g
每片钙片中含碳酸钙1.25g
答:每片钙片中碳酸钙的含量为1.25g
3.【答案】(1)9
(2)HCl、CaCl2
(3)10.6%
4.【答案】(1)C
(2)0.11kg
(3)98 44
5.【答案】(1)240
(2)解:设20g氢氧化钠溶液中氢氧化钠的质量为x。
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
80 98
x 4.9g
计算得
x=4g
所加氢氧化钠溶液的溶质质量分数为4g/20g x100%=20%。
答:所加氢氧化钠溶液的溶质质量分数为20%
(3)根据硫酸和氢氧化钠反应生成硫酸钠和水,硫酸铜和氢氧化钠反应生成蓝色沉淀氢氧化铜和硫酸钠,可得关系式2NaOH~Na2SO4 ,
设第5次反应结束后,溶液中溶质的质量分数为y。
2NaOH ~ Na2SO4
80 142
100gx20% 85.3g x
计算得
x≈12.4%
答:第5次反应结束后,溶液中溶质的质量分数为12.4%。
6.【答案】(1)有机物
(2)常温下是油状液体(或“能溶于水”、“能溶于乙醇”)
(3)6.4
7.【答案】(1)减小
(2)NaCl、HCl
(3)由图象可知,恰好酸碱中和时消耗稀盐酸的质量是20g,
设20g的稀盐酸中溶质的质量为x。
HCl + NaOH═NaCl+H2O
36.5 40
x 20g×4%
;
解得:x=0.73g;
稀盐酸中溶质的质量分数是:。
8.【答案】(1)CuSO4
(2)设与铁反应的硫酸的质量为x,同时生成硫酸亚铁的质量为y。
Fe+H2SO4═FeSO4+H2↑
98 152 2
X y 0.2g
x=9.8g y=15.2g
硫酸的质量分数为:(9.8g/50g)100%=19.6%。
(3)设铁与硫酸铜反应,生成硫酸亚铁的质量为y。
Fe+CuSO4═FeSO4+Cu
152 64
Y 3.2g
y=7.6g(
硫酸亚铁的质量分数为[(15.2g+7.6g)/(50g+8.4g-3.2g-0.2g)]×100%=41.5%
9.【答案】解:氧化铁和一氧化碳在高温的条件下生成铁和二氧化碳,
根据质量守恒定律可知,反应后固体减少的质量是氧化铁中氧元素的质量,
根据图片可知,氧化铁氧元素的质量为:13.6g-11.2g=2.4g,
设该固体样品中氧化铁的质量为x,
Fe2O3+3CO2Fe+3CO2 △m
160 112 160-112=48
x 2.4g
;
解得:y=8g;
则该固体样品中氧化铁的质量为8g,铁粉的质量为:13.6g-8g=5.6g。
10.【答案】(1)解:设100混合溶液中含MgSO4的质量为x
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
120 58
x 1.160g
x=2.4g
答:100混合溶液中含MgSO4的质量为2.4g
(2)根据质量守恒定律,化学变化前后元素的质量不变,因此MgSO4中的镁元素的质量即为5g镁矿石中的镁元素,由题意得:镁矿石中镁元素的质量分数为2.4g× ×100%÷5g×100%=9.6%
答:镁矿石中镁元素的质量分数为9.6%
(3)由实验一、二可知每消耗10.0gNaOH溶液生成氢氧化镁沉淀1.044g-0.464g=0.580g,第三次再增加10.0gNaOH溶液沉淀增加的质量为1.160g-1.044g=0.116g,说明此时硫酸镁完全反应,氢氧化钠已过量,
设10g氢氧化钠溶液中溶质的质量为y
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
80 58
y 0.58g
加入的氢氧化钠溶液的溶质质量分数为: ×100%=8%
答:加入的氢氧化钠溶液的溶质质量分数8%。
11.【答案】(1)氧化物( 化合物)
(2)0.8
(3)设反应前H2O2溶液的溶质质量为x
2H2O2 2H2O+ O2↑
68 32
x 0.8g
x=1.7g
剩余过氧化氢的质量为(52g﹣2g)×1.68%=0.84g
反应前所用H2O2溶液的溶质质量分数为 = 5%
答:反应前所用H2O2溶液的溶质质量分数为5%
12.【答案】(1)有机物
(2)15:12:4
(3)12:1
13.【答案】(1)MgO+H2SO4=MgSO4+H2O
(2)产生气泡和白色沉淀
(3)解:根据题意可知与金属镁反应的硫酸的质量=50g×49%=24.5g
设生成氢气的质量为x
Mg+ H2SO4 =MgSO4 + H2↑
98 2
24.5g x
=
x=0.5g
(4)解:根据题意可知与氧化镁反应的硫酸的质量=20g×49%=9.8g
设氧化镁的质量为y
MgO+ H2SO4= MgSO4 +H2O
40 98
y 9.8g
= y=4g
MgO%=4g/12g ≈ 33.3%
14.【答案】(1)碳酸钙和硫酸钡
(2)无色气体的质量:7.33g-5.13g=2.2g;
(3)将7.33g固体甲灼烧得无色气体和5.13g固体乙,说明原固体中一定含有碳酸钙,生成二氧化碳的质量为2.2g
设碳酸钙的质量为x
CaCO3CaO+CO2↑
100 44
x 2.2g
;
解得:x=5g。
则7.33g固体甲中还含有硫酸钡:7.33g-5g=2.33g,
因为加水溶解后得无色溶液A,一定不含硫酸铜,
所以原固体中还一定含有硝酸钡和硫酸钠。
设生成2.33g硫酸钡需要硫酸钠得质量为y,硫酸钠的质量为z
Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3
261 142 233
y z 2.33g
;;
解得:y=2.61g ,z=1.42g;
设生成4.66g硫酸钡需要硫酸钠得质量为M
Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3
142 233
M 4.66g
;
解得:M=2.84g。
所以白色固体中一定含有碳酸钙、硫酸钠、硝酸钡,
总质量为 :5g+2.61g+1.42g+2.84g=11.87g。
15.【答案】(1)铜-锌
(2)ZnSO4、H2SO4
(3)生成氢气的总质量为:20g+80g-99.80g=0.2g;
设样品中锌的质量为x。
Zn+H2SO4 =ZnSO4 +H2↑
65 2
x 0.2g
;
解得:x=6.5g;
所以黄铜中铜的质量分数为:。
(4)由表可知,每20g稀硫酸完全反应最多生成H20.08g。
设稀硫酸中溶质质量分数为y。
Zn+H2SO4 =ZnSO4 +H2↑
98 2
20y 0.08g
解得:y=19.6%。
16.【答案】(1)16
(2)56%;属于
(3)解:600t含氧化铁80%的赤铁矿石中含氧化铁的质量为600t×80%=480t。
设理论上可炼出含杂质4%的生铁质量为x。
Fe2O3+3CO 2Fe+3CO2
160 112
480t (1﹣4%)x
解得:x=350t
答:可以炼出含杂质5%的生铁的质量为350t。
17.【答案】(1)Cu和Fe
(2)由图像可知,与氯化铁反应的铁的质量为5.6克,设氯化铁的质量为x
2FeCl3+Fe=3FeCl2
325 56
x 5.6g
325:56=x:5.6g
x=32.5g
(3)由铁元素质量守恒可知, 当加入11.2g铁粉时,生成氯化亚铁中铁元素为11.2克铁粉中铁元素和氯化铁中铁元素之和,则生成氯化亚铁质量为,
则当加入11.2g铁粉时,反应后所得溶液中FeCl2的质量分数为;
18.【答案】(1)H2SO4
(2)根据图像可知,反应生成沉淀氢氧化铜的质量为9.8g,
设与CuSO4反应的NaOH的质量为x,同时生成Na2SO4的质量为y,
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
80 98 142
x 9.8g y
;
解得:x=8g,y=14.2g;
所用氢氧化钠溶液中溶质的质量分数为:;
(3)设硫酸与氢氧化钠反应生成硫酸钠质量为z,
H2SO4+2NaOH=Na2SO4+2H2O
80 142
60g×20% z
;
解得:z=21.3g
所得溶液中溶质的质量为:21.3g+14.2g=35.5g
19.【答案】(1)检验氢气中混有的水是否被浓硫酸吸收完
(2)10.5;70%
(3)解:生成的水的量为: 163.9g-161.2g=2.7g
CuO+H2 Cu+ H2O
80 18
x 2.7g
x=12g,
则氧化铜的纯度为: ×100%=80%
(4)B
20.【答案】(1)B
(2)酸性;H2SO4、CuSO4
(3)解:设参加反应的硫酸钠的质量为x
Na2SO4+Ba(NO3)2= BaSO4↓+2NaNO3
142 233
x 69.9g
=
x=42.6g
设与硫酸铜反应的氢氧化钠的质量为y,生成硫酸钠的质量为z
CuSO4+ 2NaOH= Cu(OH)2↓+ Na2SO4
80 98 142
y 9.8g z
= =
y=8g
z=14.2g
所以与硫酸反应生成硫酸钠的质量为:42.6g﹣14.2g=28.4g,
设与硫酸反应的氢氧化钠的质量为m
2NaOH+H2SO4= Na2SO4+2H2O
80 142
m 28.4g
=
m=16g
所以氢氧化钠的质量分数为: ×100%=20%,
所以图乙中的H点表示的溶液的质量是:80g+ =120g.
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第十二讲:化学方程式计算
一、解答题
1.古籍中有记载制烧碱的方法,其核心反应可表示为:2NaOH+CaCO ↓。小宁模仿古法,以实验室中的Na CO 、Ca(OH) 固体为原料,制备400g溶质质量分数为10%的NaOH溶液用于制作叶脉书签。
(1)制作叶脉书签时,用NaOH溶液去除叶肉,是利用了NaOH的 性。
(2)400g溶质质量分数为10%的NaOH溶液中,含NaOH的质量为 g、水的质量为 g。
(3)需称取Na CO 、Ca(OH) 的质量各为多少
2.小明买了一瓶钙片,但说明书某些地方模糊不清,于是拿到实验室做了探究:取2片钙片样品研磨后放在烧杯里,加入50g盐酸溶液,两者恰好完全反应(假设钙片中其他成分不与盐酸溶液反应),测得烧杯中剩余物质的总质量(m)与反应时间(t)的关系如图所示。
(1)将钙片研磨的目的是 。
(2)反应后产生气体的质量 g。
(3)试通过计算求每片钙片中碳酸钙的含量
3.小新用稀盐酸和石灰石反应制取二氧化碳(石灰石中的杂质既不溶于水也不和酸反应),为了探究反应后溶液的成分,他又进行如下实验:取反应后的溶液50g于烧杯中,逐滴滴入碳酸钠溶液,发现先有气泡产生,后生成白色沉淀。下表为产生的气体总质量、沉淀总质量与滴入碳酸钠溶液总质量的关系。
(1)表中n= 。
(2)所取的反应后50g溶液中溶质是 。
(3)所用碳酸钠溶液中溶质的质量分数是多少?
4.某兴趣小组收集到含有碳酸钠和氢氧化钠的混合废液5.11kg,他们用溶质质量分数为19.6%的稀硫酸来处理废液。在向废液中加入稀硫酸过程中,测得所得溶液的质量与加入稀硫酸质量的关系如下图所示。
(1)在处理废液过程中, (填字母)点对应的溶液pH=7。
(2)生成CO2的质量是 。
(3)求出B点的坐标(x0,y0)(写出计算过程)。
5.某化学兴趣小组做完酸碱盐实验后,得到硫酸和硫酸铜混合溶液200g,为达到排放的标准,现用120g氢氧化钠溶液分6次加入混合溶液中,得到的实验数据如下:
实验次数 1 2 3 4 5 6
加入氢氧化钠溶液的质量/g 20 20 20 20 20 20
反应后溶液的质量/g 220 a 255.1 270.2 285.3 305.3
(1)表格中“a”的值是 g。
(2)计算所加氢氧化钠溶液的溶质质量分数。
(3)计算第五次反应结束后,溶液中溶质的质量分数(精确到0.1%)。
6.近日,曾红极一时的休闲食品——槟榔的广告宣传被广电总局全面禁止。槟榔中含有的槟榔碱(C8H13NO2)就像烟碱(尼古丁)一样,会使人兴奋、上瘾,甚至致癌。槟榔碱是一种生物败,它在常温下是一种油状液体,能溶于水和乙醇。
(1)槟榔碱属于 (选填“有机物”或“混合物”)
(2)请写出槟榔碱的一条物理性质: 。
(3)31g槟榔碱中含有氧元素的质量为 g。
7.将40g稀盐酸逐滴加入到20g溶质质量分数为4%的氢氧化钠溶液中,边滴加边搅拌。随着稀盐酸的滴加,溶液的pH变化如图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。试回答:
(1)图二从A到B过程中,溶液的pH逐渐 。(填“增大”或“减小”)。
(2)图二表示C点时的溶质是 。
(3)计算稀盐酸中溶质的质量分数。
8.科学小组为测定某实验废液中硫酸铜和硫酸的质量分数,分别在三只烧杯中倒入50g废液,并在烧杯中依次加入一定量的铁粉。实验结束后,测得的数据见如表:
第一组 第二组 第三组
反应前加入铁粉质量/g 5.6 8.4 11.2
反应后剩余固体的质量/g 3.2 3.2 6.0
反应后产生氢气(H2)的质量 0.1 0.2 0.2
请回答:
(1)对比第一、二组数据,第一组实验结束后,废液中的 (填化学式)已全部参加反应。
(2)计算50g废液中所含硫酸的质量分数为多大。
(3)计算第二组反应完全后,所得溶液的溶质质量分数。
9.某科学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们称取了13.6g固体样品,用图甲所示的装置继续实验,测定的部分数据如图乙所示。试计算该固体样品中各成分的质量。
10.为测定某镁矿石中镁元素的质量分数,兴趣小组的同学取了5g该镁矿石粉末,加入过量的稀硫酸,充分反应后过滤、除杂,得到只含有MgSO4和H2SO4两种溶质的混合溶液100g,将该100g混合溶液放于烧杯中,然后取40g氢氧化钠溶液,分4次加入到盛有100g混合溶液的烧杯中,充分反应,测得的实验数据如下表所示:
实验编号 第一次 第二次 第三次 第四次
加入氢氧化钠溶液质量/g 10 10 10 10
烧杯中生成沉淀的总质量/g 0.464 1.044 1.160 1.160
请计算:
(1)100g混合液中硫酸镁的质量。
(2)该镁矿石中镁元素的质量分数。(假设5g镁矿石中的镁元素全部转化为100g混合溶液中MgSO4中的镁元素)
(3)加入的氢氧化钠溶液的溶质质量分数。
11.实验室中取50.8gH2O2溶液和2gMnO2粉末混合制取氧气。当制得所需的氧气后,停止收集,此时测得装置内剩余物质的总质量为52g,剩余H2O2溶液中溶质质量分数降为1.68%。请计算:
(1)H2O2和MnO2属于 (填物质类别)。
(2)反应中制得氧气的质量是 g。
(3)计算反应前所用H2O2溶液的溶质质量分数。
12.中医药方【金花清感颗粒】在今年新冠肺炎疫情的控制和治疗中发挥了很好的作用,它由金银花、薄荷、甘草等12味药组成。
(1)金花清感颗粒中含有的薄荷醇(C20H20O6),甘草素(C15H12O4)等有效成分属于 (填“有机物”或“无机物”)。
(2)甘草素分子中碳、氢、氧的原子个数比是 。
(3)该药方中提取某有机化合物X与8g氧气恰好完全反应,生成8.8g二氧化碳和1.8g水。则X中碳、氢的质量比为 。
13.某兴趣小组用12g镁条与溶质质量分数为49%的稀硫酸反应,测得产生氢气的质量与稀硫酸的质量关系如图(假设镁条中除表面含有氧化镁外,还有其它难溶性杂质且不与稀硫酸反应),试分析回答:
(1)稀硫酸质量在0~20g范围内,试用化学方程式解释未产生气体的原因 。
(2)当稀硫酸质量为90g时,取出部分溶液加入碳酸钡粉末,则会产生的现象是 。
(3)求出P的值。(写出计算过程,下同)
(4)计算该镁条中氧化镁的质量分数。(结果精确到0.1%)
14.某白色粉末,可能含有硫酸钠、硫酸铜、氯化钠、硝酸钡、碳酸钙中的一种或几种。某科学兴趣小组为探究其成分,设计了如下实验流程(所加试剂均足量)。回答下列问题:
(1)固体甲的成分是 。
(2)无色气体的质量是多少克?
(3)白色粉末中肯定含有的物质总质量。
15.某科学兴趣小组的同学要测定铜-锌合金或铜-银合金中铜的质量分数,实验室只提供了一瓶未标明溶质质量分数的稀硫酸和必要的仪器。称取某合金样品20g放入烧杯中,再将80g稀硫酸分四次加入,充分反应,测得实验数据如表所示:
测量次数 第1次 第2次 第3次 第4次
加入的稀硫酸质量/g 20 20 20 20
烧杯中剩余物的质量/g 39.92 59.84 79.80 99.80
(1)你认为能测出其中铜的质量分数的是 合金。(选填:铜-锌 或 铜-银)
(2)第三次实验中,溶液中所含溶质是
(3)求能测定的合金中铜的质量分数是多少
(4)求所用稀硫酸的溶质质量分数?
16.建造“南昌舰”的特种钢材需要用富铁矿石(含铁量高于50%)来冶炼。研学实践小组为测出某地赤铁矿石(主要成分是Fe2O3)中的含铁量,进行实验;取20g赤铁矿石样品,逐渐加入稀盐酸,充分反应。实验相关数据如图所示(假设杂质不溶于水,也不与酸反应)。
(1)20g赤铁矿石样品中氧化铁的质量为 g;
(2)该样品中铁元素的质量分数为 ,由此判断出该赤铁矿石 (填“属于”或“不属于”)富铁矿石。
(3)若赤铁矿中氧化铁的质量分数为80%(其他成分不含铁),600t这样的赤铁矿可以炼出含杂质为4%的生铁多少吨?
17.现有FeCl3和CuCl2的混合溶液195.2g,向其中加入铁粉,反应的先后顺序为:2FeCl3+Fe=3FeCl2;CuCl2+Fe=FeCl2+Cu。加入铁粉的质量与反应后的溶液中剩余固体的质量的关系如图所示。回答下列问题:
(1)剩余固体的质量>6.4g时,剩余固体的成分是: (填化学式)。
(2)求原FeCl3和CuCl2的混合溶液中FeCl3的质量为多少克?
(3)求当加入11.2g铁粉时,反应后所得溶液中FeCl2的质量分数。
18.图甲中 A 是一种常见的酸,它能与黑色固体 B 反应,B 质量为 8 克。将 NaOH溶液缓缓加入到 C 中,生成的蓝色沉淀 E 与加入 NaOH 溶液的质量关系如图乙所示。在D 中加入 Ba(NO3)2 溶液能生成一种不溶于稀硝酸的白色沉淀。请回答:
(1)A 溶液中溶质的化学式为 ;
(2)NaOH 溶液的溶质质量分数是多少?(列式计算)
(3)C 溶液中加入 NaOH 溶液至恰好完全反应时,所得溶液溶质质量是多少?(列式计算)
19.兴趣小组设计了以下实验装置来测定某氧化铜样品的纯度(杂质不与氢气反应),他们准确称取15g干燥样品进行实验,并准确称取完全反应前后装置丙和丁的质量如表:
装置丙 装置丁
反应前 48.8g 161.2g
反应后 46.7g 163.9g
(1)该实验中,装置乙的作用是
(2)小明认为装置丙减少的质量就是氧元素质量,他由此求得氧化铜的质量为 g,氧化铜样品的纯度为 ;
(3)小丽根据装置丁的质量变化也计算出了氧化铜样品的纯度,请写出她的计算过程。
(4)比较小明和小丽的计算结果,请分析导致这一结果的原因可能是 。
A.装置的气密性不好
B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足
D.空气中的二氧化碳被丁处浓硫酸吸收
20.学习稀硫酸的化学性质时,老师在课堂上做了稀硫酸与氧化铜粉末反应的演示实验,小东对实验后的废液进行了溶质成分的鉴定,如图甲,将NaOH溶液渐渐加入到废液A中,生成蓝色沉淀C的质量与加入的NaOH溶液的质量关系如图乙所示,在B中加入Ba(NO3)2溶液能生成一种不溶于稀硝酸的白色沉淀E.
(1)在过滤操作中,需要用到的玻璃仪器有 (选填序号).
A.酒精灯、漏斗、玻璃棒
B.漏斗、玻璃棒、烧杯
C.酒精灯、试管、玻璃棒
(2)废液A呈 (填“酸性”“碱性”或“中性”),其中含有的溶质是 (写化学式).
(3)在B中加入Ba(NO3)2溶液至恰好完全反应时,经过滤得到69.9克白色沉淀E,通过计算说明,图乙中的H点表示的溶液的质量是多少克?
答案解析部分
1.【答案】(1)腐蚀
(2)40;360
(3)解:设需称取 Na CO 、Ca(OH) 的质量各为x、y。
106 74 80
x y 40g
2.【答案】(1)增大碳酸钙与盐酸的接触面积,利于充分反应,使计算结果更准确
(2)1.1
(3)解:设2片钙片中含碳酸钙x
CaCO3+2HCl=CaCl2+H2O+ CO2↑
100 44
x 1.1g
x =2.5 g
每片钙片中含碳酸钙1.25g
答:每片钙片中碳酸钙的含量为1.25g
3.【答案】(1)9
(2)HCl、CaCl2
(3)10.6%
4.【答案】(1)C
(2)0.11kg
(3)98 44
5.【答案】(1)240
(2)解:设20g氢氧化钠溶液中氢氧化钠的质量为x。
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
80 98
x 4.9g
计算得
x=4g
所加氢氧化钠溶液的溶质质量分数为4g/20g x100%=20%。
答:所加氢氧化钠溶液的溶质质量分数为20%
(3)根据硫酸和氢氧化钠反应生成硫酸钠和水,硫酸铜和氢氧化钠反应生成蓝色沉淀氢氧化铜和硫酸钠,可得关系式2NaOH~Na2SO4 ,
设第5次反应结束后,溶液中溶质的质量分数为y。
2NaOH ~ Na2SO4
80 142
100gx20% 85.3g x
计算得
x≈12.4%
答:第5次反应结束后,溶液中溶质的质量分数为12.4%。
6.【答案】(1)有机物
(2)常温下是油状液体(或“能溶于水”、“能溶于乙醇”)
(3)6.4
7.【答案】(1)减小
(2)NaCl、HCl
(3)由图象可知,恰好酸碱中和时消耗稀盐酸的质量是20g,
设20g的稀盐酸中溶质的质量为x。
HCl + NaOH═NaCl+H2O
36.5 40
x 20g×4%
;
解得:x=0.73g;
稀盐酸中溶质的质量分数是:。
8.【答案】(1)CuSO4
(2)设与铁反应的硫酸的质量为x,同时生成硫酸亚铁的质量为y。
Fe+H2SO4═FeSO4+H2↑
98 152 2
X y 0.2g
x=9.8g y=15.2g
硫酸的质量分数为:(9.8g/50g)100%=19.6%。
(3)设铁与硫酸铜反应,生成硫酸亚铁的质量为y。
Fe+CuSO4═FeSO4+Cu
152 64
Y 3.2g
y=7.6g(
硫酸亚铁的质量分数为[(15.2g+7.6g)/(50g+8.4g-3.2g-0.2g)]×100%=41.5%
9.【答案】解:氧化铁和一氧化碳在高温的条件下生成铁和二氧化碳,
根据质量守恒定律可知,反应后固体减少的质量是氧化铁中氧元素的质量,
根据图片可知,氧化铁氧元素的质量为:13.6g-11.2g=2.4g,
设该固体样品中氧化铁的质量为x,
Fe2O3+3CO2Fe+3CO2 △m
160 112 160-112=48
x 2.4g
;
解得:y=8g;
则该固体样品中氧化铁的质量为8g,铁粉的质量为:13.6g-8g=5.6g。
10.【答案】(1)解:设100混合溶液中含MgSO4的质量为x
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
120 58
x 1.160g
x=2.4g
答:100混合溶液中含MgSO4的质量为2.4g
(2)根据质量守恒定律,化学变化前后元素的质量不变,因此MgSO4中的镁元素的质量即为5g镁矿石中的镁元素,由题意得:镁矿石中镁元素的质量分数为2.4g× ×100%÷5g×100%=9.6%
答:镁矿石中镁元素的质量分数为9.6%
(3)由实验一、二可知每消耗10.0gNaOH溶液生成氢氧化镁沉淀1.044g-0.464g=0.580g,第三次再增加10.0gNaOH溶液沉淀增加的质量为1.160g-1.044g=0.116g,说明此时硫酸镁完全反应,氢氧化钠已过量,
设10g氢氧化钠溶液中溶质的质量为y
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
80 58
y 0.58g
加入的氢氧化钠溶液的溶质质量分数为: ×100%=8%
答:加入的氢氧化钠溶液的溶质质量分数8%。
11.【答案】(1)氧化物( 化合物)
(2)0.8
(3)设反应前H2O2溶液的溶质质量为x
2H2O2 2H2O+ O2↑
68 32
x 0.8g
x=1.7g
剩余过氧化氢的质量为(52g﹣2g)×1.68%=0.84g
反应前所用H2O2溶液的溶质质量分数为 = 5%
答:反应前所用H2O2溶液的溶质质量分数为5%
12.【答案】(1)有机物
(2)15:12:4
(3)12:1
13.【答案】(1)MgO+H2SO4=MgSO4+H2O
(2)产生气泡和白色沉淀
(3)解:根据题意可知与金属镁反应的硫酸的质量=50g×49%=24.5g
设生成氢气的质量为x
Mg+ H2SO4 =MgSO4 + H2↑
98 2
24.5g x
=
x=0.5g
(4)解:根据题意可知与氧化镁反应的硫酸的质量=20g×49%=9.8g
设氧化镁的质量为y
MgO+ H2SO4= MgSO4 +H2O
40 98
y 9.8g
= y=4g
MgO%=4g/12g ≈ 33.3%
14.【答案】(1)碳酸钙和硫酸钡
(2)无色气体的质量:7.33g-5.13g=2.2g;
(3)将7.33g固体甲灼烧得无色气体和5.13g固体乙,说明原固体中一定含有碳酸钙,生成二氧化碳的质量为2.2g
设碳酸钙的质量为x
CaCO3CaO+CO2↑
100 44
x 2.2g
;
解得:x=5g。
则7.33g固体甲中还含有硫酸钡:7.33g-5g=2.33g,
因为加水溶解后得无色溶液A,一定不含硫酸铜,
所以原固体中还一定含有硝酸钡和硫酸钠。
设生成2.33g硫酸钡需要硫酸钠得质量为y,硫酸钠的质量为z
Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3
261 142 233
y z 2.33g
;;
解得:y=2.61g ,z=1.42g;
设生成4.66g硫酸钡需要硫酸钠得质量为M
Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3
142 233
M 4.66g
;
解得:M=2.84g。
所以白色固体中一定含有碳酸钙、硫酸钠、硝酸钡,
总质量为 :5g+2.61g+1.42g+2.84g=11.87g。
15.【答案】(1)铜-锌
(2)ZnSO4、H2SO4
(3)生成氢气的总质量为:20g+80g-99.80g=0.2g;
设样品中锌的质量为x。
Zn+H2SO4 =ZnSO4 +H2↑
65 2
x 0.2g
;
解得:x=6.5g;
所以黄铜中铜的质量分数为:。
(4)由表可知,每20g稀硫酸完全反应最多生成H20.08g。
设稀硫酸中溶质质量分数为y。
Zn+H2SO4 =ZnSO4 +H2↑
98 2
20y 0.08g
解得:y=19.6%。
16.【答案】(1)16
(2)56%;属于
(3)解:600t含氧化铁80%的赤铁矿石中含氧化铁的质量为600t×80%=480t。
设理论上可炼出含杂质4%的生铁质量为x。
Fe2O3+3CO 2Fe+3CO2
160 112
480t (1﹣4%)x
解得:x=350t
答:可以炼出含杂质5%的生铁的质量为350t。
17.【答案】(1)Cu和Fe
(2)由图像可知,与氯化铁反应的铁的质量为5.6克,设氯化铁的质量为x
2FeCl3+Fe=3FeCl2
325 56
x 5.6g
325:56=x:5.6g
x=32.5g
(3)由铁元素质量守恒可知, 当加入11.2g铁粉时,生成氯化亚铁中铁元素为11.2克铁粉中铁元素和氯化铁中铁元素之和,则生成氯化亚铁质量为,
则当加入11.2g铁粉时,反应后所得溶液中FeCl2的质量分数为;
18.【答案】(1)H2SO4
(2)根据图像可知,反应生成沉淀氢氧化铜的质量为9.8g,
设与CuSO4反应的NaOH的质量为x,同时生成Na2SO4的质量为y,
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
80 98 142
x 9.8g y
;
解得:x=8g,y=14.2g;
所用氢氧化钠溶液中溶质的质量分数为:;
(3)设硫酸与氢氧化钠反应生成硫酸钠质量为z,
H2SO4+2NaOH=Na2SO4+2H2O
80 142
60g×20% z
;
解得:z=21.3g
所得溶液中溶质的质量为:21.3g+14.2g=35.5g
19.【答案】(1)检验氢气中混有的水是否被浓硫酸吸收完
(2)10.5;70%
(3)解:生成的水的量为: 163.9g-161.2g=2.7g
CuO+H2 Cu+ H2O
80 18
x 2.7g
x=12g,
则氧化铜的纯度为: ×100%=80%
(4)B
20.【答案】(1)B
(2)酸性;H2SO4、CuSO4
(3)解:设参加反应的硫酸钠的质量为x
Na2SO4+Ba(NO3)2= BaSO4↓+2NaNO3
142 233
x 69.9g
=
x=42.6g
设与硫酸铜反应的氢氧化钠的质量为y,生成硫酸钠的质量为z
CuSO4+ 2NaOH= Cu(OH)2↓+ Na2SO4
80 98 142
y 9.8g z
= =
y=8g
z=14.2g
所以与硫酸反应生成硫酸钠的质量为:42.6g﹣14.2g=28.4g,
设与硫酸反应的氢氧化钠的质量为m
2NaOH+H2SO4= Na2SO4+2H2O
80 142
m 28.4g
=
m=16g
所以氢氧化钠的质量分数为: ×100%=20%,
所以图乙中的H点表示的溶液的质量是:80g+ =120g.
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
