第2章 第2节 化学反应的限度_——反应条件对化学平衡的影响(共19页)
文档属性
| 名称 | 第2章 第2节 化学反应的限度_——反应条件对化学平衡的影响(共19页) |  | |
| 格式 | pptx | ||
| 文件大小 | 371.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-26 21:37:37 | ||
图片预览





文档简介
(共19张PPT)
第二节 化学反应的限度
反应条件对化学平衡的影响
第2章 化学反应的方向、限度与速率
复习与回顾
温度对化学平衡的影响
浓度对化学平衡的影响
一定温度下,在密闭容器中发生的反应
2NO2(g) N2O4(g) △H<0
条件 平衡移动方向
升高温度
降低温度
增加c(NO2)
增加c(N2O4)
c(NO2)、 c(N2O4) 都增加至2倍或减少至1/2
向吸热方向移动
向放热方向移动
正向移动
逆向移动
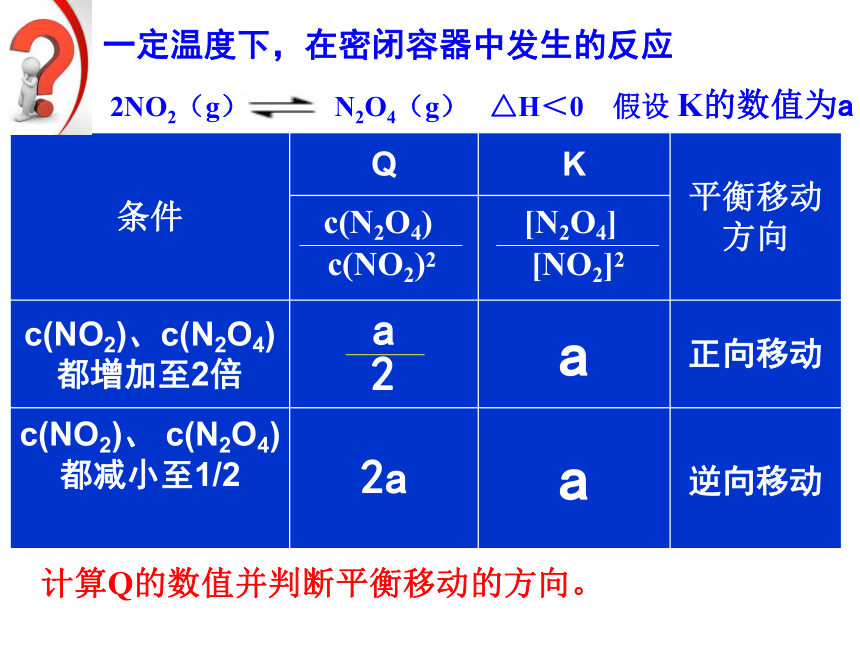
一定温度下,在密闭容器中发生的反应
2NO2(g) N2O4(g) △H<0 假设 K的数值为a
条件 Q K 平衡移动方向
c(NO2)、c(N2O4)都增加至2倍 a
c(NO2)、 c(N2O4)都减小至1/2 a
c(NO2)2
c(N2O4)
[NO2]2
[N2O4]
正向移动
逆向移动
a
2
2a
计算Q的数值并判断平衡移动的方向。
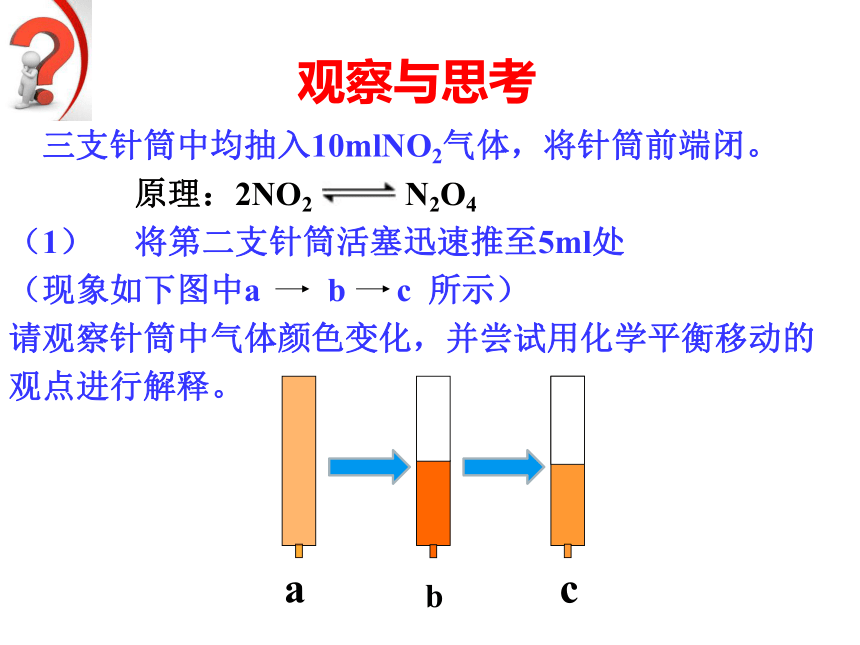
观察与思考
三支针筒中均抽入10mlNO2气体,将针筒前端闭。
原理:2NO2 N2O4
(1) 将第二支针筒活塞迅速推至5ml处
(现象如下图中a b c 所示)
请观察针筒中气体颜色变化,并尝试用化学平衡移动的
观点进行解释。
b
c
a
三支针筒中均抽入10mlNO2气体,将针筒前端闭。
原理:2NO2 N2O4
(2)将第三支针筒活塞迅速拉至20ml处。
(现象如下图中a1 b1 c1 所示)
请观察针筒中气体颜色变化,并尝试用化学平衡移动
的观点进行解释。
a1
b1
c1
观察与思考
T℃时,在密闭容器中发生的反应
2NO2(g) N2O4(g) △H<0假设K的数值为a
实验条件 现象(颜色变化) 现象变化的原因
增大压强 红棕色
减小压强 红棕色
先变深后逐渐变浅
先变浅后变逐渐深
V↓c(NO2)↑,
平衡正移c(NO2)↓
V↑c(NO2)↓,
平衡逆移c(NO2)↑
b
c
a
a1
b1
c1
在T℃时对下列处于化学平衡的三个反应将压强均增加至2倍(假设三个反应在T℃时的K的数值分别为a、b、c)
编号 反应 Q K △υ g 平衡移动方向
① 2NO2(g) N2O4(g) a
② N2(g) +O2 2NO(g) b
③ 2NH3(g) N2 (g) +3H2 (g) c
a
2
正向气态物质系数减小(△υ g<0 )
正向移动
b
不移动
4c
逆向移动
1、计算② 、 ③ Q的数据,判断加压平衡的移动方向。
2、根据上表思考讨论:加压后平衡移动方向与△υ g的关系。
气态物质系数不变(△υ g=0 )
正向气态物质系数增大(△υ g>0 )
B:减小压强,会使化学平衡向着气态物质系数增大的方向移动。
3、压强对化学平衡的影响
结论: (在其它条件不变的情况下)
(对于反应前后△υ≠0的反应)
A:增大压强,会使化学平衡向着气态物质系数减 小的方向移动。
(对于反应前后△υ=0的反应)
特例: 改变压强,化学平衡不移动。
对于只涉及固体或液体的反应,压强的影响极其微弱,可以不予考虑!!!
条件改变 平衡移动方向 移动后的结果
升温
降温
增加c(NO2)
减小c(NO2)
加压
减压
在密闭容器中的反应2NO2(g) N2O4(g) △H<0
若仅改变影响平衡的一个条件,完成下表
向吸热方向移动
温度升高
向放热方向移动
温度降低
向消耗NO2移动
c(NO2)增大
向生成NO2移动
c(NO2)减小
向气体分子数减少移动
向气体分子数减少移动
压强增大
压强减小
“反着来,拗不过”
早在1888年,法国科学家勒夏特列就发现了这其中的规律,并总结出著名的勒夏特列原理,也叫化学平衡移动原理:改变影响化学平衡的一个因素,平衡将向能够减弱这种改变的方向移动。
注意减弱的含义是:
只减小不消除
煤气中毒病人血液中的化学平衡:
CO (g) + Hb(O2) O2(g) + Hb(CO)
K=
思考:应用化学平衡移动原理分析讨论
煤气中毒后应采取那些抢救措施?
[Hb(O2)] [CO]
[Hb(CO)] [O2]
学以致用
(反应达到平衡状态)
化学反应的限度
定量描述
平衡常数
转化率
温度
压强
浓度
反应条件对
平衡的影响
第二节 知识小结
课堂练习
1. 压强变化不会使下列化学反应的平衡发生移动的是( )
H2(g)+I2(g) 2HI(g)
3H2(g)+N2(g) 2NH3(g)
2SO2(g)+O2(g) 2SO3(g)
C(s)+CO2(g) 2CO(g)
A
2. 促使化学平衡3H2(g)+N2(g) 2NH3(g) △H<0,正向移动有各种措施,下列措施可行的是( )
升高温度 B. 增大体系压强
C. 增大c(N2) D. 容器体积增大
BC
3. 下列平衡体系中,升温或减压都使平衡正向移动的是 ( )
A. 3H2(g)+N2(g) 2NH3(g) △H<0
B. 2NO(g) N2(g)+O2(g) △H > 0
C. C(s)+H2O(g) CO(g)+ H2(g) △H>0
D. 2SO2(g)+O2(g) 2SO3(g) △H<0
C
4.在一密闭容器中,反应 aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数减小了
D.a>b
A
5.在密闭容器中,反应2HI (g) H2 (g) + I2 (g) (正反应吸热),当达到平衡时,欲使混合气体颜色加深,可采取的措施有( )
A.减小容器体积
B.降低温度
C.加入催化剂
D.恒容下充入HI气体
AD
第二节 化学反应的限度
反应条件对化学平衡的影响
第2章 化学反应的方向、限度与速率
复习与回顾
温度对化学平衡的影响
浓度对化学平衡的影响
一定温度下,在密闭容器中发生的反应
2NO2(g) N2O4(g) △H<0
条件 平衡移动方向
升高温度
降低温度
增加c(NO2)
增加c(N2O4)
c(NO2)、 c(N2O4) 都增加至2倍或减少至1/2
向吸热方向移动
向放热方向移动
正向移动
逆向移动
一定温度下,在密闭容器中发生的反应
2NO2(g) N2O4(g) △H<0 假设 K的数值为a
条件 Q K 平衡移动方向
c(NO2)、c(N2O4)都增加至2倍 a
c(NO2)、 c(N2O4)都减小至1/2 a
c(NO2)2
c(N2O4)
[NO2]2
[N2O4]
正向移动
逆向移动
a
2
2a
计算Q的数值并判断平衡移动的方向。
观察与思考
三支针筒中均抽入10mlNO2气体,将针筒前端闭。
原理:2NO2 N2O4
(1) 将第二支针筒活塞迅速推至5ml处
(现象如下图中a b c 所示)
请观察针筒中气体颜色变化,并尝试用化学平衡移动的
观点进行解释。
b
c
a
三支针筒中均抽入10mlNO2气体,将针筒前端闭。
原理:2NO2 N2O4
(2)将第三支针筒活塞迅速拉至20ml处。
(现象如下图中a1 b1 c1 所示)
请观察针筒中气体颜色变化,并尝试用化学平衡移动
的观点进行解释。
a1
b1
c1
观察与思考
T℃时,在密闭容器中发生的反应
2NO2(g) N2O4(g) △H<0假设K的数值为a
实验条件 现象(颜色变化) 现象变化的原因
增大压强 红棕色
减小压强 红棕色
先变深后逐渐变浅
先变浅后变逐渐深
V↓c(NO2)↑,
平衡正移c(NO2)↓
V↑c(NO2)↓,
平衡逆移c(NO2)↑
b
c
a
a1
b1
c1
在T℃时对下列处于化学平衡的三个反应将压强均增加至2倍(假设三个反应在T℃时的K的数值分别为a、b、c)
编号 反应 Q K △υ g 平衡移动方向
① 2NO2(g) N2O4(g) a
② N2(g) +O2 2NO(g) b
③ 2NH3(g) N2 (g) +3H2 (g) c
a
2
正向气态物质系数减小(△υ g<0 )
正向移动
b
不移动
4c
逆向移动
1、计算② 、 ③ Q的数据,判断加压平衡的移动方向。
2、根据上表思考讨论:加压后平衡移动方向与△υ g的关系。
气态物质系数不变(△υ g=0 )
正向气态物质系数增大(△υ g>0 )
B:减小压强,会使化学平衡向着气态物质系数增大的方向移动。
3、压强对化学平衡的影响
结论: (在其它条件不变的情况下)
(对于反应前后△υ≠0的反应)
A:增大压强,会使化学平衡向着气态物质系数减 小的方向移动。
(对于反应前后△υ=0的反应)
特例: 改变压强,化学平衡不移动。
对于只涉及固体或液体的反应,压强的影响极其微弱,可以不予考虑!!!
条件改变 平衡移动方向 移动后的结果
升温
降温
增加c(NO2)
减小c(NO2)
加压
减压
在密闭容器中的反应2NO2(g) N2O4(g) △H<0
若仅改变影响平衡的一个条件,完成下表
向吸热方向移动
温度升高
向放热方向移动
温度降低
向消耗NO2移动
c(NO2)增大
向生成NO2移动
c(NO2)减小
向气体分子数减少移动
向气体分子数减少移动
压强增大
压强减小
“反着来,拗不过”
早在1888年,法国科学家勒夏特列就发现了这其中的规律,并总结出著名的勒夏特列原理,也叫化学平衡移动原理:改变影响化学平衡的一个因素,平衡将向能够减弱这种改变的方向移动。
注意减弱的含义是:
只减小不消除
煤气中毒病人血液中的化学平衡:
CO (g) + Hb(O2) O2(g) + Hb(CO)
K=
思考:应用化学平衡移动原理分析讨论
煤气中毒后应采取那些抢救措施?
[Hb(O2)] [CO]
[Hb(CO)] [O2]
学以致用
(反应达到平衡状态)
化学反应的限度
定量描述
平衡常数
转化率
温度
压强
浓度
反应条件对
平衡的影响
第二节 知识小结
课堂练习
1. 压强变化不会使下列化学反应的平衡发生移动的是( )
H2(g)+I2(g) 2HI(g)
3H2(g)+N2(g) 2NH3(g)
2SO2(g)+O2(g) 2SO3(g)
C(s)+CO2(g) 2CO(g)
A
2. 促使化学平衡3H2(g)+N2(g) 2NH3(g) △H<0,正向移动有各种措施,下列措施可行的是( )
升高温度 B. 增大体系压强
C. 增大c(N2) D. 容器体积增大
BC
3. 下列平衡体系中,升温或减压都使平衡正向移动的是 ( )
A. 3H2(g)+N2(g) 2NH3(g) △H<0
B. 2NO(g) N2(g)+O2(g) △H > 0
C. C(s)+H2O(g) CO(g)+ H2(g) △H>0
D. 2SO2(g)+O2(g) 2SO3(g) △H<0
C
4.在一密闭容器中,反应 aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数减小了
D.a>b
A
5.在密闭容器中,反应2HI (g) H2 (g) + I2 (g) (正反应吸热),当达到平衡时,欲使混合气体颜色加深,可采取的措施有( )
A.减小容器体积
B.降低温度
C.加入催化剂
D.恒容下充入HI气体
AD
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
