1.2.1 分离、提纯 课件 (共28张PPT) 2023-2024学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 1.2.1 分离、提纯 课件 (共28张PPT) 2023-2024学年高二化学人教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-26 00:00:00 | ||
图片预览






文档简介
(共28张PPT)
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
第一课时
学习目标
1.了解研究有机化合物的一般方法,能说出研究
有机化合物的主要步骤。
2.了解有机化合物分离、提纯的原理和操作,能
结合实际情况应用蒸馏、萃取或重结晶的方法进
行有机化合物的分离和提纯。
3.通过苯甲酸重结晶的实验探究,感受科学研究
的方法。
中国药学家屠呦呦发现了青蒿素,开创了疟疾治疗新方法,全球数亿人因这种“中国神药”而受益,她因此荣获2015年诺贝尔生理学或医学奖。
新课导入
新课导入
青蒿
青蒿素
分子结构
分离提纯?
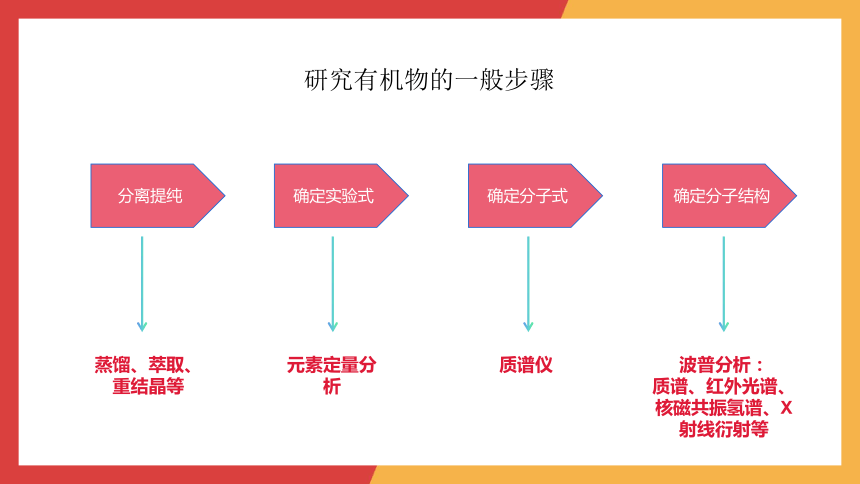
研究有机物的一般步骤
分离提纯
确定实验式
确定分子式
确定分子结构
蒸馏、萃取、重结晶等
元素定量分析
质谱仪
波普分析:
质谱、红外光谱、核磁共振氢谱、X射线衍射等
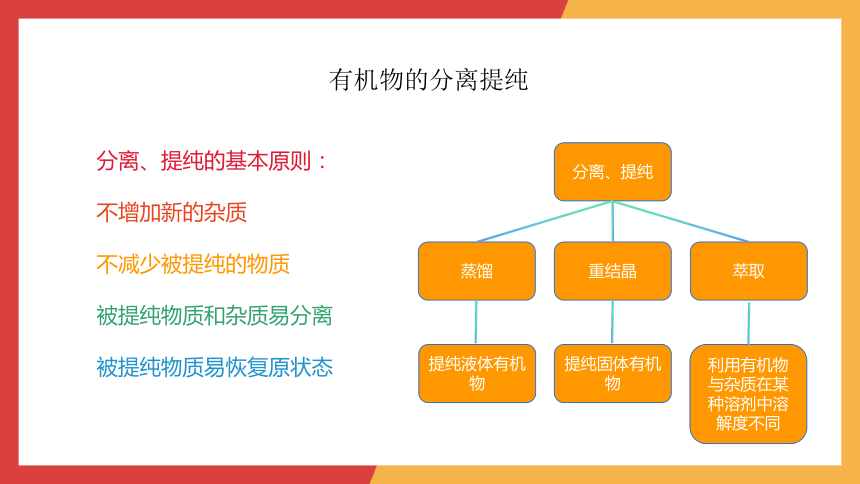
有机物的分离提纯
分离、提纯的基本原则:
不增加新的杂质
不减少被提纯的物质
被提纯物质和杂质易分离
被提纯物质易恢复原状态
分离、提纯
蒸馏
重结晶
萃取
提纯液体有机物
提纯固体有机物
利用有机物与杂质在某种溶剂中溶解度不同
有机物的分离提纯
一、蒸馏
1.原理:在一定温度和压强下,加热液态混合物,利用物质沸点差异进行物质分离的方法,使沸点低的物质汽化,然后冷凝、收集,从而达到与沸点高的物质相分离的目的。
2.适用范围:蒸馏是分离、提纯液态有机化合物的常用方法。
3.适用条件:①液体有机物中含有少量杂质;
②有机物热稳定性较强;
③有机物与杂质的沸点相差较大(一般约大于30 ℃)
有机物的分离提纯
一、蒸馏
4.实验仪器
蒸馏烧瓶、冷凝管、牛角管
注意区别!
蒸馏烧瓶
冷凝管
球形冷凝管
直形冷凝管
蒸馏时用直形冷凝管
牛角管(尾接管)
有机物的分离提纯
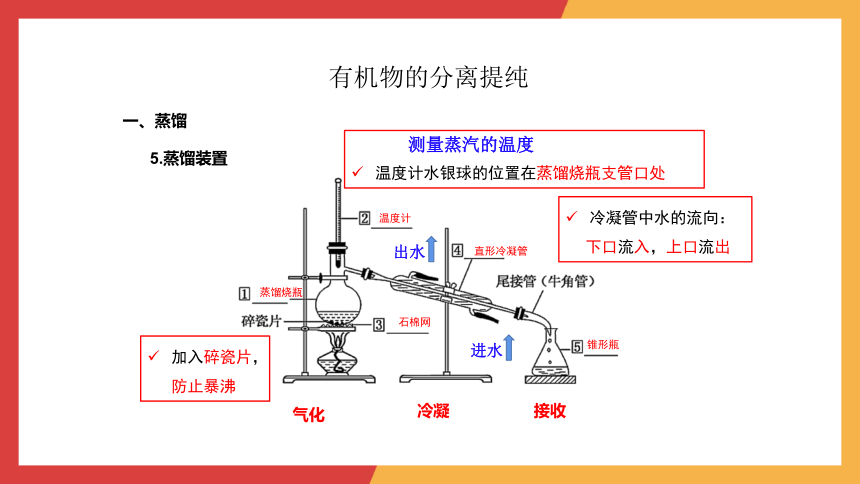
一、蒸馏
5.蒸馏装置
蒸馏烧瓶
石棉网
温度计
直形冷凝管
锥形瓶
气化
冷凝
接收
测量蒸汽的温度
温度计水银球的位置在蒸馏烧瓶支管口处
出水
进水
冷凝管中水的流向:
下口流入,上口流出
加入碎瓷片,防止暴沸
有机物的分离提纯
一、蒸馏
注意事项
①蒸馏烧瓶中所盛液体体积:1/3≤V≤2/3
②蒸馏烧瓶加热时要垫上石棉网
③蒸馏烧瓶中加入沸石,防止暴沸
PS:实验中若发现未加沸石,立即停止加热,冷却后,补加沸石。
④温度计的水银球应位于蒸馏烧瓶的支管口处
⑤冷水从下口进,上口出!
⑥检查装置气密性:用酒精灯对蒸馏烧瓶微热,伸入到水槽的牛角管有连续均匀的气泡冒出,且停止加热后,牛角管口形成一段水柱,说明不漏气
⑦操作顺序:实验前:先通水,再加热;实验后:先停止加热,再停水
有机物的分离提纯
一、蒸馏
思考:如何利用蒸馏方法提纯工业乙醇?
已知工业乙醇(主要成分是乙醇,含有水、甲醇杂质),通过蒸馏可获得95.6%乙醇和4.4%水的共沸混合物(沸点78.15℃)。共沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。
物质 乙醇 水
沸点/℃ 78.5 100
沸点差距小
有机物的分离提纯
一、蒸馏
如何获得无水乙醇?
含有杂质的乙醇
95.6%乙醇 和4.4%水
蒸馏
无水乙醇99.5%
加CaO
蒸馏
固液混合物分离为什么不用过滤而用蒸馏呢?
原因:
1.CaO和水反应生成的Ca(OH)2是糊状物,过滤时会堵塞滤纸孔。
2.Ca(OH)2微溶,少量Ca2+、OH-等离子会透过滤纸导致乙醇不纯。
有机物的分离提纯
继续思考:某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸的方法是什么?
PS:苯甲酸可用作食品防腐剂,纯净的苯甲酸为无色结晶,其结构简式可表示
为 ,熔点122℃,沸点249℃,苯甲酸微溶于水,易溶于乙醇等有机溶剂。
苯甲酸在水中的溶解度如表格所示:
温度/℃ 25 50 75
溶解度/g 0.34 0.85 2.2
重结晶
有机物的分离提纯
二、重结晶
1.原理:利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
2.适用范围:固态有机混合物。
3.适用条件:1.杂质在此溶剂中溶解度很小或者很大,易于除去。
2.被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,能够冷
却结晶。
含有杂质的苯甲酸
有机物的分离提纯
4.实验步骤——以重结晶法提纯苯甲酸为例
(1)观察粗苯甲酸样品的状态。
(2)将1g粗苯甲酸放入100mL烧杯,加入50mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
有机物的分离提纯
问:(1)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
加热溶解——搅拌,加速苯甲酸溶解;趁热过滤——引流;冷却结晶后过滤——引流
(2)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
不是。若温度过低,杂质的溶解度也会降低而析出杂质;另外温度低于0℃,水结冰,给实验带来不便。
取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,证明NaCl已经被除净。
有机物的分离提纯
三、萃取
关于提取青蒿中的青蒿素,东晋葛洪在《肘后备急方》中提到“青蒿一握,以水二升渍,绞取汁,尽服之”。但是,通常有机物的极性不大,用极性水分子提取青蒿中的药效成分收率并不高。因此,科学家们选择极性稍弱的乙醇、乙醚、四氯化碳等在不同的条件下进行实验,发现溶剂极性太强或太弱都不行。最后屠呦呦用低沸点、弱极性的乙醚对青蒿进行冷浸,再经过多次提纯得到一种晶体,又经过动物实验和临床人体实验确认这种晶体具有药效,这就是青蒿素。
提问:1.“以水二升渍,绞取汁”使用的分离提纯方法是什么?
2.屠呦呦为什么选用乙醚作为溶剂提取青蒿素?
有机物的分离提纯
三、萃取
1.萃取分为两类——固-液萃取、液-液萃取。
2.固-液萃取原理:用溶剂从固体物质中溶解出待分离组分的过程。
3.液-液萃取原理:利用待分离组分在两种不互溶的溶剂中的溶解度不同,将其从一种溶剂转移到另一种溶剂的过程。
4.要求:1)萃取剂与原溶剂互不相溶、不发生化学反应;
2)溶质在两溶剂中的溶解度有较大差别(在萃取剂中的溶解度大);
3)溶质不与萃取剂发生任何反应。
有机物的分离提纯
三、萃取
5.操作步骤
洗涤、检漏
分液漏斗
装液
振荡
静置
分液
1.分离互不相溶液态有机混合物。
2.注意下层溶液从下口放出,上层溶液从上口倒出。
1.振荡时双手托住分液漏斗,右手按住玻璃塞,平放,用力振荡(震荡后要放气)
2.震荡后,使玻璃塞凹槽和小孔对齐,静置分层
有机物的分离提纯
三、萃取
分液漏斗怎么检漏?
1.关闭分液漏斗颈部旋塞,向分液漏斗内注入适量的蒸馏水,观察旋塞的两端以及漏斗的下口处是否漏水。
原理:关闭止水夹,打开分液漏斗活塞,在分液漏斗中加水,若分液漏斗中水面不能持续下降,则证明装置气密性良好不漏气。
2、若不漏水,关闭上磨口塞,左手握住旋塞,右手食指摁住上磨口塞,倒立,检查是否漏水;若不漏水,正立,将上磨口塞旋转180度,倒立,检查是否漏水,若不漏水,则此分液漏斗可以使用。
原理:内部气体不漏气,经水压缩后气压高于外界大气压,与外界大气压和漏斗内水压平衡,托出漏斗内水不下落。
有机物的分离提纯
三、萃取
注意事项:
2.固-液萃取原理:用溶剂从固体物质中溶解出待分离组分的过程。
3.液-液萃取原理:利用待分离组分在两种不互溶的溶剂中的溶解度不同,将其从一种溶剂转移到另一种溶剂的过程。
4.要求:1)萃取剂与原溶剂互不相溶、不发生化学反应;
2)溶质在两溶剂中的溶解度有较大差别(在萃取剂中的溶解度大);
3)溶质不与萃取剂发生任何反应。
有机物的分离提纯
三、萃取
思考:如何提纯碘水中的碘单质?
根据上表,可以选用的萃取剂是?
水(H2O) 苯(C6H6) 四氯化碳 (CCl4)
碘(I2) 棕黄 紫红色 紫红色
表一:碘溶解于不同溶剂中的颜色
水(H2O) 苯(C6H6) 四氯化碳 (CCl4)
碘(I2) 0.029g 14.1g 2.9g
表二:碘在不同溶剂中的溶解度(25℃)
苯、四氯化碳
根据上表,你还可以得到什么信息?
溶解性:水不溶于四氯化碳、苯
密度:水1.0g/ml;苯0.88g/ml(比水轻);四氯化碳1.59g/ml(比水重)
有机物的分离提纯
三、萃取
【实验】提纯碘水中的碘单质
实验步骤:
1.量取10mL碘的饱和水溶液,倒入分液漏斗, 注入4mL CCl4, 盖好玻璃塞。(CCl4不溶于水,在下层)
2.用右手压住分液漏斗口部, 左手握住活塞部分, 把分液漏斗倒转过来用力振荡。
3.将分液漏斗放在铁架台上,静置。(静置后,CCl4层变紫色,水层黄色变浅)
4.液体分层后, 将分液漏斗上的玻璃塞打开, 分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁流下。
思考:分液后应如何分离碘的四氯化碳有机溶液?
(已知:四氯化碳沸点:76.8 ℃ 碘单质沸点:184.35 ℃)
蒸馏
随堂训练
B
随堂训练
(直形)冷凝管
蒸馏烧瓶
锥形瓶
进水口
出水口
蒸馏烧瓶支管口下沿处
防止暴沸
随堂训练
D
B
随堂训练
B
B
谢谢观看
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
第一课时
学习目标
1.了解研究有机化合物的一般方法,能说出研究
有机化合物的主要步骤。
2.了解有机化合物分离、提纯的原理和操作,能
结合实际情况应用蒸馏、萃取或重结晶的方法进
行有机化合物的分离和提纯。
3.通过苯甲酸重结晶的实验探究,感受科学研究
的方法。
中国药学家屠呦呦发现了青蒿素,开创了疟疾治疗新方法,全球数亿人因这种“中国神药”而受益,她因此荣获2015年诺贝尔生理学或医学奖。
新课导入
新课导入
青蒿
青蒿素
分子结构
分离提纯?
研究有机物的一般步骤
分离提纯
确定实验式
确定分子式
确定分子结构
蒸馏、萃取、重结晶等
元素定量分析
质谱仪
波普分析:
质谱、红外光谱、核磁共振氢谱、X射线衍射等
有机物的分离提纯
分离、提纯的基本原则:
不增加新的杂质
不减少被提纯的物质
被提纯物质和杂质易分离
被提纯物质易恢复原状态
分离、提纯
蒸馏
重结晶
萃取
提纯液体有机物
提纯固体有机物
利用有机物与杂质在某种溶剂中溶解度不同
有机物的分离提纯
一、蒸馏
1.原理:在一定温度和压强下,加热液态混合物,利用物质沸点差异进行物质分离的方法,使沸点低的物质汽化,然后冷凝、收集,从而达到与沸点高的物质相分离的目的。
2.适用范围:蒸馏是分离、提纯液态有机化合物的常用方法。
3.适用条件:①液体有机物中含有少量杂质;
②有机物热稳定性较强;
③有机物与杂质的沸点相差较大(一般约大于30 ℃)
有机物的分离提纯
一、蒸馏
4.实验仪器
蒸馏烧瓶、冷凝管、牛角管
注意区别!
蒸馏烧瓶
冷凝管
球形冷凝管
直形冷凝管
蒸馏时用直形冷凝管
牛角管(尾接管)
有机物的分离提纯
一、蒸馏
5.蒸馏装置
蒸馏烧瓶
石棉网
温度计
直形冷凝管
锥形瓶
气化
冷凝
接收
测量蒸汽的温度
温度计水银球的位置在蒸馏烧瓶支管口处
出水
进水
冷凝管中水的流向:
下口流入,上口流出
加入碎瓷片,防止暴沸
有机物的分离提纯
一、蒸馏
注意事项
①蒸馏烧瓶中所盛液体体积:1/3≤V≤2/3
②蒸馏烧瓶加热时要垫上石棉网
③蒸馏烧瓶中加入沸石,防止暴沸
PS:实验中若发现未加沸石,立即停止加热,冷却后,补加沸石。
④温度计的水银球应位于蒸馏烧瓶的支管口处
⑤冷水从下口进,上口出!
⑥检查装置气密性:用酒精灯对蒸馏烧瓶微热,伸入到水槽的牛角管有连续均匀的气泡冒出,且停止加热后,牛角管口形成一段水柱,说明不漏气
⑦操作顺序:实验前:先通水,再加热;实验后:先停止加热,再停水
有机物的分离提纯
一、蒸馏
思考:如何利用蒸馏方法提纯工业乙醇?
已知工业乙醇(主要成分是乙醇,含有水、甲醇杂质),通过蒸馏可获得95.6%乙醇和4.4%水的共沸混合物(沸点78.15℃)。共沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。
物质 乙醇 水
沸点/℃ 78.5 100
沸点差距小
有机物的分离提纯
一、蒸馏
如何获得无水乙醇?
含有杂质的乙醇
95.6%乙醇 和4.4%水
蒸馏
无水乙醇99.5%
加CaO
蒸馏
固液混合物分离为什么不用过滤而用蒸馏呢?
原因:
1.CaO和水反应生成的Ca(OH)2是糊状物,过滤时会堵塞滤纸孔。
2.Ca(OH)2微溶,少量Ca2+、OH-等离子会透过滤纸导致乙醇不纯。
有机物的分离提纯
继续思考:某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸的方法是什么?
PS:苯甲酸可用作食品防腐剂,纯净的苯甲酸为无色结晶,其结构简式可表示
为 ,熔点122℃,沸点249℃,苯甲酸微溶于水,易溶于乙醇等有机溶剂。
苯甲酸在水中的溶解度如表格所示:
温度/℃ 25 50 75
溶解度/g 0.34 0.85 2.2
重结晶
有机物的分离提纯
二、重结晶
1.原理:利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
2.适用范围:固态有机混合物。
3.适用条件:1.杂质在此溶剂中溶解度很小或者很大,易于除去。
2.被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,能够冷
却结晶。
含有杂质的苯甲酸
有机物的分离提纯
4.实验步骤——以重结晶法提纯苯甲酸为例
(1)观察粗苯甲酸样品的状态。
(2)将1g粗苯甲酸放入100mL烧杯,加入50mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
有机物的分离提纯
问:(1)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
加热溶解——搅拌,加速苯甲酸溶解;趁热过滤——引流;冷却结晶后过滤——引流
(2)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
不是。若温度过低,杂质的溶解度也会降低而析出杂质;另外温度低于0℃,水结冰,给实验带来不便。
取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,证明NaCl已经被除净。
有机物的分离提纯
三、萃取
关于提取青蒿中的青蒿素,东晋葛洪在《肘后备急方》中提到“青蒿一握,以水二升渍,绞取汁,尽服之”。但是,通常有机物的极性不大,用极性水分子提取青蒿中的药效成分收率并不高。因此,科学家们选择极性稍弱的乙醇、乙醚、四氯化碳等在不同的条件下进行实验,发现溶剂极性太强或太弱都不行。最后屠呦呦用低沸点、弱极性的乙醚对青蒿进行冷浸,再经过多次提纯得到一种晶体,又经过动物实验和临床人体实验确认这种晶体具有药效,这就是青蒿素。
提问:1.“以水二升渍,绞取汁”使用的分离提纯方法是什么?
2.屠呦呦为什么选用乙醚作为溶剂提取青蒿素?
有机物的分离提纯
三、萃取
1.萃取分为两类——固-液萃取、液-液萃取。
2.固-液萃取原理:用溶剂从固体物质中溶解出待分离组分的过程。
3.液-液萃取原理:利用待分离组分在两种不互溶的溶剂中的溶解度不同,将其从一种溶剂转移到另一种溶剂的过程。
4.要求:1)萃取剂与原溶剂互不相溶、不发生化学反应;
2)溶质在两溶剂中的溶解度有较大差别(在萃取剂中的溶解度大);
3)溶质不与萃取剂发生任何反应。
有机物的分离提纯
三、萃取
5.操作步骤
洗涤、检漏
分液漏斗
装液
振荡
静置
分液
1.分离互不相溶液态有机混合物。
2.注意下层溶液从下口放出,上层溶液从上口倒出。
1.振荡时双手托住分液漏斗,右手按住玻璃塞,平放,用力振荡(震荡后要放气)
2.震荡后,使玻璃塞凹槽和小孔对齐,静置分层
有机物的分离提纯
三、萃取
分液漏斗怎么检漏?
1.关闭分液漏斗颈部旋塞,向分液漏斗内注入适量的蒸馏水,观察旋塞的两端以及漏斗的下口处是否漏水。
原理:关闭止水夹,打开分液漏斗活塞,在分液漏斗中加水,若分液漏斗中水面不能持续下降,则证明装置气密性良好不漏气。
2、若不漏水,关闭上磨口塞,左手握住旋塞,右手食指摁住上磨口塞,倒立,检查是否漏水;若不漏水,正立,将上磨口塞旋转180度,倒立,检查是否漏水,若不漏水,则此分液漏斗可以使用。
原理:内部气体不漏气,经水压缩后气压高于外界大气压,与外界大气压和漏斗内水压平衡,托出漏斗内水不下落。
有机物的分离提纯
三、萃取
注意事项:
2.固-液萃取原理:用溶剂从固体物质中溶解出待分离组分的过程。
3.液-液萃取原理:利用待分离组分在两种不互溶的溶剂中的溶解度不同,将其从一种溶剂转移到另一种溶剂的过程。
4.要求:1)萃取剂与原溶剂互不相溶、不发生化学反应;
2)溶质在两溶剂中的溶解度有较大差别(在萃取剂中的溶解度大);
3)溶质不与萃取剂发生任何反应。
有机物的分离提纯
三、萃取
思考:如何提纯碘水中的碘单质?
根据上表,可以选用的萃取剂是?
水(H2O) 苯(C6H6) 四氯化碳 (CCl4)
碘(I2) 棕黄 紫红色 紫红色
表一:碘溶解于不同溶剂中的颜色
水(H2O) 苯(C6H6) 四氯化碳 (CCl4)
碘(I2) 0.029g 14.1g 2.9g
表二:碘在不同溶剂中的溶解度(25℃)
苯、四氯化碳
根据上表,你还可以得到什么信息?
溶解性:水不溶于四氯化碳、苯
密度:水1.0g/ml;苯0.88g/ml(比水轻);四氯化碳1.59g/ml(比水重)
有机物的分离提纯
三、萃取
【实验】提纯碘水中的碘单质
实验步骤:
1.量取10mL碘的饱和水溶液,倒入分液漏斗, 注入4mL CCl4, 盖好玻璃塞。(CCl4不溶于水,在下层)
2.用右手压住分液漏斗口部, 左手握住活塞部分, 把分液漏斗倒转过来用力振荡。
3.将分液漏斗放在铁架台上,静置。(静置后,CCl4层变紫色,水层黄色变浅)
4.液体分层后, 将分液漏斗上的玻璃塞打开, 分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁流下。
思考:分液后应如何分离碘的四氯化碳有机溶液?
(已知:四氯化碳沸点:76.8 ℃ 碘单质沸点:184.35 ℃)
蒸馏
随堂训练
B
随堂训练
(直形)冷凝管
蒸馏烧瓶
锥形瓶
进水口
出水口
蒸馏烧瓶支管口下沿处
防止暴沸
随堂训练
D
B
随堂训练
B
B
谢谢观看
