湖北省荆州市沙市区高级中学校2023-2024学年高二上学期1月期末考试化学试题(含答案)
文档属性
| 名称 | 湖北省荆州市沙市区高级中学校2023-2024学年高二上学期1月期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 575.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-26 23:03:49 | ||
图片预览


文档简介
2023—2024学年度上学期2022级
期末考试化学试卷
时间:75分钟 满分:100分 考试时间:2024年1月25日
第Ⅰ卷(选择题 共45分)
一、选择题:本题共15个小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学知识广泛应用于生产生活中,下列叙述不正确的是( )
A.明矾和均可用作净水剂,但净水原理不同
B.泡沫灭火器中常使用的原料是碳酸钠溶液和硫酸铝溶液
C.纯碱可以用作锅炉除垢时的转化剂
D.用饱和氯化铵溶液可以清洗钢铁表面的锈迹
2.下列说法或化学用语的使用正确的是( )
A.构造原理呈现的能级交错源于光谱学事实
B.符号为M的能层最多容纳的电子数为32个
C.基态碳原子的价电子轨道表示式:
D.24Cr的原子核外电子排布式:[Ar]3d44s2
3.下列说法不正确的是( )
A.ΔH < 0为放热反应
B.化学键断裂与形成时的能量变化是化学变化中能量变化的主要原因
C.在25℃和101 kPa时,相同浓度的盐酸、醋酸溶液分别与NaOH溶液发生中和反应生成1 mol H2O时,放出的热量相等
D.已知甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH = -890.3 kJ·mol-1
4.下列说法正确的是( )
①共价键的特征是具有饱和性和方向性
②共价化合物中一定含共价键,一定不含离子键
③H2O的非直线结构是由共价键的饱和性决定的
④分子中不一定存在共价键
⑤烯烃比烷烃的化学性质活泼是由于烷烃中的σ键比烯烃中的σ键稳定
A.①②④ B.④⑤ C.②③④ D.①③⑤
5.下列有关化学反应速率的说法中,正确的是( )
A.的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B.对有气体参加的化学反应,减小容器体积,使体系压强增大,可使单位体积内活化分子数目增大,化学反应速率加快
C.合成氨反应是一个放热反应,升高温度,正反应速率减慢,逆反应速率加快
D.在恒温恒压条件下进行,向容器中通入,化学反应速率不变
6.根据下列实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 用pH计测定相同浓度的溶液和NaClO溶液的pH,前者的pH小于后者的 HClO的酸性弱于
B 向较浓的溶液中滴入少量酸性溶液,观察溶液紫色是否褪去 证明有还原性
C 常温下测得0.1mol/L溶液和0.1mol/L溶液的pH分别为0.7和1.0 硫元素的非金属性强于氮元素
D 向2mL1mol/LNaOH溶液中加1mL0.1mol/L溶液,产生白色沉淀;再加入1mL0.1mol/L溶液,产生红褐色沉淀。 大于
7. 针对反应,下列说法正确的是( )
A.低温下能自发进行 B.高温下能自发进行
C.任何温度下都不能自发进行 D.任何温度下都能自发进行
8.常温下,用 0.1000 mol·LNaOH溶液滴定 20.00mL0.1000 mol·L溶液所得滴定曲线如图。下列说法正确的是( )
A.点①所示溶液中:
B.点②所示溶液中:
C.点③所示溶液中:
D.滴定过程中可能出现:
X
W Y R
Z
9.如图所示是元素周期表前四周期的一部分,下列关于五种元素的叙述中正确的是( )
A.Z的基态原子最外层p轨道上有2个未成对电子
B.气态氢化物的稳定性Y>X>Z
C.原子半径W>Y>X
D.第一电离能:R>Y>W
10.下列各组离子在指定溶液中一定能大量共存的是( )
A.的溶液中:、、、
B.常温下,水电离的的溶液:、、、
C.使酚酞变红色的溶液中:、、、
D.常温下,在的溶液中:、、、
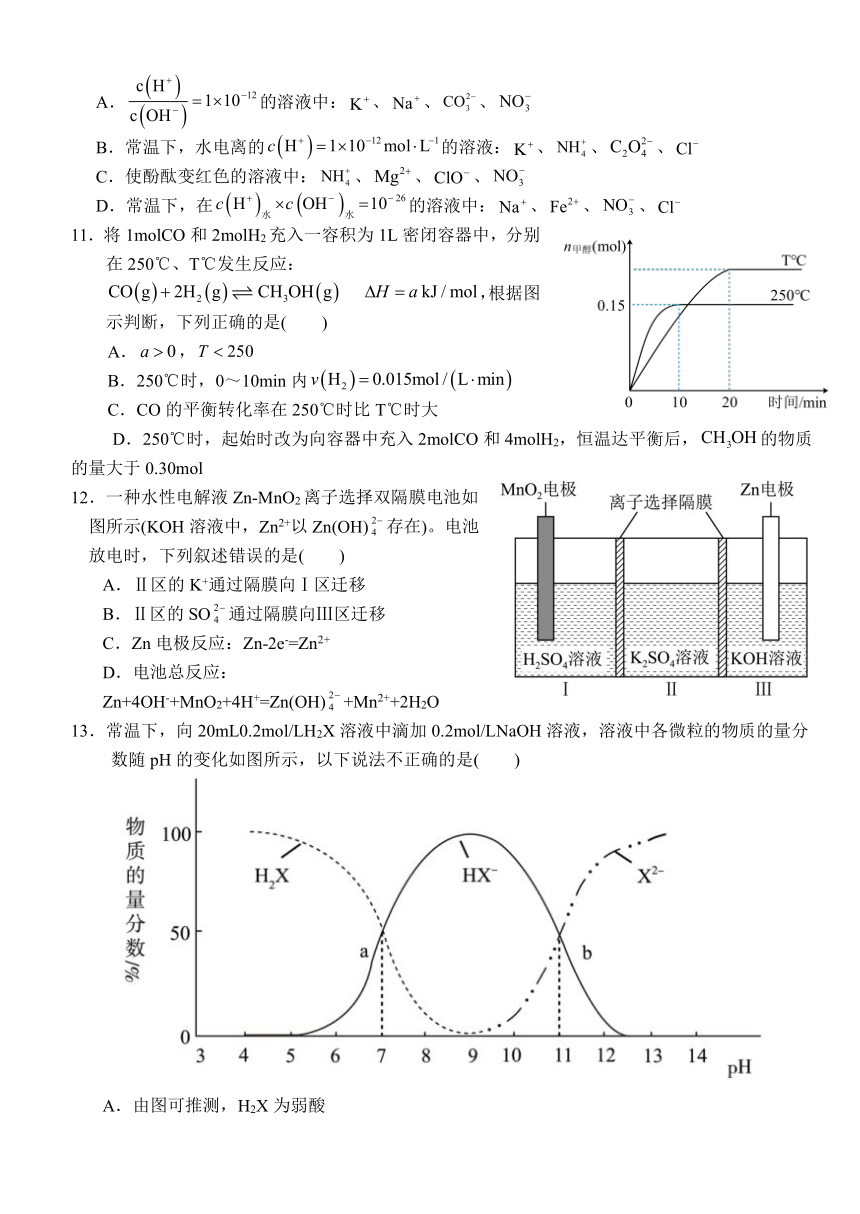
11.将1molCO和2molH2充入一容积为1L密闭容器中,分别在250℃、T℃发生反应: ,根据图示判断,下列正确的是( )
A.,
B.250℃时,0~10min内
C.CO的平衡转化率在250℃时比T℃时大
D.250℃时,起始时改为向容器中充入2molCO和4molH2,恒温达平衡后,的物质的量大于0.30mol
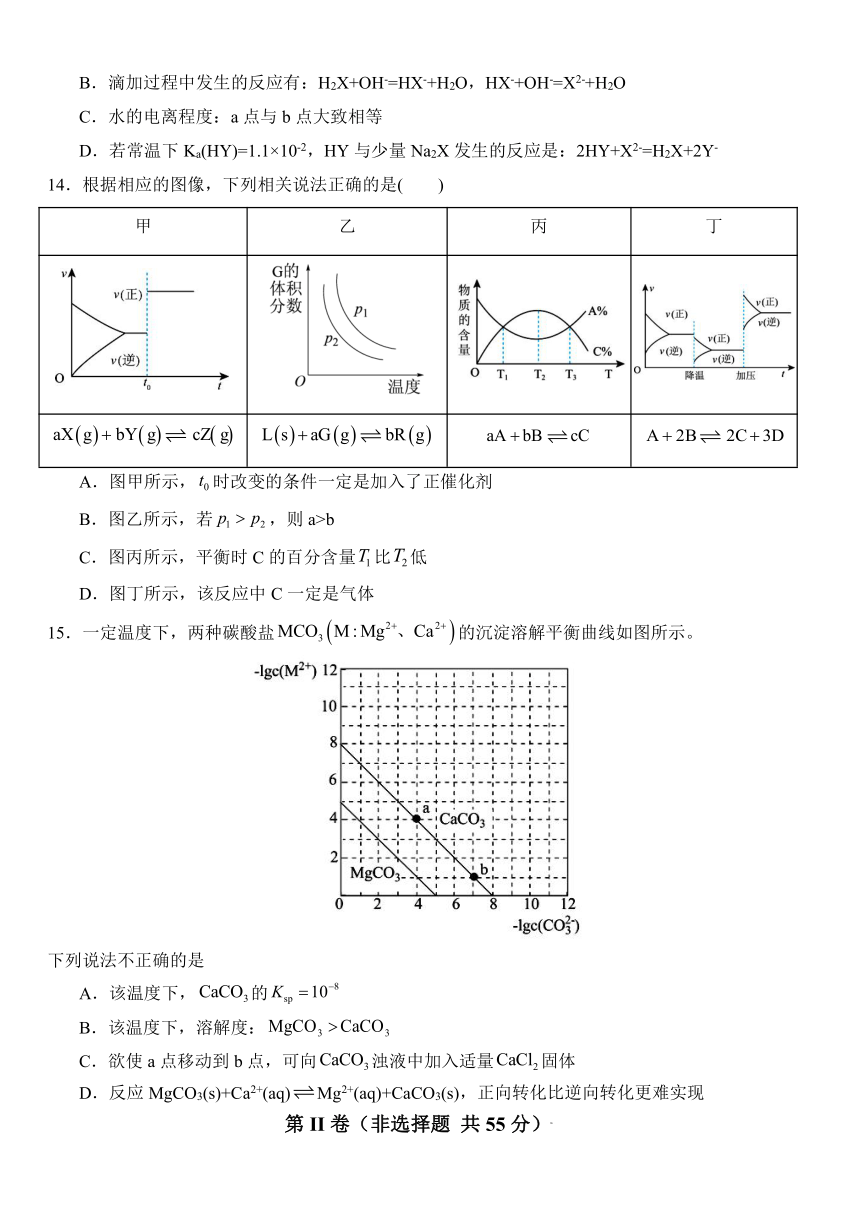
12.一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示(KOH溶液中,Zn2+以Zn(OH)存在)。电池放电时,下列叙述错误的是( )
A.Ⅱ区的K+通过隔膜向Ⅰ区迁移
B.Ⅱ区的SO通过隔膜向Ⅲ区迁移
C.Zn电极反应:Zn-2e-=Zn2+
D.电池总反应:Zn+4OH-+MnO2+4H+=Zn(OH)+Mn2++2H2O
13.常温下,向20mL0.2mol/LH2X溶液中滴加0.2mol/LNaOH溶液,溶液中各微粒的物质的量分数随pH的变化如图所示,以下说法不正确的是( )
A.由图可推测,H2X为弱酸
B.滴加过程中发生的反应有:H2X+OH-=HX-+H2O,HX-+OH-=X2-+H2O
C.水的电离程度:a点与b点大致相等
D.若常温下Ka(HY)=1.1×10-2,HY与少量Na2X发生的反应是:2HY+X2-=H2X+2Y-
14.根据相应的图像,下列相关说法正确的是( )
甲 乙 丙 丁
A.图甲所示,时改变的条件一定是加入了正催化剂
B.图乙所示,若,则a>b
C.图丙所示,平衡时C的百分含量比低
D.图丁所示,该反应中C一定是气体
15.一定温度下,两种碳酸盐的沉淀溶解平衡曲线如图所示。
下列说法不正确的是
A.该温度下,的
B.该温度下,溶解度:
C.欲使a点移动到b点,可向浊液中加入适量固体
D.反应MgCO3(s)+Ca2+(aq)Mg2+(aq)+CaCO3(s),正向转化比逆向转化更难实现
第II卷(非选择题 共55分)
二、非选择题:本题共4个小题,共55分。
16.(13分)某同学欲用0.10mol.L-1的标准盐酸测定未知浓度的氢氧化钠溶液,选择酚酞作指示剂。其操作步骤可分为以下几步:
A.移取待测氢氧化钠溶液注入洁净的锥形瓶中,并滴加滴酚酞溶液。
B.用标准溶液润洗滴定管次。
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液。
D.取标准溶液注入酸式滴定管至“0”刻度以上处。
E.调节液面至“0”或“0”以下刻度,记下读数。
F.把锥形瓶放在滴定管的下面,用标准溶液滴定至终点,并记下滴定管液面的刻度。
请填写下列空白:
(1)正确的操作步骤顺序是 (用字母表示)。
(2)步骤B中应选择图1中的滴定管 (填“甲”或“乙”),该步操作的目的是 。
(3)若某次滴定结束时,酸式滴定管中的液面如图2所示,则读数为 。若仰视,会使读数偏 (填“大”或“小”)。
(4)结合下表数据,计算被测氢氧化钠溶液的物质的量浓度为 。
滴定次数 待测溶液体积 标准盐酸体积
滴定前的刻度 滴定后的刻度
第一次 20.00 2.34 20.39
第二次 20.00 3.20 20.42
第三次 20.00 0.60 17.80
(5)下列操作中可能使所测氢氧化钠溶液的浓度偏低的是 (填字母)。
a.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
b.盛溶液的锥形瓶滴定前用溶液润洗次
c.酸式滴定管在装液前末用标准盐酸润洗次
d.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
17.(12分)镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、、和铁的氧化物)为原料,采用酸溶法制取和,工业流程如图所示:
已知:①常温下,易溶于水,和NiOOH不溶于水;。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
沉淀物
开始沉淀时的pH 7.1 7.6 2.7 3.4 9.2
沉淀完全()时的pH 9.0 9.6 3.2 4.7 11.1
回答下列问题:
(1)“滤液1”中加入的作用是____________________________________(用离子反应方程式表示)。
(2)操作II为达到实验目的,由表中的数据判断通入调节溶液pH的范围是_____________。
(3)“滤液1”中是否存在,可用___________检验。
(4)“沉镍”中pH调为8.5,则滤液中的浓度为______。
(5)操作V是__________________、过滤、洗涤。
(6)在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为________________________________________________。
18.(16分)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)基态N原子中电子占据最高能级的电子云轮廓图为 形,基态N原子的轨道表示式为 。
(2)B的第一电离能I1(B)=800kJ·mol 1,判断I1(Be) 800kJ·mol 1(填“>”或“<”),从电子排布的角度说明判断理由 。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-)。在H、B、N三种元素中:
①电负性由大到小的顺序是 。
②原子半径由大到小的顺序是 。
③在元素周期表中的分区与其他两种不同的是 。
(4)26Fe、27Co、28Ni、29Cu是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。
这四种催化剂中:
①催化效果最好的金属基态原子中未成对的电子数为 。
②催化效果最差的金属基态原子的价层电子排布式为 。
19.(14分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为离子交换膜。请按要求回答相关问题:
(1)甲烷燃料电池负极反应式是 。
(2)Fe电极的电极反应式为 。
(3)X选择 离子交换膜(填“阴”,“阳”)。
(4)丙模拟粗铜的精炼,那么粗铜放在 (填“A”,“B”)极,反应结束后硫酸铜溶液的浓度 (填“变大”,“变小”,“不变”)。
(5)若在标准状况下,有1.12 L氧气参加反应,则乙装置中铁极上生成的气体体积为 L。
(6)写出图中电解饱和食盐水的总的化学反应方程式 。
高二年级期末考试化学答案
1-15 BACAB ACDCA DCCDD
16.(13分,除标注的外,每空2分)
(1)BDCEAF
(2)甲 (1分) 避免稀释溶液,使消耗标准液的体积偏大
(3)19.80 (“19.8”不给分) ;大
(4)0.08605 (“0.086”也给分)
(5)d (写“D”不给分)
17.(12分,每空2分)
(1)
(2)4.7≦pH<7.1 (3)KSCN(硫氰化钾)溶液
(4)
(5)蒸发浓缩、冷却结晶
(6)
18.(16分,除标注的外,每空2分)
(1)哑铃(1分) (1分)
(2)> ; 因为Be的2s2全充满是相对稳定状态,因此I1(Be)>I1(B)
(3)①N>H>B ②B>N>H ③H
(4)①3 ②3d64s2
19.(14分,每空2分)(1)CH4+10OH--8e-=CO+7H2O
(2)2H2O+2e-=H2↑+2OH-
(3)阳
(4)B 变小
(5)2.24
(6)2NaCl+2H2O2NaOH+H2↑+Cl2↑
期末考试化学试卷
时间:75分钟 满分:100分 考试时间:2024年1月25日
第Ⅰ卷(选择题 共45分)
一、选择题:本题共15个小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学知识广泛应用于生产生活中,下列叙述不正确的是( )
A.明矾和均可用作净水剂,但净水原理不同
B.泡沫灭火器中常使用的原料是碳酸钠溶液和硫酸铝溶液
C.纯碱可以用作锅炉除垢时的转化剂
D.用饱和氯化铵溶液可以清洗钢铁表面的锈迹
2.下列说法或化学用语的使用正确的是( )
A.构造原理呈现的能级交错源于光谱学事实
B.符号为M的能层最多容纳的电子数为32个
C.基态碳原子的价电子轨道表示式:
D.24Cr的原子核外电子排布式:[Ar]3d44s2
3.下列说法不正确的是( )
A.ΔH < 0为放热反应
B.化学键断裂与形成时的能量变化是化学变化中能量变化的主要原因
C.在25℃和101 kPa时,相同浓度的盐酸、醋酸溶液分别与NaOH溶液发生中和反应生成1 mol H2O时,放出的热量相等
D.已知甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH = -890.3 kJ·mol-1
4.下列说法正确的是( )
①共价键的特征是具有饱和性和方向性
②共价化合物中一定含共价键,一定不含离子键
③H2O的非直线结构是由共价键的饱和性决定的
④分子中不一定存在共价键
⑤烯烃比烷烃的化学性质活泼是由于烷烃中的σ键比烯烃中的σ键稳定
A.①②④ B.④⑤ C.②③④ D.①③⑤
5.下列有关化学反应速率的说法中,正确的是( )
A.的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B.对有气体参加的化学反应,减小容器体积,使体系压强增大,可使单位体积内活化分子数目增大,化学反应速率加快
C.合成氨反应是一个放热反应,升高温度,正反应速率减慢,逆反应速率加快
D.在恒温恒压条件下进行,向容器中通入,化学反应速率不变
6.根据下列实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 用pH计测定相同浓度的溶液和NaClO溶液的pH,前者的pH小于后者的 HClO的酸性弱于
B 向较浓的溶液中滴入少量酸性溶液,观察溶液紫色是否褪去 证明有还原性
C 常温下测得0.1mol/L溶液和0.1mol/L溶液的pH分别为0.7和1.0 硫元素的非金属性强于氮元素
D 向2mL1mol/LNaOH溶液中加1mL0.1mol/L溶液,产生白色沉淀;再加入1mL0.1mol/L溶液,产生红褐色沉淀。 大于
7. 针对反应,下列说法正确的是( )
A.低温下能自发进行 B.高温下能自发进行
C.任何温度下都不能自发进行 D.任何温度下都能自发进行
8.常温下,用 0.1000 mol·LNaOH溶液滴定 20.00mL0.1000 mol·L溶液所得滴定曲线如图。下列说法正确的是( )
A.点①所示溶液中:
B.点②所示溶液中:
C.点③所示溶液中:
D.滴定过程中可能出现:
X
W Y R
Z
9.如图所示是元素周期表前四周期的一部分,下列关于五种元素的叙述中正确的是( )
A.Z的基态原子最外层p轨道上有2个未成对电子
B.气态氢化物的稳定性Y>X>Z
C.原子半径W>Y>X
D.第一电离能:R>Y>W
10.下列各组离子在指定溶液中一定能大量共存的是( )
A.的溶液中:、、、
B.常温下,水电离的的溶液:、、、
C.使酚酞变红色的溶液中:、、、
D.常温下,在的溶液中:、、、
11.将1molCO和2molH2充入一容积为1L密闭容器中,分别在250℃、T℃发生反应: ,根据图示判断,下列正确的是( )
A.,
B.250℃时,0~10min内
C.CO的平衡转化率在250℃时比T℃时大
D.250℃时,起始时改为向容器中充入2molCO和4molH2,恒温达平衡后,的物质的量大于0.30mol
12.一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示(KOH溶液中,Zn2+以Zn(OH)存在)。电池放电时,下列叙述错误的是( )
A.Ⅱ区的K+通过隔膜向Ⅰ区迁移
B.Ⅱ区的SO通过隔膜向Ⅲ区迁移
C.Zn电极反应:Zn-2e-=Zn2+
D.电池总反应:Zn+4OH-+MnO2+4H+=Zn(OH)+Mn2++2H2O
13.常温下,向20mL0.2mol/LH2X溶液中滴加0.2mol/LNaOH溶液,溶液中各微粒的物质的量分数随pH的变化如图所示,以下说法不正确的是( )
A.由图可推测,H2X为弱酸
B.滴加过程中发生的反应有:H2X+OH-=HX-+H2O,HX-+OH-=X2-+H2O
C.水的电离程度:a点与b点大致相等
D.若常温下Ka(HY)=1.1×10-2,HY与少量Na2X发生的反应是:2HY+X2-=H2X+2Y-
14.根据相应的图像,下列相关说法正确的是( )
甲 乙 丙 丁
A.图甲所示,时改变的条件一定是加入了正催化剂
B.图乙所示,若,则a>b
C.图丙所示,平衡时C的百分含量比低
D.图丁所示,该反应中C一定是气体
15.一定温度下,两种碳酸盐的沉淀溶解平衡曲线如图所示。
下列说法不正确的是
A.该温度下,的
B.该温度下,溶解度:
C.欲使a点移动到b点,可向浊液中加入适量固体
D.反应MgCO3(s)+Ca2+(aq)Mg2+(aq)+CaCO3(s),正向转化比逆向转化更难实现
第II卷(非选择题 共55分)
二、非选择题:本题共4个小题,共55分。
16.(13分)某同学欲用0.10mol.L-1的标准盐酸测定未知浓度的氢氧化钠溶液,选择酚酞作指示剂。其操作步骤可分为以下几步:
A.移取待测氢氧化钠溶液注入洁净的锥形瓶中,并滴加滴酚酞溶液。
B.用标准溶液润洗滴定管次。
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液。
D.取标准溶液注入酸式滴定管至“0”刻度以上处。
E.调节液面至“0”或“0”以下刻度,记下读数。
F.把锥形瓶放在滴定管的下面,用标准溶液滴定至终点,并记下滴定管液面的刻度。
请填写下列空白:
(1)正确的操作步骤顺序是 (用字母表示)。
(2)步骤B中应选择图1中的滴定管 (填“甲”或“乙”),该步操作的目的是 。
(3)若某次滴定结束时,酸式滴定管中的液面如图2所示,则读数为 。若仰视,会使读数偏 (填“大”或“小”)。
(4)结合下表数据,计算被测氢氧化钠溶液的物质的量浓度为 。
滴定次数 待测溶液体积 标准盐酸体积
滴定前的刻度 滴定后的刻度
第一次 20.00 2.34 20.39
第二次 20.00 3.20 20.42
第三次 20.00 0.60 17.80
(5)下列操作中可能使所测氢氧化钠溶液的浓度偏低的是 (填字母)。
a.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
b.盛溶液的锥形瓶滴定前用溶液润洗次
c.酸式滴定管在装液前末用标准盐酸润洗次
d.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
17.(12分)镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、、和铁的氧化物)为原料,采用酸溶法制取和,工业流程如图所示:
已知:①常温下,易溶于水,和NiOOH不溶于水;。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
沉淀物
开始沉淀时的pH 7.1 7.6 2.7 3.4 9.2
沉淀完全()时的pH 9.0 9.6 3.2 4.7 11.1
回答下列问题:
(1)“滤液1”中加入的作用是____________________________________(用离子反应方程式表示)。
(2)操作II为达到实验目的,由表中的数据判断通入调节溶液pH的范围是_____________。
(3)“滤液1”中是否存在,可用___________检验。
(4)“沉镍”中pH调为8.5,则滤液中的浓度为______。
(5)操作V是__________________、过滤、洗涤。
(6)在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为________________________________________________。
18.(16分)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)基态N原子中电子占据最高能级的电子云轮廓图为 形,基态N原子的轨道表示式为 。
(2)B的第一电离能I1(B)=800kJ·mol 1,判断I1(Be) 800kJ·mol 1(填“>”或“<”),从电子排布的角度说明判断理由 。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-)。在H、B、N三种元素中:
①电负性由大到小的顺序是 。
②原子半径由大到小的顺序是 。
③在元素周期表中的分区与其他两种不同的是 。
(4)26Fe、27Co、28Ni、29Cu是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。
这四种催化剂中:
①催化效果最好的金属基态原子中未成对的电子数为 。
②催化效果最差的金属基态原子的价层电子排布式为 。
19.(14分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为离子交换膜。请按要求回答相关问题:
(1)甲烷燃料电池负极反应式是 。
(2)Fe电极的电极反应式为 。
(3)X选择 离子交换膜(填“阴”,“阳”)。
(4)丙模拟粗铜的精炼,那么粗铜放在 (填“A”,“B”)极,反应结束后硫酸铜溶液的浓度 (填“变大”,“变小”,“不变”)。
(5)若在标准状况下,有1.12 L氧气参加反应,则乙装置中铁极上生成的气体体积为 L。
(6)写出图中电解饱和食盐水的总的化学反应方程式 。
高二年级期末考试化学答案
1-15 BACAB ACDCA DCCDD
16.(13分,除标注的外,每空2分)
(1)BDCEAF
(2)甲 (1分) 避免稀释溶液,使消耗标准液的体积偏大
(3)19.80 (“19.8”不给分) ;大
(4)0.08605 (“0.086”也给分)
(5)d (写“D”不给分)
17.(12分,每空2分)
(1)
(2)4.7≦pH<7.1 (3)KSCN(硫氰化钾)溶液
(4)
(5)蒸发浓缩、冷却结晶
(6)
18.(16分,除标注的外,每空2分)
(1)哑铃(1分) (1分)
(2)> ; 因为Be的2s2全充满是相对稳定状态,因此I1(Be)>I1(B)
(3)①N>H>B ②B>N>H ③H
(4)①3 ②3d64s2
19.(14分,每空2分)(1)CH4+10OH--8e-=CO+7H2O
(2)2H2O+2e-=H2↑+2OH-
(3)阳
(4)B 变小
(5)2.24
(6)2NaCl+2H2O2NaOH+H2↑+Cl2↑
同课章节目录
