广东省大湾区2023-2024学年高一上学期期末联合考试化学试题(含答案)
文档属性
| 名称 | 广东省大湾区2023-2024学年高一上学期期末联合考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 733.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-26 23:17:53 | ||
图片预览



文档简介
★启用前注意保密
大湾区2023~2024学年第一学期末普通高中一年级联合考试
化学
本卷共8页,分第Ⅰ卷(选择题)第Ⅱ卷(非选择题)两部分,满分100分。考试时间90分钟。
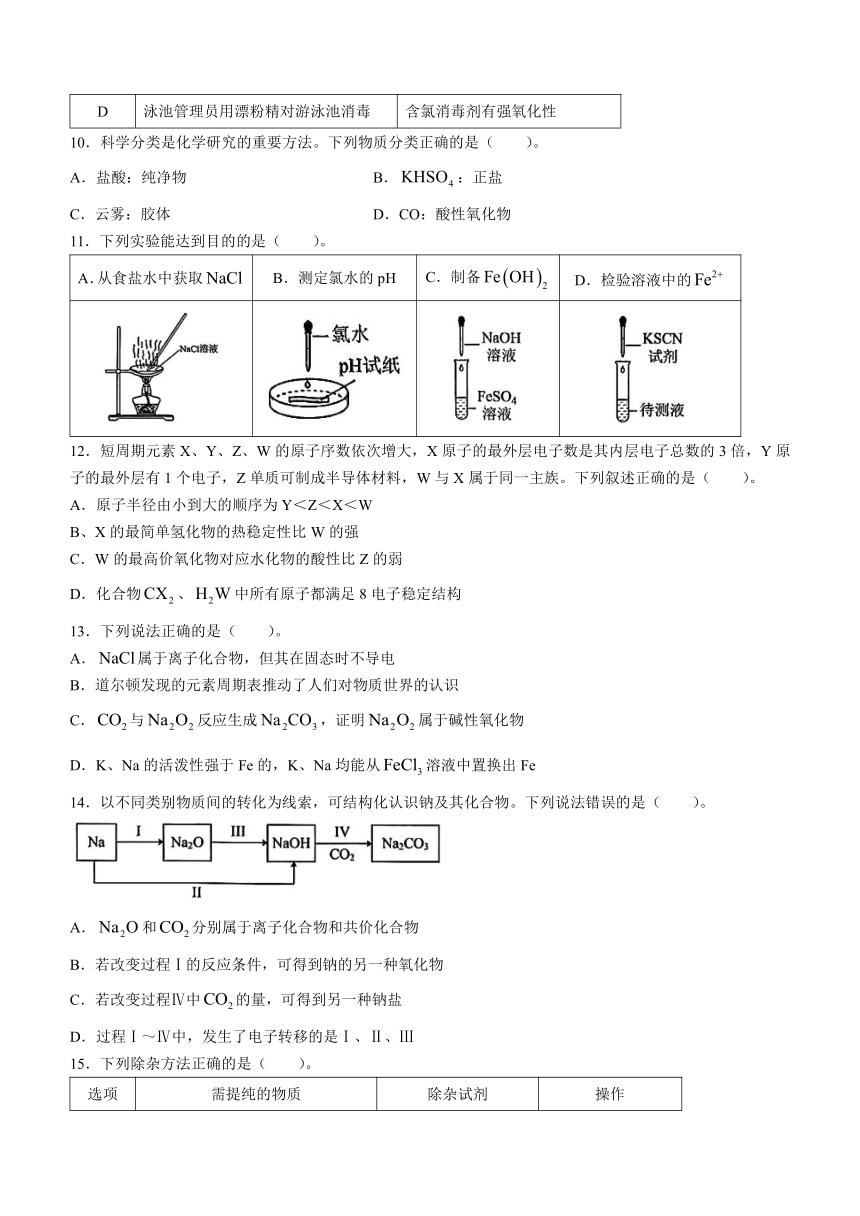
注意事项:
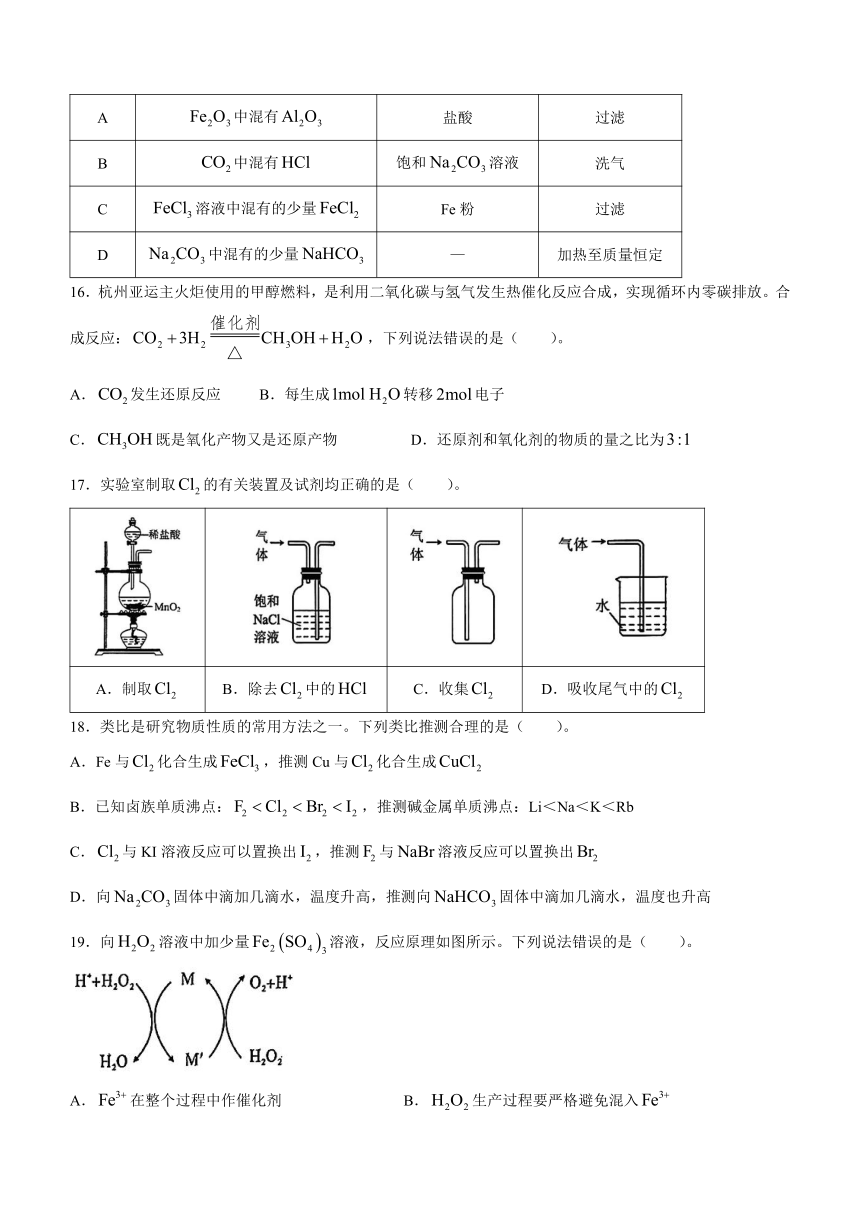
1.答卷前,考生务必将自己的学校、班级、姓名、考场号、座位号和准考证号填写在答题卡上,将条形码横贴在答题卡“条形码粘贴处”。
2.作答选择题时,选出每小题答案后,用2B铅笔在答题卡上将对应题目选项的答案信息点涂黑;如需改动,用橡皮擦干净后,再选涂其他答案。答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新答案;不准使用铅笔和涂改液。不按以上要求作答无效。
4.考生必须保证答题卡的整洁。考试结束后,将试卷和答题卡一并交回。
可能用到的相对原子质量:
第Ⅰ卷(选择题,共50分)
一、选择题(本题共20小题,每小题只有一个正确选项。其中1~15题每小题2分,16~20题每小题4分,共50分。)
1.下列图片所展示的物品不是用合金材料制成的是( )。
物品
选项 A.杭州亚运会“湖山”金属奖牌 B.飞机外壳所用的硬铝 C.刚玉耐火坩埚 D.商朝的后母戊鼎
2.下列物质之间转化均要求一步完成,其中不符合要求的是( )。
A. B.
C. D.
3.下列说法不正确的是( )。
A.过氧化钠的电子式:
B.月壤中的与地球上的互为同位素
C.核素中质子数为116,中子数为177
D.臭氧层中的与空气中的互为同素异形体
4.设为阿伏加德罗常数的值。下列说法正确的是( )。
A.溶液中含有数目为
B.标准状况下,中所含电子数为
C.常温常压下,中所含的氧原子数目为
D.与足量烧碱溶液反应,转移的电子数为
5.宏观辨识与微观探析是化学学科核心素养之一。下列离子反应方程式书写正确的是( )。
A.钠放入水中:
B.覆铜板制作印刷电路板:
C.向碳酸钡溶液中加入足量稀盐酸:
D.向溶液中加入足量的溶液:
6.食品包装袋内填充氮气或氩气可以延长食品的保质期。同温、同压下,相同体积的氮气和氩气具有相同的( )。
A.质量 B.原子数 C.密度 D.分子数
7.常温下,的酸性溶液中能大量共存的是( )。
A.、、、 B.、、、
C.、、、 D.、、、
8.研究化学键有助于研究物质的某些性质。下列各组物质中,化学键类型完全相同的是( )。
A.HI和 B.和
C.和 D.和
9.劳动创造美好生活。下列劳动与所涉及的化学知识没有关联的是( )。
选项 劳动 化学知识
A 保洁员用白醋清洗水壶中的水垢 醋酸具有酸性
B 用“爆炸盐”(含)漂白衣物 有强氧化性
C 用含的涂料粉刷墙面 是电解质
D 泳池管理员用漂粉精对游泳池消毒 含氯消毒剂有强氧化性
10.科学分类是化学研究的重要方法。下列物质分类正确的是( )。
A.盐酸:纯净物 B.:正盐
C.云雾:胶体 D.CO:酸性氧化物
11.下列实验能达到目的的是( )。
A.从食盐水中获取 B.测定氯水的pH C.制备 D.检验溶液中的
12.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层有1个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )。
A.原子半径由小到大的顺序为Y<Z<X<W
B、X的最简单氢化物的热稳定性比W的强
C.W的最高价氧化物对应水化物的酸性比Z的弱
D.化合物、中所有原子都满足8电子稳定结构
13.下列说法正确的是( )。
A.属于离子化合物,但其在固态时不导电
B.道尔顿发现的元素周期表推动了人们对物质世界的认识
C.与反应生成,证明属于碱性氧化物
D.K、Na的活泼性强于Fe的,K、Na均能从溶液中置换出Fe
14.以不同类别物质间的转化为线索,可结构化认识钠及其化合物。下列说法错误的是( )。
A.和分别属于离子化合物和共价化合物
B.若改变过程Ⅰ的反应条件,可得到钠的另一种氧化物
C.若改变过程Ⅳ中的量,可得到另一种钠盐
D.过程Ⅰ~Ⅳ中,发生了电子转移的是Ⅰ、Ⅱ、Ⅲ
15.下列除杂方法正确的是( )。
选项 需提纯的物质 除杂试剂 操作
A 中混有 盐酸 过滤
B 中混有 饱和溶液 洗气
C 溶液中混有的少量 Fe粉 过滤
D 中混有的少量 — 加热至质量恒定
16.杭州亚运主火炬使用的甲醇燃料,是利用二氧化碳与氢气发生热催化反应合成,实现循环内零碳排放。合成反应:,下列说法错误的是( )。
A.发生还原反应 B.每生成转移电子
C.既是氧化产物又是还原产物 D.还原剂和氧化剂的物质的量之比为
17.实验室制取的有关装置及试剂均正确的是( )。
A.制取 B.除去中的 C.收集 D.吸收尾气中的
18.类比是研究物质性质的常用方法之一。下列类比推测合理的是( )。
A.Fe与化合生成,推测Cu与化合生成
B.已知卤族单质沸点:,推测碱金属单质沸点:Li<Na<K<Rb
C.与KI溶液反应可以置换出,推测与溶液反应可以置换出
D.向固体中滴加几滴水,温度升高,推测向固体中滴加几滴水,温度也升高
19.向溶液中加少量溶液,反应原理如图所示。下列说法错误的是( )。
A.在整个过程中作催化剂 B.生产过程要严格避免混入
C.有生成时,转移电子 D.该反应过程中,M是,M是
20.下列各组实验,根据实验操作和现象得出结论正确的是( )。
选项 实验操作和实验现象 结论
A 用铂丝蘸取溶液,放在火焰上灼烧,未观察到火焰呈紫色 该溶液中不含有
B 向溶液中加入盐酸酸化的溶液,有白色沉淀生成 该溶液中一定含有
C 将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片,鲜花褪色 氯气具有漂白性
D 向饱和碳酸钠溶液中通入足量,溶液变浑浊 析出固体
第Ⅱ卷(共50分)
21.(11分)周末小明同学在家学做家务,他发现居家用品的很多调味品、厨具材料、洗涤用品等都与化学密切相关。他做了仔细观察统计,记录信息如下表。
物品 食醋 料酒 调味盐 鸡蛋 生粉 不锈钢 门窗 洁厕灵
主要成分 醋酸 乙醇 蛋白质(外壳) 淀粉 铁合金 铝合金 盐酸
回答下列问题:
(1)表格中的“主要成分”的物质属于电解质的是__________(任填两种化学式)。
(2)做咸蛋时用食醋先浸泡鸡蛋一段时间,有气泡产生,离子反应方程式为__________=== ____________________。
(3)铝合金可做门窗主要是利用了其质量轻及__________的性能(填一种)。
(4)劳动时不小心把洁厕灵喷洒到不锈钢上,铁与盐酸反应方程式为__________。
(5)食醋标签注明醋酸含量,则__________(保留2位有效数字)。
(6)国家规定碘缺乏地区食盐中应添加适量,设计实验检验调味盐里是否添加了,完善反应方程式__________+______,取反应后溶液,滴加__________,则证明有添加。
22.(10分)2019年是化学元素周期表问世150周年,联合国宣布此年为“国际化学元素周期表年”。元素周期表在学习、研究中有很重要的作用。下表是元素周期表的一部分。
族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 a b
3 c d e f g
(1)e的元素符号是__________。
(2)f、g的最高价氧化物对应的水化物中,酸性较强的物质的化学式是__________。
(3)c的金属性强于d的金属性,据原子结构解释原因:__________。
(4)下列说法正确的是__________(填序号)。
①最简单氢化物的稳定性:a>f ②单质a比单质b难与氢气反应
⑧a的最高正价和最低负价绝对值相等 ④a、g的最简单氢化物化合形成共价化合物
(5)价类二维图是归纳整理元素化合物知识好工具。与e同主族的元素h广泛存在于大气、地壳和生物体中,由它组成的有机物是生命之本。在下图中相应位置写出h的不同类型化合物的化学式(任意3个合理答案即可)。
CO(例)
0
氢化物 单质 氧化物 含氧酸 盐
23.(14分)小组同学制备,并探究其性质。
Ⅰ.制备:
(1)A装置中装的仪器名称为__________,C中试剂为__________。
(2)若装置的连接顺序为A→C→B,制得的不纯,正确的连接应为a→____→____→____→____→____(装置可重复使用)。
Ⅱ.性质实验:
(3)取少量产品于试管中,加足量水,振荡,产生气体、无固体残留,与水反应方程式为__________。
(4)取反应后的溶液,分两等份于两支试管中进行下列实验
试管 添加试剂 现象结论
甲 滴加几滴酚酞 先__________,后褪色
乙 加少量、向试管内伸入带火星木条 能使带火星木条复燃,产生气体是__________(填化学式)。
查阅资料:过氧化钠与水反应的过程中可能存在以下两个反应:
ⅰ.
ⅱ.
结论:与水反应可能生成“中间”产物有__________(填化学式)。
关于ⅰ、ⅱ中的反应及相关物质说法正确的是__________。
A.两个反应是氧化还原反应
B.含极性共价键
C.,、都具有强氧化性
D.与水反应不是一步完成的
(5)在生产生活中的一种应用为__________。
24.(15分)
Ⅰ.七水合硫酸亚铁是一种重要的食品或饲料添加剂,也是颜料及电子工业的原材料。某同学利用工业烧渣(含有、、)采用下图所示流程来模拟制备七水合硫酸亚铁。
回答下列问题:
(1)“滤渣”主要成分的名称是__________,被还原的离子方程式__________。
(2)若检验,取溶液中滴加溶液,产生的现象是__________。
此过程涉及反应的化学方程式为,__________。
Ⅱ.流程需要溶液,若由你配制所需溶液,回答下列问题:
硫酸 化学纯(CP级) 品名:硫酸 化学式: 相对分子质量:98 密度: 质量分数:98%
(3)实验中除量筒、烧杯、玻璃棒、胶头滴管外,还需要的主要仪器有:__________。
(4)计算所需浓硫酸的体积约为__________mL(精确到)。
(5)在量取浓硫酸后,进行了下列操作:
①等稀释的硫酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线时,改用胶头滴管加蒸馏水,使溶液的凹液面与瓶颈的刻度线相切。
③将量取的浓硫酸稀释。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是__________(填序号)。
(6)下列操作会引起所配溶液浓度偏大的是__________(填字母)。
A.定容时仰视刻度线
B.容量瓶中原来有少量蒸馏水
C.用量筒量取浓硫酸时,仰视量筒的刻度
D.向容量瓶中转移溶液时,有少量液体溅出
Ⅲ.(7)产品(摩尔质量为)纯度测定:取a g样品,配成溶液,量取待测液于锥形瓶中,加入酸性溶液至恰好完全反应,消耗溶液体积为b mL,纯度为__________。
高一化学试卷参考答案及评分细则
Ⅰ卷 单项选择题(1~15题,每题2分;16~20题,每题4分,共50分)
1 2 3 4 5 6 7 8 9 10
C C B C D D A B C C
11 12 13 14 15 16 17 18 19 20
A B A D D B C A D D
Ⅱ卷(共50分)
21.(12分)
(1)、、、(任填两种物质即可得满分2分),
(2)(反应物产物均正确1分,配平1分,共2分),
(3)硬度大(1分,其他不给分)
(4)(完全正确2分,其他不给分)
(5)0.58(2分,数据正确有效数字不符合要求给1分)
(6)(答到给1分,配平1分,共2分),滴加几滴淀粉溶液,出现蓝色(1分,试剂与现象都正确才给分)
22.(10分)
(1)Si(2分)
(2)(2分,若答高氯酸给1分)
(3)c、d电子层相同,c的核电荷数小1分,原子半径更大1分(共2分)。
(4)①②(2分,漏答扣1分,选错倒扣1分,扣完为止)
(5)(2分,写出3个合理答案即可得满分,写出2个1分,氢化物、含氧酸、盐合理答案都可给分,有错不扣分)
CO(例)
0
氢化物 单质 氧化物 含氧酸 盐
23.(13分)
Ⅰ.(1)分液漏斗(1分) 浓硫酸(1分)
(2)a→b→c→d→e→b(2分,其他都不给分)
Ⅱ.(3)(反应物、产物、气体符号均正确1分,配平1分,其他正确仅漏气体符号扣1分,共2分)
(4)变红(1分),(1分),、(每个1分,2分),CD(2分,漏答扣1分,选错倒扣1分,扣完为止)
(5)作供氧剂或漂白剂(任意答一点合理即给分,1分)
24.(共15分)
Ⅰ.(1)二氧化硅(1分),(完全正确1分,其他不给分)
(2)生成白色絮状沉淀迅速变成灰绿色(1分),过一段时间后变为红褐色沉淀(1分)(共2分)
(反应物产物均正确1分,配平1分,共2分)
Ⅱ.(3)容量瓶(完全正确1分,其他不给分)
(4)13.6(2分)
(5)③①④②(完全正确2分,其他不给分)
(6)c(2分)
Ⅲ.(7)%(2分),(2分)
大湾区2023~2024学年第一学期末普通高中一年级联合考试
化学
本卷共8页,分第Ⅰ卷(选择题)第Ⅱ卷(非选择题)两部分,满分100分。考试时间90分钟。
注意事项:
1.答卷前,考生务必将自己的学校、班级、姓名、考场号、座位号和准考证号填写在答题卡上,将条形码横贴在答题卡“条形码粘贴处”。
2.作答选择题时,选出每小题答案后,用2B铅笔在答题卡上将对应题目选项的答案信息点涂黑;如需改动,用橡皮擦干净后,再选涂其他答案。答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新答案;不准使用铅笔和涂改液。不按以上要求作答无效。
4.考生必须保证答题卡的整洁。考试结束后,将试卷和答题卡一并交回。
可能用到的相对原子质量:
第Ⅰ卷(选择题,共50分)
一、选择题(本题共20小题,每小题只有一个正确选项。其中1~15题每小题2分,16~20题每小题4分,共50分。)
1.下列图片所展示的物品不是用合金材料制成的是( )。
物品
选项 A.杭州亚运会“湖山”金属奖牌 B.飞机外壳所用的硬铝 C.刚玉耐火坩埚 D.商朝的后母戊鼎
2.下列物质之间转化均要求一步完成,其中不符合要求的是( )。
A. B.
C. D.
3.下列说法不正确的是( )。
A.过氧化钠的电子式:
B.月壤中的与地球上的互为同位素
C.核素中质子数为116,中子数为177
D.臭氧层中的与空气中的互为同素异形体
4.设为阿伏加德罗常数的值。下列说法正确的是( )。
A.溶液中含有数目为
B.标准状况下,中所含电子数为
C.常温常压下,中所含的氧原子数目为
D.与足量烧碱溶液反应,转移的电子数为
5.宏观辨识与微观探析是化学学科核心素养之一。下列离子反应方程式书写正确的是( )。
A.钠放入水中:
B.覆铜板制作印刷电路板:
C.向碳酸钡溶液中加入足量稀盐酸:
D.向溶液中加入足量的溶液:
6.食品包装袋内填充氮气或氩气可以延长食品的保质期。同温、同压下,相同体积的氮气和氩气具有相同的( )。
A.质量 B.原子数 C.密度 D.分子数
7.常温下,的酸性溶液中能大量共存的是( )。
A.、、、 B.、、、
C.、、、 D.、、、
8.研究化学键有助于研究物质的某些性质。下列各组物质中,化学键类型完全相同的是( )。
A.HI和 B.和
C.和 D.和
9.劳动创造美好生活。下列劳动与所涉及的化学知识没有关联的是( )。
选项 劳动 化学知识
A 保洁员用白醋清洗水壶中的水垢 醋酸具有酸性
B 用“爆炸盐”(含)漂白衣物 有强氧化性
C 用含的涂料粉刷墙面 是电解质
D 泳池管理员用漂粉精对游泳池消毒 含氯消毒剂有强氧化性
10.科学分类是化学研究的重要方法。下列物质分类正确的是( )。
A.盐酸:纯净物 B.:正盐
C.云雾:胶体 D.CO:酸性氧化物
11.下列实验能达到目的的是( )。
A.从食盐水中获取 B.测定氯水的pH C.制备 D.检验溶液中的
12.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层有1个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )。
A.原子半径由小到大的顺序为Y<Z<X<W
B、X的最简单氢化物的热稳定性比W的强
C.W的最高价氧化物对应水化物的酸性比Z的弱
D.化合物、中所有原子都满足8电子稳定结构
13.下列说法正确的是( )。
A.属于离子化合物,但其在固态时不导电
B.道尔顿发现的元素周期表推动了人们对物质世界的认识
C.与反应生成,证明属于碱性氧化物
D.K、Na的活泼性强于Fe的,K、Na均能从溶液中置换出Fe
14.以不同类别物质间的转化为线索,可结构化认识钠及其化合物。下列说法错误的是( )。
A.和分别属于离子化合物和共价化合物
B.若改变过程Ⅰ的反应条件,可得到钠的另一种氧化物
C.若改变过程Ⅳ中的量,可得到另一种钠盐
D.过程Ⅰ~Ⅳ中,发生了电子转移的是Ⅰ、Ⅱ、Ⅲ
15.下列除杂方法正确的是( )。
选项 需提纯的物质 除杂试剂 操作
A 中混有 盐酸 过滤
B 中混有 饱和溶液 洗气
C 溶液中混有的少量 Fe粉 过滤
D 中混有的少量 — 加热至质量恒定
16.杭州亚运主火炬使用的甲醇燃料,是利用二氧化碳与氢气发生热催化反应合成,实现循环内零碳排放。合成反应:,下列说法错误的是( )。
A.发生还原反应 B.每生成转移电子
C.既是氧化产物又是还原产物 D.还原剂和氧化剂的物质的量之比为
17.实验室制取的有关装置及试剂均正确的是( )。
A.制取 B.除去中的 C.收集 D.吸收尾气中的
18.类比是研究物质性质的常用方法之一。下列类比推测合理的是( )。
A.Fe与化合生成,推测Cu与化合生成
B.已知卤族单质沸点:,推测碱金属单质沸点:Li<Na<K<Rb
C.与KI溶液反应可以置换出,推测与溶液反应可以置换出
D.向固体中滴加几滴水,温度升高,推测向固体中滴加几滴水,温度也升高
19.向溶液中加少量溶液,反应原理如图所示。下列说法错误的是( )。
A.在整个过程中作催化剂 B.生产过程要严格避免混入
C.有生成时,转移电子 D.该反应过程中,M是,M是
20.下列各组实验,根据实验操作和现象得出结论正确的是( )。
选项 实验操作和实验现象 结论
A 用铂丝蘸取溶液,放在火焰上灼烧,未观察到火焰呈紫色 该溶液中不含有
B 向溶液中加入盐酸酸化的溶液,有白色沉淀生成 该溶液中一定含有
C 将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片,鲜花褪色 氯气具有漂白性
D 向饱和碳酸钠溶液中通入足量,溶液变浑浊 析出固体
第Ⅱ卷(共50分)
21.(11分)周末小明同学在家学做家务,他发现居家用品的很多调味品、厨具材料、洗涤用品等都与化学密切相关。他做了仔细观察统计,记录信息如下表。
物品 食醋 料酒 调味盐 鸡蛋 生粉 不锈钢 门窗 洁厕灵
主要成分 醋酸 乙醇 蛋白质(外壳) 淀粉 铁合金 铝合金 盐酸
回答下列问题:
(1)表格中的“主要成分”的物质属于电解质的是__________(任填两种化学式)。
(2)做咸蛋时用食醋先浸泡鸡蛋一段时间,有气泡产生,离子反应方程式为__________=== ____________________。
(3)铝合金可做门窗主要是利用了其质量轻及__________的性能(填一种)。
(4)劳动时不小心把洁厕灵喷洒到不锈钢上,铁与盐酸反应方程式为__________。
(5)食醋标签注明醋酸含量,则__________(保留2位有效数字)。
(6)国家规定碘缺乏地区食盐中应添加适量,设计实验检验调味盐里是否添加了,完善反应方程式__________+______,取反应后溶液,滴加__________,则证明有添加。
22.(10分)2019年是化学元素周期表问世150周年,联合国宣布此年为“国际化学元素周期表年”。元素周期表在学习、研究中有很重要的作用。下表是元素周期表的一部分。
族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 a b
3 c d e f g
(1)e的元素符号是__________。
(2)f、g的最高价氧化物对应的水化物中,酸性较强的物质的化学式是__________。
(3)c的金属性强于d的金属性,据原子结构解释原因:__________。
(4)下列说法正确的是__________(填序号)。
①最简单氢化物的稳定性:a>f ②单质a比单质b难与氢气反应
⑧a的最高正价和最低负价绝对值相等 ④a、g的最简单氢化物化合形成共价化合物
(5)价类二维图是归纳整理元素化合物知识好工具。与e同主族的元素h广泛存在于大气、地壳和生物体中,由它组成的有机物是生命之本。在下图中相应位置写出h的不同类型化合物的化学式(任意3个合理答案即可)。
CO(例)
0
氢化物 单质 氧化物 含氧酸 盐
23.(14分)小组同学制备,并探究其性质。
Ⅰ.制备:
(1)A装置中装的仪器名称为__________,C中试剂为__________。
(2)若装置的连接顺序为A→C→B,制得的不纯,正确的连接应为a→____→____→____→____→____(装置可重复使用)。
Ⅱ.性质实验:
(3)取少量产品于试管中,加足量水,振荡,产生气体、无固体残留,与水反应方程式为__________。
(4)取反应后的溶液,分两等份于两支试管中进行下列实验
试管 添加试剂 现象结论
甲 滴加几滴酚酞 先__________,后褪色
乙 加少量、向试管内伸入带火星木条 能使带火星木条复燃,产生气体是__________(填化学式)。
查阅资料:过氧化钠与水反应的过程中可能存在以下两个反应:
ⅰ.
ⅱ.
结论:与水反应可能生成“中间”产物有__________(填化学式)。
关于ⅰ、ⅱ中的反应及相关物质说法正确的是__________。
A.两个反应是氧化还原反应
B.含极性共价键
C.,、都具有强氧化性
D.与水反应不是一步完成的
(5)在生产生活中的一种应用为__________。
24.(15分)
Ⅰ.七水合硫酸亚铁是一种重要的食品或饲料添加剂,也是颜料及电子工业的原材料。某同学利用工业烧渣(含有、、)采用下图所示流程来模拟制备七水合硫酸亚铁。
回答下列问题:
(1)“滤渣”主要成分的名称是__________,被还原的离子方程式__________。
(2)若检验,取溶液中滴加溶液,产生的现象是__________。
此过程涉及反应的化学方程式为,__________。
Ⅱ.流程需要溶液,若由你配制所需溶液,回答下列问题:
硫酸 化学纯(CP级) 品名:硫酸 化学式: 相对分子质量:98 密度: 质量分数:98%
(3)实验中除量筒、烧杯、玻璃棒、胶头滴管外,还需要的主要仪器有:__________。
(4)计算所需浓硫酸的体积约为__________mL(精确到)。
(5)在量取浓硫酸后,进行了下列操作:
①等稀释的硫酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线时,改用胶头滴管加蒸馏水,使溶液的凹液面与瓶颈的刻度线相切。
③将量取的浓硫酸稀释。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是__________(填序号)。
(6)下列操作会引起所配溶液浓度偏大的是__________(填字母)。
A.定容时仰视刻度线
B.容量瓶中原来有少量蒸馏水
C.用量筒量取浓硫酸时,仰视量筒的刻度
D.向容量瓶中转移溶液时,有少量液体溅出
Ⅲ.(7)产品(摩尔质量为)纯度测定:取a g样品,配成溶液,量取待测液于锥形瓶中,加入酸性溶液至恰好完全反应,消耗溶液体积为b mL,纯度为__________。
高一化学试卷参考答案及评分细则
Ⅰ卷 单项选择题(1~15题,每题2分;16~20题,每题4分,共50分)
1 2 3 4 5 6 7 8 9 10
C C B C D D A B C C
11 12 13 14 15 16 17 18 19 20
A B A D D B C A D D
Ⅱ卷(共50分)
21.(12分)
(1)、、、(任填两种物质即可得满分2分),
(2)(反应物产物均正确1分,配平1分,共2分),
(3)硬度大(1分,其他不给分)
(4)(完全正确2分,其他不给分)
(5)0.58(2分,数据正确有效数字不符合要求给1分)
(6)(答到给1分,配平1分,共2分),滴加几滴淀粉溶液,出现蓝色(1分,试剂与现象都正确才给分)
22.(10分)
(1)Si(2分)
(2)(2分,若答高氯酸给1分)
(3)c、d电子层相同,c的核电荷数小1分,原子半径更大1分(共2分)。
(4)①②(2分,漏答扣1分,选错倒扣1分,扣完为止)
(5)(2分,写出3个合理答案即可得满分,写出2个1分,氢化物、含氧酸、盐合理答案都可给分,有错不扣分)
CO(例)
0
氢化物 单质 氧化物 含氧酸 盐
23.(13分)
Ⅰ.(1)分液漏斗(1分) 浓硫酸(1分)
(2)a→b→c→d→e→b(2分,其他都不给分)
Ⅱ.(3)(反应物、产物、气体符号均正确1分,配平1分,其他正确仅漏气体符号扣1分,共2分)
(4)变红(1分),(1分),、(每个1分,2分),CD(2分,漏答扣1分,选错倒扣1分,扣完为止)
(5)作供氧剂或漂白剂(任意答一点合理即给分,1分)
24.(共15分)
Ⅰ.(1)二氧化硅(1分),(完全正确1分,其他不给分)
(2)生成白色絮状沉淀迅速变成灰绿色(1分),过一段时间后变为红褐色沉淀(1分)(共2分)
(反应物产物均正确1分,配平1分,共2分)
Ⅱ.(3)容量瓶(完全正确1分,其他不给分)
(4)13.6(2分)
(5)③①④②(完全正确2分,其他不给分)
(6)c(2分)
Ⅲ.(7)%(2分),(2分)
同课章节目录
