宁夏固原市2023-2024学年高二上学期期末质量监测化学试题(含答案)
文档属性
| 名称 | 宁夏固原市2023-2024学年高二上学期期末质量监测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-26 23:20:04 | ||
图片预览



文档简介
固原市2023-2024学年高二上学期期末质量监测
化学试卷
可能用到的相对原子质量:H 1 B 11 C 12 N 14 O 16 Na 23
一、选择题:本题包括14小题。每小题3分,共42分,在每小题给出的四个选项中,只有一个选项符合题意。
1.自热火锅由于其加热方便快捷,深受人们的喜爱。其原理是发热包中的氧化钙与水发生了放热反应。下列属于放热反应的是( )
A.盐的水解反应 B.酸碱中和反应
C.碳酸钙高温分解 D.晶体与晶体反应
2.下列消毒剂属于强电解质的是( )
A.高锰酸钾 B.二氧化氯 C.酒精 D.过氧化氢
3.人们可通过改变条件来调控化学反应的速率与限度,使其向着对人类更有益的方向发展。下列条件的改变不是从化学反应速率与限度的角度考虑的是( )
A.橡胶轮胎中加入防老剂 B.燃煤中加入CaO
C.汽车排气管中使用三元催化器 D.工业合成氨不断移去液氨
4.下列相关事实不能用勒夏特列原理解释的是( )
A.增大压强能提高合成氨的产率 B.升高温度,水的离子积常数增大
C.加入能加快分解放出 D.大部分盐类水解符合“越稀越水解”的规律
5.理论研究表明,在101kPa和298K下,异构化反应过程的能量变化如图所示。下列说法错误的是( )
A.HCN比HNC稳定 B.该异构化反应的
C.使用催化剂,可以改变反应的反应热 D.正反应的活化能大于逆反应的活化能
6.由金红石制取单质钛过程中涉及的步骤为:,已知:
则反应的等于( )
A. B.
C. D.
7.下列溶液一定呈碱性的是( )
A.的溶液 B.能够和盐酸反应的溶液
C.的溶液 D.滴加酚酞显无色的溶液
8.常温下,对于的氨水,下列说法正确的是( )
A.加入稀氨水,的电离平衡向右移动,增大
B.加入少量NaOH固体,的电离度减小,溶液的pH增大
C.加水稀释后,溶液中减小
D.通入少量HCl气体后,的电离平衡常数减小
9.一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中正确的是( )
A.a、b、c三点醋酸的电离程度:
B.a、b、c三点醋酸电离平衡常数:
C.a、b、c三点溶液中的
D.a、b、c三点溶液用氢氧化钠溶液中和,消耗氢氧化钠溶液体积:
10.有pH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是( )
A.在三种酸HX、HY、HZ中以HX酸性相对最强
B.中和1 mol HY酸,需要的NaOH稍小于1mol
C.在、、三者中,以最易发生水解
D.HX、HY、HZ三者均为弱酸
11.已知,。一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器,反应10min,测得Y的物质的量为2.4mol。下列说法正确的是( )
A.10min内,消耗0.1molX,生成0.2molZ
B.10min内,Y的平均反应速率为
C.第10min时,X的反应速率为
D.10min内,X和Y反应放出的热量为a kJ
12.在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
A. B.
C. D.
13.用下列实验装置进行相应实验,能达到实验目的的是( )
A。甲探究温度对平衡的影响
B.乙测定中和反应的反应热
C.丙给酸式滴定管排气泡
D.丁测定化学反应速率
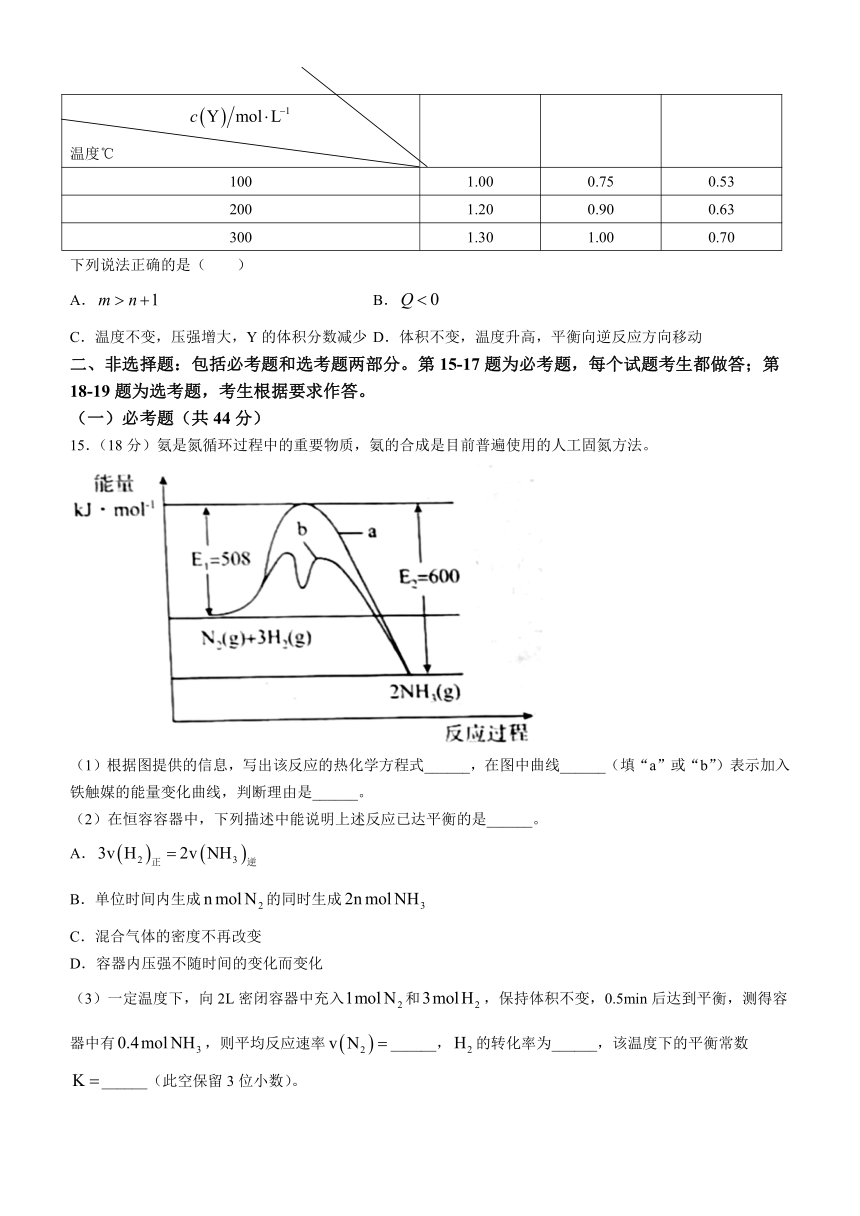
14.在容积可变的密闭容器中通入一定量的X,发生反应:,。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如表所示:
容器体积/L 温度℃ 1 2 4
100 1.00 0.75 0.53
200 1.20 0.90 0.63
300 1.30 1.00 0.70
下列说法正确的是( )
A. B.
C.温度不变,压强增大,Y的体积分数减少 D.体积不变,温度升高,平衡向逆反应方向移动
二、非选择题:包括必考题和选考题两部分。第15-17题为必考题,每个试题考生都做答;第18-19题为选考题,考生根据要求作答。
(一)必考题(共44分)
15.(18分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图提供的信息,写出该反应的热化学方程式______,在图中曲线______(填“a”或“b”)表示加入铁触媒的能量变化曲线,判断理由是______。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是______。
A.
B.单位时间内生成的同时生成
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入和,保持体积不变,0.5min后达到平衡,测得容器中有,则平均反应速率______,的转化率为______,该温度下的平衡常数______(此空保留3位小数)。
(4)保持温度和体积不变,向上述平衡体系中再加入、、后该反应的速率大小关系为______(填“大于”、“小于”或“等于”)。
(5)反应 ,在下列温度下反应能自发进行的是______。
A.25℃ B.125℃ C.225℃ D.325℃
16.(14分)如图是用的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
(1)仪器A的名称是______,使用前应______。
(2)盐酸的体积读数:滴定后读数为______mL。
(3)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的平均浓度是______mol/L。(保留4位小数)
实验序 待测NaOH溶液的体积 HCl溶液的体积/mL
号 /mL 滴定前刻度 滴定后刻度
1 25.00 0.00 26.11
2 25.00 1.56 31.30
3 25.00 0.22 26.31
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCI溶液注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCI溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是______(用序号字母填写)。
(5)判断到达滴定终点的实验现象是:______。
(6)下列哪些操作会使测定结果偏高(填序号)______。
A.锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定
B.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
C.滴定前平视滴定管读数,滴定后俯视滴定管读数
D.酸式滴定管在滴定前有气泡,滴定后气泡消失
17.(12分)乙酸、碳酸、次氯酸、草酸在生产、生活及医药方面有广泛用途。回答下列问题:
Ⅰ.已知25℃时,、、HClO和的电离平衡常数如下:
化学式 HClO
电离平衡常数(Ka)
(1)的下列四种溶液,pH由小到大的顺序是______(填标号)。
A. B. C.NaClO D.
(2)的溶液中,结合数据用化学用语解释原因______。
(3)向NaClO溶液中通入少量,反应的离子方程式为______。
(4)向NaClO溶液中分别加入下列物质,能增大的是______(填标号)。
A. B. C. D.NaOH
Ⅱ.乙二酸俗称草酸,在实验研究和化学工业中应用广泛。
室温下,测得溶液的,草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
(5)向草酸溶液中滴加KOH溶液至时发生的主要反应的离子方程式是______。
(6)溶液中,下列粒子浓度关系正确的是______(填序号)。
a.
b.
c.
(二)选考题:共14分。请考生从18-19题中任选一题作答。如果多做,则按所做的第一题计分。
18.(14分)依据氧化还原反应:设计的原电池如图所示,请回答下列问题:
(1)电极X的材料是______;电解质溶液Y是______。
(2)X电极上发生的电极反应为______。
(3)银电极为电池的______极,发生的电极反应为______。
(4)外电路中的电子是从______电极流向______电极(每空1分)。
(5)盐桥中的______(填“阳离子”或“阴离子”)应该移向溶液。
19.(14分)根据所学化学知识回答下列问题:
(1)基态Cr原子的价电子排布式为______;基态S原子电子占据最高能级的电子云轮廓图为______形(每空1分)。
(2)稳定性:______(填“>”或“<”)。
(3)水是生命之源,通常水加热至100℃时变为水蒸气,破坏的粒子间的相互作用包含______,加热至2000℃会缓慢分解为和时破坏的粒子间的相互作用是______。
(4)硼砂中阴离子(含B、O、H三种元素)的球棍模型如图所示,则在中,2号硼原子的杂化类型为______;4号硼原子是否参与形成配位键?______(填“是”或“否”)。
(5)和过量NaF作用可生成,的空间结构为______。
固原市2023-2024学年高二上学期期末质量监测
化学试题参考答案
一、选择题:每小题3分,共42分。
1-5:BABCC 6-10:DCBCB 11-14:BDAC
二、非选择题
15.(18分,每空2分)
(1) ;b;
使用催化剂,降低活化能
(2)BD (3);20%;0.058
(4)小于 (5)CD
16.(14分,每空2分)
(1)酸式滴定管;查漏 (2)22.80 (3)0.1044 (4)BDCEAF
(5)当溶液颜色由粉红色变为无色,且半分钟内不变色 (6)BD
17.(12分,每空2分)
(1)D(2)的电离常数为,其水解常数:,的水解程度大其程度,因此溶液中(没数据计算的,得1分)
(3)
(4)A (5) (6)be
18.(14分,除标注外,每空2分)
(1)Cu;硝酸银溶液 (2) (3)正;
(4)Cu(1分);Ag(1分) (5)阴离子
19.(14分,除标注外,每空2分)
(1)(1分);哑铃(1分) (2)<
(3)氢键、范德华力;共价键 (4)杂化;是
(5)正四面体形
化学试卷
可能用到的相对原子质量:H 1 B 11 C 12 N 14 O 16 Na 23
一、选择题:本题包括14小题。每小题3分,共42分,在每小题给出的四个选项中,只有一个选项符合题意。
1.自热火锅由于其加热方便快捷,深受人们的喜爱。其原理是发热包中的氧化钙与水发生了放热反应。下列属于放热反应的是( )
A.盐的水解反应 B.酸碱中和反应
C.碳酸钙高温分解 D.晶体与晶体反应
2.下列消毒剂属于强电解质的是( )
A.高锰酸钾 B.二氧化氯 C.酒精 D.过氧化氢
3.人们可通过改变条件来调控化学反应的速率与限度,使其向着对人类更有益的方向发展。下列条件的改变不是从化学反应速率与限度的角度考虑的是( )
A.橡胶轮胎中加入防老剂 B.燃煤中加入CaO
C.汽车排气管中使用三元催化器 D.工业合成氨不断移去液氨
4.下列相关事实不能用勒夏特列原理解释的是( )
A.增大压强能提高合成氨的产率 B.升高温度,水的离子积常数增大
C.加入能加快分解放出 D.大部分盐类水解符合“越稀越水解”的规律
5.理论研究表明,在101kPa和298K下,异构化反应过程的能量变化如图所示。下列说法错误的是( )
A.HCN比HNC稳定 B.该异构化反应的
C.使用催化剂,可以改变反应的反应热 D.正反应的活化能大于逆反应的活化能
6.由金红石制取单质钛过程中涉及的步骤为:,已知:
则反应的等于( )
A. B.
C. D.
7.下列溶液一定呈碱性的是( )
A.的溶液 B.能够和盐酸反应的溶液
C.的溶液 D.滴加酚酞显无色的溶液
8.常温下,对于的氨水,下列说法正确的是( )
A.加入稀氨水,的电离平衡向右移动,增大
B.加入少量NaOH固体,的电离度减小,溶液的pH增大
C.加水稀释后,溶液中减小
D.通入少量HCl气体后,的电离平衡常数减小
9.一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中正确的是( )
A.a、b、c三点醋酸的电离程度:
B.a、b、c三点醋酸电离平衡常数:
C.a、b、c三点溶液中的
D.a、b、c三点溶液用氢氧化钠溶液中和,消耗氢氧化钠溶液体积:
10.有pH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是( )
A.在三种酸HX、HY、HZ中以HX酸性相对最强
B.中和1 mol HY酸,需要的NaOH稍小于1mol
C.在、、三者中,以最易发生水解
D.HX、HY、HZ三者均为弱酸
11.已知,。一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器,反应10min,测得Y的物质的量为2.4mol。下列说法正确的是( )
A.10min内,消耗0.1molX,生成0.2molZ
B.10min内,Y的平均反应速率为
C.第10min时,X的反应速率为
D.10min内,X和Y反应放出的热量为a kJ
12.在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
A. B.
C. D.
13.用下列实验装置进行相应实验,能达到实验目的的是( )
A。甲探究温度对平衡的影响
B.乙测定中和反应的反应热
C.丙给酸式滴定管排气泡
D.丁测定化学反应速率
14.在容积可变的密闭容器中通入一定量的X,发生反应:,。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如表所示:
容器体积/L 温度℃ 1 2 4
100 1.00 0.75 0.53
200 1.20 0.90 0.63
300 1.30 1.00 0.70
下列说法正确的是( )
A. B.
C.温度不变,压强增大,Y的体积分数减少 D.体积不变,温度升高,平衡向逆反应方向移动
二、非选择题:包括必考题和选考题两部分。第15-17题为必考题,每个试题考生都做答;第18-19题为选考题,考生根据要求作答。
(一)必考题(共44分)
15.(18分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图提供的信息,写出该反应的热化学方程式______,在图中曲线______(填“a”或“b”)表示加入铁触媒的能量变化曲线,判断理由是______。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是______。
A.
B.单位时间内生成的同时生成
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入和,保持体积不变,0.5min后达到平衡,测得容器中有,则平均反应速率______,的转化率为______,该温度下的平衡常数______(此空保留3位小数)。
(4)保持温度和体积不变,向上述平衡体系中再加入、、后该反应的速率大小关系为______(填“大于”、“小于”或“等于”)。
(5)反应 ,在下列温度下反应能自发进行的是______。
A.25℃ B.125℃ C.225℃ D.325℃
16.(14分)如图是用的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
(1)仪器A的名称是______,使用前应______。
(2)盐酸的体积读数:滴定后读数为______mL。
(3)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的平均浓度是______mol/L。(保留4位小数)
实验序 待测NaOH溶液的体积 HCl溶液的体积/mL
号 /mL 滴定前刻度 滴定后刻度
1 25.00 0.00 26.11
2 25.00 1.56 31.30
3 25.00 0.22 26.31
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCI溶液注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCI溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是______(用序号字母填写)。
(5)判断到达滴定终点的实验现象是:______。
(6)下列哪些操作会使测定结果偏高(填序号)______。
A.锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定
B.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
C.滴定前平视滴定管读数,滴定后俯视滴定管读数
D.酸式滴定管在滴定前有气泡,滴定后气泡消失
17.(12分)乙酸、碳酸、次氯酸、草酸在生产、生活及医药方面有广泛用途。回答下列问题:
Ⅰ.已知25℃时,、、HClO和的电离平衡常数如下:
化学式 HClO
电离平衡常数(Ka)
(1)的下列四种溶液,pH由小到大的顺序是______(填标号)。
A. B. C.NaClO D.
(2)的溶液中,结合数据用化学用语解释原因______。
(3)向NaClO溶液中通入少量,反应的离子方程式为______。
(4)向NaClO溶液中分别加入下列物质,能增大的是______(填标号)。
A. B. C. D.NaOH
Ⅱ.乙二酸俗称草酸,在实验研究和化学工业中应用广泛。
室温下,测得溶液的,草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
(5)向草酸溶液中滴加KOH溶液至时发生的主要反应的离子方程式是______。
(6)溶液中,下列粒子浓度关系正确的是______(填序号)。
a.
b.
c.
(二)选考题:共14分。请考生从18-19题中任选一题作答。如果多做,则按所做的第一题计分。
18.(14分)依据氧化还原反应:设计的原电池如图所示,请回答下列问题:
(1)电极X的材料是______;电解质溶液Y是______。
(2)X电极上发生的电极反应为______。
(3)银电极为电池的______极,发生的电极反应为______。
(4)外电路中的电子是从______电极流向______电极(每空1分)。
(5)盐桥中的______(填“阳离子”或“阴离子”)应该移向溶液。
19.(14分)根据所学化学知识回答下列问题:
(1)基态Cr原子的价电子排布式为______;基态S原子电子占据最高能级的电子云轮廓图为______形(每空1分)。
(2)稳定性:______(填“>”或“<”)。
(3)水是生命之源,通常水加热至100℃时变为水蒸气,破坏的粒子间的相互作用包含______,加热至2000℃会缓慢分解为和时破坏的粒子间的相互作用是______。
(4)硼砂中阴离子(含B、O、H三种元素)的球棍模型如图所示,则在中,2号硼原子的杂化类型为______;4号硼原子是否参与形成配位键?______(填“是”或“否”)。
(5)和过量NaF作用可生成,的空间结构为______。
固原市2023-2024学年高二上学期期末质量监测
化学试题参考答案
一、选择题:每小题3分,共42分。
1-5:BABCC 6-10:DCBCB 11-14:BDAC
二、非选择题
15.(18分,每空2分)
(1) ;b;
使用催化剂,降低活化能
(2)BD (3);20%;0.058
(4)小于 (5)CD
16.(14分,每空2分)
(1)酸式滴定管;查漏 (2)22.80 (3)0.1044 (4)BDCEAF
(5)当溶液颜色由粉红色变为无色,且半分钟内不变色 (6)BD
17.(12分,每空2分)
(1)D
(3)
(4)A (5) (6)be
18.(14分,除标注外,每空2分)
(1)Cu;硝酸银溶液 (2) (3)正;
(4)Cu(1分);Ag(1分) (5)阴离子
19.(14分,除标注外,每空2分)
(1)(1分);哑铃(1分) (2)<
(3)氢键、范德华力;共价键 (4)杂化;是
(5)正四面体形
同课章节目录
