陕西省榆林市2023-2024学年高二上学期1月过程性评价质量检测(期末考试)化学试题(含答案)
文档属性
| 名称 | 陕西省榆林市2023-2024学年高二上学期1月过程性评价质量检测(期末考试)化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-27 00:00:00 | ||
图片预览




文档简介
榆林市2023~2024学年度第一学期普通高中过程性评价质量检测
高二年级化学试题
注意事项:
1.本试题共8页,满分100分,时间75分钟。
2.答卷前,考生务必将自己的姓名和准考证号填写在答题卡上。
3.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
4.考试结束后,监考员将答题卡按顺序收回,装袋整理;试题不回收。
可能用到的相对原子质量:Li-7 O-16 F-19 Si-28 S-32 Cl-35.5 Br-80 I-127
第Ⅰ卷(选择题 共45分)
一、选择题(本大题共15小题,每小题3分,计45分。每小题只有一个选项是符合题意的)
1.化学与人类生产、生活密切相关。下列描述不涉及盐类水解的是( )
A.明矾净水 B.氯化铵溶液除铁锈
C.小苏打中和胃酸 D.草木灰去油污
2.25℃时,下列溶液中水的电离程度最小的是( )
A.溶液 B.pH=12的氨水
C.溶液 D.0.1mo/L盐酸
3.下列化学用语表述正确的是( )
A.基态N原子的核外电子排布图:
B.的VSEPR模型:
C.基态钠原子最外层电子占据的原子轨道的形状:
D.用电子云轮廓图表示H-Cl的s-pσ键:
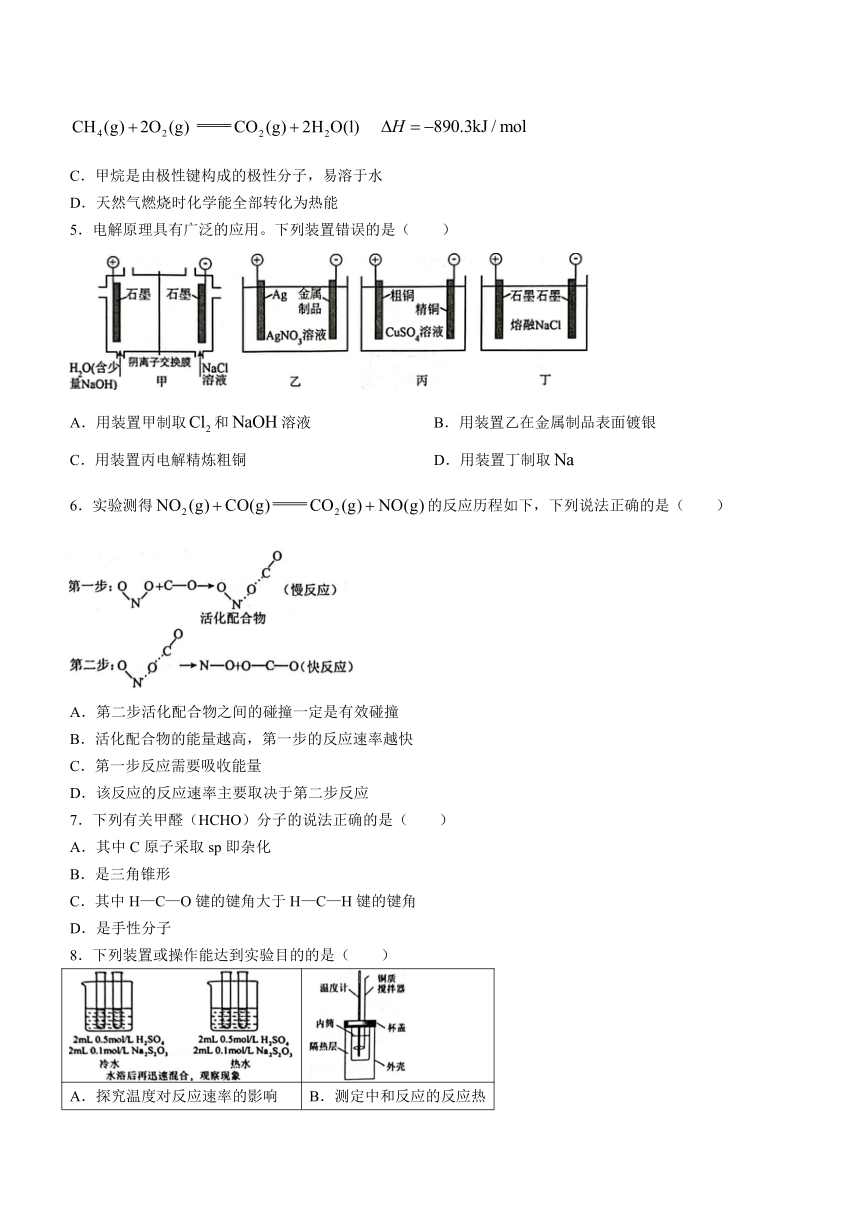
4.《天工开物 作咸》中记载了天然气的开发和利用,“西川有火井……以长竹剖开去节,合缝漆布,一头插入井底,其上曲接,以口紧对釜脐,注卤水釜中,只见火意烘烘,水即滚沸”。下列说法正确的是( )
A.已知,,C—H、H—H键的键能分别为、,则健的键能为
B.甲烷的燃烧热为,则甲烷燃烧的热化学方程式可表示为:
C.甲烷是由极性键构成的极性分子,易溶于水
D.天然气燃烧时化学能全部转化为热能
5.电解原理具有广泛的应用。下列装置错误的是( )
A.用装置甲制取和溶液 B.用装置乙在金属制品表面镀银
C.用装置丙电解精炼粗铜 D.用装置丁制取
6.实验测得的反应历程如下,下列说法正确的是( )
A.第二步活化配合物之间的碰撞一定是有效碰撞
B.活化配合物的能量越高,第一步的反应速率越快
C.第一步反应需要吸收能量
D.该反应的反应速率主要取决于第二步反应
7.下列有关甲醛(HCHO)分子的说法正确的是( )
A.其中C原子采取sp即杂化
B.是三角锥形
C.其中H—C—O键的键角大于H—C—H键的键角
D.是手性分子
8.下列装置或操作能达到实验目的的是( )
A.探究温度对反应速率的影响 B.测定中和反应的反应热
C.证明AgI比AgCl更难溶 D.保护钢管柱不被腐蚀
9.恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)加入和,进行反应。下列叙述正确的是( )
A.其他条件不变,将图示容器换成绝热容器,B的平衡转化率会增大
B.混合气体的密度不再改变时,反应达到平衡状态
C.若反应达到平衡后,拔去活栓,再充入适量(不参与反应),平衡逆向移动
D.其他条件不变,起始时将活塞下移,反应物中活化分子百分数增大
10.设为阿伏加德罗常数的值。下列说法正确的是( )
A.25℃时,的溶液中含有的数目为
B.标准状况下,中含有的键数目为
C.与充分反应得到的气体分子数为
D.将含有个的溶液完全蒸干,可得到
11.一定条件下,在容积为的密闭容器中,发生反应,在不同温度下甲醇的物质的量随时间的变化如图所示。下列叙述正确的是( )
A.平行常数
B.300℃时,加入催化剂,甲醇的平衡浓度不变
C.在其他条件不变的情况下,将处于点体系的容积压缩到原来的一半,氢气的浓度减小
D.500℃时,从反应开始到平衡,氢气的平均反应速率
12.下列物质的结构或性质及其解释均正确的是( )
选项 物质的结构或性质 解释
A 极性: 元素和元素的电负性差值大于元素和元素的电负性差值
B 沸点:对羟基苯甲醛>邻羟基苯甲醛 对羟基苯甲醇分子间范德华力更强
C 在水中的溶解度比在中的溶解度更大 是弱极性分子
D 电子云半径3s>1s 3s电子能量高,在离核更远的区域出现的概率大
13.X、Y、Z、Q、R是元素周期表前四周期元素,且原子序数依次增大;X原子核外有6种不同运动状态的电子;Y原子的最外层电子数比次外层电子数多3个;基态Z原子的L能层成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是( )
A.的价电子排布式为 B.电负性:X>Y>Z
C.最简单氢化物的稳定性:Y>Q D.X的氢化物中只含有σ键
14.测定溶液先升温再降温过程中的pH,数据如下表:
时刻 ① ② ③ ④
温度/℃ 25 30 40 25
pH 9.66 9.52 9.37 9.2
实验过程中,取①、④时刻的溶液,加入盐酸酸化的溶液做对比实验,④产生白色沉淀多。下列说法错误的是( )
A.①与④的值相等
B.④产生的白色沉淀是
C.④的pH与①不同,是由于浓度减小造成的
D.①→③的过程中,温度对水解平衡的影响比的影响更大
15.秦俑彩绘中含有难溶的和,常温下,和达到沉淀溶解平衡时,阳离子浓度的负对数(pM)与阴离子浓度的负对数(pR)的关系如图所示,下列说法正确的是( )
A.代表的是沉淀溶解平衡曲线
B.反应的化学平衡常数
C.向点对应溶液中加入对应阴离子的固态钠盐,点向点移动
D.向点对应溶液中加入,无法继续溶解
第Ⅱ卷(非选择题 共55分)
二、非选择题(本大题共4小题,计55分)
16.(12分)明代科学家宋应星在《天工开物》中写道:“凡玉入中国,贵者尽出于田、葱岭”。和田玉的主要化学成分是含水的钙镁硅酸盐。回答下列问题:
(1)某同学所画基态镁原子的核外电子排布图为,该电子排布图违背了______。
(2)四种元素的第一电离能由大到小的顺序是______;的空间结构是______。
(3)Ca元素位于元素周期表中的______区,的前三级电离能数据依次为,第三电离能增大较多的原因是______。
(4)硅与碳同族,键能:C-H______(填“大于”或“小于”)。
(5)硅元素与碳元素同主族,硅元素和卤素单质反应可以得到的熔、沸点如下表所示:
化合物
熔点 183.0 203.2 278.6 393.7
沸点 187.2 330.8 427.2 560.7
20℃时,呈液态的是______(填化学式),熔、沸点依次升高的原因是______。
17.(13分)自重轻、体积小、容量大、使用安全、环保是新型电池的典型特点,回答下列问题:
(1)空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,原理如图1所示:
气体X的化学式为______,c极上发生的电极反应式为______。
(2)我国“神舟”飞船返回舱使用的是银锌蓄电池组,其工作原理为:。电池放电时负极质量______(填“增大”、“减小”或“不变”,下同),在电池使用的过程中,电解质溶液中KOH的物质的量浓度将______,写出充电时阳极的电极反应式______。
(3)非水系锂氧()电池因其高能量密度而成为一种有前景的先进电池技术,其放电电池示意图及正极示意图分别为图2和图3,隔膜a只允许通过。
①放电时,电池的总反应为______;电解液a不选用LiCl水溶液的原因可能是______。
②不考虑其他副反应,放电时,若负极质量减少7g,则正极质量增加______g(假设生成的不溶物全覆盖在电极表面,生成的可溶物全部扩散至电解液中,参与电极反应的物质均过量)。
18.(15分)盐酸和草酸是生活中常见的酸,回答下列问题:
Ⅰ.某学生用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,操作如下:
a.用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
b.固定好滴定管并使滴定管尖嘴处充满液体;
c.调节液面至“0”或“0”刻度线以下,并记下读数;
d.移取20.00L待测液注入洁净的存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
e.用标准液滴定至终点,记下滴定管液面读数。
(1)以上步骤中有错误的是______(填字母)。
(2)该同学将中和滴定原理应用到葡萄酒中抗氧化剂残留量(以游离计算)的测定中:
准确量取100.00L葡萄酒样品,加酸蒸馏出抗氧化剂成分,取馏分于维形瓶中,滴加少量淀粉溶液,用0.0100mo/L标准溶液滴定至终点,重复操作三次,平均消耗标准溶液22.50mL。(已知滴定过程中所发生的反应是)
①滴定前需排放装有标准溶液的滴定管尖嘴处的气泡,其正确的图示为______(填字母)。
A. B. C. D.
②判断达到滴定终点的依据是______;所测100.00mL葡萄酒样品中抗氧化剂的残留量为______mg/L。
Ⅱ.已知常温下的电离平衡常数,某化学小组研究草酸及其盐的性质。
(3)中的杂化类型是______。
(4)常温下,溶液中各离子浓度由大到小的顺序为______。
(5)下列溶液中离子浓度的关系不正确的是______(填字母)。
A.
B.
C.
(6)探究和在溶液中的反应。
【资料】i.三水三草酸合铁酸钾为翠绿色晶体,光照易分解,其水溶液中存在:。
ii.。
进行如下实验:
操作 现象
在避光处,向溶液中缓慢加入溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 得到翠绿色溶液和翠绿色晶体
经检验,上述实验中和未发生氧化还原反应。
取实验中少量晶体洗净,配成溶液波,滴加溶液,不变红,原因是______(结合资料,用必要的化学用语和数据解释原因),继续加入硫酸,溶液变红,说明加入硫酸,与结合使反应平衡______(填“正向”或“逆向”)移动。
(7)设计实验证明草酸的酸性比碳酸强:______。
19.(15分)氢能源是最具应用前景的能源之一。甲烷-水蒸气催化重整制氢(SMR)是一种制高纯氢的方法,其涉及的主要反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)______,反应Ⅱ能在______(填“高温”或“低温”)的条件下自发进行。
(2)某温度下,按照投料比加入密闭容器中发生反应Ⅰ,平衡时的体积分数为,则的转化率为______(填分数);实际生产中反应物投料比小于反应的化学计量数之比,目的是______。
(3)在常压、600℃条件下,向体系中加入适量生石灰后可提高的产率。应用化学平衡移动原理解释原因______。
(4)在T℃、条件下,向恒温恒容密闭容器中充入水蒸气和,发生反应Ⅲ,达平衡时,的转化率为。平衡时,的平衡分压为______,此温度下,该反应的平衡常数______(用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
(5)调整CO和初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:
A、B、C、D、E中温度最高的点是______。
榆林市2023~2024学年度第一学期普通高中过程性评价质量检测
高二年级化学试题参考答案及评分标准
一、选择题(本大题共15小题,每小题3分,计45分。每小题只有一个选项是符合题意的)
1.C 2.D 3.B 4.B
5.A 6.C 7.C 8.A
9.B 10.A 11.B 12.D
13.C 14.D 15.D
二、非选择题(本大题共4小题,计55分)
16.(12分)(1)泡利原理
(2)O>Si>Mg>Ca(2分) 平面三角形
(3)s 钙原子失去2个电子后,核外电子达到稳定结构,再失去1个电子属于内层电子,原子核吸引力更强,所以突然增大(2分)
(4)大于
(5)、(2分) 中不含氢键且分子结构相似,随相对分子质量逐渐增大,分子间作用力逐渐增强(2分)(其余每空1分)
17.(13分)(1)(1分)
(2)增大(1分) 增大(1分)
(3)① 与水剧烈反应,产生易爆的,存在安全隐患(其他合理答案均可)
②23(其余每空2分)
18.(15分)(1)a(1分)
(2)①C(1分)
②滴入最后半滴标准液,溶液由无色恰好变为蓝色,且30s内不褪去 144.00
(3)、(1分)
(4)
(5)A(1分)
(6)的平衡常数,该反应的值极小,所以很难发生 正向(1分)
(7)向盛有少量的试管中滴加草酸溶液,有气泡产生(其余每空2分)
19.(15分)(1)+165.0 高温(1分)
(2) 利用水提高的转化率
(3)加入生石灰,发生反应,二氧化碳浓度降低,总反应平衡正向移动,氢气的产率升高
(4)
(5)B(其余每空2分)
高二年级化学试题
注意事项:
1.本试题共8页,满分100分,时间75分钟。
2.答卷前,考生务必将自己的姓名和准考证号填写在答题卡上。
3.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
4.考试结束后,监考员将答题卡按顺序收回,装袋整理;试题不回收。
可能用到的相对原子质量:Li-7 O-16 F-19 Si-28 S-32 Cl-35.5 Br-80 I-127
第Ⅰ卷(选择题 共45分)
一、选择题(本大题共15小题,每小题3分,计45分。每小题只有一个选项是符合题意的)
1.化学与人类生产、生活密切相关。下列描述不涉及盐类水解的是( )
A.明矾净水 B.氯化铵溶液除铁锈
C.小苏打中和胃酸 D.草木灰去油污
2.25℃时,下列溶液中水的电离程度最小的是( )
A.溶液 B.pH=12的氨水
C.溶液 D.0.1mo/L盐酸
3.下列化学用语表述正确的是( )
A.基态N原子的核外电子排布图:
B.的VSEPR模型:
C.基态钠原子最外层电子占据的原子轨道的形状:
D.用电子云轮廓图表示H-Cl的s-pσ键:
4.《天工开物 作咸》中记载了天然气的开发和利用,“西川有火井……以长竹剖开去节,合缝漆布,一头插入井底,其上曲接,以口紧对釜脐,注卤水釜中,只见火意烘烘,水即滚沸”。下列说法正确的是( )
A.已知,,C—H、H—H键的键能分别为、,则健的键能为
B.甲烷的燃烧热为,则甲烷燃烧的热化学方程式可表示为:
C.甲烷是由极性键构成的极性分子,易溶于水
D.天然气燃烧时化学能全部转化为热能
5.电解原理具有广泛的应用。下列装置错误的是( )
A.用装置甲制取和溶液 B.用装置乙在金属制品表面镀银
C.用装置丙电解精炼粗铜 D.用装置丁制取
6.实验测得的反应历程如下,下列说法正确的是( )
A.第二步活化配合物之间的碰撞一定是有效碰撞
B.活化配合物的能量越高,第一步的反应速率越快
C.第一步反应需要吸收能量
D.该反应的反应速率主要取决于第二步反应
7.下列有关甲醛(HCHO)分子的说法正确的是( )
A.其中C原子采取sp即杂化
B.是三角锥形
C.其中H—C—O键的键角大于H—C—H键的键角
D.是手性分子
8.下列装置或操作能达到实验目的的是( )
A.探究温度对反应速率的影响 B.测定中和反应的反应热
C.证明AgI比AgCl更难溶 D.保护钢管柱不被腐蚀
9.恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)加入和,进行反应。下列叙述正确的是( )
A.其他条件不变,将图示容器换成绝热容器,B的平衡转化率会增大
B.混合气体的密度不再改变时,反应达到平衡状态
C.若反应达到平衡后,拔去活栓,再充入适量(不参与反应),平衡逆向移动
D.其他条件不变,起始时将活塞下移,反应物中活化分子百分数增大
10.设为阿伏加德罗常数的值。下列说法正确的是( )
A.25℃时,的溶液中含有的数目为
B.标准状况下,中含有的键数目为
C.与充分反应得到的气体分子数为
D.将含有个的溶液完全蒸干,可得到
11.一定条件下,在容积为的密闭容器中,发生反应,在不同温度下甲醇的物质的量随时间的变化如图所示。下列叙述正确的是( )
A.平行常数
B.300℃时,加入催化剂,甲醇的平衡浓度不变
C.在其他条件不变的情况下,将处于点体系的容积压缩到原来的一半,氢气的浓度减小
D.500℃时,从反应开始到平衡,氢气的平均反应速率
12.下列物质的结构或性质及其解释均正确的是( )
选项 物质的结构或性质 解释
A 极性: 元素和元素的电负性差值大于元素和元素的电负性差值
B 沸点:对羟基苯甲醛>邻羟基苯甲醛 对羟基苯甲醇分子间范德华力更强
C 在水中的溶解度比在中的溶解度更大 是弱极性分子
D 电子云半径3s>1s 3s电子能量高,在离核更远的区域出现的概率大
13.X、Y、Z、Q、R是元素周期表前四周期元素,且原子序数依次增大;X原子核外有6种不同运动状态的电子;Y原子的最外层电子数比次外层电子数多3个;基态Z原子的L能层成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是( )
A.的价电子排布式为 B.电负性:X>Y>Z
C.最简单氢化物的稳定性:Y>Q D.X的氢化物中只含有σ键
14.测定溶液先升温再降温过程中的pH,数据如下表:
时刻 ① ② ③ ④
温度/℃ 25 30 40 25
pH 9.66 9.52 9.37 9.2
实验过程中,取①、④时刻的溶液,加入盐酸酸化的溶液做对比实验,④产生白色沉淀多。下列说法错误的是( )
A.①与④的值相等
B.④产生的白色沉淀是
C.④的pH与①不同,是由于浓度减小造成的
D.①→③的过程中,温度对水解平衡的影响比的影响更大
15.秦俑彩绘中含有难溶的和,常温下,和达到沉淀溶解平衡时,阳离子浓度的负对数(pM)与阴离子浓度的负对数(pR)的关系如图所示,下列说法正确的是( )
A.代表的是沉淀溶解平衡曲线
B.反应的化学平衡常数
C.向点对应溶液中加入对应阴离子的固态钠盐,点向点移动
D.向点对应溶液中加入,无法继续溶解
第Ⅱ卷(非选择题 共55分)
二、非选择题(本大题共4小题,计55分)
16.(12分)明代科学家宋应星在《天工开物》中写道:“凡玉入中国,贵者尽出于田、葱岭”。和田玉的主要化学成分是含水的钙镁硅酸盐。回答下列问题:
(1)某同学所画基态镁原子的核外电子排布图为,该电子排布图违背了______。
(2)四种元素的第一电离能由大到小的顺序是______;的空间结构是______。
(3)Ca元素位于元素周期表中的______区,的前三级电离能数据依次为,第三电离能增大较多的原因是______。
(4)硅与碳同族,键能:C-H______(填“大于”或“小于”)。
(5)硅元素与碳元素同主族,硅元素和卤素单质反应可以得到的熔、沸点如下表所示:
化合物
熔点 183.0 203.2 278.6 393.7
沸点 187.2 330.8 427.2 560.7
20℃时,呈液态的是______(填化学式),熔、沸点依次升高的原因是______。
17.(13分)自重轻、体积小、容量大、使用安全、环保是新型电池的典型特点,回答下列问题:
(1)空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,原理如图1所示:
气体X的化学式为______,c极上发生的电极反应式为______。
(2)我国“神舟”飞船返回舱使用的是银锌蓄电池组,其工作原理为:。电池放电时负极质量______(填“增大”、“减小”或“不变”,下同),在电池使用的过程中,电解质溶液中KOH的物质的量浓度将______,写出充电时阳极的电极反应式______。
(3)非水系锂氧()电池因其高能量密度而成为一种有前景的先进电池技术,其放电电池示意图及正极示意图分别为图2和图3,隔膜a只允许通过。
①放电时,电池的总反应为______;电解液a不选用LiCl水溶液的原因可能是______。
②不考虑其他副反应,放电时,若负极质量减少7g,则正极质量增加______g(假设生成的不溶物全覆盖在电极表面,生成的可溶物全部扩散至电解液中,参与电极反应的物质均过量)。
18.(15分)盐酸和草酸是生活中常见的酸,回答下列问题:
Ⅰ.某学生用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,操作如下:
a.用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
b.固定好滴定管并使滴定管尖嘴处充满液体;
c.调节液面至“0”或“0”刻度线以下,并记下读数;
d.移取20.00L待测液注入洁净的存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
e.用标准液滴定至终点,记下滴定管液面读数。
(1)以上步骤中有错误的是______(填字母)。
(2)该同学将中和滴定原理应用到葡萄酒中抗氧化剂残留量(以游离计算)的测定中:
准确量取100.00L葡萄酒样品,加酸蒸馏出抗氧化剂成分,取馏分于维形瓶中,滴加少量淀粉溶液,用0.0100mo/L标准溶液滴定至终点,重复操作三次,平均消耗标准溶液22.50mL。(已知滴定过程中所发生的反应是)
①滴定前需排放装有标准溶液的滴定管尖嘴处的气泡,其正确的图示为______(填字母)。
A. B. C. D.
②判断达到滴定终点的依据是______;所测100.00mL葡萄酒样品中抗氧化剂的残留量为______mg/L。
Ⅱ.已知常温下的电离平衡常数,某化学小组研究草酸及其盐的性质。
(3)中的杂化类型是______。
(4)常温下,溶液中各离子浓度由大到小的顺序为______。
(5)下列溶液中离子浓度的关系不正确的是______(填字母)。
A.
B.
C.
(6)探究和在溶液中的反应。
【资料】i.三水三草酸合铁酸钾为翠绿色晶体,光照易分解,其水溶液中存在:。
ii.。
进行如下实验:
操作 现象
在避光处,向溶液中缓慢加入溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 得到翠绿色溶液和翠绿色晶体
经检验,上述实验中和未发生氧化还原反应。
取实验中少量晶体洗净,配成溶液波,滴加溶液,不变红,原因是______(结合资料,用必要的化学用语和数据解释原因),继续加入硫酸,溶液变红,说明加入硫酸,与结合使反应平衡______(填“正向”或“逆向”)移动。
(7)设计实验证明草酸的酸性比碳酸强:______。
19.(15分)氢能源是最具应用前景的能源之一。甲烷-水蒸气催化重整制氢(SMR)是一种制高纯氢的方法,其涉及的主要反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)______,反应Ⅱ能在______(填“高温”或“低温”)的条件下自发进行。
(2)某温度下,按照投料比加入密闭容器中发生反应Ⅰ,平衡时的体积分数为,则的转化率为______(填分数);实际生产中反应物投料比小于反应的化学计量数之比,目的是______。
(3)在常压、600℃条件下,向体系中加入适量生石灰后可提高的产率。应用化学平衡移动原理解释原因______。
(4)在T℃、条件下,向恒温恒容密闭容器中充入水蒸气和,发生反应Ⅲ,达平衡时,的转化率为。平衡时,的平衡分压为______,此温度下,该反应的平衡常数______(用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
(5)调整CO和初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:
A、B、C、D、E中温度最高的点是______。
榆林市2023~2024学年度第一学期普通高中过程性评价质量检测
高二年级化学试题参考答案及评分标准
一、选择题(本大题共15小题,每小题3分,计45分。每小题只有一个选项是符合题意的)
1.C 2.D 3.B 4.B
5.A 6.C 7.C 8.A
9.B 10.A 11.B 12.D
13.C 14.D 15.D
二、非选择题(本大题共4小题,计55分)
16.(12分)(1)泡利原理
(2)O>Si>Mg>Ca(2分) 平面三角形
(3)s 钙原子失去2个电子后,核外电子达到稳定结构,再失去1个电子属于内层电子,原子核吸引力更强,所以突然增大(2分)
(4)大于
(5)、(2分) 中不含氢键且分子结构相似,随相对分子质量逐渐增大,分子间作用力逐渐增强(2分)(其余每空1分)
17.(13分)(1)(1分)
(2)增大(1分) 增大(1分)
(3)① 与水剧烈反应,产生易爆的,存在安全隐患(其他合理答案均可)
②23(其余每空2分)
18.(15分)(1)a(1分)
(2)①C(1分)
②滴入最后半滴标准液,溶液由无色恰好变为蓝色,且30s内不褪去 144.00
(3)、(1分)
(4)
(5)A(1分)
(6)的平衡常数,该反应的值极小,所以很难发生 正向(1分)
(7)向盛有少量的试管中滴加草酸溶液,有气泡产生(其余每空2分)
19.(15分)(1)+165.0 高温(1分)
(2) 利用水提高的转化率
(3)加入生石灰,发生反应,二氧化碳浓度降低,总反应平衡正向移动,氢气的产率升高
(4)
(5)B(其余每空2分)
同课章节目录
