【知识清单】第10单元 酸和碱-2024中考化学总复习-人教版(pdf版)
文档属性
| 名称 | 【知识清单】第10单元 酸和碱-2024中考化学总复习-人教版(pdf版) |  | |
| 格式 | |||
| 文件大小 | 37.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-26 08:59:18 | ||
图片预览




文档简介
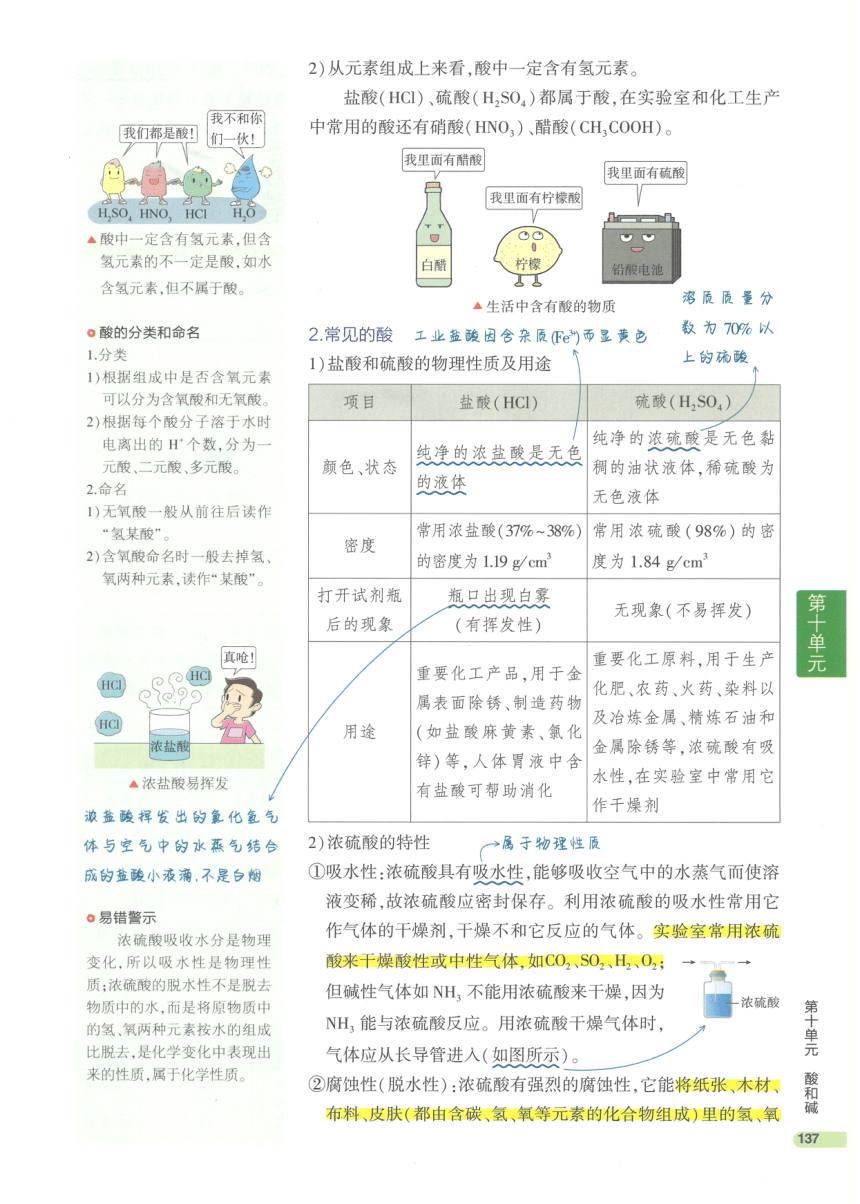
第十单元
酸和碱
①概念
①牍念
在溶液中解离出的阳离子全部是「的北合物
在溶液中解离出的阴离子全部是0H的化合地
②常乳的酸
②常见的威
色、态、宋
重要特性
用途
氨丸化钩为白色固体,易客于水,易潮解
纯净的浓盐酸是
氯乳化钠·俗称背性纳、火威、是威。广泛应用于制取
无色、有剌激性
月于金勇表
肥皂、纺织等工业,生活上用于除油污等。
法酸
气味的液依,工
挥发性
面除锈、钊
业用的虚取含有
造药潮架
氢乳化钙为白色粉末状图体,俗称就石灰
杂沃而显黄色
消石灰。藏溶于水,其水溶液俗称石灰水。
该硫酸为无色
波疏酸具
后于生产化
氨氧化钙
氯栽化每可用于建筑工业,制波尔多液
流酸无味、黏糊、油
有啜水性
把、
农药
状液伤
脱水性
特炼万油
漂白粉,改良酸性土壤等。
(霄但性)金莴除锈等
③碱的通性
注进事项
碱的
浓疏酸韩释时,应将液疵酸沿器壁缓慢注入
通性
金氧化钠
反应
氢氧化钙
类型
水中,并用波璃捧不断搅拌,切勿将水注入
酸破
使紫色石蕊溶液交流:
使于色爵酞溶
浓靡酸中,以免造成液滴飞浅!
指示剂液变红
③酸的道性(以稀盐酸为例)】
与非金
属氧化
CO2+2NaOH
C02+Cw0T2=
①与酸藏指示剂反应
NaCO+H2O
H03↓+H2,0
物反应
使装色石盖溶液变红,不能使元色酚款溶液变色
与酸
NAOH+HCI=
Ca(OH)+2HCI-
复分解
②与活发金属反应
反应
NaCl+H.O
CaCl+2H2Q
反应
7m+2ITC1=ZnCl+H,↑(置换反应)
与某些2Va(0H+5)
Na(:()+Ca(O)Hh
复分解
益反应
lu)Hin↓+Vm)
H(C)3↓+2Na(0H
反应
③与金属兼花物反应
(u(0+2Hc:1=(Ccl+TI20(笈分解反应.)
闻与成反应
溶液酸藏度的表示方法
pH
①pH与酸威性的关系
NaOH+HCl=Nal+H,)(复分-腳反应)
配与某些盐溶液反应
9123A;6了89012134
Na,CO+2HCl=
=2u(1+H0+()2↑(复分解反应
中性
秘件性增磁
酸
pH<7,溶液呈酸性:pH越小,酸性越蛋
中和反应
pH=7,溶液呈中性。
①定义
pH>7,容液里威性pH越大,酸性越蛋。
特指酸与藏作用生成盐知水的反应。
②溶液pH的测定方法
②实质
”一效”“二旅”“三滴
四比
酸中的蔻高子与碱中的盏氧根离子作用生成水分子的过程
注意辛项
①不能直接把试纸浸入待测液中
③验旺实验
②不能先用水将试纸润显再进行测定
5口L深氧减化脑液
③用pH试纸测得溶液的pH一疑为整效。
④中和反应的应用
①阅节土壤的酸藏性。
注意本项
②处理工∫的废水。
中和反应一定生成盐和水.但生成盐和水的反应不一定是中和反应:中
③用干医疗。刘如刻用氢敦北铝
和度应一定是复分解反应,但复分解反应不一定是中和反应:中肚反应
来治疗胃酸过多症等。
是效热反应。
酸和碱
①概念
①牍念
在溶液中解离出的阳离子全部是「的北合物
在溶液中解离出的阴离子全部是0H的化合地
②常乳的酸
②常见的威
色、态、宋
重要特性
用途
氨丸化钩为白色固体,易客于水,易潮解
纯净的浓盐酸是
氯乳化钠·俗称背性纳、火威、是威。广泛应用于制取
无色、有剌激性
月于金勇表
肥皂、纺织等工业,生活上用于除油污等。
法酸
气味的液依,工
挥发性
面除锈、钊
业用的虚取含有
造药潮架
氢乳化钙为白色粉末状图体,俗称就石灰
杂沃而显黄色
消石灰。藏溶于水,其水溶液俗称石灰水。
该硫酸为无色
波疏酸具
后于生产化
氨氧化钙
氯栽化每可用于建筑工业,制波尔多液
流酸无味、黏糊、油
有啜水性
把、
农药
状液伤
脱水性
特炼万油
漂白粉,改良酸性土壤等。
(霄但性)金莴除锈等
③碱的通性
注进事项
碱的
浓疏酸韩释时,应将液疵酸沿器壁缓慢注入
通性
金氧化钠
反应
氢氧化钙
类型
水中,并用波璃捧不断搅拌,切勿将水注入
酸破
使紫色石蕊溶液交流:
使于色爵酞溶
浓靡酸中,以免造成液滴飞浅!
指示剂液变红
③酸的道性(以稀盐酸为例)】
与非金
属氧化
CO2+2NaOH
C02+Cw0T2=
①与酸藏指示剂反应
NaCO+H2O
H03↓+H2,0
物反应
使装色石盖溶液变红,不能使元色酚款溶液变色
与酸
NAOH+HCI=
Ca(OH)+2HCI-
复分解
②与活发金属反应
反应
NaCl+H.O
CaCl+2H2Q
反应
7m+2ITC1=ZnCl+H,↑(置换反应)
与某些2Va(0H+5)
Na(:()+Ca(O)Hh
复分解
益反应
lu)Hin↓+Vm)
H(C)3↓+2Na(0H
反应
③与金属兼花物反应
(u(0+2Hc:1=(Ccl+TI20(笈分解反应.)
闻与成反应
溶液酸藏度的表示方法
pH
①pH与酸威性的关系
NaOH+HCl=Nal+H,)(复分-腳反应)
配与某些盐溶液反应
9123A;6了89012134
Na,CO+2HCl=
=2u(1+H0+()2↑(复分解反应
中性
秘件性增磁
酸
pH<7,溶液呈酸性:pH越小,酸性越蛋
中和反应
pH=7,溶液呈中性。
①定义
pH>7,容液里威性pH越大,酸性越蛋。
特指酸与藏作用生成盐知水的反应。
②溶液pH的测定方法
②实质
”一效”“二旅”“三滴
四比
酸中的蔻高子与碱中的盏氧根离子作用生成水分子的过程
注意辛项
①不能直接把试纸浸入待测液中
③验旺实验
②不能先用水将试纸润显再进行测定
5口L深氧减化脑液
③用pH试纸测得溶液的pH一疑为整效。
④中和反应的应用
①阅节土壤的酸藏性。
注意本项
②处理工∫的废水。
中和反应一定生成盐和水.但生成盐和水的反应不一定是中和反应:中
③用干医疗。刘如刻用氢敦北铝
和度应一定是复分解反应,但复分解反应不一定是中和反应:中肚反应
来治疗胃酸过多症等。
是效热反应。
同课章节目录
