浙江省宁波市慈溪市2023-2024学年高二上学期1月期末测试化学试题(含答案)
文档属性
| 名称 | 浙江省宁波市慈溪市2023-2024学年高二上学期1月期末测试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 338.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-28 11:43:55 | ||
图片预览


文档简介
慈溪市2023学年第一学期高二年级期末测试
化学试题
1.本卷分选择题和非选择题两部分,共8页,共100分,时间90分钟,答案答在答题纸上。
2.可能用到的相对原子质量:
一、选择题(本大题共20小题,1-10每小题2分,11-20每小题3分,共50分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.下列物质属于弱电解质的是
A. B. C. D.
2.下列物质溶于水,呈酸性的是
A. B. C. D.
3.下列化学用语正确的是
A.的电子式: B.的模型:
C.基态锂原子的简化电子排布式: D.的空间填充模型:
4.关于乙炔的说法不正确的是
A.碳原子的价层电子的轨道表示式 ,违反了泡利原理
B.基态碳原子核外共有6个运动状态不同的电子
C.乙炔分子内含极性键、非极性键,是非极性分子
D.乙炔分子中的 原子间采用 杂化轨道形成了一个键和两个键
5.下列各组比较正确的是
A.键能: B.键角:
C.酸性:乙酸 甲酸 D.中的溶解度:
6.下列事实可用氢键解释的是
A.氯气易液化 B.极易溶于水 C.比 稳定 D.比酸性弱
7.下列说法正确的是
A.增大压强,增加了反应物分子中的活化分子的百分数,反应速率增大
B.反应能否自发进行与温度有关,一般高温时影响较大
C.马口铁(镀锡)镀层破损后,镀层先被氧化
D.海水中钢闸门腐蚀主要是发生吸氧腐蚀,其阴极反应式为
8.关于盐酸与溶液反应的反应热测定实验,下列说法不正确的是
A.为了保证完全被中和,采用稍过量的溶液
B.所需的玻璃仪器有烧杯、温度计、玻璃搅拌器、量筒
C.需要测定并记录的实验数据有盐酸的浓度、氢氧化钠溶液的浓度反应后混合溶液的最高温度
D.若用同浓度的醋酸溶液代替盐酸进行上述实验,计算所得反应热偏大
9.某研究小组为探究室温下水溶液体系中的化学反应 的反应物初始浓度、溶液中的始浓度及初始速率间的关系,得到如下数据。
实验编号 的初始浓度 初始浓度 初始浓度 初始速率
1 1.00
2 1.00
3 2.00
4 1.00
已知表中初始反应速率与有关离子浓度关系可以表示为:(温度一定时,为常数)。下列说法不正确的是
A.实验2中,
B.设计实验2和实验4的目的是研究离子浓度对反应速率的影响
C.;;
D.若实验编号4的其它浓度不变,时,反应的初始速率
10.在恒容密闭容器中,将和一定量混合加热反应 ,
平衡后物质的量为,化学平衡常数为0.1。下列说法正确的是
A.的转化率之比为
B.达平衡后的体积分数为
C.升高温度,浓度减小,表明该反应是吸热反应
D.平衡后,再通入,正反应速率逐渐增大
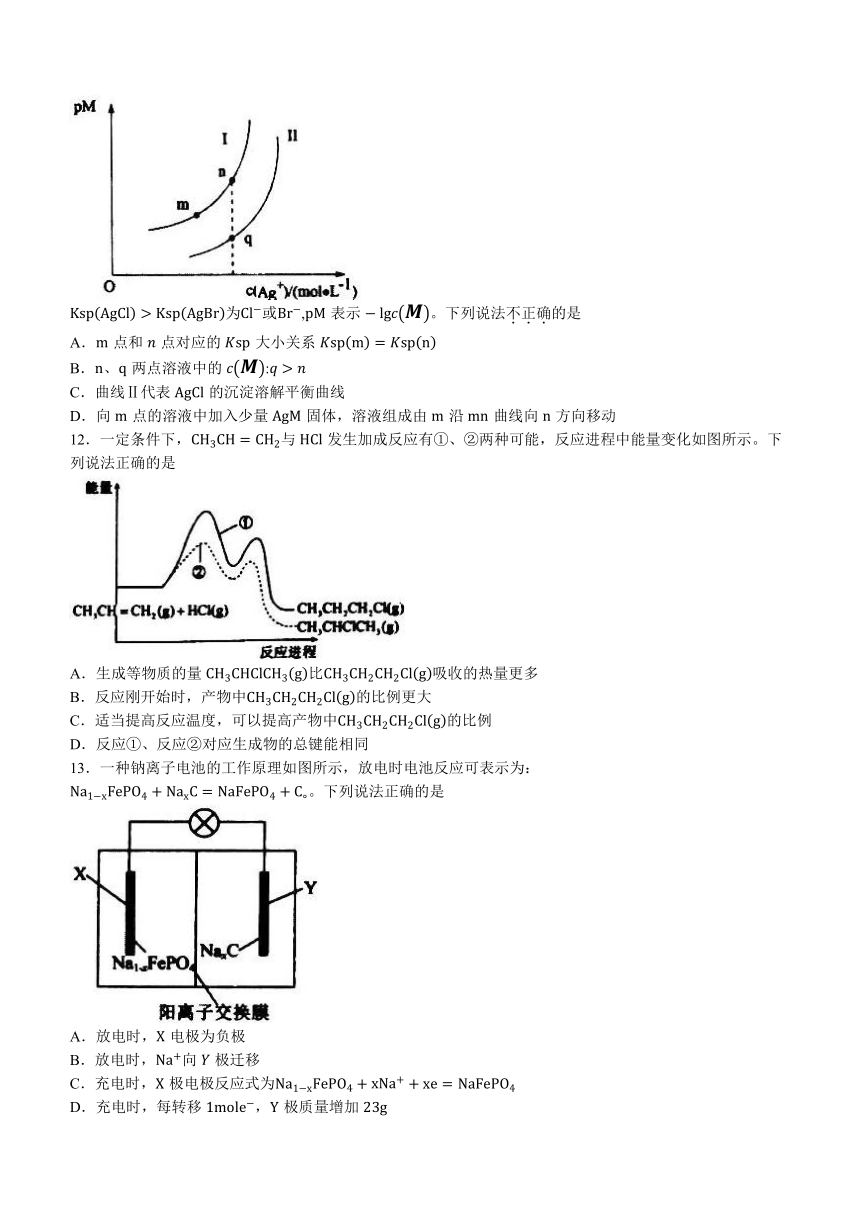
11.氯化银和溴化银常用于制造感光材料。它们在水中的沉淀溶解平衡曲线如图所示。已知:
为或,表示 。下列说法不正确的是
A.点和 点对应的大小关系
B.两点溶液中的 :
C.曲线Ⅱ代表的沉淀溶解平衡曲线
D.向点的溶液中加入少量固体,溶液组成由沿曲线向方向移动
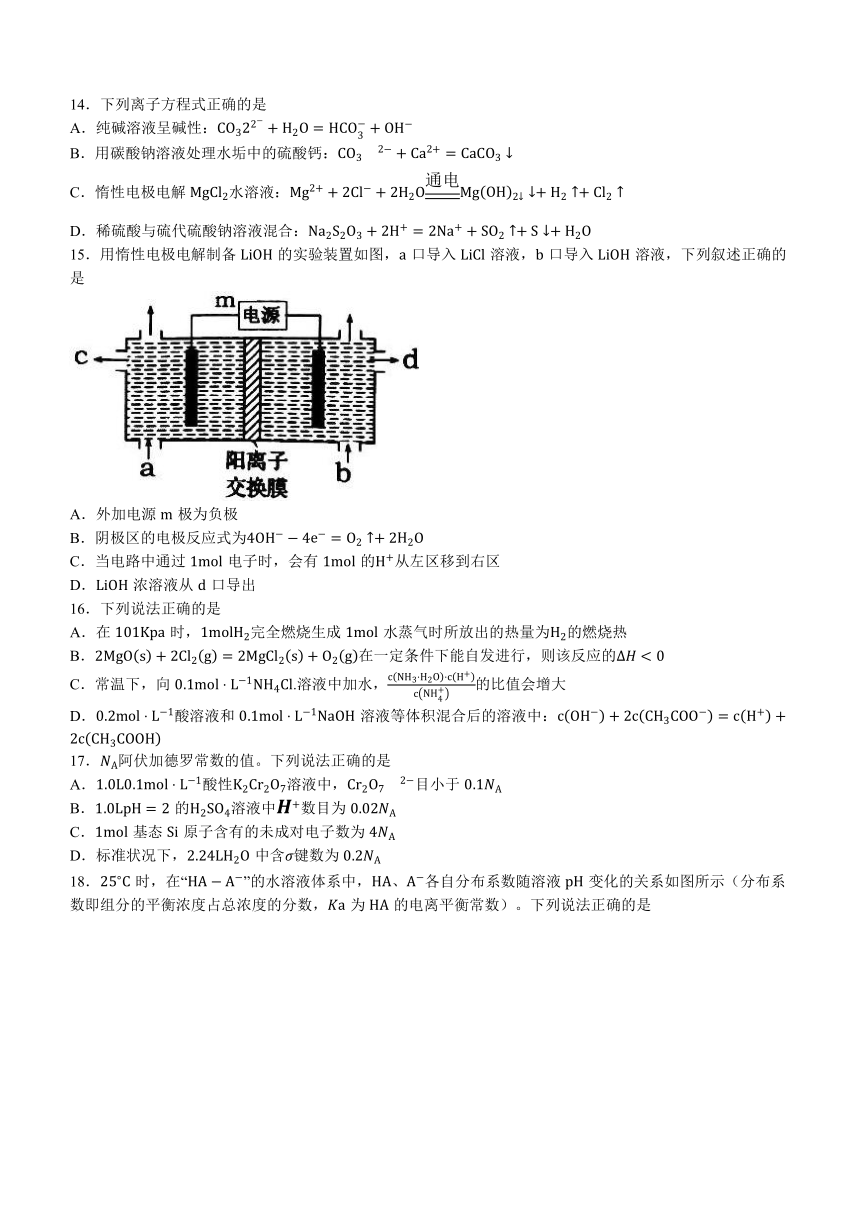
12.一定条件下,与发生加成反应有①、②两种可能,反应进程中能量变化如图所示。下列说法正确的是
A.生成等物质的量 比吸收的热量更多
B.反应刚开始时,产物中的比例更大
C.适当提高反应温度,可以提高产物中的比例
D.反应①、反应②对应生成物的总键能相同
13.一种钠离子电池的工作原理如图所示,放电时电池反应可表示为:
。下列说法正确的是
A.放电时,电极为负极
B.放电时,向 极迁移
C.充电时,极电极反应式为
D.充电时,每转移,极质量增加
14.下列离子方程式正确的是
A.纯碱溶液呈碱性:
B.用碳酸钠溶液处理水垢中的硫酸钙:
C.惰性电极电解 水溶液:
D.稀硫酸与硫代硫酸钠溶液混合:
15.用惰性电极电解制备的实验装置如图,口导入 溶液,口导入 溶液,下列叙述正确的是
A.外加电源 极为负极
B.阴极区的电极反应式为
C.当电路中通过电子时,会有的从左区移到右区
D.浓溶液从口导出
16.下列说法正确的是
A.在时,完全燃烧生成水蒸气时所放出的热量为的燃烧热
B.在一定条件下能自发进行,则该反应的
C.常温下,向.溶液中加水,的比值会增大
D.酸溶液和溶液等体积混合后的溶液中:
17.阿伏加德罗常数的值。下列说法正确的是
A.酸性溶液中,目小于
B.的溶液中数目为
C.基态原子含有的未成对电子数为
D.标准状况下,中含键数为
18.时,在“”的水溶液体系中,各自分布系数随溶液变化的关系如图所示(分布系数即组分的平衡浓度占总浓度的分数,为的电离平衡常数)。下列说法正确的是
A.表示的的分布系数 B.的
C.当时, D.的水解常数
19.化合物是一种液态化合物,在盛水的锥形瓶中小心滴加滴可观察到剧烈反应,液面上形成白雾,并有刺激性气味的气体放出。下列说法不正确的是
A.分子的空间构型为三角锥,中心原子的杂化方式为
B.三种元素的电负性大小:
C.与水反应的化学方程式为:
D.作为脱水剂,与混合共热,可得无水
20.下列方案设计、现象和结论正确的是
目的 方案设计 现象和结论
A 探究用“相似相溶”规律理解的溶解性 将一小粒碘晶体溶于约蒸馏水中,观察碘在水中的溶解性。加入约乙醇,振荡试管,观察溶液颜色变化 溶液分层,观察到紫红色的碘的乙醇溶液,说明碘易溶于有机溶剂
B 比较与的酸性强弱 分别用玻璃板蘸取与溶液点在试纸上,观察现象 前者大,说明酸性弱于
C 探究温度对比学平衡移动方向的影响 分别取溶液加入两支试管中,将其中的一支试管先加热,然后置于冷水中,与另一支试管进行对比 加热试管,溶液变为黄绿色,置于冷水中变为蓝绿色,说明其他条件不变时,升高温度,平衡向吸热反应方向移动
D 探究、大小 向盛有溶液的试管中滴加4滴溶液,振荡后,继续滴加4滴溶液,观察现象 先产生白色沉淀,后产生黄色沉淀,说明
二、非选择题(本大题共4题,共50分)
21.(14分) 时,三种弱酸的电离平衡常数如下表所示。
名称 醋酸 亚硝酸 草酸
化学式
电离平衡常数
(1)的 性,(填“酸”、“碱”或“中”),其溶液中各离子浓度大小顺序为 。
(2)将和体积均相同的溶液和溶液分别稀释,其随加水体积的变化如图所示。
①曲线Ⅰ代表溶液 (填“”或 “”)。
②图中,点水的电离程度 (填“大于”、“小于”或“等于”) 点水的电离程度。
③若向上述和溶液中分别滴加等浓度的溶液,恰好中和时消耗溶液体积分别为和。则 (填“”、“”或“”)。
(3)向溶液中加入少量的,写出该反应的离子方程式: 。
(4)某实验小组探究某食用白醋中醋酸的准确浓度,在实验室用标准溶液对其进行滴定。
①如图表示滴定管中液面的位置,处的刻度为19,滴定管中液面读数应为 。
②为了减小实验误差,某同学用标准溶液进行了三次实验,假设每次所取白醋体积均为,三次实验结果记录如下:
实验次数 第一次 第二次 第三次
消耗溶液体积 18.02 16.35 16.30
从上表可看出,第一次实验中记录消耗溶液的体积明显多于后两次,原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.第一次滴定用的锥形瓶用白醋润洗
C.滴定结束时,俯视读数
D.标准液保存时间过长,有部分变质,浓度降低
22.(10分)是原子序数依次增大的四种短周期元素,最外层电子数之和为15,的基态原子最外层电子排布式为。基态原子的层全充满,层没有成对电子,只有一个未成对电子。为同周期相邻元素,且均不与同族。
(1)元素基态原子核外含有 个能层, 个能级,能量最高的电子其电子云轮廓图呈 形。
(2)原子半径大小: (填“”、“”或“”,下同);第一电离能大小: 。
(3)与同主族的短周期元素为,二者的简单氢化物的沸点高低: (填化学式),理由是 。
(4)位于元素周期表的 区,基态原子填有电子的轨道数目为 。
23.(15分)合成氨是人类科学技术发展史上的一项重大突破。
(1)下列途径可提高工业固氮原料气平衡转化率的是 (选填序号)。
A.采用高温条件 B.采用适当的催化剂
C.将原料气加压 D.将氨液化,不断移去液氨
(2)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:)与催化剂的对应关系如表所示。
催化剂
初始速率 0.5 1.8 2.2 3.0
在不同催化剂的催化作用下,氨气分解反应中活化能最大的催化剂是 。
(3)如图所示,隔板 固定不动,活塞 可自由移动。 时,两个容器中均发生反。相同温度时向容器 中各充入和 ,初始容积均为,并保持温度不变。
①反应达到平衡时的转化率: (填“”、“”或“ ”)
②容器中达到平衡,测得容器中含有。则该反应在此条件下的平衡常数为 。
(4)用离子交换膜 型 膜作电解质,在一定条件下实现了常温常压下电解法合成氨的原理如图所示。
①为外接电源的 极,右室电极反应式为 。
②理论上左、右室产生气体同温同压下体积比为 。
(5)以 和 为原料合成尿素的主要反应如下:
反应Ⅰ
反应Ⅱ
在一定体积的密闭容器中投入氨和二氧化碳,实验测得反应中各组分随时间的变化如图1所示。
①据图可知,总反应约在 时达到平衡状态。
②在图2中绘制尿素合成过程中“ ”
的“能量 反应过程”示意图。
24.(11分)采用化学沉降法处理硫酸工厂的酸性含砷废水,相关数据如下表。
难溶物
表1.集中坤酸盐的
污染物
浓度
排放标准
表2. 工厂污染物排放浓度及允许排放标准
回答以下问题:
(1)已知砷元素与同一主族,砷原子比原子多两个电子层,则砷元素的原子结构示意图为 。
(2)工厂排放出的酸性废水中的三价砷( 为弱酸)不易沉降,可投入先将其氧化成五价砷(为弱酸),该反应的离子方程式为 。
(3)在处理含砷废水时采用分段式,先向废水中投入生石灰调节为2,再投入生石灰将调节到8左右使砷以形式沉降。
①将调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 。
②调节到8左右才开始沉淀的原因是 。
(4)经过一系列反应后得到含 等沉淀的低浓度含砷废水。若低浓度含砷废水(假设砷均以形式存在)中的浓度为 ,则低浓度含砷废水中的浓度为 , (填“符合”或“不符合”)排放标准。
【参考答案】
慈溪市2023学年第一学期高二年级期末测试
化学试题
一、选择题(本大题共20小题,1-10每小题2分,11-20每小题3分,共50分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.C 2.A 3.D 4.D 5.D 6.B 7.B 8.C 9.C 10.B 11.D 12.C 13.D 14.C 15.D 16.D 17.A 18.D 19.D 20.C
二、非选择题(本大题共4题,共50分)
21.(1) 碱(1分); (2分)
(2) ① (2分)
② 大于(2分)
③ (2分)
(3) (2分)
(4) ① (1分)
② (2分)
22.(1) 2(1分); 3(1分); 哑铃(1分)
(2) (1分); (1分)
(3) ; (1分); 结构相似,相对分子质量越大,范德华力越大,沸点越高(1分)
(4) (1分); 15(2分)
23.(1) CD
(2) (2分)
(3) ① (1分)
② (2分)
(4) ① 正(1分); (2分)
② (2分)
(5) ① 55(1分,55左右均可)
② (2分,对高低不予考虑,物质符号不写不予扣分)
24.(1) (2分)
(2) (2分)
(3) ① (2分)
② 是弱酸,当溶液中调节到8左右时浓度增大,开始沉淀(2分)
(4) (2分); 符合(1分)
化学试题
1.本卷分选择题和非选择题两部分,共8页,共100分,时间90分钟,答案答在答题纸上。
2.可能用到的相对原子质量:
一、选择题(本大题共20小题,1-10每小题2分,11-20每小题3分,共50分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.下列物质属于弱电解质的是
A. B. C. D.
2.下列物质溶于水,呈酸性的是
A. B. C. D.
3.下列化学用语正确的是
A.的电子式: B.的模型:
C.基态锂原子的简化电子排布式: D.的空间填充模型:
4.关于乙炔的说法不正确的是
A.碳原子的价层电子的轨道表示式 ,违反了泡利原理
B.基态碳原子核外共有6个运动状态不同的电子
C.乙炔分子内含极性键、非极性键,是非极性分子
D.乙炔分子中的 原子间采用 杂化轨道形成了一个键和两个键
5.下列各组比较正确的是
A.键能: B.键角:
C.酸性:乙酸 甲酸 D.中的溶解度:
6.下列事实可用氢键解释的是
A.氯气易液化 B.极易溶于水 C.比 稳定 D.比酸性弱
7.下列说法正确的是
A.增大压强,增加了反应物分子中的活化分子的百分数,反应速率增大
B.反应能否自发进行与温度有关,一般高温时影响较大
C.马口铁(镀锡)镀层破损后,镀层先被氧化
D.海水中钢闸门腐蚀主要是发生吸氧腐蚀,其阴极反应式为
8.关于盐酸与溶液反应的反应热测定实验,下列说法不正确的是
A.为了保证完全被中和,采用稍过量的溶液
B.所需的玻璃仪器有烧杯、温度计、玻璃搅拌器、量筒
C.需要测定并记录的实验数据有盐酸的浓度、氢氧化钠溶液的浓度反应后混合溶液的最高温度
D.若用同浓度的醋酸溶液代替盐酸进行上述实验,计算所得反应热偏大
9.某研究小组为探究室温下水溶液体系中的化学反应 的反应物初始浓度、溶液中的始浓度及初始速率间的关系,得到如下数据。
实验编号 的初始浓度 初始浓度 初始浓度 初始速率
1 1.00
2 1.00
3 2.00
4 1.00
已知表中初始反应速率与有关离子浓度关系可以表示为:(温度一定时,为常数)。下列说法不正确的是
A.实验2中,
B.设计实验2和实验4的目的是研究离子浓度对反应速率的影响
C.;;
D.若实验编号4的其它浓度不变,时,反应的初始速率
10.在恒容密闭容器中,将和一定量混合加热反应 ,
平衡后物质的量为,化学平衡常数为0.1。下列说法正确的是
A.的转化率之比为
B.达平衡后的体积分数为
C.升高温度,浓度减小,表明该反应是吸热反应
D.平衡后,再通入,正反应速率逐渐增大
11.氯化银和溴化银常用于制造感光材料。它们在水中的沉淀溶解平衡曲线如图所示。已知:
为或,表示 。下列说法不正确的是
A.点和 点对应的大小关系
B.两点溶液中的 :
C.曲线Ⅱ代表的沉淀溶解平衡曲线
D.向点的溶液中加入少量固体,溶液组成由沿曲线向方向移动
12.一定条件下,与发生加成反应有①、②两种可能,反应进程中能量变化如图所示。下列说法正确的是
A.生成等物质的量 比吸收的热量更多
B.反应刚开始时,产物中的比例更大
C.适当提高反应温度,可以提高产物中的比例
D.反应①、反应②对应生成物的总键能相同
13.一种钠离子电池的工作原理如图所示,放电时电池反应可表示为:
。下列说法正确的是
A.放电时,电极为负极
B.放电时,向 极迁移
C.充电时,极电极反应式为
D.充电时,每转移,极质量增加
14.下列离子方程式正确的是
A.纯碱溶液呈碱性:
B.用碳酸钠溶液处理水垢中的硫酸钙:
C.惰性电极电解 水溶液:
D.稀硫酸与硫代硫酸钠溶液混合:
15.用惰性电极电解制备的实验装置如图,口导入 溶液,口导入 溶液,下列叙述正确的是
A.外加电源 极为负极
B.阴极区的电极反应式为
C.当电路中通过电子时,会有的从左区移到右区
D.浓溶液从口导出
16.下列说法正确的是
A.在时,完全燃烧生成水蒸气时所放出的热量为的燃烧热
B.在一定条件下能自发进行,则该反应的
C.常温下,向.溶液中加水,的比值会增大
D.酸溶液和溶液等体积混合后的溶液中:
17.阿伏加德罗常数的值。下列说法正确的是
A.酸性溶液中,目小于
B.的溶液中数目为
C.基态原子含有的未成对电子数为
D.标准状况下,中含键数为
18.时,在“”的水溶液体系中,各自分布系数随溶液变化的关系如图所示(分布系数即组分的平衡浓度占总浓度的分数,为的电离平衡常数)。下列说法正确的是
A.表示的的分布系数 B.的
C.当时, D.的水解常数
19.化合物是一种液态化合物,在盛水的锥形瓶中小心滴加滴可观察到剧烈反应,液面上形成白雾,并有刺激性气味的气体放出。下列说法不正确的是
A.分子的空间构型为三角锥,中心原子的杂化方式为
B.三种元素的电负性大小:
C.与水反应的化学方程式为:
D.作为脱水剂,与混合共热,可得无水
20.下列方案设计、现象和结论正确的是
目的 方案设计 现象和结论
A 探究用“相似相溶”规律理解的溶解性 将一小粒碘晶体溶于约蒸馏水中,观察碘在水中的溶解性。加入约乙醇,振荡试管,观察溶液颜色变化 溶液分层,观察到紫红色的碘的乙醇溶液,说明碘易溶于有机溶剂
B 比较与的酸性强弱 分别用玻璃板蘸取与溶液点在试纸上,观察现象 前者大,说明酸性弱于
C 探究温度对比学平衡移动方向的影响 分别取溶液加入两支试管中,将其中的一支试管先加热,然后置于冷水中,与另一支试管进行对比 加热试管,溶液变为黄绿色,置于冷水中变为蓝绿色,说明其他条件不变时,升高温度,平衡向吸热反应方向移动
D 探究、大小 向盛有溶液的试管中滴加4滴溶液,振荡后,继续滴加4滴溶液,观察现象 先产生白色沉淀,后产生黄色沉淀,说明
二、非选择题(本大题共4题,共50分)
21.(14分) 时,三种弱酸的电离平衡常数如下表所示。
名称 醋酸 亚硝酸 草酸
化学式
电离平衡常数
(1)的 性,(填“酸”、“碱”或“中”),其溶液中各离子浓度大小顺序为 。
(2)将和体积均相同的溶液和溶液分别稀释,其随加水体积的变化如图所示。
①曲线Ⅰ代表溶液 (填“”或 “”)。
②图中,点水的电离程度 (填“大于”、“小于”或“等于”) 点水的电离程度。
③若向上述和溶液中分别滴加等浓度的溶液,恰好中和时消耗溶液体积分别为和。则 (填“”、“”或“”)。
(3)向溶液中加入少量的,写出该反应的离子方程式: 。
(4)某实验小组探究某食用白醋中醋酸的准确浓度,在实验室用标准溶液对其进行滴定。
①如图表示滴定管中液面的位置,处的刻度为19,滴定管中液面读数应为 。
②为了减小实验误差,某同学用标准溶液进行了三次实验,假设每次所取白醋体积均为,三次实验结果记录如下:
实验次数 第一次 第二次 第三次
消耗溶液体积 18.02 16.35 16.30
从上表可看出,第一次实验中记录消耗溶液的体积明显多于后两次,原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.第一次滴定用的锥形瓶用白醋润洗
C.滴定结束时,俯视读数
D.标准液保存时间过长,有部分变质,浓度降低
22.(10分)是原子序数依次增大的四种短周期元素,最外层电子数之和为15,的基态原子最外层电子排布式为。基态原子的层全充满,层没有成对电子,只有一个未成对电子。为同周期相邻元素,且均不与同族。
(1)元素基态原子核外含有 个能层, 个能级,能量最高的电子其电子云轮廓图呈 形。
(2)原子半径大小: (填“”、“”或“”,下同);第一电离能大小: 。
(3)与同主族的短周期元素为,二者的简单氢化物的沸点高低: (填化学式),理由是 。
(4)位于元素周期表的 区,基态原子填有电子的轨道数目为 。
23.(15分)合成氨是人类科学技术发展史上的一项重大突破。
(1)下列途径可提高工业固氮原料气平衡转化率的是 (选填序号)。
A.采用高温条件 B.采用适当的催化剂
C.将原料气加压 D.将氨液化,不断移去液氨
(2)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:)与催化剂的对应关系如表所示。
催化剂
初始速率 0.5 1.8 2.2 3.0
在不同催化剂的催化作用下,氨气分解反应中活化能最大的催化剂是 。
(3)如图所示,隔板 固定不动,活塞 可自由移动。 时,两个容器中均发生反。相同温度时向容器 中各充入和 ,初始容积均为,并保持温度不变。
①反应达到平衡时的转化率: (填“”、“”或“ ”)
②容器中达到平衡,测得容器中含有。则该反应在此条件下的平衡常数为 。
(4)用离子交换膜 型 膜作电解质,在一定条件下实现了常温常压下电解法合成氨的原理如图所示。
①为外接电源的 极,右室电极反应式为 。
②理论上左、右室产生气体同温同压下体积比为 。
(5)以 和 为原料合成尿素的主要反应如下:
反应Ⅰ
反应Ⅱ
在一定体积的密闭容器中投入氨和二氧化碳,实验测得反应中各组分随时间的变化如图1所示。
①据图可知,总反应约在 时达到平衡状态。
②在图2中绘制尿素合成过程中“ ”
的“能量 反应过程”示意图。
24.(11分)采用化学沉降法处理硫酸工厂的酸性含砷废水,相关数据如下表。
难溶物
表1.集中坤酸盐的
污染物
浓度
排放标准
表2. 工厂污染物排放浓度及允许排放标准
回答以下问题:
(1)已知砷元素与同一主族,砷原子比原子多两个电子层,则砷元素的原子结构示意图为 。
(2)工厂排放出的酸性废水中的三价砷( 为弱酸)不易沉降,可投入先将其氧化成五价砷(为弱酸),该反应的离子方程式为 。
(3)在处理含砷废水时采用分段式,先向废水中投入生石灰调节为2,再投入生石灰将调节到8左右使砷以形式沉降。
①将调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 。
②调节到8左右才开始沉淀的原因是 。
(4)经过一系列反应后得到含 等沉淀的低浓度含砷废水。若低浓度含砷废水(假设砷均以形式存在)中的浓度为 ,则低浓度含砷废水中的浓度为 , (填“符合”或“不符合”)排放标准。
【参考答案】
慈溪市2023学年第一学期高二年级期末测试
化学试题
一、选择题(本大题共20小题,1-10每小题2分,11-20每小题3分,共50分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.C 2.A 3.D 4.D 5.D 6.B 7.B 8.C 9.C 10.B 11.D 12.C 13.D 14.C 15.D 16.D 17.A 18.D 19.D 20.C
二、非选择题(本大题共4题,共50分)
21.(1) 碱(1分); (2分)
(2) ① (2分)
② 大于(2分)
③ (2分)
(3) (2分)
(4) ① (1分)
② (2分)
22.(1) 2(1分); 3(1分); 哑铃(1分)
(2) (1分); (1分)
(3) ; (1分); 结构相似,相对分子质量越大,范德华力越大,沸点越高(1分)
(4) (1分); 15(2分)
23.(1) CD
(2) (2分)
(3) ① (1分)
② (2分)
(4) ① 正(1分); (2分)
② (2分)
(5) ① 55(1分,55左右均可)
② (2分,对高低不予考虑,物质符号不写不予扣分)
24.(1) (2分)
(2) (2分)
(3) ① (2分)
② 是弱酸,当溶液中调节到8左右时浓度增大,开始沉淀(2分)
(4) (2分); 符合(1分)
同课章节目录
